沪教版(全国)化学九年级下册同步课时练习:第6章 第3节 物质的溶解性 第2课时 物质溶解性的定量表示(word版 含答案)
文档属性
| 名称 | 沪教版(全国)化学九年级下册同步课时练习:第6章 第3节 物质的溶解性 第2课时 物质溶解性的定量表示(word版 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 181.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-31 20:51:28 | ||
图片预览


文档简介
第3节 物质的溶解性
第2课时 物质溶解性的定量表示
知识点 1 溶解度
1.20 ℃时,氯化钠的溶解度为36 g。对这句话理解错误的是 ( )
A.20 ℃时,100 g水中最多能溶解氯化钠36 g
B.20 ℃时,100 g氯化钠饱和溶液中含氯化钠36 g
C.20 ℃时,氯化钠饱和溶液中水与氯化钠的质量比为100∶36
D.20 ℃时,将36 g氯化钠溶解于100 g水中,所得溶液为该温度下氯化钠的饱和溶液
2.增大二氧化碳在水中的溶解度的方法是 ( )
A.升温增压 B.升温减压
C.降温增压 D.降温减压
3.20 ℃时,NaCl的溶解度为36 g,其为 (填“易溶”“可溶”或“微溶”)物质。该温度下,将15 g NaCl放入50 g水中,充分溶解,溶质质量分数为 (结果精确至0.1%,下同)。若将20 g NaCl放入50 g 水中,充分溶解,溶质质量分数为 ,形成的溶液是 (填“饱和”或“不饱和”)溶液。
知识点 2 溶解度曲线
4.[2020·内蒙古改编] 不同温度时甲和乙在水中的溶解度如下表,根据此表回答下列问题。
温度/℃ 10 20 30 40 50
溶解度/g 甲 30 33 35 38 41
乙 21 31 45 65 88
(1)从表中数据可以看出,两种物质的溶解度受温度影响变化较大的是 。
(2)30 ℃时,向100 g水中加入50 g甲,充分搅拌后得到的溶液质量为 g。
(3)由表中的数据分析可知,甲和乙在某一温度时具有相同的溶解度x g。则x取值范围是 。
5.甲、乙、丙三种固体物质的溶解度曲线如图 所示,回答下列问题。
(1)a3℃时,三种物质的溶解度由小到大的顺序是 。
(2)a2℃时, 和 的溶解度相等。
(3)三种物质中, 的溶解度受温度的影响最大, 的溶解度受温度的影响最小, 的溶解度随温度的升高而减小。
6.如图是甲、乙、丙三种物质的溶解度曲线。下列说法正确的是 ( )
A.P点表示甲、丙两种物质的饱和溶液质量相等
B.将t1 ℃时乙物质的饱和溶液升温至t2 ℃,仍是饱和溶液
C.t1 ℃时,甲物质的饱和溶液中溶质和溶剂的质量比为1∶4
D.丙物质的溶解度随温度的升高而增大
7.[2020·北京] 不同温度下KNO3的溶解度如下表所示。下列说法正确的是 ( )
温度/℃ 20 30 40
溶解度/g 31.6 45.8 63.9
A.20 ℃时,100 g KNO3饱和溶液中溶质质量为31.6 g
B.30 ℃时,100 g KNO3饱和溶液的溶质质量分数为45.8%
C.30 ℃时,将50 g KNO3放入100 g水中得到150 g溶液
D.40 ℃时,100 g水最多溶解63.9 g KNO3
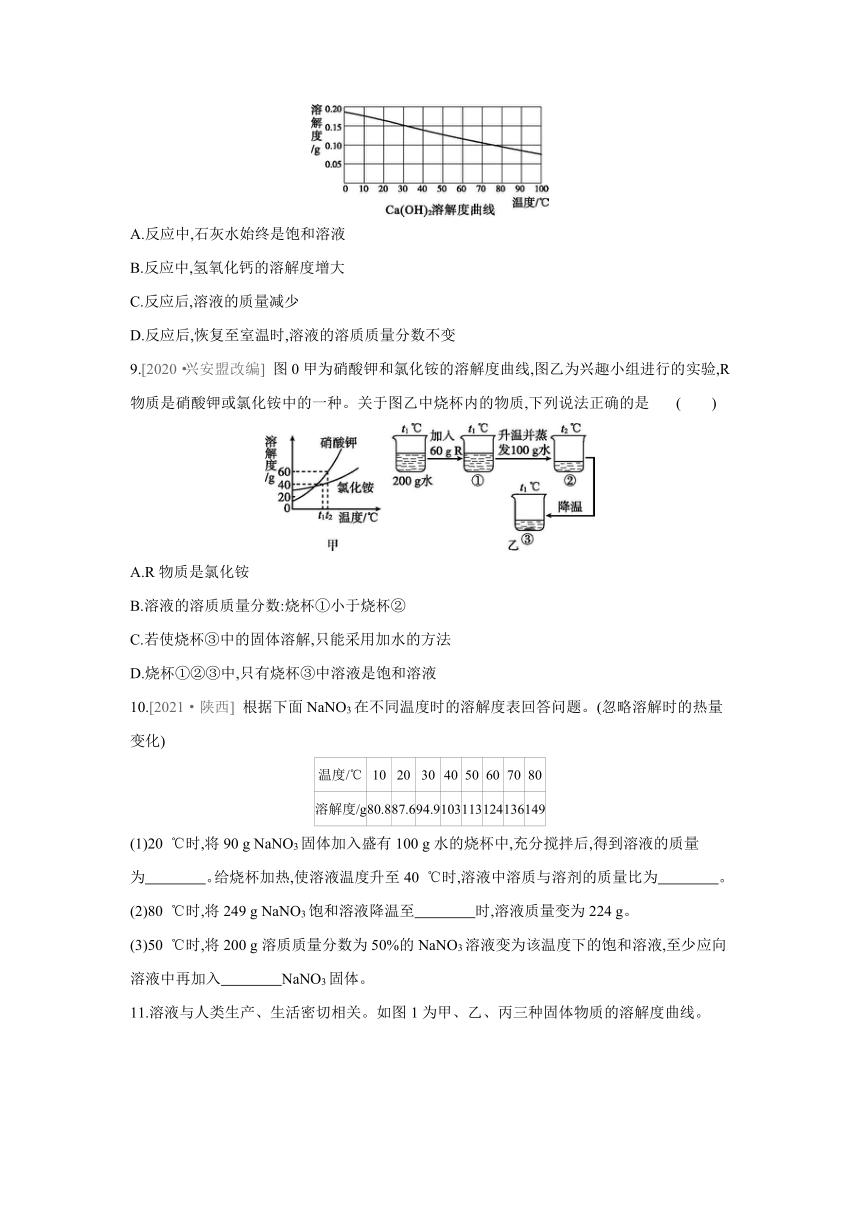
8.生石灰的主要成分是氧化钙,与水反应生成氢氧化钙并放出大量的热。室温时,将生石灰加入饱和石灰水中,下列有关生石灰对溶解影响的判断(参照如图所示溶解度曲线)中,错误的是( )
A.反应中,石灰水始终是饱和溶液
B.反应中,氢氧化钙的溶解度增大
C.反应后,溶液的质量减少
D.反应后,恢复至室温时,溶液的溶质质量分数不变
9.[2020·兴安盟改编] 图0甲为硝酸钾和氯化铵的溶解度曲线,图乙为兴趣小组进行的实验,R物质是硝酸钾或氯化铵中的一种。关于图乙中烧杯内的物质,下列说法正确的是 ( )
A.R物质是氯化铵
B.溶液的溶质质量分数:烧杯①小于烧杯②
C.若使烧杯③中的固体溶解,只能采用加水的方法
D.烧杯①②③中,只有烧杯③中溶液是饱和溶液
10.[2021·陕西] 根据下面NaNO3在不同温度时的溶解度表回答问题。(忽略溶解时的热量变化)
温度/℃ 10 20 30 40 50 60 70 80
溶解度/g 80.8 87.6 94.9 103 113 124 136 149
(1)20 ℃时,将90 g NaNO3固体加入盛有100 g水的烧杯中,充分搅拌后,得到溶液的质量为 。给烧杯加热,使溶液温度升至40 ℃时,溶液中溶质与溶剂的质量比为 。
(2)80 ℃时,将249 g NaNO3饱和溶液降温至 时,溶液质量变为224 g。
(3)50 ℃时,将200 g溶质质量分数为50%的NaNO3溶液变为该温度下的饱和溶液,至少应向溶液中再加入 NaNO3固体。
11.溶液与人类生产、生活密切相关。如图1为甲、乙、丙三种固体物质的溶解度曲线。
(1)t1 ℃时,甲、乙两种物质的溶解度 (填“相等”或“不相等”)。
(2)t2 ℃时,甲物质的饱和溶液中溶质与溶剂的质量比为 (填最简整数比)。
(3)现有t1 ℃时甲、乙、丙三种物质的饱和溶液,将这三种溶液分别升温到t2 ℃,所得溶液中溶质质量分数大小关系是 (填字母)。
A.甲>乙>丙 B.甲=乙<丙
C.甲=乙>丙
12.[2021·江西改编] 甲、乙两种固体的溶解度曲线如图2所示。下列说法正确的是( )
A.甲和乙两种物质的溶解度相等
B.t1 ℃时甲溶液中溶质和溶剂的质量比为3∶10
C.t2 ℃时,在100 g水中加入50 g乙物质能得到该物质的饱和溶液
D.将t1 ℃时甲、乙两种物质的饱和溶液升温至t2 ℃,溶剂量不变,所得溶液的溶质质量分数大小关系:甲>乙
13.[2021·成都] 60 ℃时,向100 g水中加入一定量KNO3形成溶液,再降温至20 ℃,析出固体质量的变化如图3甲,结合图乙,下列说法正确的是 ( )
A.加入的KNO3质量为41.6 g
B.降温过程中KNO3溶液始终为饱和溶液
C.蒸发溶剂可将M点的溶液转化到N点
D.20 ℃时,100 g KNO3饱和溶液中有KNO3 31.6 g
14.[2021·天津改编] 溶液与人类的生活息息相关。
下表是氯化钠和氯化钾在不同温度时的溶解度。
温度/℃ 0 20 40 60 80
溶解 度/g NaCl 35.7 36.0 36.6 37.3 38.4
KCl 27.6 34.0 40.0 45.5 51.1
(1)20 ℃时,氯化钠的溶解度为 g。
(2)20 ℃时,将20 g氯化钠固体加入50 g水中,充分溶解,所得氯化钠溶液的质量为 g。
(3)某同学进行如图4所示实验,得到相应的A、B、C三种溶液,C中析出的氯化钾固体质量为 g。
图4
答案
1.B 2.C
3.易溶 23.1% 26.5% 饱和
20 ℃时NaCl的溶解度为36 g,50 g水中最多能溶解18 g NaCl,当溶解15 g NaCl时形成的是不饱和溶液;向50 g水中加入20 g NaCl时形成的是饱和溶液,且还有2 g固体未溶解。饱和溶液中溶质的质量分数=×100%。
4.(1)乙
(2)135
(3)335.(1)乙<丙<甲
(2)甲 丙
(3)甲 乙 丙
6.C P点表示甲、丙在t1 ℃时的溶解度相等;乙的溶解度随温度的升高而增大,所以升温后乙物质的饱和溶液会变成不饱和溶液;t1 ℃时甲的溶解度为25 g,即25 g甲溶解于100 g水中恰好形成饱和溶液,所以t1 ℃时,甲物质的饱和溶液中溶质和溶剂的质量比为1∶4;由图可知,丙物质的溶解度随温度的升高而减小。
7.D 20 ℃时,硝酸钾的溶解度为31.6 g,含义是20 ℃时,100 g水中最多能溶解硝酸钾31.6 g,溶液达到饱和状态,形成饱和溶液131.6 g,则20 ℃时,131.6 g硝酸钾饱和溶液中溶质质量为31.6 g;30 ℃时,100 g硝酸钾饱和溶液的溶质质量分数为×100%=31.4%<45.8%;30 ℃时,硝酸钾的溶解度为45.8 g,则30 ℃时,将50 g硝酸钾放入100 g水中,最多溶解45.8 g,得到45.8 g+100 g=145.8 g溶液;40 ℃时,硝酸钾的溶解度为63.9 g,则40 ℃时,100 g水最多溶解63.9 g硝酸钾。
8.B 向饱和石灰水中加入生石灰,生石灰会与水反应,溶剂质量减少,且反应过程中温度升高,氢氧化钙的溶解度随温度的升高而减小,溶质质量减少,溶液质量减少,但溶液始终是饱和溶液;待恢复到室温后,石灰水仍为饱和溶液,溶质质量分数不变。
9.B 升温到t2 ℃并且蒸发100 g水,烧杯中没有析出固体,说明t2 ℃时该物质的溶解度大于或等于60 g,由图甲信息可知,t2 ℃时硝酸钾的溶解度是60 g,氯化铵的溶解度小于60 g,所以烧杯内的R物质是硝酸钾;烧杯①中溶液的溶质质量分数为×100%=23.1%,烧杯②中溶液的溶质质量分数为×100%=37.5%,所以烧杯①中溶液的溶质质量分数小于烧杯②;若使烧杯③中的固体溶解,可采用加水、升温的方法;t2 ℃时,硝酸钾的溶解度是60 g,烧杯②③中溶液均是饱和溶液。
10.(1)187.6 g 9∶10
(2)60 ℃
(3)13 g
11.(1)相等 (2)1∶2 (3)C
12.C
13.A 20 ℃时KNO3的溶解度是31.6 g,即20 ℃时此KNO3溶液中溶质质量是31.6 g,由于降温至20 ℃时析出10 g固体,因此加入的KNO3质量为41.6 g。
14.(1)36.0 (2)68 (3)2
第2课时 物质溶解性的定量表示
知识点 1 溶解度
1.20 ℃时,氯化钠的溶解度为36 g。对这句话理解错误的是 ( )
A.20 ℃时,100 g水中最多能溶解氯化钠36 g
B.20 ℃时,100 g氯化钠饱和溶液中含氯化钠36 g
C.20 ℃时,氯化钠饱和溶液中水与氯化钠的质量比为100∶36
D.20 ℃时,将36 g氯化钠溶解于100 g水中,所得溶液为该温度下氯化钠的饱和溶液
2.增大二氧化碳在水中的溶解度的方法是 ( )
A.升温增压 B.升温减压
C.降温增压 D.降温减压
3.20 ℃时,NaCl的溶解度为36 g,其为 (填“易溶”“可溶”或“微溶”)物质。该温度下,将15 g NaCl放入50 g水中,充分溶解,溶质质量分数为 (结果精确至0.1%,下同)。若将20 g NaCl放入50 g 水中,充分溶解,溶质质量分数为 ,形成的溶液是 (填“饱和”或“不饱和”)溶液。
知识点 2 溶解度曲线
4.[2020·内蒙古改编] 不同温度时甲和乙在水中的溶解度如下表,根据此表回答下列问题。
温度/℃ 10 20 30 40 50
溶解度/g 甲 30 33 35 38 41
乙 21 31 45 65 88
(1)从表中数据可以看出,两种物质的溶解度受温度影响变化较大的是 。
(2)30 ℃时,向100 g水中加入50 g甲,充分搅拌后得到的溶液质量为 g。
(3)由表中的数据分析可知,甲和乙在某一温度时具有相同的溶解度x g。则x取值范围是 。
5.甲、乙、丙三种固体物质的溶解度曲线如图 所示,回答下列问题。
(1)a3℃时,三种物质的溶解度由小到大的顺序是 。
(2)a2℃时, 和 的溶解度相等。
(3)三种物质中, 的溶解度受温度的影响最大, 的溶解度受温度的影响最小, 的溶解度随温度的升高而减小。
6.如图是甲、乙、丙三种物质的溶解度曲线。下列说法正确的是 ( )
A.P点表示甲、丙两种物质的饱和溶液质量相等
B.将t1 ℃时乙物质的饱和溶液升温至t2 ℃,仍是饱和溶液
C.t1 ℃时,甲物质的饱和溶液中溶质和溶剂的质量比为1∶4
D.丙物质的溶解度随温度的升高而增大
7.[2020·北京] 不同温度下KNO3的溶解度如下表所示。下列说法正确的是 ( )
温度/℃ 20 30 40
溶解度/g 31.6 45.8 63.9
A.20 ℃时,100 g KNO3饱和溶液中溶质质量为31.6 g
B.30 ℃时,100 g KNO3饱和溶液的溶质质量分数为45.8%
C.30 ℃时,将50 g KNO3放入100 g水中得到150 g溶液
D.40 ℃时,100 g水最多溶解63.9 g KNO3
8.生石灰的主要成分是氧化钙,与水反应生成氢氧化钙并放出大量的热。室温时,将生石灰加入饱和石灰水中,下列有关生石灰对溶解影响的判断(参照如图所示溶解度曲线)中,错误的是( )
A.反应中,石灰水始终是饱和溶液
B.反应中,氢氧化钙的溶解度增大
C.反应后,溶液的质量减少
D.反应后,恢复至室温时,溶液的溶质质量分数不变
9.[2020·兴安盟改编] 图0甲为硝酸钾和氯化铵的溶解度曲线,图乙为兴趣小组进行的实验,R物质是硝酸钾或氯化铵中的一种。关于图乙中烧杯内的物质,下列说法正确的是 ( )
A.R物质是氯化铵
B.溶液的溶质质量分数:烧杯①小于烧杯②
C.若使烧杯③中的固体溶解,只能采用加水的方法
D.烧杯①②③中,只有烧杯③中溶液是饱和溶液
10.[2021·陕西] 根据下面NaNO3在不同温度时的溶解度表回答问题。(忽略溶解时的热量变化)
温度/℃ 10 20 30 40 50 60 70 80
溶解度/g 80.8 87.6 94.9 103 113 124 136 149
(1)20 ℃时,将90 g NaNO3固体加入盛有100 g水的烧杯中,充分搅拌后,得到溶液的质量为 。给烧杯加热,使溶液温度升至40 ℃时,溶液中溶质与溶剂的质量比为 。
(2)80 ℃时,将249 g NaNO3饱和溶液降温至 时,溶液质量变为224 g。
(3)50 ℃时,将200 g溶质质量分数为50%的NaNO3溶液变为该温度下的饱和溶液,至少应向溶液中再加入 NaNO3固体。
11.溶液与人类生产、生活密切相关。如图1为甲、乙、丙三种固体物质的溶解度曲线。
(1)t1 ℃时,甲、乙两种物质的溶解度 (填“相等”或“不相等”)。
(2)t2 ℃时,甲物质的饱和溶液中溶质与溶剂的质量比为 (填最简整数比)。
(3)现有t1 ℃时甲、乙、丙三种物质的饱和溶液,将这三种溶液分别升温到t2 ℃,所得溶液中溶质质量分数大小关系是 (填字母)。
A.甲>乙>丙 B.甲=乙<丙
C.甲=乙>丙
12.[2021·江西改编] 甲、乙两种固体的溶解度曲线如图2所示。下列说法正确的是( )
A.甲和乙两种物质的溶解度相等
B.t1 ℃时甲溶液中溶质和溶剂的质量比为3∶10
C.t2 ℃时,在100 g水中加入50 g乙物质能得到该物质的饱和溶液
D.将t1 ℃时甲、乙两种物质的饱和溶液升温至t2 ℃,溶剂量不变,所得溶液的溶质质量分数大小关系:甲>乙
13.[2021·成都] 60 ℃时,向100 g水中加入一定量KNO3形成溶液,再降温至20 ℃,析出固体质量的变化如图3甲,结合图乙,下列说法正确的是 ( )
A.加入的KNO3质量为41.6 g
B.降温过程中KNO3溶液始终为饱和溶液
C.蒸发溶剂可将M点的溶液转化到N点
D.20 ℃时,100 g KNO3饱和溶液中有KNO3 31.6 g
14.[2021·天津改编] 溶液与人类的生活息息相关。
下表是氯化钠和氯化钾在不同温度时的溶解度。
温度/℃ 0 20 40 60 80
溶解 度/g NaCl 35.7 36.0 36.6 37.3 38.4
KCl 27.6 34.0 40.0 45.5 51.1
(1)20 ℃时,氯化钠的溶解度为 g。
(2)20 ℃时,将20 g氯化钠固体加入50 g水中,充分溶解,所得氯化钠溶液的质量为 g。
(3)某同学进行如图4所示实验,得到相应的A、B、C三种溶液,C中析出的氯化钾固体质量为 g。
图4
答案
1.B 2.C
3.易溶 23.1% 26.5% 饱和
20 ℃时NaCl的溶解度为36 g,50 g水中最多能溶解18 g NaCl,当溶解15 g NaCl时形成的是不饱和溶液;向50 g水中加入20 g NaCl时形成的是饱和溶液,且还有2 g固体未溶解。饱和溶液中溶质的质量分数=×100%。
4.(1)乙
(2)135
(3)33
(2)甲 丙
(3)甲 乙 丙
6.C P点表示甲、丙在t1 ℃时的溶解度相等;乙的溶解度随温度的升高而增大,所以升温后乙物质的饱和溶液会变成不饱和溶液;t1 ℃时甲的溶解度为25 g,即25 g甲溶解于100 g水中恰好形成饱和溶液,所以t1 ℃时,甲物质的饱和溶液中溶质和溶剂的质量比为1∶4;由图可知,丙物质的溶解度随温度的升高而减小。
7.D 20 ℃时,硝酸钾的溶解度为31.6 g,含义是20 ℃时,100 g水中最多能溶解硝酸钾31.6 g,溶液达到饱和状态,形成饱和溶液131.6 g,则20 ℃时,131.6 g硝酸钾饱和溶液中溶质质量为31.6 g;30 ℃时,100 g硝酸钾饱和溶液的溶质质量分数为×100%=31.4%<45.8%;30 ℃时,硝酸钾的溶解度为45.8 g,则30 ℃时,将50 g硝酸钾放入100 g水中,最多溶解45.8 g,得到45.8 g+100 g=145.8 g溶液;40 ℃时,硝酸钾的溶解度为63.9 g,则40 ℃时,100 g水最多溶解63.9 g硝酸钾。
8.B 向饱和石灰水中加入生石灰,生石灰会与水反应,溶剂质量减少,且反应过程中温度升高,氢氧化钙的溶解度随温度的升高而减小,溶质质量减少,溶液质量减少,但溶液始终是饱和溶液;待恢复到室温后,石灰水仍为饱和溶液,溶质质量分数不变。
9.B 升温到t2 ℃并且蒸发100 g水,烧杯中没有析出固体,说明t2 ℃时该物质的溶解度大于或等于60 g,由图甲信息可知,t2 ℃时硝酸钾的溶解度是60 g,氯化铵的溶解度小于60 g,所以烧杯内的R物质是硝酸钾;烧杯①中溶液的溶质质量分数为×100%=23.1%,烧杯②中溶液的溶质质量分数为×100%=37.5%,所以烧杯①中溶液的溶质质量分数小于烧杯②;若使烧杯③中的固体溶解,可采用加水、升温的方法;t2 ℃时,硝酸钾的溶解度是60 g,烧杯②③中溶液均是饱和溶液。
10.(1)187.6 g 9∶10
(2)60 ℃
(3)13 g
11.(1)相等 (2)1∶2 (3)C
12.C
13.A 20 ℃时KNO3的溶解度是31.6 g,即20 ℃时此KNO3溶液中溶质质量是31.6 g,由于降温至20 ℃时析出10 g固体,因此加入的KNO3质量为41.6 g。
14.(1)36.0 (2)68 (3)2
