沪教版(全国)化学九年级下册同步课时练习:第7章 第2节 常见的酸和碱 第3课时 常见的碱 复分解反应(word版 含答案)
文档属性
| 名称 | 沪教版(全国)化学九年级下册同步课时练习:第7章 第2节 常见的酸和碱 第3课时 常见的碱 复分解反应(word版 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 207.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-31 21:06:52 | ||
图片预览

文档简介
第2节 常见的酸和碱
第3课时 常见的碱 复分解反应
知识点 1 几种常见的碱
1.掌握物质的分类是学好化学的基础。下列物质中属于碱的是 ( )
A. NaCl B. KOH
C. MgO D.Cu
2.下列选项中物质的俗名、化学式、类别、用途完全对应的是 ( )
A.氢氧化钙 Ca(OH)2 碱 去除油污
B.生石灰 CaO 氧化物 补钙剂
C.双氧水 H2O2 酸 消毒
D.火碱 NaOH 碱 生产橡胶
3.氢氧化钠固体必须密封保存,这是因为氢氧化钠固体 ( )
A.易挥发和有腐蚀性
B.易挥发和易潮解
C.有腐蚀性和易与二氧化碳反应
D.易潮解和易与二氧化碳反应
4.氨水(NH3·H2O)也是一种常见的碱,是NH3溶于水后形成的溶液。氨水很不稳定,容易放出有刺激性气味的NH3。根据所学知识回答下列问题。
(1)NH3·H2O在水溶液中解离出来的离子有 。
(2)将一片有酚酞的干燥纸条和一片有酚酞的湿润纸条分别放入两瓶干燥的NH3中,现象是
。
5.在某些食品的包装袋内,有一个装有白色颗粒状固体的小纸袋,上面写着“干燥剂,主要成分为生石灰”,生石灰能作干燥剂是因为它能与 反应。如果将小纸袋拿出来放在空气中,一段时间后,会发现纸袋内的白色颗粒粘在一起成为块状,用化学方程式解释原因:① ;② 。
知识点 2 复分解反应
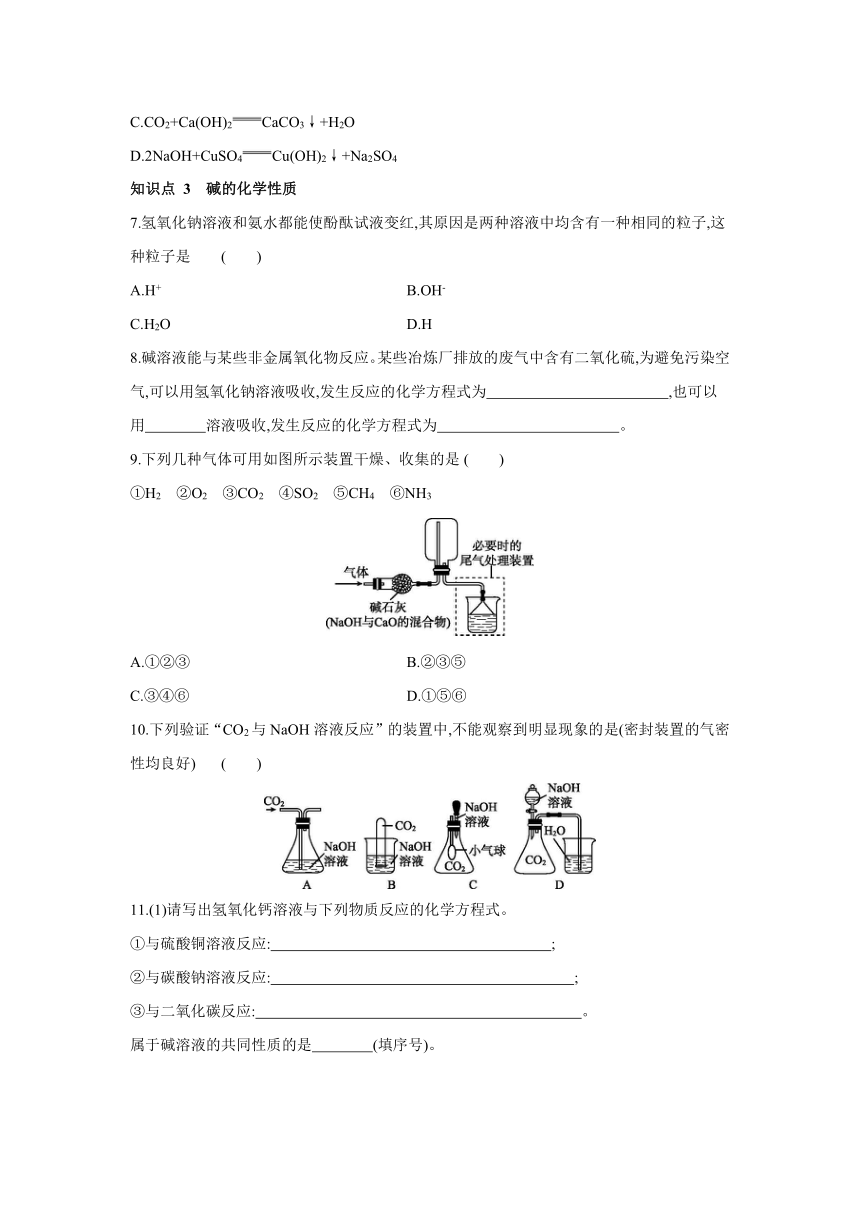
6.下列不属于复分解反应的是 ( )
A.Fe2O3+3H2SO4Fe2(SO4)3+3H2O
B.Na2CO3+2HCl2NaCl+CO2↑+H2O
C.CO2+Ca(OH)2CaCO3↓+H2O
D.2NaOH+CuSO4Cu(OH)2↓+Na2SO4
知识点 3 碱的化学性质
7.氢氧化钠溶液和氨水都能使酚酞试液变红,其原因是两种溶液中均含有一种相同的粒子,这种粒子是 ( )
A.H+ B.OH-
C.H2O D.H
8.碱溶液能与某些非金属氧化物反应。某些冶炼厂排放的废气中含有二氧化硫,为避免污染空气,可以用氢氧化钠溶液吸收,发生反应的化学方程式为 ,也可以用 溶液吸收,发生反应的化学方程式为 。
9.下列几种气体可用如图所示装置干燥、收集的是 ( )
①H2 ②O2 ③CO2 ④SO2 ⑤CH4 ⑥NH3
A.①②③ B.②③⑤
C.③④⑥ D.①⑤⑥
10.下列验证“CO2与NaOH溶液反应”的装置中,不能观察到明显现象的是(密封装置的气密性均良好) ( )
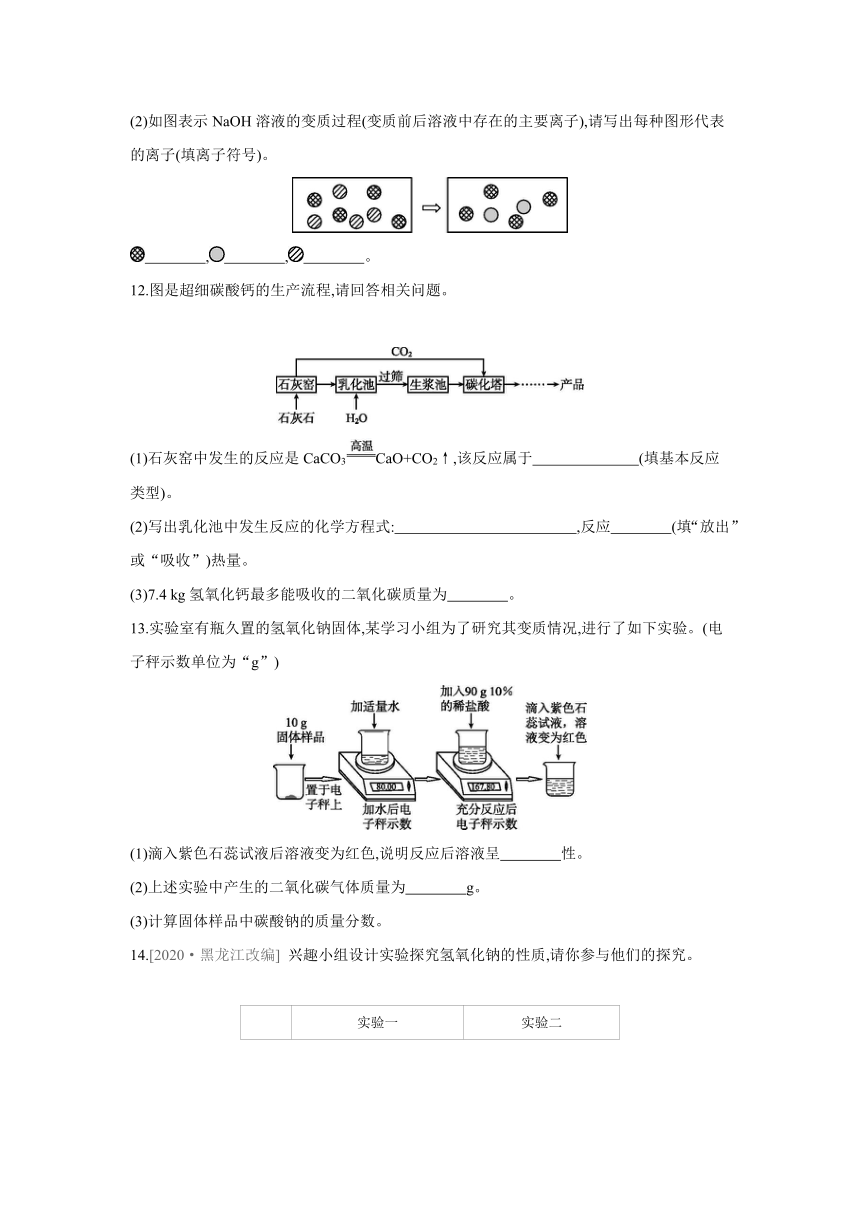
11.(1)请写出氢氧化钙溶液与下列物质反应的化学方程式。
①与硫酸铜溶液反应: ;
②与碳酸钠溶液反应: ;
③与二氧化碳反应: 。
属于碱溶液的共同性质的是 (填序号)。
(2)如图表示NaOH溶液的变质过程(变质前后溶液中存在的主要离子),请写出每种图形代表的离子(填离子符号)。
, , 。
12.图是超细碳酸钙的生产流程,请回答相关问题。
(1)石灰窑中发生的反应是CaCO3CaO+CO2↑,该反应属于 (填基本反应类型)。
(2)写出乳化池中发生反应的化学方程式: ,反应 (填“放出”或“吸收”)热量。
(3)7.4 kg氢氧化钙最多能吸收的二氧化碳质量为 。
13.实验室有瓶久置的氢氧化钠固体,某学习小组为了研究其变质情况,进行了如下实验。(电子秤示数单位为“g”)
(1)滴入紫色石蕊试液后溶液变为红色,说明反应后溶液呈 性。
(2)上述实验中产生的二氧化碳气体质量为 g。
(3)计算固体样品中碳酸钠的质量分数。
14.[2020·黑龙江改编] 兴趣小组设计实验探究氢氧化钠的性质,请你参与他们的探究。
实验一 实验二
实验 操作
实验 现象
实验 结论 氢氧化钠能与硫酸铜发生反应 氢氧化钠能与氯化铵发生反应
(1)实验一的现象: 。
(2)实验二的现象: 。
(3)实验一中发生反应的化学方程式: 。
(4)实验一和实验二都产生了明显现象。但有一些化学反应虽然发生,却没有明显现象。例如二氧化碳通入氢氧化钠溶液中没有明显现象,那么二氧化碳与氢氧化钠是否发生了化学反应呢 (本实验中忽略CO2溶于水)
①甲同学设计了如图所示实验,当观察到 现象时,说明两者发生了化学反应。
②乙同学重新设计实验方案:取NaOH溶液于试管中,通入少量CO2,然后向所得溶液中加入
溶液,当观察到 现象时,也能证明二氧化碳与氢氧化钠发生了化学反应。
15. [2020·潍坊改编] 某同学总结的Ca(OH)2的化学性质如图8。下列说法错误的是 ( )
A.甲一定是碳酸盐
B.反应②可用于改良酸性土壤
C.反应③可用于检验某种温室气体
D.向澄清石灰水中加入紫色石蕊试液,试液由紫色变为蓝色
答案
1.B 2.D
3.D 氢氧化钠固体在空气中易吸水而潮解,易与二氧化碳反应而变质,因此应密封保存。
4.(1)N和OH-
(2)有酚酞的干燥纸条不变色,有酚酞的湿润纸条变红
5.水 CaO+H2OCa(OH)2
Ca(OH)2+CO2CaCO3↓+H2O
6.C
7.B 碱溶液有相似的化学性质,是因为所有的碱溶液中都含有OH-。
8.SO2+2NaOHNa2SO3+H2O 氢氧化钙
SO2+Ca(OH)2CaSO3↓+H2O
9.D 由图示可知气体用碱石灰来干燥,说明气体显中性或碱性,不能是酸性气体,由收集方法可知该气体密度比空气小。
10.A 本题考查的是实验设计与评价。二氧化碳和氢氧化钠溶液反应无明显现象,可以借助反应中密闭容器内气压的变化或者反应中生成物的性质来验证二者发生了化学反应。
11.(1)①Ca(OH)2+CuSO4CaSO4+Cu(OH)2↓
②Ca(OH)2+Na2CO3CaCO3↓+2NaOH
③Ca(OH)2+CO2CaCO3↓+H2O ①③
(2)Na+ C OH-
(2)变质前溶液中存在的主要离子是钠离子和氢氧根离子,完全变质的NaOH溶液中含有钠离子、碳酸根离子等,故“”表示Na+,“”表示C,“”表示OH-。
12.(1)分解反应
(2)CaO+H2OCa(OH)2 放出
(3)4.4 kg
(3)设7.4 kg氢氧化钙最多能吸收的二氧化碳质量为x。
Ca(OH)2+CO2CaCO3↓+H2O
74 44
7.4 kg x
= x=4.4 kg
用7.4 kg氢氧化钙最多能吸收的二氧化碳质量为4.4 kg。
13.(1)酸 (2)2.2
(3)解:设10 g固体样品中碳酸钠的质量为x。
Na2CO3+2HCl2NaCl+H2O+CO2↑
106 44
x 2.2 g
=
x=5.3 g
固体样品中碳酸钠的质量分数为×100%=53%。
答:固体样品中碳酸钠的质量分数为53%。
(2)根据质量守恒定律,产生的二氧化碳气体的质量为80.00 g+90 g-167.80 g=2.2 g。
14.(1)产生蓝色沉淀,溶液由蓝色变为无色
(2)溶液中有气泡冒出,产生有刺激性气味的气体
(3)2NaOH+CuSO4Cu(OH)2↓+Na2SO4
(4)①气球膨胀 ②足量稀盐酸 有气泡产生(与前一空对应即可)
15.A 甲不一定是碳酸盐,也可能是硫酸铜等盐,氢氧化钙能与硫酸铜反应生成氢氧化铜沉淀和硫酸钙;熟石灰可用于改良酸性土壤;反应③是非金属氧化物与氢氧化钙反应生成盐和水,二氧化碳能与氢氧化钙反应生成碳酸钙沉淀和水,反应③可用于检验温室气体二氧化碳;澄清石灰水显碱性,向澄清石灰水中加入紫色石蕊试液,试液由紫色变为蓝色。
第3课时 常见的碱 复分解反应
知识点 1 几种常见的碱
1.掌握物质的分类是学好化学的基础。下列物质中属于碱的是 ( )
A. NaCl B. KOH
C. MgO D.Cu
2.下列选项中物质的俗名、化学式、类别、用途完全对应的是 ( )
A.氢氧化钙 Ca(OH)2 碱 去除油污
B.生石灰 CaO 氧化物 补钙剂
C.双氧水 H2O2 酸 消毒
D.火碱 NaOH 碱 生产橡胶
3.氢氧化钠固体必须密封保存,这是因为氢氧化钠固体 ( )
A.易挥发和有腐蚀性
B.易挥发和易潮解
C.有腐蚀性和易与二氧化碳反应
D.易潮解和易与二氧化碳反应
4.氨水(NH3·H2O)也是一种常见的碱,是NH3溶于水后形成的溶液。氨水很不稳定,容易放出有刺激性气味的NH3。根据所学知识回答下列问题。
(1)NH3·H2O在水溶液中解离出来的离子有 。
(2)将一片有酚酞的干燥纸条和一片有酚酞的湿润纸条分别放入两瓶干燥的NH3中,现象是
。
5.在某些食品的包装袋内,有一个装有白色颗粒状固体的小纸袋,上面写着“干燥剂,主要成分为生石灰”,生石灰能作干燥剂是因为它能与 反应。如果将小纸袋拿出来放在空气中,一段时间后,会发现纸袋内的白色颗粒粘在一起成为块状,用化学方程式解释原因:① ;② 。
知识点 2 复分解反应
6.下列不属于复分解反应的是 ( )
A.Fe2O3+3H2SO4Fe2(SO4)3+3H2O
B.Na2CO3+2HCl2NaCl+CO2↑+H2O
C.CO2+Ca(OH)2CaCO3↓+H2O
D.2NaOH+CuSO4Cu(OH)2↓+Na2SO4
知识点 3 碱的化学性质
7.氢氧化钠溶液和氨水都能使酚酞试液变红,其原因是两种溶液中均含有一种相同的粒子,这种粒子是 ( )
A.H+ B.OH-
C.H2O D.H
8.碱溶液能与某些非金属氧化物反应。某些冶炼厂排放的废气中含有二氧化硫,为避免污染空气,可以用氢氧化钠溶液吸收,发生反应的化学方程式为 ,也可以用 溶液吸收,发生反应的化学方程式为 。
9.下列几种气体可用如图所示装置干燥、收集的是 ( )
①H2 ②O2 ③CO2 ④SO2 ⑤CH4 ⑥NH3
A.①②③ B.②③⑤
C.③④⑥ D.①⑤⑥
10.下列验证“CO2与NaOH溶液反应”的装置中,不能观察到明显现象的是(密封装置的气密性均良好) ( )
11.(1)请写出氢氧化钙溶液与下列物质反应的化学方程式。
①与硫酸铜溶液反应: ;
②与碳酸钠溶液反应: ;
③与二氧化碳反应: 。
属于碱溶液的共同性质的是 (填序号)。
(2)如图表示NaOH溶液的变质过程(变质前后溶液中存在的主要离子),请写出每种图形代表的离子(填离子符号)。
, , 。
12.图是超细碳酸钙的生产流程,请回答相关问题。
(1)石灰窑中发生的反应是CaCO3CaO+CO2↑,该反应属于 (填基本反应类型)。
(2)写出乳化池中发生反应的化学方程式: ,反应 (填“放出”或“吸收”)热量。
(3)7.4 kg氢氧化钙最多能吸收的二氧化碳质量为 。
13.实验室有瓶久置的氢氧化钠固体,某学习小组为了研究其变质情况,进行了如下实验。(电子秤示数单位为“g”)
(1)滴入紫色石蕊试液后溶液变为红色,说明反应后溶液呈 性。
(2)上述实验中产生的二氧化碳气体质量为 g。
(3)计算固体样品中碳酸钠的质量分数。
14.[2020·黑龙江改编] 兴趣小组设计实验探究氢氧化钠的性质,请你参与他们的探究。
实验一 实验二
实验 操作
实验 现象
实验 结论 氢氧化钠能与硫酸铜发生反应 氢氧化钠能与氯化铵发生反应
(1)实验一的现象: 。
(2)实验二的现象: 。
(3)实验一中发生反应的化学方程式: 。
(4)实验一和实验二都产生了明显现象。但有一些化学反应虽然发生,却没有明显现象。例如二氧化碳通入氢氧化钠溶液中没有明显现象,那么二氧化碳与氢氧化钠是否发生了化学反应呢 (本实验中忽略CO2溶于水)
①甲同学设计了如图所示实验,当观察到 现象时,说明两者发生了化学反应。
②乙同学重新设计实验方案:取NaOH溶液于试管中,通入少量CO2,然后向所得溶液中加入
溶液,当观察到 现象时,也能证明二氧化碳与氢氧化钠发生了化学反应。
15. [2020·潍坊改编] 某同学总结的Ca(OH)2的化学性质如图8。下列说法错误的是 ( )
A.甲一定是碳酸盐
B.反应②可用于改良酸性土壤
C.反应③可用于检验某种温室气体
D.向澄清石灰水中加入紫色石蕊试液,试液由紫色变为蓝色
答案
1.B 2.D
3.D 氢氧化钠固体在空气中易吸水而潮解,易与二氧化碳反应而变质,因此应密封保存。
4.(1)N和OH-
(2)有酚酞的干燥纸条不变色,有酚酞的湿润纸条变红
5.水 CaO+H2OCa(OH)2
Ca(OH)2+CO2CaCO3↓+H2O
6.C
7.B 碱溶液有相似的化学性质,是因为所有的碱溶液中都含有OH-。
8.SO2+2NaOHNa2SO3+H2O 氢氧化钙
SO2+Ca(OH)2CaSO3↓+H2O
9.D 由图示可知气体用碱石灰来干燥,说明气体显中性或碱性,不能是酸性气体,由收集方法可知该气体密度比空气小。
10.A 本题考查的是实验设计与评价。二氧化碳和氢氧化钠溶液反应无明显现象,可以借助反应中密闭容器内气压的变化或者反应中生成物的性质来验证二者发生了化学反应。
11.(1)①Ca(OH)2+CuSO4CaSO4+Cu(OH)2↓
②Ca(OH)2+Na2CO3CaCO3↓+2NaOH
③Ca(OH)2+CO2CaCO3↓+H2O ①③
(2)Na+ C OH-
(2)变质前溶液中存在的主要离子是钠离子和氢氧根离子,完全变质的NaOH溶液中含有钠离子、碳酸根离子等,故“”表示Na+,“”表示C,“”表示OH-。
12.(1)分解反应
(2)CaO+H2OCa(OH)2 放出
(3)4.4 kg
(3)设7.4 kg氢氧化钙最多能吸收的二氧化碳质量为x。
Ca(OH)2+CO2CaCO3↓+H2O
74 44
7.4 kg x
= x=4.4 kg
用7.4 kg氢氧化钙最多能吸收的二氧化碳质量为4.4 kg。
13.(1)酸 (2)2.2
(3)解:设10 g固体样品中碳酸钠的质量为x。
Na2CO3+2HCl2NaCl+H2O+CO2↑
106 44
x 2.2 g
=
x=5.3 g
固体样品中碳酸钠的质量分数为×100%=53%。
答:固体样品中碳酸钠的质量分数为53%。
(2)根据质量守恒定律,产生的二氧化碳气体的质量为80.00 g+90 g-167.80 g=2.2 g。
14.(1)产生蓝色沉淀,溶液由蓝色变为无色
(2)溶液中有气泡冒出,产生有刺激性气味的气体
(3)2NaOH+CuSO4Cu(OH)2↓+Na2SO4
(4)①气球膨胀 ②足量稀盐酸 有气泡产生(与前一空对应即可)
15.A 甲不一定是碳酸盐,也可能是硫酸铜等盐,氢氧化钙能与硫酸铜反应生成氢氧化铜沉淀和硫酸钙;熟石灰可用于改良酸性土壤;反应③是非金属氧化物与氢氧化钙反应生成盐和水,二氧化碳能与氢氧化钙反应生成碳酸钙沉淀和水,反应③可用于检验温室气体二氧化碳;澄清石灰水显碱性,向澄清石灰水中加入紫色石蕊试液,试液由紫色变为蓝色。
