沪教版(全国)化学九年级下册同步课时练习:第7章 第3节 几种重要的盐 第1课时 盐 复分解反应发生的条件(word版 含答案)
文档属性
| 名称 | 沪教版(全国)化学九年级下册同步课时练习:第7章 第3节 几种重要的盐 第1课时 盐 复分解反应发生的条件(word版 含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 135.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-31 00:00:00 | ||
图片预览


文档简介
第3节 几种重要的盐
第1课时 盐 复分解反应发生的条件
知识点 1 盐的组成、分类和命名
1.[2020·福建改编] Na2CO3俗称纯碱,侯德榜为纯碱工业的发展作出了杰出贡献。Na2CO3属于 ( )
A.氧化物 B.盐
C.碱 D.酸
2.下列各种盐中,与其他三种盐对应的酸根不相同的是 ( )
A.硫酸铵 B.硫酸铝
C.纯碱 D.硫酸钠
3.写出下列常见盐溶液的颜色。
CuSO4溶液 FeCl2溶液
FeCl3溶液 KMnO4溶液
4.下表为部分酸、碱和盐在水中的溶解性。请回答:
离子 OH- N Cl- C S
H+ - 溶、挥 溶、挥 溶、挥 溶
Na+ 溶 溶 溶 溶 溶
Ca2+ 微 溶 溶 不 微
Ba2+ 溶 溶 溶 不 不
Cu2+ 不 溶 溶 - 溶
(1)CaSO4的溶解性: 。
(2)从上表中找出一种不溶性碱: (填化学式)。
(3)上表中有 种可溶性钠盐。
知识点 2 盐的化学性质
5.硫酸铜、碳酸钠、氯化钠都是常见的盐,按要求写出与这三种盐有关的化学方程式。
(1)与铁单质的置换反应: 。
(2)与盐酸的反应: 。
(3)与碱的反应:
①与氢氧化钠的反应: 。
②能生成氢氧化钠的反应: 。
(4)与盐的反应:
①氯化钠溶液中滴入硝酸银溶液 。
②碳酸钠溶液中滴入氯化钡溶液 。
据此,可以认识到盐能与 、 、 、 等类别的物质发生化学反应。
知识点 3 复分解反应发生的条件
6.判断下列各组物质相互间能否发生反应,若能,请写出化学方程式;若不能,请说明理由。
(1)HCl和NaOH: 。
(2)Na2CO3和BaCl2: 。
(3)Na2SO4和KCl: 。
(4)CuSO4和Ca(OH)2: 。
7.[2020·深圳] 小深同学用思维导图梳理了Na2CO3的相关知识,其中描述错误的是 ( )
8.[2020·苏州] 下列各组离子在溶液中能大量共存的是 ( )
A.N、S、N B.H+、Ba2+、OH-
C.Fe3+、Na+、OH- D.Ca2+、Cl-、C
9.[2020·咸宁] 将一定质量的锌粉加入Cu(NO3)2、AgNO3两种物质的混合溶液中,充分反应后过滤,得到滤液和滤渣。下列有关说法正确的是 ( )
A.若滤液为蓝色,则滤渣中一定有银和铜
B.若滤液为无色,则滤渣中一定有银和锌,可能含有铜
C.若向滤液中加入稀盐酸有白色沉淀生成,则原滤液中溶质只有AgNO3和Zn(NO3)2
D.若向滤渣中加入稀盐酸有气泡产生,则滤液中溶质只有Zn(NO3)2
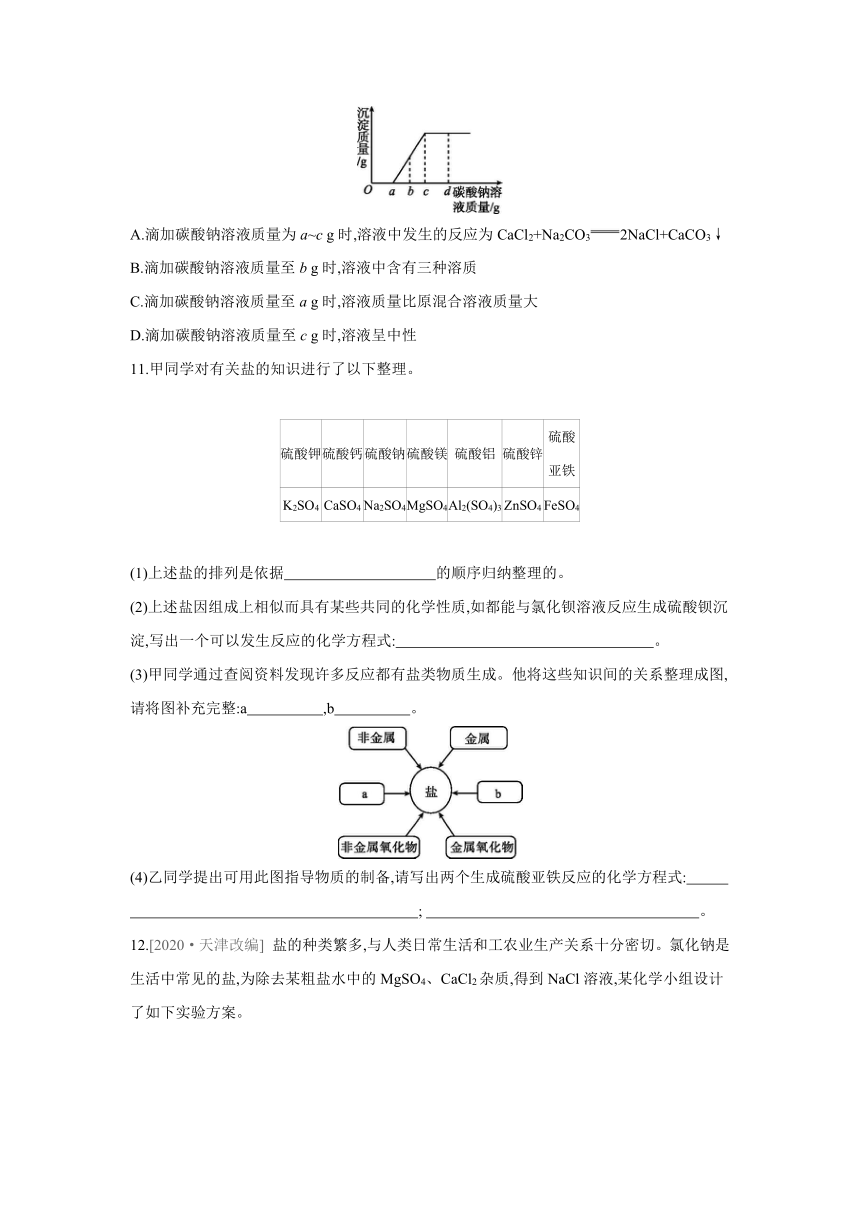
10.现有盐酸和氯化钙的混合溶液,向其中逐滴滴入碳酸钠溶液,生成沉淀质量与滴入碳酸钠溶液质量的变化关系如图所示。下列说法错误的是 ( )
A.滴加碳酸钠溶液质量为a~c g时,溶液中发生的反应为CaCl2+Na2CO32NaCl+CaCO3↓
B.滴加碳酸钠溶液质量至b g时,溶液中含有三种溶质
C.滴加碳酸钠溶液质量至a g时,溶液质量比原混合溶液质量大
D.滴加碳酸钠溶液质量至c g时,溶液呈中性
11.甲同学对有关盐的知识进行了以下整理。
硫酸钾 硫酸钙 硫酸钠 硫酸镁 硫酸铝 硫酸锌 硫酸 亚铁
K2SO4 CaSO4 Na2SO4 MgSO4 Al2(SO4)3 ZnSO4 FeSO4
(1)上述盐的排列是依据 的顺序归纳整理的。
(2)上述盐因组成上相似而具有某些共同的化学性质,如都能与氯化钡溶液反应生成硫酸钡沉淀,写出一个可以发生反应的化学方程式: 。
(3)甲同学通过查阅资料发现许多反应都有盐类物质生成。他将这些知识间的关系整理成图,请将图补充完整:a ,b 。
(4)乙同学提出可用此图指导物质的制备,请写出两个生成硫酸亚铁反应的化学方程式:
; 。
12.[2020·天津改编] 盐的种类繁多,与人类日常生活和工农业生产关系十分密切。氯化钠是生活中常见的盐,为除去某粗盐水中的MgSO4、CaCl2杂质,得到NaCl溶液,某化学小组设计了如下实验方案。
(1)过滤操作中所用到的玻璃仪器有烧杯、漏斗和 。
(2)写出一个以上方案中有关反应的化学方程式:
(3)溶液乙中含有的杂质为 ,请将以上方案补充完整:
。
13.早在西汉时期的《淮南万毕术》中就记载着“曾青得铁则化为铜”,这是现代湿法冶金的先驱。现有含1.6 kg硫酸铜的工业废液,加入铁粉回收铜,请计算:
(1)硫酸铜中铜元素的质量分数为 。
(2)理论上所消耗的铁粉的质量。
中考链接
14.[2021·苏州] 下列各组离子在溶液中能大量共存的是 ( )
A.K+、Ca2+、Cl- B.Ba2+、S、Cl-
C.N、H+、OH- D.H+、Na+、C
答案
1.B 2.C
3.蓝色 浅绿色 黄色 紫红色
4.(1)微溶 (2)Cu(OH)2 (3)4
5.(1)Fe+CuSO4Cu+FeSO4
(2)Na2CO3+2HCl2NaCl+H2O+CO2↑
(3)①CuSO4+2NaOHCu(OH)2↓+Na2SO4
②Na2CO3+Ca(OH)2CaCO3↓+2NaOH(合理即可)
(4)①AgNO3+NaClNaNO3+AgCl↓
②Na2CO3+BaCl2BaCO3↓+2NaCl
某些金属单质 酸 碱 盐
6.(1)HCl+NaOHNaCl+H2O
(2)Na2CO3+BaCl22NaCl+BaCO3↓
(3)不能,两种溶液混合没有沉淀、气体或水生成(或不满足复分解反应发生的条件)
(4)CuSO4+Ca(OH)2Cu(OH)2↓+CaSO4
7.A 8.A 9.D
10.B 向盐酸和氯化钙的混合溶液中逐滴滴入碳酸钠溶液,滴入碳酸钠溶液的质量小于a g 时的反应是Na2CO3+2HCl2NaCl+H2O+CO2↑,a~c g时的反应是CaCl2+Na2CO32NaCl+CaCO3↓;滴加碳酸钠溶液质量至b g时,溶液中含有的溶质是生成的氯化钠和剩余的氯化钙;滴加碳酸钠溶液质量至a g时,所加物质的质量远大于释放出的二氧化碳的质量,故溶液质量比原混合溶液质量大;滴加碳酸钠溶液质量至c g时,恰好完全反应,此时溶质只有氯化钠,溶液呈中性。
11.(1)所含金属的活动性由强到弱
(2)K2SO4+BaCl22KCl+BaSO4↓(合理即可)
(3)酸 碱(顺序可调换)
(4)Fe+H2SO4FeSO4+H2↑
FeO+H2SO4FeSO4+H2O(合理即可)
12.(1)玻璃棒
(2)Ba(OH)2+MgSO4BaSO4↓+Mg(OH)2↓[或Ba(OH)2+Na2CO3BaCO3↓+2NaOH或CaCl2+Na2CO3CaCO3↓+2NaCl]
(3)Na2CO3和NaOH 在溶液乙中加入适量稀盐酸
13.(1)40%
(2)解:设理论上所消耗的铁粉的质量为x。
Fe+CuSO4Cu+FeSO4
56 160
x 1.6 kg
= x=0.56 kg
答:理论上所消耗的铁粉的质量为0.56 kg。
(1)纯净物中某元素的质量分数=×100%,则硫酸铜中铜元素的质量分数为×100%=40%。
14.A
第1课时 盐 复分解反应发生的条件
知识点 1 盐的组成、分类和命名
1.[2020·福建改编] Na2CO3俗称纯碱,侯德榜为纯碱工业的发展作出了杰出贡献。Na2CO3属于 ( )
A.氧化物 B.盐
C.碱 D.酸
2.下列各种盐中,与其他三种盐对应的酸根不相同的是 ( )
A.硫酸铵 B.硫酸铝
C.纯碱 D.硫酸钠
3.写出下列常见盐溶液的颜色。
CuSO4溶液 FeCl2溶液
FeCl3溶液 KMnO4溶液
4.下表为部分酸、碱和盐在水中的溶解性。请回答:
离子 OH- N Cl- C S
H+ - 溶、挥 溶、挥 溶、挥 溶
Na+ 溶 溶 溶 溶 溶
Ca2+ 微 溶 溶 不 微
Ba2+ 溶 溶 溶 不 不
Cu2+ 不 溶 溶 - 溶
(1)CaSO4的溶解性: 。
(2)从上表中找出一种不溶性碱: (填化学式)。
(3)上表中有 种可溶性钠盐。
知识点 2 盐的化学性质
5.硫酸铜、碳酸钠、氯化钠都是常见的盐,按要求写出与这三种盐有关的化学方程式。
(1)与铁单质的置换反应: 。
(2)与盐酸的反应: 。
(3)与碱的反应:
①与氢氧化钠的反应: 。
②能生成氢氧化钠的反应: 。
(4)与盐的反应:
①氯化钠溶液中滴入硝酸银溶液 。
②碳酸钠溶液中滴入氯化钡溶液 。
据此,可以认识到盐能与 、 、 、 等类别的物质发生化学反应。
知识点 3 复分解反应发生的条件
6.判断下列各组物质相互间能否发生反应,若能,请写出化学方程式;若不能,请说明理由。
(1)HCl和NaOH: 。
(2)Na2CO3和BaCl2: 。
(3)Na2SO4和KCl: 。
(4)CuSO4和Ca(OH)2: 。
7.[2020·深圳] 小深同学用思维导图梳理了Na2CO3的相关知识,其中描述错误的是 ( )
8.[2020·苏州] 下列各组离子在溶液中能大量共存的是 ( )
A.N、S、N B.H+、Ba2+、OH-
C.Fe3+、Na+、OH- D.Ca2+、Cl-、C
9.[2020·咸宁] 将一定质量的锌粉加入Cu(NO3)2、AgNO3两种物质的混合溶液中,充分反应后过滤,得到滤液和滤渣。下列有关说法正确的是 ( )
A.若滤液为蓝色,则滤渣中一定有银和铜
B.若滤液为无色,则滤渣中一定有银和锌,可能含有铜
C.若向滤液中加入稀盐酸有白色沉淀生成,则原滤液中溶质只有AgNO3和Zn(NO3)2
D.若向滤渣中加入稀盐酸有气泡产生,则滤液中溶质只有Zn(NO3)2
10.现有盐酸和氯化钙的混合溶液,向其中逐滴滴入碳酸钠溶液,生成沉淀质量与滴入碳酸钠溶液质量的变化关系如图所示。下列说法错误的是 ( )
A.滴加碳酸钠溶液质量为a~c g时,溶液中发生的反应为CaCl2+Na2CO32NaCl+CaCO3↓
B.滴加碳酸钠溶液质量至b g时,溶液中含有三种溶质
C.滴加碳酸钠溶液质量至a g时,溶液质量比原混合溶液质量大
D.滴加碳酸钠溶液质量至c g时,溶液呈中性
11.甲同学对有关盐的知识进行了以下整理。
硫酸钾 硫酸钙 硫酸钠 硫酸镁 硫酸铝 硫酸锌 硫酸 亚铁
K2SO4 CaSO4 Na2SO4 MgSO4 Al2(SO4)3 ZnSO4 FeSO4
(1)上述盐的排列是依据 的顺序归纳整理的。
(2)上述盐因组成上相似而具有某些共同的化学性质,如都能与氯化钡溶液反应生成硫酸钡沉淀,写出一个可以发生反应的化学方程式: 。
(3)甲同学通过查阅资料发现许多反应都有盐类物质生成。他将这些知识间的关系整理成图,请将图补充完整:a ,b 。
(4)乙同学提出可用此图指导物质的制备,请写出两个生成硫酸亚铁反应的化学方程式:
; 。
12.[2020·天津改编] 盐的种类繁多,与人类日常生活和工农业生产关系十分密切。氯化钠是生活中常见的盐,为除去某粗盐水中的MgSO4、CaCl2杂质,得到NaCl溶液,某化学小组设计了如下实验方案。
(1)过滤操作中所用到的玻璃仪器有烧杯、漏斗和 。
(2)写出一个以上方案中有关反应的化学方程式:
(3)溶液乙中含有的杂质为 ,请将以上方案补充完整:
。
13.早在西汉时期的《淮南万毕术》中就记载着“曾青得铁则化为铜”,这是现代湿法冶金的先驱。现有含1.6 kg硫酸铜的工业废液,加入铁粉回收铜,请计算:
(1)硫酸铜中铜元素的质量分数为 。
(2)理论上所消耗的铁粉的质量。
中考链接
14.[2021·苏州] 下列各组离子在溶液中能大量共存的是 ( )
A.K+、Ca2+、Cl- B.Ba2+、S、Cl-
C.N、H+、OH- D.H+、Na+、C
答案
1.B 2.C
3.蓝色 浅绿色 黄色 紫红色
4.(1)微溶 (2)Cu(OH)2 (3)4
5.(1)Fe+CuSO4Cu+FeSO4
(2)Na2CO3+2HCl2NaCl+H2O+CO2↑
(3)①CuSO4+2NaOHCu(OH)2↓+Na2SO4
②Na2CO3+Ca(OH)2CaCO3↓+2NaOH(合理即可)
(4)①AgNO3+NaClNaNO3+AgCl↓
②Na2CO3+BaCl2BaCO3↓+2NaCl
某些金属单质 酸 碱 盐
6.(1)HCl+NaOHNaCl+H2O
(2)Na2CO3+BaCl22NaCl+BaCO3↓
(3)不能,两种溶液混合没有沉淀、气体或水生成(或不满足复分解反应发生的条件)
(4)CuSO4+Ca(OH)2Cu(OH)2↓+CaSO4
7.A 8.A 9.D
10.B 向盐酸和氯化钙的混合溶液中逐滴滴入碳酸钠溶液,滴入碳酸钠溶液的质量小于a g 时的反应是Na2CO3+2HCl2NaCl+H2O+CO2↑,a~c g时的反应是CaCl2+Na2CO32NaCl+CaCO3↓;滴加碳酸钠溶液质量至b g时,溶液中含有的溶质是生成的氯化钠和剩余的氯化钙;滴加碳酸钠溶液质量至a g时,所加物质的质量远大于释放出的二氧化碳的质量,故溶液质量比原混合溶液质量大;滴加碳酸钠溶液质量至c g时,恰好完全反应,此时溶质只有氯化钠,溶液呈中性。
11.(1)所含金属的活动性由强到弱
(2)K2SO4+BaCl22KCl+BaSO4↓(合理即可)
(3)酸 碱(顺序可调换)
(4)Fe+H2SO4FeSO4+H2↑
FeO+H2SO4FeSO4+H2O(合理即可)
12.(1)玻璃棒
(2)Ba(OH)2+MgSO4BaSO4↓+Mg(OH)2↓[或Ba(OH)2+Na2CO3BaCO3↓+2NaOH或CaCl2+Na2CO3CaCO3↓+2NaCl]
(3)Na2CO3和NaOH 在溶液乙中加入适量稀盐酸
13.(1)40%
(2)解:设理论上所消耗的铁粉的质量为x。
Fe+CuSO4Cu+FeSO4
56 160
x 1.6 kg
= x=0.56 kg
答:理论上所消耗的铁粉的质量为0.56 kg。
(1)纯净物中某元素的质量分数=×100%,则硫酸铜中铜元素的质量分数为×100%=40%。
14.A
