6.3物质的溶解性同步练习 -2021-2022学年九年级化学沪教版下册(word版 含答案)
文档属性
| 名称 | 6.3物质的溶解性同步练习 -2021-2022学年九年级化学沪教版下册(word版 含答案) |
|
|
| 格式 | docx | ||
| 文件大小 | 117.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-31 00:00:00 | ||
图片预览


文档简介
沪教版(全国) 6.3 物质的溶解性 同步练习
一、单选题
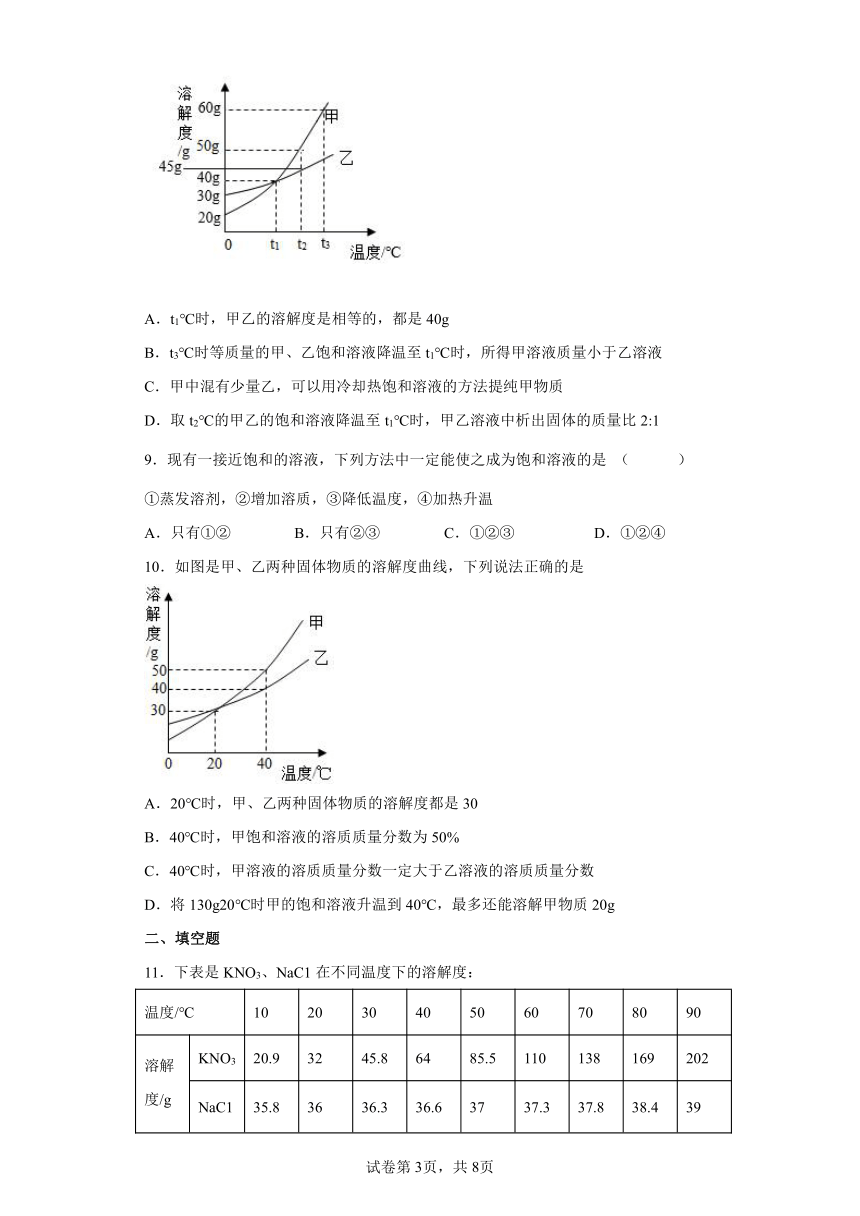
1.20℃时,将等质量的a、b两种固体,分别加入到盛有l00g水的烧杯中,充分搅拌后现象如图甲,升温到50℃时,现象如图乙,a、b两种固体的溶解度曲线如图丙。下列说法正确的是
A.图丙中M表示b的溶解度曲线
B.图甲溶液中溶质的质量分数a大于b
C.图乙中a、b溶液一定是不饱和溶液
D.30℃时a、b溶液溶质质量分数不相等
2.下列关于溶液的说法中,正确的是
A.泥土加入水中,振荡后可以形成溶液
B.蔗糖溶液上半部分溶液的甜度低于下半部分溶液的甜度
C.氢氧化钠溶液能导电,因为溶液中有较多自由移动的离子
D.氯化钠饱和溶液中不能再溶解少量硝酸钾晶体
3.甲、乙两种物质的溶解度曲线如图,下列说法正确的是
A.时,甲、乙两种物质溶液的溶解度相等
B.时,乙物质饱和溶液降温到,溶质质量分数升高
C.时,甲、乙两种物质饱和溶液的溶质质量分数相等
D.时,甲物质溶液的质量分数一定大于乙物质溶液的质量分数
4.下列说法正确的是( )
A.均一、稳定的液体都是溶液
B.溶质均以离子形式分散到溶剂中
C.同一温度下,硝酸钾的饱和溶液比不饱和溶液浓
D.饱和溶液析出晶体后溶质质量分数一定变小
5.下列方法能使硝酸钾固体在水中溶解度增大的是
A.增加水的质量 B.增加硝酸钾的质量
C.升高溶液的温度 D.将硝酸钾固体粉碎
6.甲、乙两种物质的溶解度曲线如图所示,下列说法正确的是
A.t1℃时,甲、乙两物质的溶解度相等
B.乙物质的溶解度大于甲物质的溶解度
C.t2℃时,乙物质的饱和溶液降温至t1℃,乙溶液变为不饱和溶液
D.t2℃时,30g甲物质能溶解于50g水中形成80g的溶液
7.25℃时,探究某固体物质的溶解性,实验记录如下表。下列实验结论正确的是
编号 ① ② ③ ④
水的质量/g 50 50 50 50
加入固体质量/g 5 10 15 20
现象 固体完全溶解 固体完全溶解 剩余少量固体 剩余较多固体
A.实验①所得溶液质量分数为10%
B.实验说明25℃时该物质的溶解度是20g
C.实验③④所得溶液质量分数相同
D.实验④所得溶液中含溶质20g
8.分析下图溶解度曲线,判断下列说法错误的是
A.t1℃时,甲乙的溶解度是相等的,都是40g
B.t3℃时等质量的甲、乙饱和溶液降温至t1℃时,所得甲溶液质量小于乙溶液
C.甲中混有少量乙,可以用冷却热饱和溶液的方法提纯甲物质
D.取t2℃的甲乙的饱和溶液降温至t1℃时,甲乙溶液中析出固体的质量比2:1
9.现有一接近饱和的溶液,下列方法中一定能使之成为饱和溶液的是 ( )
①蒸发溶剂,②增加溶质,③降低温度,④加热升温
A.只有①② B.只有②③ C.①②③ D.①②④
10.如图是甲、乙两种固体物质的溶解度曲线,下列说法正确的是
A.20℃时,甲、乙两种固体物质的溶解度都是30
B.40℃时,甲饱和溶液的溶质质量分数为50%
C.40℃时,甲溶液的溶质质量分数一定大于乙溶液的溶质质量分数
D.将130g20℃时甲的饱和溶液升温到40℃,最多还能溶解甲物质20g
二、填空题
11.下表是KNO3、NaC1在不同温度下的溶解度:
温度/℃ 10 20 30 40 50 60 70 80 90
溶解度/g KNO3 20.9 32 45.8 64 85.5 110 138 169 202
NaC1 35.8 36 36.3 36.6 37 37.3 37.8 38.4 39
根据上表信息,完成下列各题
(1)60℃时,KNO3的溶解度为__________。
(2)溶解度受温度的影响较大的物质是___________。
(3)10℃时,将KNO3和NaC1的饱和溶液同时升高温度到30℃,所得溶液中溶质的质量分数的大小关系是:前者________后者(填“大于”“小于”或“等于”)。
(4)20℃时,15gNaCl加入到40g水中充分溶解所得溶液的质量为_________。
12.如图所示,一物体悬挂在弹簧秤上并浸没在饱和的氯化钠溶液中,在恒温条件下向烧杯内的溶液中分别加入下列物质(悬挂物不参与反应),说明弹簧秤示数变化情况(填“变大”“不变”或“变小”):
(1)如果加入氯化钠晶体,弹簧秤示数______。
(2)如果加入蒸馏水,弹簧秤示数______。
(3)如果加入氯化钾晶体,弹簧秤示数______。
13.根据图中a、b、c三种固体的溶解度曲线,回答问题。
(1)N点的意义是_______________________________。
(2)温度为t1 ℃时,a、b、c三种物质的溶解度从大到小的顺序是____________。
(3)将t3 ℃时a、b、c三种物质的饱和溶液都降温到t1 ℃,三种溶液中溶质的质量分数由大到小的顺序为____________。
14.请根据如图甲、乙、丙三种固体物质的溶解度曲线,回答下列问题。
(1)在___℃时,甲、丙两种物质的溶解度相等;
(2)在t2°C时,向盛有25g甲物质的烧杯中加入50g水,充分溶解后,所得溶液的溶质质量分数为_____;
(3)若乙物质中混有少量甲物质,最好采用____(填"降温结晶''或“蒸发结晶")的方法提纯;
(4)t2°C时,甲、乙、丙三种物质的饱和溶液各100g,所含溶剂的质量由大到小的顺序是____。
15.NaCl、KNO3的部分溶解度数据见下表。
温度(℃) 10 20 30 40 60 80 100
溶解度(g/100g水) 硝酸钾 20.9 31.6 45.8 64 110 169 246
氯化钠 35.8 36 36.3 36.4 37 38.4 39.8
①20℃时,硝酸钾的溶解度是_______。
②20℃时,称取 60g硝酸钾固体加入到100g水中,用_______(写出仪器名称)搅拌,充分溶解后得到_______(选填“饱和”或“不饱和”)溶液。将此溶液升温至 60℃,所得溶液的溶质质量分数是_______。
③从含有84.5g硝酸钾和8g氯化钠的混合物中提纯硝酸钾,进行如下实验。(实验中不考虑各种损耗)
I、操作1的名称_______。
II、溶液1、2、3中关于溶质硝酸钾质量的大小关系_______(用“1”、“2”、“3”表示)
III、固体M的成分及质量是_______。
IV、对整个实验过程分析正确的是_______。
A、40℃~60℃开始析出晶体
B、氯化钠在整个过程中一直保持不饱和状态
C、上述方法不能将氯化钠和硝酸钾完全分离
D、若溶液1直接降温至20℃,析出硝酸钾的质量不变
三、综合应用题
16.硝酸钾、氯化钾的溶解度曲线如图1所示。图2是有关硝酸钾溶液的实验操作及变化情况。
(1)P点的含义是__________。
(2)当温度__________时,氯化钾的溶解度大于硝酸钾的溶解度。
(3)若保持溶液的质量不变,图2中操作I是__________。
(4)下列说法不正确的是__________(填选项字母)。
a.①与②的溶质质量可能相等
b.②与③的溶质质量分数一定相等
c.相同温度下、等质量的硝酸钾和氯化钾饱和溶液,恒温蒸发等质量的水,析出的晶体质量:硝酸钾>氯化钾
d.将硝酸钾和氯化钾饱和溶液,从t2℃降低到t1℃,析出晶体质量:硝酸钾>氯化钾
e.②的溶质质量分数一定大于①的溶质质量分数
17.溶液在日常生活、工农业生产和科学研究中具有广泛的用途。
(1)消毒酒精是医疗上常用的一种溶液,其溶质是________。
(2)现有100g溶质质量分数为10%的硝酸钾溶液,若使溶液的溶质质量分数增大一倍,应蒸发掉水______g。
(3)为了探究影响物质溶解性的因素,小林设计并进行了如下实验。
①实验一的目的是_________。实验一的现象是:氯化钠溶于水溶液,氯化钠几乎不溶于酒精。对比得出的实验结论是_________。
②实验二的目的是________。
思路分析:在实验中需要改变的因素是________,需要保持不变的因素是________。
实验步骤及现象:取一定量的硝酸钾加入5mL水中,充分振荡,有部分硝酸钾未溶解;加热后硝酸钾完全溶解,冷至室温又有部分硝酸钾析出。
实验结论:在________保持不变的情况下,当温度升高时,硝酸钾晶体在水中的最大溶解量会________;降低温度时,其最大溶解量会_______。
18.溶液与人类生产、生活密切相关。
(1)A、B、C三种固体物质的溶解度曲线如图所示。
①时,A、B、C三种物质的溶解度由大到小的顺序是 _____ 。
②A、B、C三种物质中,溶解度随温度升高而减小的是 _____ 。
③时,完全溶解ag A物质最少需要水的质量是 _____ g。
④时,相同质量的A、B饱和溶液中,A的饱和溶液中所含水的质量 _____ B的饱和溶液中所含水的质量(填“大于”、“等于”或“小于”)
(2)实验室欲除去粗盐样品中含有的不溶性泥沙,在过滤操作中需要用到的实验仪器和用品有:烧杯、铁架台(带铁圈)、玻璃棒、 _____ 和滤纸。
(3)在实验室中,配制溶质质量分数为的氯化钠溶液45g,需要氯化钠固体的质量是 _____ g。将的氯化钠溶液配成含氯化钠为0.9%的溶液,得到氯化钠溶液的质量是 _____ g。
19.小可同学在学习了近一年的化学后,总结了一些说法,判断这些说法是否正确。若正确,请在旁边的空白栏打“√”,若错误,用溶质的化学式或者化学反应方程式证明。
说法 溶质的化学式或化学反应方程式
不是所有的溶液都是无色的 _________________
有一种单质和一种化合物生成的一定是置换反应 _____________________
饱和溶液降温,溶质质量分数一定减小 ______________________________
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.C
3.C
4.C
5.C
6.A
7.C
8.D
9.A
10.D
11. 110g KNO3 小于 54.4g
12. 不变 变大 变小
13. t2 ℃时,a、c两物质的溶解度相等 c>b>a b>a>c
14. t1 20% 降温结晶
15. 31.6g 玻璃棒 饱和 37.5% 过滤 1=2>3 硝酸钾68.7g BC
16. t1℃时,硝酸钾和氯化钾的溶解度相等 小于t1℃ 降低温度 cde
17. 酒精 50 比较氯化钠在水和酒精中的溶解情况 同种溶质在不同的溶剂中溶解性不同 比较温度对硝酸钾在水中的溶解性的影响 温度 一定质量的硝酸钾和一定质量的水(或溶质、溶剂的种类及质量) 溶质和溶剂的种类和质量 增加 减少
18. CBA .C 100 小于 漏斗 4.5 500
19. √ 合理方程式即可 Ca(OH)2 或其他合理答案
答案第1页,共2页
答案第1页,共2页
一、单选题
1.20℃时,将等质量的a、b两种固体,分别加入到盛有l00g水的烧杯中,充分搅拌后现象如图甲,升温到50℃时,现象如图乙,a、b两种固体的溶解度曲线如图丙。下列说法正确的是
A.图丙中M表示b的溶解度曲线
B.图甲溶液中溶质的质量分数a大于b
C.图乙中a、b溶液一定是不饱和溶液
D.30℃时a、b溶液溶质质量分数不相等
2.下列关于溶液的说法中,正确的是
A.泥土加入水中,振荡后可以形成溶液
B.蔗糖溶液上半部分溶液的甜度低于下半部分溶液的甜度
C.氢氧化钠溶液能导电,因为溶液中有较多自由移动的离子
D.氯化钠饱和溶液中不能再溶解少量硝酸钾晶体
3.甲、乙两种物质的溶解度曲线如图,下列说法正确的是
A.时,甲、乙两种物质溶液的溶解度相等
B.时,乙物质饱和溶液降温到,溶质质量分数升高
C.时,甲、乙两种物质饱和溶液的溶质质量分数相等
D.时,甲物质溶液的质量分数一定大于乙物质溶液的质量分数
4.下列说法正确的是( )
A.均一、稳定的液体都是溶液
B.溶质均以离子形式分散到溶剂中
C.同一温度下,硝酸钾的饱和溶液比不饱和溶液浓
D.饱和溶液析出晶体后溶质质量分数一定变小
5.下列方法能使硝酸钾固体在水中溶解度增大的是
A.增加水的质量 B.增加硝酸钾的质量
C.升高溶液的温度 D.将硝酸钾固体粉碎
6.甲、乙两种物质的溶解度曲线如图所示,下列说法正确的是
A.t1℃时,甲、乙两物质的溶解度相等
B.乙物质的溶解度大于甲物质的溶解度
C.t2℃时,乙物质的饱和溶液降温至t1℃,乙溶液变为不饱和溶液
D.t2℃时,30g甲物质能溶解于50g水中形成80g的溶液
7.25℃时,探究某固体物质的溶解性,实验记录如下表。下列实验结论正确的是
编号 ① ② ③ ④
水的质量/g 50 50 50 50
加入固体质量/g 5 10 15 20
现象 固体完全溶解 固体完全溶解 剩余少量固体 剩余较多固体
A.实验①所得溶液质量分数为10%
B.实验说明25℃时该物质的溶解度是20g
C.实验③④所得溶液质量分数相同
D.实验④所得溶液中含溶质20g
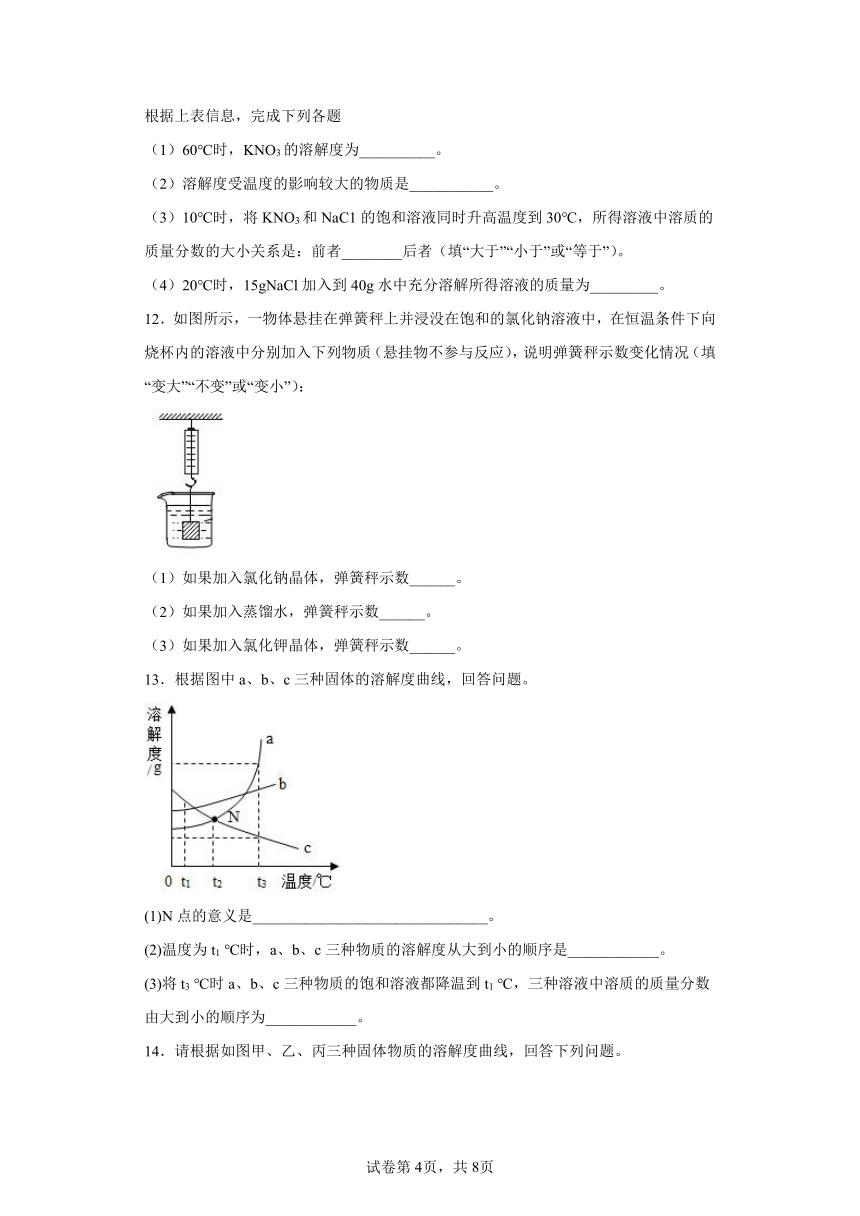
8.分析下图溶解度曲线,判断下列说法错误的是
A.t1℃时,甲乙的溶解度是相等的,都是40g
B.t3℃时等质量的甲、乙饱和溶液降温至t1℃时,所得甲溶液质量小于乙溶液
C.甲中混有少量乙,可以用冷却热饱和溶液的方法提纯甲物质
D.取t2℃的甲乙的饱和溶液降温至t1℃时,甲乙溶液中析出固体的质量比2:1
9.现有一接近饱和的溶液,下列方法中一定能使之成为饱和溶液的是 ( )
①蒸发溶剂,②增加溶质,③降低温度,④加热升温
A.只有①② B.只有②③ C.①②③ D.①②④
10.如图是甲、乙两种固体物质的溶解度曲线,下列说法正确的是
A.20℃时,甲、乙两种固体物质的溶解度都是30
B.40℃时,甲饱和溶液的溶质质量分数为50%
C.40℃时,甲溶液的溶质质量分数一定大于乙溶液的溶质质量分数
D.将130g20℃时甲的饱和溶液升温到40℃,最多还能溶解甲物质20g
二、填空题
11.下表是KNO3、NaC1在不同温度下的溶解度:
温度/℃ 10 20 30 40 50 60 70 80 90
溶解度/g KNO3 20.9 32 45.8 64 85.5 110 138 169 202
NaC1 35.8 36 36.3 36.6 37 37.3 37.8 38.4 39
根据上表信息,完成下列各题
(1)60℃时,KNO3的溶解度为__________。
(2)溶解度受温度的影响较大的物质是___________。
(3)10℃时,将KNO3和NaC1的饱和溶液同时升高温度到30℃,所得溶液中溶质的质量分数的大小关系是:前者________后者(填“大于”“小于”或“等于”)。
(4)20℃时,15gNaCl加入到40g水中充分溶解所得溶液的质量为_________。
12.如图所示,一物体悬挂在弹簧秤上并浸没在饱和的氯化钠溶液中,在恒温条件下向烧杯内的溶液中分别加入下列物质(悬挂物不参与反应),说明弹簧秤示数变化情况(填“变大”“不变”或“变小”):
(1)如果加入氯化钠晶体,弹簧秤示数______。
(2)如果加入蒸馏水,弹簧秤示数______。
(3)如果加入氯化钾晶体,弹簧秤示数______。
13.根据图中a、b、c三种固体的溶解度曲线,回答问题。
(1)N点的意义是_______________________________。
(2)温度为t1 ℃时,a、b、c三种物质的溶解度从大到小的顺序是____________。
(3)将t3 ℃时a、b、c三种物质的饱和溶液都降温到t1 ℃,三种溶液中溶质的质量分数由大到小的顺序为____________。
14.请根据如图甲、乙、丙三种固体物质的溶解度曲线,回答下列问题。
(1)在___℃时,甲、丙两种物质的溶解度相等;
(2)在t2°C时,向盛有25g甲物质的烧杯中加入50g水,充分溶解后,所得溶液的溶质质量分数为_____;
(3)若乙物质中混有少量甲物质,最好采用____(填"降温结晶''或“蒸发结晶")的方法提纯;
(4)t2°C时,甲、乙、丙三种物质的饱和溶液各100g,所含溶剂的质量由大到小的顺序是____。
15.NaCl、KNO3的部分溶解度数据见下表。
温度(℃) 10 20 30 40 60 80 100
溶解度(g/100g水) 硝酸钾 20.9 31.6 45.8 64 110 169 246
氯化钠 35.8 36 36.3 36.4 37 38.4 39.8
①20℃时,硝酸钾的溶解度是_______。
②20℃时,称取 60g硝酸钾固体加入到100g水中,用_______(写出仪器名称)搅拌,充分溶解后得到_______(选填“饱和”或“不饱和”)溶液。将此溶液升温至 60℃,所得溶液的溶质质量分数是_______。
③从含有84.5g硝酸钾和8g氯化钠的混合物中提纯硝酸钾,进行如下实验。(实验中不考虑各种损耗)
I、操作1的名称_______。
II、溶液1、2、3中关于溶质硝酸钾质量的大小关系_______(用“1”、“2”、“3”表示)
III、固体M的成分及质量是_______。
IV、对整个实验过程分析正确的是_______。
A、40℃~60℃开始析出晶体
B、氯化钠在整个过程中一直保持不饱和状态
C、上述方法不能将氯化钠和硝酸钾完全分离
D、若溶液1直接降温至20℃,析出硝酸钾的质量不变
三、综合应用题
16.硝酸钾、氯化钾的溶解度曲线如图1所示。图2是有关硝酸钾溶液的实验操作及变化情况。
(1)P点的含义是__________。
(2)当温度__________时,氯化钾的溶解度大于硝酸钾的溶解度。
(3)若保持溶液的质量不变,图2中操作I是__________。
(4)下列说法不正确的是__________(填选项字母)。
a.①与②的溶质质量可能相等
b.②与③的溶质质量分数一定相等
c.相同温度下、等质量的硝酸钾和氯化钾饱和溶液,恒温蒸发等质量的水,析出的晶体质量:硝酸钾>氯化钾
d.将硝酸钾和氯化钾饱和溶液,从t2℃降低到t1℃,析出晶体质量:硝酸钾>氯化钾
e.②的溶质质量分数一定大于①的溶质质量分数
17.溶液在日常生活、工农业生产和科学研究中具有广泛的用途。
(1)消毒酒精是医疗上常用的一种溶液,其溶质是________。
(2)现有100g溶质质量分数为10%的硝酸钾溶液,若使溶液的溶质质量分数增大一倍,应蒸发掉水______g。
(3)为了探究影响物质溶解性的因素,小林设计并进行了如下实验。
①实验一的目的是_________。实验一的现象是:氯化钠溶于水溶液,氯化钠几乎不溶于酒精。对比得出的实验结论是_________。
②实验二的目的是________。
思路分析:在实验中需要改变的因素是________,需要保持不变的因素是________。
实验步骤及现象:取一定量的硝酸钾加入5mL水中,充分振荡,有部分硝酸钾未溶解;加热后硝酸钾完全溶解,冷至室温又有部分硝酸钾析出。
实验结论:在________保持不变的情况下,当温度升高时,硝酸钾晶体在水中的最大溶解量会________;降低温度时,其最大溶解量会_______。
18.溶液与人类生产、生活密切相关。
(1)A、B、C三种固体物质的溶解度曲线如图所示。
①时,A、B、C三种物质的溶解度由大到小的顺序是 _____ 。
②A、B、C三种物质中,溶解度随温度升高而减小的是 _____ 。
③时,完全溶解ag A物质最少需要水的质量是 _____ g。
④时,相同质量的A、B饱和溶液中,A的饱和溶液中所含水的质量 _____ B的饱和溶液中所含水的质量(填“大于”、“等于”或“小于”)
(2)实验室欲除去粗盐样品中含有的不溶性泥沙,在过滤操作中需要用到的实验仪器和用品有:烧杯、铁架台(带铁圈)、玻璃棒、 _____ 和滤纸。
(3)在实验室中,配制溶质质量分数为的氯化钠溶液45g,需要氯化钠固体的质量是 _____ g。将的氯化钠溶液配成含氯化钠为0.9%的溶液,得到氯化钠溶液的质量是 _____ g。
19.小可同学在学习了近一年的化学后,总结了一些说法,判断这些说法是否正确。若正确,请在旁边的空白栏打“√”,若错误,用溶质的化学式或者化学反应方程式证明。
说法 溶质的化学式或化学反应方程式
不是所有的溶液都是无色的 _________________
有一种单质和一种化合物生成的一定是置换反应 _____________________
饱和溶液降温,溶质质量分数一定减小 ______________________________
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.C
3.C
4.C
5.C
6.A
7.C
8.D
9.A
10.D
11. 110g KNO3 小于 54.4g
12. 不变 变大 变小
13. t2 ℃时,a、c两物质的溶解度相等 c>b>a b>a>c
14. t1 20% 降温结晶
15. 31.6g 玻璃棒 饱和 37.5% 过滤 1=2>3 硝酸钾68.7g BC
16. t1℃时,硝酸钾和氯化钾的溶解度相等 小于t1℃ 降低温度 cde
17. 酒精 50 比较氯化钠在水和酒精中的溶解情况 同种溶质在不同的溶剂中溶解性不同 比较温度对硝酸钾在水中的溶解性的影响 温度 一定质量的硝酸钾和一定质量的水(或溶质、溶剂的种类及质量) 溶质和溶剂的种类和质量 增加 减少
18. CBA .C 100 小于 漏斗 4.5 500
19. √ 合理方程式即可 Ca(OH)2 或其他合理答案
答案第1页,共2页
答案第1页,共2页
