【化学 鲁科版必修二】12--13学年最新版高中化学同步授课课件:第1章第2节 元素周期律和元素周期表(鲁科版必修2)
文档属性
| 名称 | 【化学 鲁科版必修二】12--13学年最新版高中化学同步授课课件:第1章第2节 元素周期律和元素周期表(鲁科版必修2) | 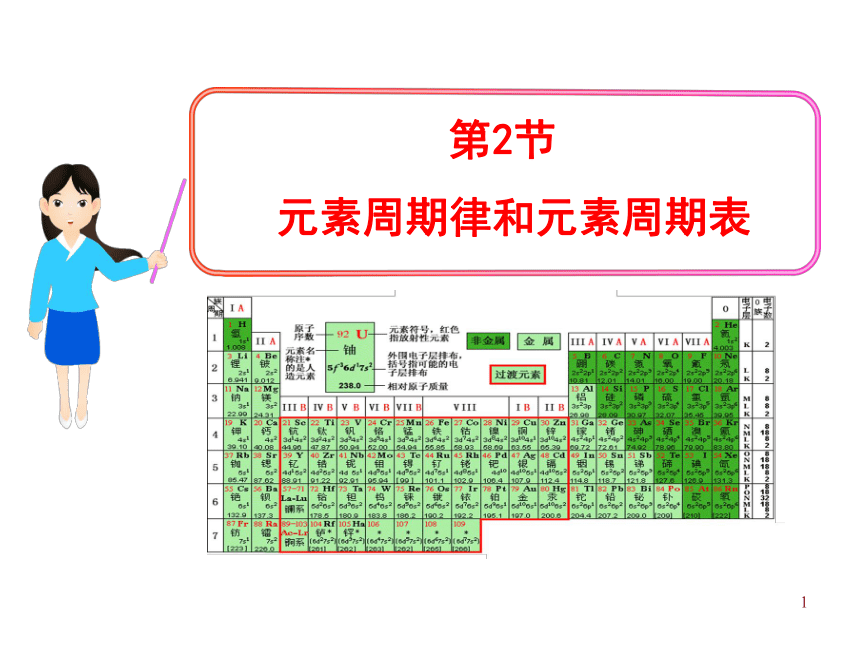 | |
| 格式 | zip | ||
| 文件大小 | 4.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2013-03-05 08:06:34 | ||
图片预览









文档简介
课件37张PPT。1第2节
元素周期律和元素周期表21、了解原子核外电子排布、原子半径、主要化合价的
周期性变化,认识元素周期律。
2、学会利用各种图表处理数据,提高处理数据的能力。
3、认识元素性质的周期性变化是元素原子核外电子排布
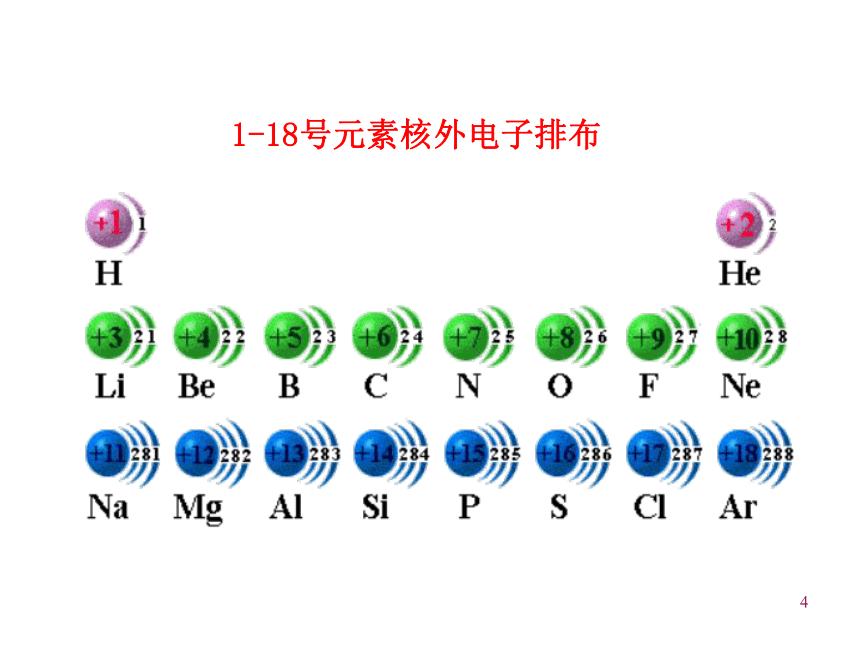
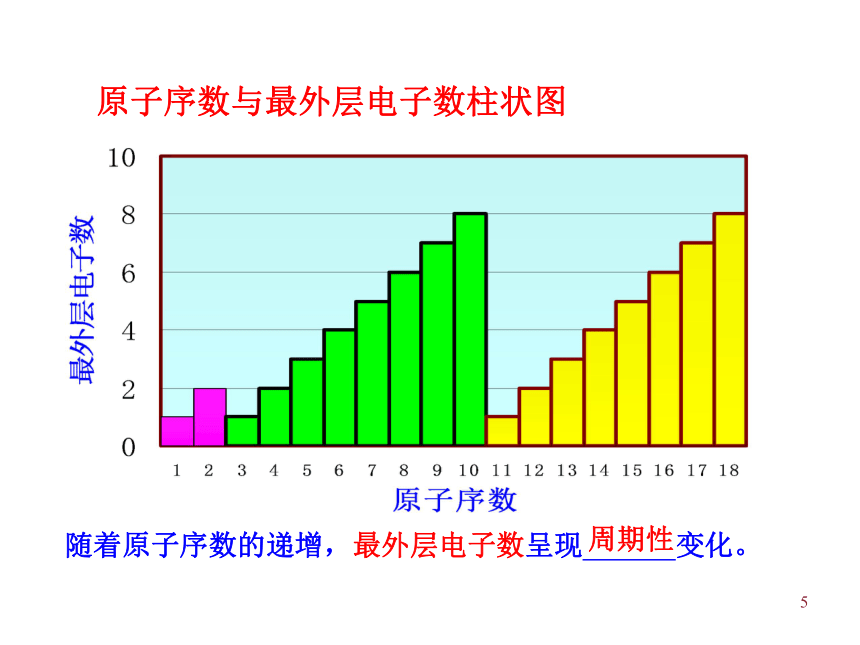
周期性变化的结果,从而理解元素周期律的实质。3一、元素周期律:活动—探究原子序数 = 质子数 = 核外电子数1、原子序数:元素在周期表中的序号补充P11表中所缺内容,作出三个图并寻找相关规律。41-18号元素核外电子排布5原子序数与最外层电子数柱状图随着原子序数的递增,最外层电子数呈现 变化。周期性6原子序数与原子半径线状图7随着原子序数的递增,原子半径呈现 变化。0.186nm 0.099nm
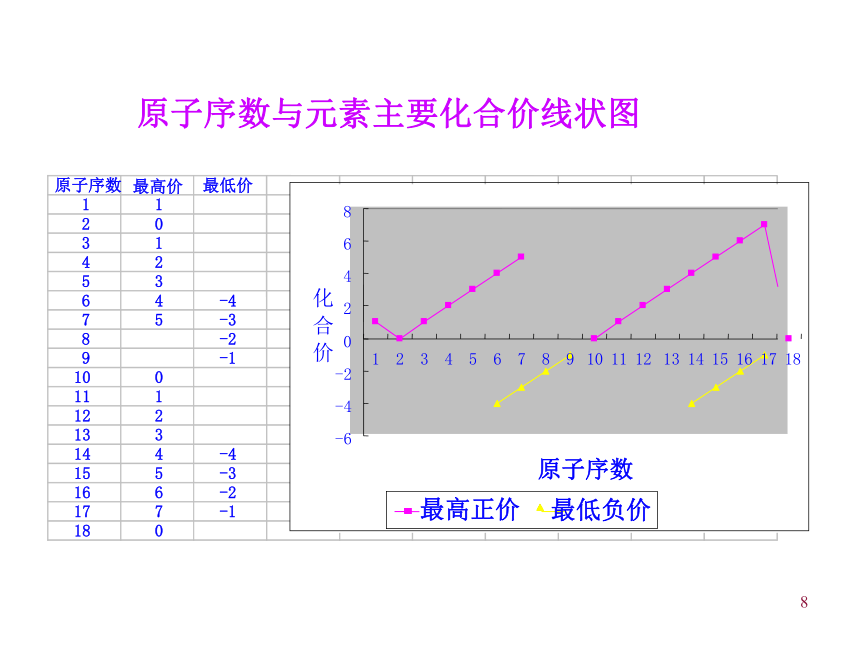
(大 小)周期性89随着原子序数的递增,元素的主要化合价呈现_________ 变化。+1 +7; - 4 -1 0311 — 18+1 +5; - 4 -1 023—10+1 011 — 2元素最高价和最低价电子层数原子序数周期性103、元素周期律的本质原因(实质):2、元素周期律的内容:元素的性质随着元素原子序数的递增而呈周期性的变
化,这个规律叫做元素周期律。随着元素原子序数的递增,原子核外电子排布呈周期性
变化。111、元素化合价的计算规律NH3、H3O+(四核)2、常见的10e- 微粒:N3-、O2-、 F-、Ne、Na+、Mg2+、Al3+(单核)OH-、HF(双核)H2O(三核)CH4、NH4+(五核)最高正价=最外层电子数
最低负价= 最高正价- 8 12你能否将前18号元素编一个周期表?遵循的原则:
1、能体现原子序数递增;
2、相同电子层数的原子在表中处于同一行;
3、原子最外层电子数相同的元素处于同一列。二、元素周期表13形式一形式二14周期表中每一个小格中的符号和数字分别代表什么意义呢? U
铀
5f36d17s2
238.0【思考】15长周期 (第4、5、6周期 ) 元素种数(18、18、32) 1、元素周期表的结构(1)周期(3短3长1不完全,共7个周期)短周期 (第1、2、3 周期 ) 元素种数(2、 8、8)16副族(7个) :只包含长周期元素
ⅢB---ⅥB、ⅦB 、ⅠB、ⅡB(2)族(7主7副1零1八,共16个族。)主族(7个) :包含长周期和短周期元素
ⅠA、ⅡA、ⅢA---ⅥA、ⅦAⅧ族(1个):第8、9、10三列0族 (1个) :第18列(稀有气体)17每一周期元素有哪些特点?①周期序数 = 。
②同一周期元素的原子, 数相同,
数依次增多。
③除第1、7周期外,每一周期的元素都是
从 开始,逐渐过渡到非金属元素,
最后以 结束。碱金属元素电子层数 稀有气体元素最外层电子 电子层归纳·总结18同一主族的元素有哪些特点?①主族序数= = 。
②同一主族的元素,自上而下,最外层电子数 ,
依次增多
③由于同一主族元素最外层电子数相同,因此每一主
族的各元素具有相似的性质。电子层数 最外层电子数最高正价归纳·总结相同191.简单画出元素周期表。
2.在绘制的元素周期表中标出金属、非金属元素的分界线。
3.在绘制的元素周期表中标出过渡元素区域。
4.第ⅠA族元素的原子序数分别是多少?
(用于已知原子序数判断元素在周期表中的位置)H B Si As Te At1、3、11、19、37、55、8776号元素在周期表中的位置?第六周期第Ⅷ族【思考】205.同周期相邻两主族元素原子序数差可能为多少?
6.同主族相邻两周期元素原子序数差可能为多少?
同主族不相邻两周期元素原子序数差为多少?
1、11、252、8、18、32每周期所含的元素种数之和是多少?每周期所含的元素种数之和如10、16、18、26、36、50等34×217.第3、4周期,5、6周期同主族元素的原子序数差为多少?3、4周期:5、6周期:ⅠA、ⅡA为8,ⅢA~ⅦA为18ⅠA、ⅡA为18,ⅢA~ⅦA为32ⅢBⅥA8、哪一族含有的元素种数最多?
哪一族元素所形成的化合物种数最多?22形式多样的周期表螺旋型周期表23不同种元素:电子层结构相同的微粒:半径大小的比较电子层数相同:电子层数不相同: (同主族自上而下)
电子层数越多,原子半径越大原子同种元素:价低径大,如Na+Cl离子序小径大序小径大如Cl- > K+层多径大归纳提高24半径的大小主要与电子层数、质子数有关25练习:比较下列微粒半径的大小。1、S2- S2、Mg2+ Mg3、F-、Na+ 、Al3+、O2-4、F、Na、Al、O5、N、P、Al、O> F- > Na+ > Al3+Na > Al > O > FAl > P > N > O牛刀小试,我最棒!26原子半径、元素主要化合价。1、原子序数
2、元素的性质
3、元素周期律的内容与实质元素性质随原子序数的递增呈周期性变化。4、元素化合价计算规律
微粒半径比较的规律5、元素周期表的结构271、同周期元素的原子结构相同之处是( )
A、最外层电子数 B、核电荷数
C、电子层数 D、核外电子数 C282、银在周期表中的表示如图所示,
下列叙述不正确的是( ) A. 银原子序数为47 B. 银摩尔质量为107.9
C. 银为过渡金属元素 D. 银原子最外层有1个电子B293、 在短周期元素中,原子最外电子层只有1个或2个电子的元素是( )
A.金属元素 B.稀有气体元素
C.非金属元素 D.无法确定为哪一类元素D304. 已知下列元素的原子半径为:
根据以上数据判断,磷原子的半径可能是( )
A.0.080nm B.0.110nm
C.0.120nm D.0.070nmB 31BC5、对于具有相同电子层结构的三种微粒:Bn-、An+ 、C,下列说法正确的是( )
A.原子半径:r(A)> r(C)> r(B)
B.微粒半径:Bn->An+
C.C元素一定是稀有气体元素??????????????
D.原子序数:C>B>A32B6、下列各组元素,按最高正价递增顺序排列的是
( )
A、C、N、O、F
B、K、Mg、C、S
C、F、Cl、Br、I
D、Li、Al、N、P33A7、X的阳离子和Y的阴离子具有相同的电子层结构,Z
和Y两元素的原子核外电子层数相同,Z元素的原子半
径大于Y元素的原子半径。X、Y、Z三种元素原子序数
的关系是(???)
A、X>Y>Z?????????? B、Y>X>Z
C、Z>X>Y?????????? D、Z>Y>X348、An +、B(n+1) +、C(n-1) -、D(n+1) –四种离子的电子层结
构相同,下列说法错误的是( )
A、原子序数 D < C < A < B
B、离子半径 C > D > A > B
C、原子半径 A > B > D > C
D、如果An +、B(n+1) +、C(n-1) -、D(n+1) –四种离子电子层
结构与氩相同,则A、B的最高正价一定小于C、D的最高正价B359、周期表填空:
① 原子序数为17的元素的符号是 ,
位于 周期, 族。
②第4周期,第ⅤA族元素的原子序数为 。 Cl第ⅦA第三 333610、A、B、C为短周期元素,在周期表中的位置关系如下
图。
A、C两种元素的原子序数之和等于B原子的质子数, B原子
的质子数与中子数相等。
(1)A、B、C的元素名称 、 、 。
(2)B在周期表中的位置: 第 周期,第 族。
(3)C的原子结构示意图 。氮硫氟 3 ⅥA37不论去往何方,身后永远有不变的祝福,凝注的眼光——母校用宽大的胸怀包容我们,等待我们,期许我们。
元素周期律和元素周期表21、了解原子核外电子排布、原子半径、主要化合价的
周期性变化,认识元素周期律。
2、学会利用各种图表处理数据,提高处理数据的能力。
3、认识元素性质的周期性变化是元素原子核外电子排布
周期性变化的结果,从而理解元素周期律的实质。3一、元素周期律:活动—探究原子序数 = 质子数 = 核外电子数1、原子序数:元素在周期表中的序号补充P11表中所缺内容,作出三个图并寻找相关规律。41-18号元素核外电子排布5原子序数与最外层电子数柱状图随着原子序数的递增,最外层电子数呈现 变化。周期性6原子序数与原子半径线状图7随着原子序数的递增,原子半径呈现 变化。0.186nm 0.099nm
(大 小)周期性89随着原子序数的递增,元素的主要化合价呈现_________ 变化。+1 +7; - 4 -1 0311 — 18+1 +5; - 4 -1 023—10+1 011 — 2元素最高价和最低价电子层数原子序数周期性103、元素周期律的本质原因(实质):2、元素周期律的内容:元素的性质随着元素原子序数的递增而呈周期性的变
化,这个规律叫做元素周期律。随着元素原子序数的递增,原子核外电子排布呈周期性
变化。111、元素化合价的计算规律NH3、H3O+(四核)2、常见的10e- 微粒:N3-、O2-、 F-、Ne、Na+、Mg2+、Al3+(单核)OH-、HF(双核)H2O(三核)CH4、NH4+(五核)最高正价=最外层电子数
最低负价= 最高正价- 8 12你能否将前18号元素编一个周期表?遵循的原则:
1、能体现原子序数递增;
2、相同电子层数的原子在表中处于同一行;
3、原子最外层电子数相同的元素处于同一列。二、元素周期表13形式一形式二14周期表中每一个小格中的符号和数字分别代表什么意义呢? U
铀
5f36d17s2
238.0【思考】15长周期 (第4、5、6周期 ) 元素种数(18、18、32) 1、元素周期表的结构(1)周期(3短3长1不完全,共7个周期)短周期 (第1、2、3 周期 ) 元素种数(2、 8、8)16副族(7个) :只包含长周期元素
ⅢB---ⅥB、ⅦB 、ⅠB、ⅡB(2)族(7主7副1零1八,共16个族。)主族(7个) :包含长周期和短周期元素
ⅠA、ⅡA、ⅢA---ⅥA、ⅦAⅧ族(1个):第8、9、10三列0族 (1个) :第18列(稀有气体)17每一周期元素有哪些特点?①周期序数 = 。
②同一周期元素的原子, 数相同,
数依次增多。
③除第1、7周期外,每一周期的元素都是
从 开始,逐渐过渡到非金属元素,
最后以 结束。碱金属元素电子层数 稀有气体元素最外层电子 电子层归纳·总结18同一主族的元素有哪些特点?①主族序数= = 。
②同一主族的元素,自上而下,最外层电子数 ,
依次增多
③由于同一主族元素最外层电子数相同,因此每一主
族的各元素具有相似的性质。电子层数 最外层电子数最高正价归纳·总结相同191.简单画出元素周期表。
2.在绘制的元素周期表中标出金属、非金属元素的分界线。
3.在绘制的元素周期表中标出过渡元素区域。
4.第ⅠA族元素的原子序数分别是多少?
(用于已知原子序数判断元素在周期表中的位置)H B Si As Te At1、3、11、19、37、55、8776号元素在周期表中的位置?第六周期第Ⅷ族【思考】205.同周期相邻两主族元素原子序数差可能为多少?
6.同主族相邻两周期元素原子序数差可能为多少?
同主族不相邻两周期元素原子序数差为多少?
1、11、252、8、18、32每周期所含的元素种数之和是多少?每周期所含的元素种数之和如10、16、18、26、36、50等34×217.第3、4周期,5、6周期同主族元素的原子序数差为多少?3、4周期:5、6周期:ⅠA、ⅡA为8,ⅢA~ⅦA为18ⅠA、ⅡA为18,ⅢA~ⅦA为32ⅢBⅥA8、哪一族含有的元素种数最多?
哪一族元素所形成的化合物种数最多?22形式多样的周期表螺旋型周期表23不同种元素:电子层结构相同的微粒:半径大小的比较电子层数相同:电子层数不相同: (同主族自上而下)
电子层数越多,原子半径越大原子同种元素:价低径大,如Na+
2、元素的性质
3、元素周期律的内容与实质元素性质随原子序数的递增呈周期性变化。4、元素化合价计算规律
微粒半径比较的规律5、元素周期表的结构271、同周期元素的原子结构相同之处是( )
A、最外层电子数 B、核电荷数
C、电子层数 D、核外电子数 C282、银在周期表中的表示如图所示,
下列叙述不正确的是( ) A. 银原子序数为47 B. 银摩尔质量为107.9
C. 银为过渡金属元素 D. 银原子最外层有1个电子B293、 在短周期元素中,原子最外电子层只有1个或2个电子的元素是( )
A.金属元素 B.稀有气体元素
C.非金属元素 D.无法确定为哪一类元素D304. 已知下列元素的原子半径为:
根据以上数据判断,磷原子的半径可能是( )
A.0.080nm B.0.110nm
C.0.120nm D.0.070nmB 31BC5、对于具有相同电子层结构的三种微粒:Bn-、An+ 、C,下列说法正确的是( )
A.原子半径:r(A)> r(C)> r(B)
B.微粒半径:Bn->An+
C.C元素一定是稀有气体元素??????????????
D.原子序数:C>B>A32B6、下列各组元素,按最高正价递增顺序排列的是
( )
A、C、N、O、F
B、K、Mg、C、S
C、F、Cl、Br、I
D、Li、Al、N、P33A7、X的阳离子和Y的阴离子具有相同的电子层结构,Z
和Y两元素的原子核外电子层数相同,Z元素的原子半
径大于Y元素的原子半径。X、Y、Z三种元素原子序数
的关系是(???)
A、X>Y>Z?????????? B、Y>X>Z
C、Z>X>Y?????????? D、Z>Y>X348、An +、B(n+1) +、C(n-1) -、D(n+1) –四种离子的电子层结
构相同,下列说法错误的是( )
A、原子序数 D < C < A < B
B、离子半径 C > D > A > B
C、原子半径 A > B > D > C
D、如果An +、B(n+1) +、C(n-1) -、D(n+1) –四种离子电子层
结构与氩相同,则A、B的最高正价一定小于C、D的最高正价B359、周期表填空:
① 原子序数为17的元素的符号是 ,
位于 周期, 族。
②第4周期,第ⅤA族元素的原子序数为 。 Cl第ⅦA第三 333610、A、B、C为短周期元素,在周期表中的位置关系如下
图。
A、C两种元素的原子序数之和等于B原子的质子数, B原子
的质子数与中子数相等。
(1)A、B、C的元素名称 、 、 。
(2)B在周期表中的位置: 第 周期,第 族。
(3)C的原子结构示意图 。氮硫氟 3 ⅥA37不论去往何方,身后永远有不变的祝福,凝注的眼光——母校用宽大的胸怀包容我们,等待我们,期许我们。
