第3章 空气与生命(3.1-3.4)阶段练习(含答案)
文档属性
| 名称 | 第3章 空气与生命(3.1-3.4)阶段练习(含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2022-04-22 21:46:30 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
第三章化学测试(3.1-3.4)
满分100分,时间2小时
一、选择题(15空,共30分)
1.在化学反应前后,下列诸项中肯定没有变化的是( )
①原子的数目 ②分子的数目 ③元素的种类 ④物质的种类 ⑤物质的总质量 ⑥原子的种类
A.①③⑤⑥ B.①③④⑤ C.①⑤⑥ D.①③④
2.(2021八下·杭州期末)下列对二氧化碳的四个方面认识中不正确的是( )
A.组成:二氧化碳由碳、氧两种元素组成 B.性质:二氧化碳不能燃烧,也不支持燃烧
C.制备:实验室常用石灰石和稀硫酸制备二氧化碳
D.用途:固态二氧化碳可用作制冷剂,可用于食品冷藏保鲜
3.化学方程式是重要的化学用语。下列化学方程式书写正确的是( )
A.2KMnO4 K2MnO4+MnO2+O2↑ B.P+O2=P2O5
C.4Fe+3O2 2Fe2O3 D.C+O2 CO2↑
4.丙烷(C3H8)是液化石油气的主要成分之一,燃烧前后分子种类变化的微观示意图如图。下列说法正确的是( )
A.甲中碳、氢元素质量比为3:8 B.乙物质由两个氧原子构成
C.44g甲完全燃烧至少需160g乙 D.生成的丙与丁的分子个数比为1:1
5.铜片与浓硝酸可以发生如下反应:Cu+4HNO3=Cu(NO3)2+2X↑+2H2O,对该反应的下列说法中正确的
是( )
A.生成物X的化学式为H2 B.浓硝酸属于纯净物
C.反应中N元素化合价改变的原子与N元素化合价不变的原子的个数比为1∶1
D.反应物Cu与生成物H2O的质量比为32∶9
6.已知蜡烛的着火点约为190℃,蜡烛的火焰由气态蜡燃烧形成,如图所示,在温度示数为280℃以上时,快速
推动火塞,观察到蜡烛立即熄灭,其主要原因是( )
A. 隔绝氧气 B. 移走可燃物 C. 降温到着火点以下 D. 无法判断
7.在反应A+3B=2C+3D中,已知A和B的相对分子质量之比为7:8,当2.8g A与一定量B恰好完全反应后,生成3.6g D,则C的相对分子质量为( )
A.20 B.25 C.11 D.44
8.(2021八下·西湖期中)水是化学实验中常见且用途广泛的一种物质。对下列各实验中水的主要作用的解释不合理的是( )
A B C D
A.硫在氧气中燃烧--集气瓶中的水:吸收放出的热量
B.测定空气中氧气含量--量筒中的水:通过水体积变化得到氧气体积
C.细铁丝在氧气中燃烧--集气瓶中的水:防止集气瓶炸裂
D.探究燃烧的条件--烧杯中的水:加热铜片,隔绝空气
9.将一定量的乙醇(C2H5OH)和氧气置于一个完全封闭的容器中引燃,反应生成二氧化碳、水蒸气和一种未知
物X。测得反应前后物质的质量如下表:
物质 乙醇 氧气 二氧化碳 水 X
反应前质量/g 4.6 8 0 0 0
反应后质量/g 0 0 4.4 5.4 m
下列判断正确的是( )
A.表中m的值无法确定 B.增加氧气的量可以减少X的生成
C.X可能是该反应的催化剂 D.物质X一定含有碳元素,可能含有氢元素
10.某实验过程如下:取ag锡粉置于密闭容器中,称得容器和固体的总质量为bg,煅烧使锡粉与O2充分反应;冷却后打开容器时发现有空气冲入,待容器内气体组成恢复到反应前,称得容器和固体的总质量为cg;取出所有固体,称得固体为dg,则c等于( )
A、d+b+a B、d-b-a C、d-b+a D、d+b-a
11.(2020八下·台州月考)在不同时刻,某反应中的甲、乙、丙、丁四种物质的质量如下表。已知甲的相对分子质量为丁的2倍,则下列说法正确的是( )
甲的质量/g 乙的质量/g 丙的质量/g 丁的质量/g
反应前 64 10 1 16
t时刻 32 a
反应后 0 54 b 0
A.生成物只有乙 B.a等于15
C.b等于36 D.该反应方程式中甲与丁的化学计量数之比为2:1
12.在锥形瓶甲中放人10 g纯净的块状碳酸钙,在锥形瓶乙中放人10 g纯净的粉末状碳酸钙,分别同时加入足量同浓度的稀盐酸与碳酸钙反应。下列图中对该实验产生气体的质量与反应时间的关系,描述合理的是( )
A.B.C.D.
13.氢气和氧气的混合气体24g充分反应后,测得生成水18g,则原混合气体中氢气和氧气的质量比不可能是( )
A.1:2 B.1:11 C.2:1 D.2:22
14.如图所示:甲瓶中盛放的是浓硫酸(可吸收水蒸气)乙瓶中放的是用石蕊溶液染成紫色的干燥小花。甲同学
关闭阀门Ⅰ,打开阀门Ⅱ,通入潮湿的二氧化碳观察紫色小花的颜色;乙同学关闭阀门Ⅱ,打开阀门Ⅰ,通入潮湿的二氧化碳观察紫色小花的颜色。甲乙两位同学观察到的紫色小花的颜色分别是( )
A.不变色、变红色 B.变红色、不变色 C.变红色、变红色 D.不变色、不变色
15.某气体由CH4、C2H4、C2H2中的一种或几种组成,取气体样品在氧气中完全燃烧,测得生成的二氧化碳和水的质量比为22:9,下列对该气体组成的判断正确的是( )
A.该气体可能是由C2H4和C2H2组成 B.该气体一定含有C2H4
C.该气体中可能含有CH4 D.该气体不可能同时含有CH4、C2H4、C2H2
二、填空题(15空,15分)
16.写出下列反应的化学方程式。
(1)碳酸钙和稀盐酸反应: 。
(2)氯酸钾在催化剂加热作用下制取氧气: 。
17.有A、B、C三种物质各5g组成的混合物,在一定条件下发生化学反应B+C═2A+D.充分反应后的剩余物质中含有6gA、6gD和若干克B,则参加反应B、C的质量比为 。
18.(2021八下·拱墅期末)小乐用如图所示装置测量空气中氧气的含量,集气瓶的容积为600mL,集气瓶内水的体积为100mL,实验开始前量筒中水的体积200mL,实验结束后量筒中水的体积为120mL。(忽略燃烧匙和白磷所占据的体积)
(1)该实验测得空气中氧气的体积分数为 ,导致结果偏小的原因可能是 (写出1点)。
(2)本实验若要耗尽集气瓶中的氧气,实验至少需要白磷 g。(空气中氧气的体积分数按20%计算,氧气的密度为1.43g/L,结果保留2位小数)
19.(2020八下·丽水期末)如图所示,探究“物质燃烧的条件”实验时,将一根火柴折断,分成火柴头(主要成分为氯酸钾、二氧化锰、硫磺和玻璃粉)和火柴梗两部分,放在铜片上加热。
(1)当观察到 现象时,说明物质的燃烧和着火点有关;
A.火柴头先被点燃 B.燃烧剧烈程度不同 C.燃烧持续时间不同
(2)火柴头点燃的瞬间可观察到“喷”出火焰,这是因为火柴头受热,内部某些物质反应产生了氧气,使燃烧更旺。该现象说明了氧气具有 性;
(3)森林火灾在我国及全球各地频发,消防员通常会用大型吹风机的风筒对着火焰吹风,以达到灭火的目的。
此灭火的原理是 。
20.用纳米级的某种氧化物做催化剂,使汽车尾气中的CO跟NO反应转化为两种气体,其中一种可参与植物的光
合作用,另一种是空气中含量最多的气体。这两种气体是______和_______ 。写出CO和NO反应的化学方程式_________________________。
21.1909年化学家哈伯在实验室首次合成了氨.2007年化学家格哈德 埃特尔在哈伯研究所证实了氢气与氮
气在固体催化剂表面合成氨的反应过程,获得诺贝尔化学奖.
(1)用 分别表示N2、H2、NH3.观察下图,写出符合在催化剂表面合成氨反应过程的顺序是 (将下面五张图按反应过程顺序用序号排列).
(2)氢气与氮气反应时的化学计量数比是 ;该反应属于 反应.
3、实验探究题(10空,20分)
22.实验装置如图甲所示.将整套装置(包括CO2及NaOH溶液)放在天平上称量,测得质量为78.2g.
用力推压注射器活塞向密闭的软塑料瓶中注入10mLNaOH溶液(装置如图乙所示),振荡后观察到的现象
有 。静置片刻后,将整套装置再次放在天平上称量,测得其
质量仍为78.2g,你对这一结果的解析是_____ __________。
通过上述探究实验,
你得到的启示是:①若采用有气体参加或生成的反应来验证质量守恒定律,应让化学反应在__________中进行。
②为进一步证明CO2与NaOH溶液确已发生了化学反应,你还能想到的方法是____________________。
23.甲乙两位同学为了验证质量守恒定律,分别设计了如图1、图2的实验装置,进行实验。
(1)甲同学:①按图1连接好装置,检查装置气密性的方法是 ;
②向锥形瓶中加入石灰石粉末,注射器吸入少量稀盐酸;
③将装置放在天平左盘,通过加减砝码和移动游码使天平平衡;
④快速下推注射器活塞,使反应发生,此时观察到的现象为 ;
⑤反应结束后,再进行第2次称量,发现质量没有发生变化,于是证明质量是守恒。
(2)乙同学:按图2装置进行实验,称量反应物至天平平衡,然后将气球中的粉末倒入锥形瓶中充分反应,再次称量发现天平的指针向右倾斜,得出质量并不守恒。反应后天平不平衡的原因是 。
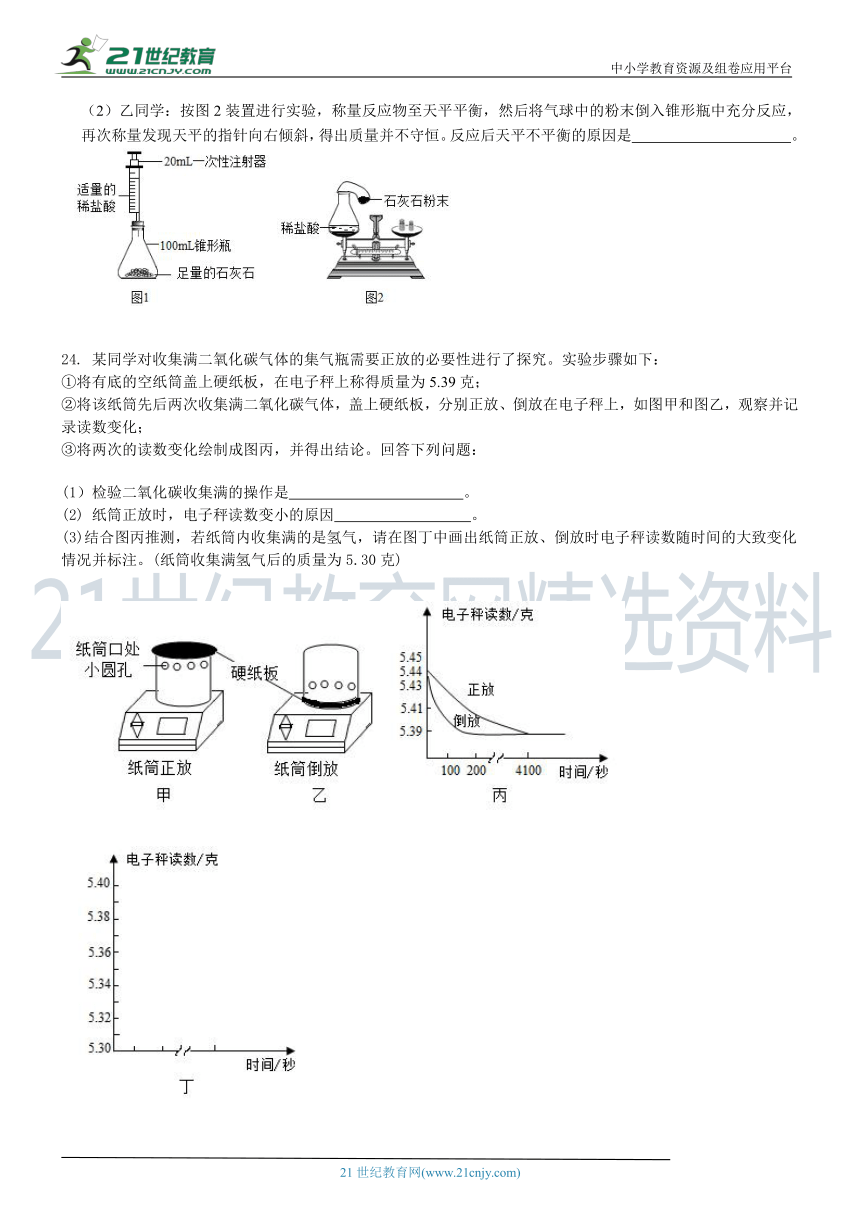
24. 某同学对收集满二氧化碳气体的集气瓶需要正放的必要性进行了探究。实验步骤如下: ①将有底的空纸筒盖上硬纸板,在电子秤上称得质量为5.39克; ②将该纸筒先后两次收集满二氧化碳气体,盖上硬纸板,分别正放、倒放在电子秤上,如图甲和图乙,观察并记录读数变化; ③将两次的读数变化绘制成图丙,并得出结论。回答下列问题:
(1)检验二氧化碳收集满的操作是 。
(2) 纸筒正放时,电子秤读数变小的原因 。
(3)结合图丙推测,若纸筒内收集满的是氢气,请在图丁中画出纸筒正放、倒放时电子秤读数随时间的大致变化情况并标注。(纸筒收集满氢气后的质量为5.30克)
四、解答题(5题,25、26、题各6分,27题7分,28各8分,29题8分)
25.4.6g某物质在空气中完全燃烧生成8.8gCO2和5.4gH2O,则
⑴共消耗氧气多少克?
⑵计算说明该物质的组成及各元素的质量。
⑶写出其化学式。
26.某同学把3克碳放在给定的氧气中充分燃烧,实验数据如下:
第一次 第二次 第三次
给定氧气的质量 6克 13克 8克
生成二氧化碳的质量 8.25克 11克 11克
(1)通过以上数据说明,这三次实验中第 次恰好完全反应;
(2)第 次实验中碳有剩余,剩余 克;
(3)第 次实验中氧气有剩余,剩余 克;
(4)在三次化学反应过程中,是否有不符合质量守恒定律的? 。
27.(2021八下·诸暨期中)某同学采用如图装置,用胡萝卜分解H2O2制取氧气,
(1)要使胡萝卜能够更快地促进过氧化氢的分解,可采用的方法是 。
(2)当量筒内的水达到 80 毫升时,打开广口瓶的橡皮塞,立即将带火星的木条伸入瓶内,却发现木条不能复燃。请你解释木条不能复燃的原因是 。
(3)计算:17 克 15%的 H2O2 溶液中的溶质完全分解,能制得氧气多少 g?
28.(2021八下·萧山月考)小豪参加学校的湘湖研学山坡上发现漂亮的大理石,于是带了一些回来,想去学校实验室测定这此大理石中CaCO3的含量。他称取了20克大理石样品置于烧杯中,然后将250g稀盐酸分成五等份,依次加入烧杯充分反应,记录有关实验数据如下表所示(大理石中其他分均不溶于水,也不参与化学反应)。
加入次数 一 二 三 四 五
加入稀盐酸的质量 50 50 50 50 50
烧杯中剩余固体的质量 15 10 5 5 m
试求:
(1)m的值应为 ;
(2)实验中大理石样品所含CaCO3的质量分数?
(3)实验中所用稀盐酸的溶质质量分数?
29.(2021八下·乐清期末)乐乐假期从风景区捡回一块岩石,通过实验证明其成分主要是碳酸钙。为了测定碳酸钙的质量分数(杂质不与稀盐酸反应,也不溶于水),他将这块岩石粉碎成粉末后与稀盐酸反应(如甲图所示),化学方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑。经过一系列的测定,记录了如下表的实验数据:
实验次数 ① ② ③ ④
稀盐酸质量(克) 80 80 100 100
岩石粉末质量(克) 10 12.5 10 15
剩余固体质量(克) 2 4.5 2 m
(1)实验过程中,若观察到图甲装置中 的现象可判断反应结束。
(2)表中m的值为 。
(3)列式计算乐乐所用的稀盐酸溶质质量分数。
参考答案:
1-5、ACACC 6-10、BCABD 11-15、DCCAC
16、CaCO3+2HCl=CaCl2+H2O+CO2↑。
2KClO32KCl+3O2↑
点燃
17、44,C2H4+5O2 〓2CO2+H2O
18、白磷不足,0.11,
19、A,助燃,降低温度到着火点以下
20、二氧化碳,氮气,
催化剂
2CO+2NO 〓 2CO2+N2
21、⑤④①②③ 3:1 化合
22、塑料瓶变瘪,注射器中溶液自动进入塑料瓶中
23、(1)轻轻下推注射器活塞一小段距离后松开手,若注射器能够回到原来的刻度,则说明不漏气;
有气泡冒出;注射器活塞慢慢上移;
(2)生成的二氧化碳气体使气球鼓起,受到空气的浮力增大。
24、燃着的木条置于直筒口,木条熄灭,则已集满;二氧化碳逸出,空气进入,且二氧化碳的密度大
25、(1)8.8+5.4-4.6=9.6;
(2)碳元素8.8×12/44=2.4克,氢元素5.4×2/18=0.6g克,氧元素4.6-2.4-0.6=1.6克,
各元素的质量比C:H:O=2.4:0.6:1.6=12:3:8
各元素的原子个数比C:H:O=12/12:3/1:8/16=2:6:1
化学式为C2H6O
26、三;一、0.75;二、5;否
可知该反应中碳与氧气及二氧化碳的质量比为:12:16×2:44=3:8:11;
(1)参加反应的各物质质量总与反应生成物质质量总和相等,符合这一要求的只有第三次实验,所以此次实验中两种物质恰好完全反应;
(2)由于第一次实验中氧气只有6g不足8g,所以碳会有剩余;剩余碳的质量=3g-(8.25g-6g)=0.75g;
(3)由于第二次反应中二氧化碳的质量是11g,所以反应的氧气量是8g,则剩余氧气质量=13g-8g=5g;
(4)由于任何化学反应一定符合质量守恒定律,故1、2、3均符合质量守恒定律;
27、将萝卜切成更小的颗粒;氧气的纯度不够高;1.2
28、5、75%、7.3%
从第三四次对比可以发现加入盐酸,固体质量不再减少,因此CaCO3已经反应完了,所以m=5,
CaCO3 %=(20-5)/20=75%,
假设盐酸的溶质质量分数为x
CaCO3+2HCl=CaCl2+H2O+CO2↑。
100 73
5 50x 100/5=73/50x x=7.3%
29、电子天平示数不变;5;7.3%
第一二次实验对比,增加固体,但是参加的碳酸钙仍然是8克,所以得出80克酸已经完全反应,不够了。一三实验对比,增加酸,但是参加的碳酸钙仍然是8克,所以得出固体完全反应,不够了。因此得出恰好完全反应的固体和盐酸质量是8:80,所以100克稀盐酸能反应的碳酸钙是100/80×8=10克,所以m=15-10=5g
假设盐酸的溶质质量分数为x,选择第一次实验来计算
CaCO3+2HCl=CaCl2+H2O+CO2↑。
100 73
8 80x
100/8=73/80x x=7.3%
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
第三章化学测试(3.1-3.4)
满分100分,时间2小时
一、选择题(15空,共30分)
1.在化学反应前后,下列诸项中肯定没有变化的是( )
①原子的数目 ②分子的数目 ③元素的种类 ④物质的种类 ⑤物质的总质量 ⑥原子的种类
A.①③⑤⑥ B.①③④⑤ C.①⑤⑥ D.①③④
2.(2021八下·杭州期末)下列对二氧化碳的四个方面认识中不正确的是( )
A.组成:二氧化碳由碳、氧两种元素组成 B.性质:二氧化碳不能燃烧,也不支持燃烧
C.制备:实验室常用石灰石和稀硫酸制备二氧化碳
D.用途:固态二氧化碳可用作制冷剂,可用于食品冷藏保鲜
3.化学方程式是重要的化学用语。下列化学方程式书写正确的是( )
A.2KMnO4 K2MnO4+MnO2+O2↑ B.P+O2=P2O5
C.4Fe+3O2 2Fe2O3 D.C+O2 CO2↑
4.丙烷(C3H8)是液化石油气的主要成分之一,燃烧前后分子种类变化的微观示意图如图。下列说法正确的是( )
A.甲中碳、氢元素质量比为3:8 B.乙物质由两个氧原子构成
C.44g甲完全燃烧至少需160g乙 D.生成的丙与丁的分子个数比为1:1
5.铜片与浓硝酸可以发生如下反应:Cu+4HNO3=Cu(NO3)2+2X↑+2H2O,对该反应的下列说法中正确的
是( )
A.生成物X的化学式为H2 B.浓硝酸属于纯净物
C.反应中N元素化合价改变的原子与N元素化合价不变的原子的个数比为1∶1
D.反应物Cu与生成物H2O的质量比为32∶9
6.已知蜡烛的着火点约为190℃,蜡烛的火焰由气态蜡燃烧形成,如图所示,在温度示数为280℃以上时,快速
推动火塞,观察到蜡烛立即熄灭,其主要原因是( )
A. 隔绝氧气 B. 移走可燃物 C. 降温到着火点以下 D. 无法判断
7.在反应A+3B=2C+3D中,已知A和B的相对分子质量之比为7:8,当2.8g A与一定量B恰好完全反应后,生成3.6g D,则C的相对分子质量为( )
A.20 B.25 C.11 D.44
8.(2021八下·西湖期中)水是化学实验中常见且用途广泛的一种物质。对下列各实验中水的主要作用的解释不合理的是( )
A B C D
A.硫在氧气中燃烧--集气瓶中的水:吸收放出的热量
B.测定空气中氧气含量--量筒中的水:通过水体积变化得到氧气体积
C.细铁丝在氧气中燃烧--集气瓶中的水:防止集气瓶炸裂
D.探究燃烧的条件--烧杯中的水:加热铜片,隔绝空气
9.将一定量的乙醇(C2H5OH)和氧气置于一个完全封闭的容器中引燃,反应生成二氧化碳、水蒸气和一种未知
物X。测得反应前后物质的质量如下表:
物质 乙醇 氧气 二氧化碳 水 X
反应前质量/g 4.6 8 0 0 0
反应后质量/g 0 0 4.4 5.4 m
下列判断正确的是( )
A.表中m的值无法确定 B.增加氧气的量可以减少X的生成
C.X可能是该反应的催化剂 D.物质X一定含有碳元素,可能含有氢元素
10.某实验过程如下:取ag锡粉置于密闭容器中,称得容器和固体的总质量为bg,煅烧使锡粉与O2充分反应;冷却后打开容器时发现有空气冲入,待容器内气体组成恢复到反应前,称得容器和固体的总质量为cg;取出所有固体,称得固体为dg,则c等于( )
A、d+b+a B、d-b-a C、d-b+a D、d+b-a
11.(2020八下·台州月考)在不同时刻,某反应中的甲、乙、丙、丁四种物质的质量如下表。已知甲的相对分子质量为丁的2倍,则下列说法正确的是( )
甲的质量/g 乙的质量/g 丙的质量/g 丁的质量/g
反应前 64 10 1 16
t时刻 32 a
反应后 0 54 b 0
A.生成物只有乙 B.a等于15
C.b等于36 D.该反应方程式中甲与丁的化学计量数之比为2:1
12.在锥形瓶甲中放人10 g纯净的块状碳酸钙,在锥形瓶乙中放人10 g纯净的粉末状碳酸钙,分别同时加入足量同浓度的稀盐酸与碳酸钙反应。下列图中对该实验产生气体的质量与反应时间的关系,描述合理的是( )
A.B.C.D.
13.氢气和氧气的混合气体24g充分反应后,测得生成水18g,则原混合气体中氢气和氧气的质量比不可能是( )
A.1:2 B.1:11 C.2:1 D.2:22
14.如图所示:甲瓶中盛放的是浓硫酸(可吸收水蒸气)乙瓶中放的是用石蕊溶液染成紫色的干燥小花。甲同学
关闭阀门Ⅰ,打开阀门Ⅱ,通入潮湿的二氧化碳观察紫色小花的颜色;乙同学关闭阀门Ⅱ,打开阀门Ⅰ,通入潮湿的二氧化碳观察紫色小花的颜色。甲乙两位同学观察到的紫色小花的颜色分别是( )
A.不变色、变红色 B.变红色、不变色 C.变红色、变红色 D.不变色、不变色
15.某气体由CH4、C2H4、C2H2中的一种或几种组成,取气体样品在氧气中完全燃烧,测得生成的二氧化碳和水的质量比为22:9,下列对该气体组成的判断正确的是( )
A.该气体可能是由C2H4和C2H2组成 B.该气体一定含有C2H4
C.该气体中可能含有CH4 D.该气体不可能同时含有CH4、C2H4、C2H2
二、填空题(15空,15分)
16.写出下列反应的化学方程式。
(1)碳酸钙和稀盐酸反应: 。
(2)氯酸钾在催化剂加热作用下制取氧气: 。
17.有A、B、C三种物质各5g组成的混合物,在一定条件下发生化学反应B+C═2A+D.充分反应后的剩余物质中含有6gA、6gD和若干克B,则参加反应B、C的质量比为 。
18.(2021八下·拱墅期末)小乐用如图所示装置测量空气中氧气的含量,集气瓶的容积为600mL,集气瓶内水的体积为100mL,实验开始前量筒中水的体积200mL,实验结束后量筒中水的体积为120mL。(忽略燃烧匙和白磷所占据的体积)
(1)该实验测得空气中氧气的体积分数为 ,导致结果偏小的原因可能是 (写出1点)。
(2)本实验若要耗尽集气瓶中的氧气,实验至少需要白磷 g。(空气中氧气的体积分数按20%计算,氧气的密度为1.43g/L,结果保留2位小数)
19.(2020八下·丽水期末)如图所示,探究“物质燃烧的条件”实验时,将一根火柴折断,分成火柴头(主要成分为氯酸钾、二氧化锰、硫磺和玻璃粉)和火柴梗两部分,放在铜片上加热。
(1)当观察到 现象时,说明物质的燃烧和着火点有关;
A.火柴头先被点燃 B.燃烧剧烈程度不同 C.燃烧持续时间不同
(2)火柴头点燃的瞬间可观察到“喷”出火焰,这是因为火柴头受热,内部某些物质反应产生了氧气,使燃烧更旺。该现象说明了氧气具有 性;
(3)森林火灾在我国及全球各地频发,消防员通常会用大型吹风机的风筒对着火焰吹风,以达到灭火的目的。
此灭火的原理是 。
20.用纳米级的某种氧化物做催化剂,使汽车尾气中的CO跟NO反应转化为两种气体,其中一种可参与植物的光
合作用,另一种是空气中含量最多的气体。这两种气体是______和_______ 。写出CO和NO反应的化学方程式_________________________。
21.1909年化学家哈伯在实验室首次合成了氨.2007年化学家格哈德 埃特尔在哈伯研究所证实了氢气与氮
气在固体催化剂表面合成氨的反应过程,获得诺贝尔化学奖.
(1)用 分别表示N2、H2、NH3.观察下图,写出符合在催化剂表面合成氨反应过程的顺序是 (将下面五张图按反应过程顺序用序号排列).
(2)氢气与氮气反应时的化学计量数比是 ;该反应属于 反应.
3、实验探究题(10空,20分)
22.实验装置如图甲所示.将整套装置(包括CO2及NaOH溶液)放在天平上称量,测得质量为78.2g.
用力推压注射器活塞向密闭的软塑料瓶中注入10mLNaOH溶液(装置如图乙所示),振荡后观察到的现象
有 。静置片刻后,将整套装置再次放在天平上称量,测得其
质量仍为78.2g,你对这一结果的解析是_____ __________。
通过上述探究实验,
你得到的启示是:①若采用有气体参加或生成的反应来验证质量守恒定律,应让化学反应在__________中进行。
②为进一步证明CO2与NaOH溶液确已发生了化学反应,你还能想到的方法是____________________。
23.甲乙两位同学为了验证质量守恒定律,分别设计了如图1、图2的实验装置,进行实验。
(1)甲同学:①按图1连接好装置,检查装置气密性的方法是 ;
②向锥形瓶中加入石灰石粉末,注射器吸入少量稀盐酸;
③将装置放在天平左盘,通过加减砝码和移动游码使天平平衡;
④快速下推注射器活塞,使反应发生,此时观察到的现象为 ;
⑤反应结束后,再进行第2次称量,发现质量没有发生变化,于是证明质量是守恒。
(2)乙同学:按图2装置进行实验,称量反应物至天平平衡,然后将气球中的粉末倒入锥形瓶中充分反应,再次称量发现天平的指针向右倾斜,得出质量并不守恒。反应后天平不平衡的原因是 。
24. 某同学对收集满二氧化碳气体的集气瓶需要正放的必要性进行了探究。实验步骤如下: ①将有底的空纸筒盖上硬纸板,在电子秤上称得质量为5.39克; ②将该纸筒先后两次收集满二氧化碳气体,盖上硬纸板,分别正放、倒放在电子秤上,如图甲和图乙,观察并记录读数变化; ③将两次的读数变化绘制成图丙,并得出结论。回答下列问题:
(1)检验二氧化碳收集满的操作是 。
(2) 纸筒正放时,电子秤读数变小的原因 。
(3)结合图丙推测,若纸筒内收集满的是氢气,请在图丁中画出纸筒正放、倒放时电子秤读数随时间的大致变化情况并标注。(纸筒收集满氢气后的质量为5.30克)
四、解答题(5题,25、26、题各6分,27题7分,28各8分,29题8分)
25.4.6g某物质在空气中完全燃烧生成8.8gCO2和5.4gH2O,则
⑴共消耗氧气多少克?
⑵计算说明该物质的组成及各元素的质量。
⑶写出其化学式。
26.某同学把3克碳放在给定的氧气中充分燃烧,实验数据如下:
第一次 第二次 第三次
给定氧气的质量 6克 13克 8克
生成二氧化碳的质量 8.25克 11克 11克
(1)通过以上数据说明,这三次实验中第 次恰好完全反应;
(2)第 次实验中碳有剩余,剩余 克;
(3)第 次实验中氧气有剩余,剩余 克;
(4)在三次化学反应过程中,是否有不符合质量守恒定律的? 。
27.(2021八下·诸暨期中)某同学采用如图装置,用胡萝卜分解H2O2制取氧气,
(1)要使胡萝卜能够更快地促进过氧化氢的分解,可采用的方法是 。
(2)当量筒内的水达到 80 毫升时,打开广口瓶的橡皮塞,立即将带火星的木条伸入瓶内,却发现木条不能复燃。请你解释木条不能复燃的原因是 。
(3)计算:17 克 15%的 H2O2 溶液中的溶质完全分解,能制得氧气多少 g?
28.(2021八下·萧山月考)小豪参加学校的湘湖研学山坡上发现漂亮的大理石,于是带了一些回来,想去学校实验室测定这此大理石中CaCO3的含量。他称取了20克大理石样品置于烧杯中,然后将250g稀盐酸分成五等份,依次加入烧杯充分反应,记录有关实验数据如下表所示(大理石中其他分均不溶于水,也不参与化学反应)。
加入次数 一 二 三 四 五
加入稀盐酸的质量 50 50 50 50 50
烧杯中剩余固体的质量 15 10 5 5 m
试求:
(1)m的值应为 ;
(2)实验中大理石样品所含CaCO3的质量分数?
(3)实验中所用稀盐酸的溶质质量分数?
29.(2021八下·乐清期末)乐乐假期从风景区捡回一块岩石,通过实验证明其成分主要是碳酸钙。为了测定碳酸钙的质量分数(杂质不与稀盐酸反应,也不溶于水),他将这块岩石粉碎成粉末后与稀盐酸反应(如甲图所示),化学方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑。经过一系列的测定,记录了如下表的实验数据:
实验次数 ① ② ③ ④
稀盐酸质量(克) 80 80 100 100
岩石粉末质量(克) 10 12.5 10 15
剩余固体质量(克) 2 4.5 2 m
(1)实验过程中,若观察到图甲装置中 的现象可判断反应结束。
(2)表中m的值为 。
(3)列式计算乐乐所用的稀盐酸溶质质量分数。
参考答案:
1-5、ACACC 6-10、BCABD 11-15、DCCAC
16、CaCO3+2HCl=CaCl2+H2O+CO2↑。
2KClO32KCl+3O2↑
点燃
17、44,C2H4+5O2 〓2CO2+H2O
18、白磷不足,0.11,
19、A,助燃,降低温度到着火点以下
20、二氧化碳,氮气,
催化剂
2CO+2NO 〓 2CO2+N2
21、⑤④①②③ 3:1 化合
22、塑料瓶变瘪,注射器中溶液自动进入塑料瓶中
23、(1)轻轻下推注射器活塞一小段距离后松开手,若注射器能够回到原来的刻度,则说明不漏气;
有气泡冒出;注射器活塞慢慢上移;
(2)生成的二氧化碳气体使气球鼓起,受到空气的浮力增大。
24、燃着的木条置于直筒口,木条熄灭,则已集满;二氧化碳逸出,空气进入,且二氧化碳的密度大
25、(1)8.8+5.4-4.6=9.6;
(2)碳元素8.8×12/44=2.4克,氢元素5.4×2/18=0.6g克,氧元素4.6-2.4-0.6=1.6克,
各元素的质量比C:H:O=2.4:0.6:1.6=12:3:8
各元素的原子个数比C:H:O=12/12:3/1:8/16=2:6:1
化学式为C2H6O
26、三;一、0.75;二、5;否
可知该反应中碳与氧气及二氧化碳的质量比为:12:16×2:44=3:8:11;
(1)参加反应的各物质质量总与反应生成物质质量总和相等,符合这一要求的只有第三次实验,所以此次实验中两种物质恰好完全反应;
(2)由于第一次实验中氧气只有6g不足8g,所以碳会有剩余;剩余碳的质量=3g-(8.25g-6g)=0.75g;
(3)由于第二次反应中二氧化碳的质量是11g,所以反应的氧气量是8g,则剩余氧气质量=13g-8g=5g;
(4)由于任何化学反应一定符合质量守恒定律,故1、2、3均符合质量守恒定律;
27、将萝卜切成更小的颗粒;氧气的纯度不够高;1.2
28、5、75%、7.3%
从第三四次对比可以发现加入盐酸,固体质量不再减少,因此CaCO3已经反应完了,所以m=5,
CaCO3 %=(20-5)/20=75%,
假设盐酸的溶质质量分数为x
CaCO3+2HCl=CaCl2+H2O+CO2↑。
100 73
5 50x 100/5=73/50x x=7.3%
29、电子天平示数不变;5;7.3%
第一二次实验对比,增加固体,但是参加的碳酸钙仍然是8克,所以得出80克酸已经完全反应,不够了。一三实验对比,增加酸,但是参加的碳酸钙仍然是8克,所以得出固体完全反应,不够了。因此得出恰好完全反应的固体和盐酸质量是8:80,所以100克稀盐酸能反应的碳酸钙是100/80×8=10克,所以m=15-10=5g
假设盐酸的溶质质量分数为x,选择第一次实验来计算
CaCO3+2HCl=CaCl2+H2O+CO2↑。
100 73
8 80x
100/8=73/80x x=7.3%
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
