鲁科版必修二第二章化学键与化学反应课件
图片预览


文档简介
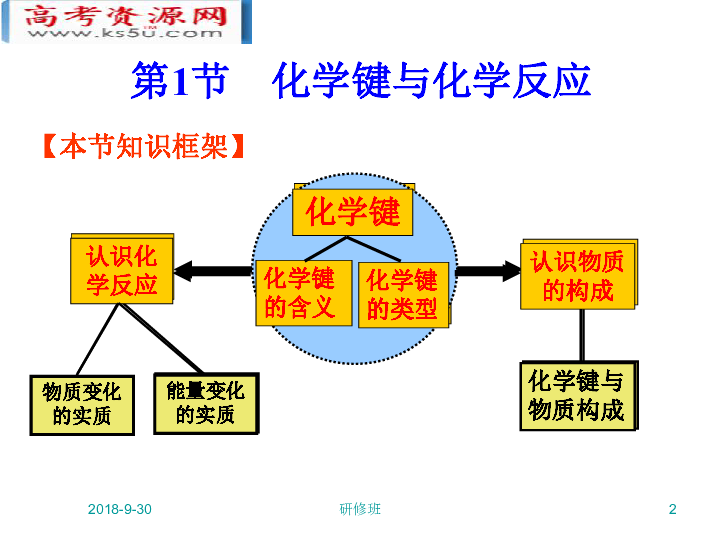
课件61张PPT。第2章 化学键 化学反应与能量第一节 化学键与化学反应鲁科版化学必修2 2019/1/25研修班2第1节 化学键与化学反应【本节知识框架】2019/1/25研修班32019/1/25研修班42019/1/25研修班5第1课时:化学键与化学反应中的物质变化1.化学键与物质变化 原子的重新组合。
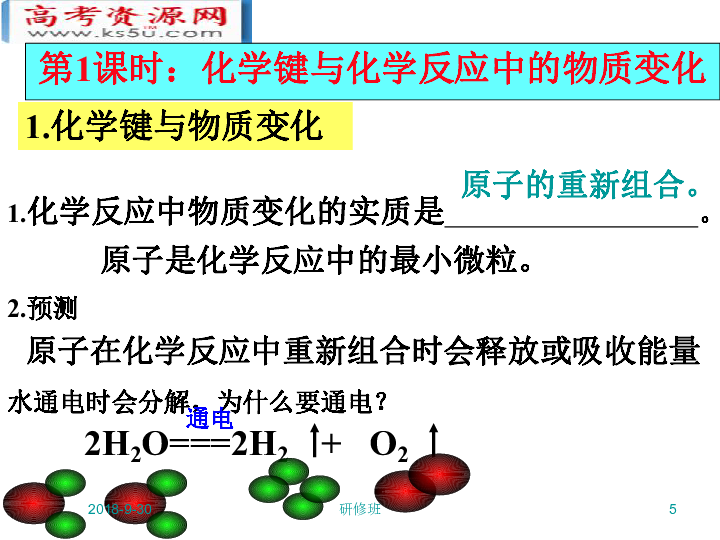
1.化学反应中物质变化的实质是 。
2.预测
水通电时会分解,为什么要通电?
原子在化学反应中重新组合时会释放或吸收能量原子是化学反应中的最小微粒。2019/1/25研修班6H2OH2O通电H2O2旧化学键断裂 水分子中氢原子和氧原子间的化学键断裂★这种相邻原子间的强相互作用称为化学键水是由 组成的,电解水时,水分中的氢原子和氧原子会重新组合,水分子中氢原子和氧原子之间存在着强的相互作用,要破坏这种强相互作用就要消耗能量,通电就是为水的分解提供能量的。水分子水分子之间也存在相互作用,但化学反应是原子的重新组合,要破坏原子间的相互作用,而不是破坏分子间的相互作用,水的蒸发会破坏水分子间的作用力。新化学键断裂 氢原子间形成新的化学键,氧原子间也形成新的化学键2019/1/25研修班7注 1.分子间不存在化学键水是由水分子组成的左边水分子中的氢原子与右边水分子中的氧原子
之间不存在化学键5.水分子中的2个氢原子间也不存在化学键6.化学键中既有相互吸引有有相互排斥作用2.不是一切物质中都存在化学键,
如He等任何稀有气体原子 间不存在化学键。3.化学键的形成原因是成键原子最外电子层未达稳
定结构。4.水中氢原子和氧原子间不是都存在化学键。如2019/1/25研修班8氢氢键、氧氧键H2O分子内 氢氧键氢氢键、氯氯键HCl分子内 氢氯键氮氮键、氢氢键氨分子内 氮氢键2019/1/25研修班9化学反应的实质:2.化学反应是原子的重新组合;3.从化学键的角度看,化学反应既有旧化学键的断裂又有 新化学键的形成。1.化学反应中有新物质生成4. 化学反应中一定既有物质的变化又有能量的变化4. 有化学键断裂的变化不一定是化学变化,如HCl或NaCl溶于水时的电离有化学键的断裂,不是化学变化,是物理变化。2019/1/25研修班10H2O 分子中,HCl分子中NaCl固体中都存在化学键,但NaCl固体中的化学键与H2O 分子中、HCl分子中的化学键有区别2.化学键的类型交流研讨 H2在Cl2中燃烧时, H2分子和Cl2分别获得能量,使各自的化学键断裂,分别生成H和Cl, H和Cl结合生成HCl分子,请根据核外电子排布规律讨论
H和Cl为什么有形成分子的趋势
HCl分子是怎样形成的2019/1/25研修班11Cl2气体分子H2 气体分子共价键的形成(以氢气在氯气中燃烧为例)分开后,她们为什么不高兴?让我们听听她们说些什么?探究1获得能量获得能量H 原子Cl 原子2019/1/25研修班12我只有一个电子,太少了我也少一个电子eH 原子Cl 原子2原子都未达稳定结构且都不易失电子2019/1/25研修班13二位好!我有一个好办法.你们每人拿出一个电子共用,就象共同分享快乐一样共同拥有.行吗?2019/1/25研修班14愿意H原子,你愿意拿出一个电子共用吗?Cl原子,你愿意拿出一个电子共用吗?我给你们点燃之后,你们要结合在一起,为人类做出自己的贡献.HCl2019/1/25研修班15H2+Cl2===2HCl点燃2019/1/25研修班16分析氯化氢的形成过程通过共用电子对2氢原子和氯原子各提供一个电子组成一对共用电子,使两者的最外电子层都达稳定结构,并产生强相互作用—即化学键,从而形成HCl分子。2019/1/25研修班17 ★原子之间通过共用电子所形成的化学键,叫做共价键。★共价键形成元素: 一般是非金属元素原子间的相互作用。
非金属元素可以是同种,也可以是不同种;如:H2、Cl2、HCl、CO2 等分子中均含有共价键。
不活泼金属元素也可形成共价键 ,如AlCl3
非金属元素间不一定只能形成共价键,如NH4Cl含离子键
通过共价键原子不仅可以形成分子也可以直接形成物质,如金刚石,SiO2,
金刚石、SiO2中不含分子, SiO2晶体由Si、O构成2019/1/25研修班18在HCl分子中, 吸引电子能力强于 ,共用电子对偏向 ,偏离 ,所以 显负价, 显正价,
有一个共用电子对偏向Cl,所以Cl最外电子层多了一个电子,显 价,
有一个共用电子对偏离H,即H最外电子层原有的一个电子偏离了H,显 价 ClH-1H Cl+1 ClH2019/1/25研修班19★化合物中共价键的成键元素的化合价是成键元素间共用电子对的数目如 下列分子中的原子都达8e-稳定结构的是
A PCl3 B PCl5 C CO2 D H2O★只含共价键的分子,由于成键原子的电性很弱,所以分子间的作用力是弱相互作用,即熔化或汽化只需破坏分子间作用力,不破坏化学键,因而液态氯化氢中只含HCl分子,但在水溶液中电离时共价键断裂,形成阴阳离子H+、Cl- ★共价键的形成原因:是成键原子由不稳定结构通过共用电子对相互作用后变成稳定结构。 ★共价键的成键方式:是通过共用电子对成键 ★共价键的成键微粒:是原子2019/1/25研修班20下列变化有共价键断裂的是( )
A碘升华 B干冰气化 C HCl溶于水
D溴蒸气被木炭吸附 E金刚石变为石墨
金刚石的熔点很高硬度很大,氯化氢的熔点 很低是因为:
金刚石是 构成的,
熔化时要破坏 。
氯化氢是 构成的,熔化
时只需破坏 。碳原子通过共价键共价键HCl分子HCl分子间作用力C E2019/1/25研修班21★氢分子的形成: H · ★氯化氢分子的形成:· H+→H ·+→H H ··共价键形成过程可用电子式表示如下)H﹣H(结构式)H﹣Cl(结构式)知识拓展电子式是一种由元素符号和用于表示该元素原子最外层电子的·或X组成的式子 CO2 N2 H2O H2O2的电子式
··C O ·· ·· O ·· ·· ·· ·· ··N ·· ·· ··NOH ··H ·· ·· ··OHHO ·· ·· ·· ·· ·· ·· ·· ·· ··2019/1/25研修班22键的极性特点非极性键:电子对不偏向任何原子,成键两原子不出现正负两极。成键原子的化合价为0电子对不偏移极性键:电子对偏向得电子能力强的原子,使成键的两原子电荷分布不均匀,一个带部分正电荷,为正极,另一个带部分负电荷,为负极电子对偏向Cl2019/1/25研修班23交流研讨
你已知道钠在氯气中燃烧生成氯化钠,看课本图2-1-7是金属钠氯气氯化钠及它们的微观结构示意图。
讨论
1.运用核外电子排布的知识解释氯化钠是怎样形成的?
2.运用化学键的知识分析这个反应的实质。由图可知金属钠、氯气、氯化钠分别由钠原子、氯气分子、Na+和Cl-构成,金属钠、氯化钠中没有分子存在2019/1/25研修班24最外层得到一个电子氯化钠的形成探究2失去最外层一个电子2019/1/25研修班252019/1/25研修班26氯化钠的形成过程演示2019/1/25研修班27Na和Cl最外层均未达8电子稳定结构
钠原子易失电子,失去最外层的一个电子形成Na+ ,氯原子易得电子,最外层的到Na原子的一个电子形成Cl- ,Na+和Cl-最外层均达8电子稳定结构,且Na+和Cl-带相反电荷,通过静电作用形成稳定的化合物氯化钠晶体晶体的形成原因:晶体中无分子是因为Na+周围可吸引6个Cl-, 而Cl-周围有6个Na+,如此向外延伸,形成晶体。★阴、阳离子通过静电作用形成的化学键叫做离子键。★阴离子的化合价=阴离子所带的电荷数=阴离子的原子得电子数
★阳离子的化合价=阳离子所带的电荷数=阳离子的原子失电子数
2019/1/25研修班284.哪些元素的原子之间可能形成离子键(成键条件) ?1.离子键的形成原因是什么?3.离子键的成键本质或方式是什么?2.形成离子键的微粒是什么?答: 是因为参与化学反应的成键原子的结构不稳定,易得、失电子形成阴、阳离子最外电子层达稳定结构。。 答:是阴、阳离子。答:阴、阳离子的静电作用(静电引力和斥力)。答:活泼金属元素与活泼非金属元素之间容易形成。第ⅠA族、
第ⅡA族的金属卤素(VⅡA)及O、S等交流·研讨如Na2 S、MgCl2 、 KI、 CaO等
注 阴阳离子的静电作用既有静电引力又有斥力
金属元素不一定形成离子键,如AlCl3
非金属元素不一定不能形成离子键,如NH4Cl
HCl溶于水HCl= H++Cl-不是离子键断裂,是共价键断裂。2019/1/25研修班292019/1/25研修班30NaCl晶体是由 构成,晶体的的熔点较高,是因为NaCl的熔化时,要破坏 ,需要较高的能量。
晶体中的离子键共价键N2的化学性质稳定是因为N2分子内部
存在很强的 ,很难被破坏。Na+和Cl-2019/1/25研修班31用 电子式 表示 离子化合物 的 形成过程 用电子式表示氯化钠的形成过程 用电子式表示氯化钙的形成过程 ··Na ·+→+用电子式表示Na2O2的形成过程 2Na ·+2· O · ·· ··Na+[ o ]2- ·· ·· : : O ·· ·· :Na+Na2O2中 阴阳离子的个数比为 。1:22个Na+1个O22-→2019/1/25研修班32(1)原子的电子式:常把其最外层电子数用小黑点“.”或小叉“×”来表示。(2)简单阳离子的电子式:用其阳离子的符号表示。多核阳离子类似阴离子表示方法
铵根离子:(3)阴离子的电子式:不但要画出最外层电子数,而且还应用于括号“[ ]”括起来,并在右上角标出“n-”电荷字样。电子式小结2019/1/25研修班33[ 练习] ⑴ 用电子式表示氧化镁的形成过程 ⑵ 用电子式表示硫化钾的形成过程 箭头左方相同的微粒可以合并,
箭头右方相同的微粒不可以合并。注
意· Mg ·+→+2K·→2019/1/25研修班34电子式 :元素符号周围用“ · ”或“×”来表示原子最外层电子的式子,叫电子式。H ·Na · ·Mg · ·Ca · 原子的电子式: 离子的电子式:H+Na+Mg2+Ca2+元素的性质与化学反应都与原子最外层电子有密切联系:2019/1/25研修班35 [ 练习] 写出下列微粒的电子式:
硫原子, 溴原子, 硫离子, 溴离子用电子式可以直观地表示出原子之间是怎样结合的,看到原子结构特点与键之间的关系。2019/1/25研修班36离子化合物的电子式:由阴、阳离子的电子式组成,但相同离子不能合并AB型AB2型A2B型书写时2019/1/25研修班37第2课时:化学键与物质构成复习提问?1.通过上节课的学习你是怎么理解“化学键”的?水气化变成水蒸气及金刚石变成石墨是否破坏化学键?2.化学键的有哪些主要类型?●化学键定义:相邻原子间强烈的相互作用●化学键分类●化学反应的实质——
旧化学键断裂和新化学键形成的过程2019/1/25研修班38●下面给出的都是你熟悉的物质请你利用所学知识分析它们的构成情况。 H、O共价键(极性) N、H共价键(极性) C、O共价键(极性) Ca2+ 、O2- K+ 、 Cl-离子键离子键 H共价键(非极性)构成物质的
微粒H2分子CO2分子NH3分子Ca2+O2-K+ Cl-H2O分子 HK+ OH-K+ OH-离子键 和共价键Na+ O22-Na+ O22- O离子键 和共价键H2SO4、HCl、Na2SO4、NH4Cl呢
2019/1/25研修班39由阴、阳离子通过离子键形成的化合物叫做离子化合物。如Na Cl 、KOH、 Na2 S、MgCl2 、 NH4Cl、 CaO等3.化学键与物质构成Na Cl 晶体结构模型2019/1/25研修班40注意:含有共价键的化合物不一定是共价
化合物,如NaOH、Na2SO4 、 NH4Cl等只含有含有共价键的化合物称为共价
化合物,如HCl、H2O、CO2、CH4、NH3 等
离子化合物、共价化合物的判别1.据化合物的性质
熔融态导电的化合物一定是离子化合物
熔化或溶于水不导电的化合物一定是共价化合物。
溶于水能电离为离子的化合物不一定是离子化合物
电解质可以是 化合物
离子化合物或共价化合物2019/1/25研修班412.据化学键的类型
(1)含离子键的化合物一定是离子化合物,离子化合物一定含离子键也可含共价键
(2)含离子键的物质一定是离子化合物
(3)含共价键的化合物不一定是共价化合物,也可以是离子化合物,如NaOH、Na2SO4 、 NH4Cl
(4)只含共价键的物质不一定是共价化合物,如H2分子
共价化合物一定不含离子键
(5)离子键只存在于离子化合物中,
共价键存在于共价化合物或非金属单质(除稀有气体单质)
中或部分离子化合物中,及原子团中,如OH-、CO32-、SO42-、NO3-等
练习
1.下列变化既无化学键断裂,又无化学键生成的是
有共价键断裂的是
A NaCl溶于水 B HCl溶于水 C 蔗糖溶于水 D 生石灰溶于水
2.下列属于共价化合物的是( ),含共价键的是( )
A Cl2 B P2O5 C NaCl D Ca(OH)2BABD2019/1/25研修班423.据物质的类别
酸类物质均属于共价化合物,强碱均属于离子化合物,
大多数盐类物质属于离子化合物(但AlCl3、FeCl3等例外,它们属于共价化合物)。 4.根据元素种类
离子化合物一般由活泼金属元素和非金属元素共同组成。
但NH4Cl等NH4盐不含金属元素的化合物也是离子化合物
共价化合物一般完全由非金属元素组成。
但AlCl3含金属元素也是共价化合物。2019/1/25研修班43小 结化学键 离子键
阴阳离子通过静电作用共价键
通过共用电子对化学变化的实质旧键断裂,新键生成共价化合物
只含有共价键离子化合物
含有离子键2019/1/25研修班44共 价 键离 子 键 成键微粒原 子阴、阳离子微 粒
间的作用成键元素范围存在的物质类型原子间通过共用电子对相互作用阴、阳离子间静电作用同种或不同种的非金属元素活泼金属(ⅠA、ⅡA)元素与 活泼非金属(ⅥA、ⅦA)元素离子化合物,如
NaCl 、Na2 S、MgCl2 、
NaOH、 Na2SO4或离子化合物如 NaOH、 NH4Cl共价化合物如HCl、CO2 归纳单质如H2、Cl2、O2 2019/1/25研修班45课堂练习·活动1.下列物质中含有离子键的是A.H2O B CaCl2 C. HCl D. Cl22、下列各组化合物中化学键类型不同的是1. NaCl和KF 2. H2O和NH3 3. CaF2和CsCl 4. CCl4和Na2O2019/1/25研修班463. 下列叙述正确的是
A.两个非金属原子间不可能形成离子键
B.非金属原子间不可能形成离子化合物
C.离子化合物中可能有共价键
D.共价化合物中可能有离子键(AC)4. 下列说法正确的是
A.含有共价键的化合物一定是共价化合物
B.分子中只有共价键的化合物一定是共价化合物
C.由共价键形成的物质一定是共价化合物
D. 只有非金属原子间才能形成共价键(B)2019/1/25研修班47 5.判断下列化合物是离子化合物 还是共价化合物离子化合物共价化合物CaCl2 SO2H2O MgO NaOH NH3 Na2SO4HCl2019/1/25研修班487、与Ne的核外电子排布相同的离子跟与Ar的核外电子排布相同的离子所形成的化合物是
A.Na2S B.CCl4
C.KCl D.KF AD6、下列化合物中,既含有离子键又含有共价键的是( )
A.NaOH B.NH4Cl
C.CH4 D.HNO3 A、B2019/1/25研修班49第3课时:化学键与化学反应中的能量变化【复习提问】1.木炭在氧气中燃烧除了发生物质变化之外,还有什么变化?为什么?
2.水在通电条件下发生的分解反应生成氢气和氧气是释放能量还是吸收能量? 3.请你推测:氢气在氧气中燃烧是生成水蒸气时 是释放能量还是吸收能量?【导课】本节课,我们将围绕这些问题,从 微观和宏观的角度来揭示这些秘密。2019/1/25研修班50实验二、锌粉与盐酸反应
取一小勺锌粉放入试管中,将温度计插入试管,再量取5ml盐酸倒入试管,观察温度计液柱的变化。第3课时:化学键与化学反应中的能量变化在化学反应中,反应物转变为生成物时所经历的旧化学键
的断裂,和新化学键的形成过程伴随着能量变化实验一、氢氧化钠与盐酸反应2019/1/25研修班51实验三、Ba(OH)2 · 8H2O晶体与NH4Cl晶体的反应在玻璃片上加少量的水,将一个小烧杯放在玻璃片上。称取Ba(OH)2.8H2O晶体18g、NH4Cl晶体6g都倒入烧杯中。用玻璃棒将Ba(OH)2.8H2O晶体与NH4Cl晶体搅拌使之混合均匀。约3min~5min后,用手小心地提起烧杯,看烧杯与玻璃片是否黏在一起。2019/1/25研修班52混合液的
温度升高中和反应是放热的
混合液的温度升高,有气泡产生该反应是放热反应烧杯温度降低使烧杯和玻璃片冻结,产生刺激性气味的气体 该反应是吸热反应2019/1/25研修班53【实验结论】每一个化学反应都伴随有能量的改变,有的对外释放能量,有的从外界吸收能量。2019/1/25研修班54信息:
破坏1molH2共价键
H2 2H
吸收436kJ能量 形成1molH2O的共价
H20
0.5molO2共价键断裂 键要释放930KJ能量
0.5O2 O
需吸收249KJ能量
问题:1.根据上述信息判断H2燃烧生成水蒸气时是释放能量还是吸收能量?
2.从化学键的角度分析化学反应中的能量变化的实质交流·研讨可知形成 1molH2共价键 能量 可知形成 1mol液态H2O的共价键 释放的能量 930KJ大于2019/1/25研修班55【分析】1. 由上面信息可知,1molH2的共价键断裂吸收能量436KJ,0.5molO2的共价键断裂吸收能量249KJ,两项共吸收能量685KJ。2molH与1molO形成1molH2O的共价键释放能量930KJ。在1molH2与0.5molO2生1molH2O的过程中,放出的能量比吸收的能量多245KJ。即H2燃烧生成水蒸气时是释放能量。2.化学反应过程中,破坏旧化学键,需要吸收能量来克服原子或离子间的相互作用,形成新化学键时,要释放能量,因此在化学反应中不仅有新物质生成,而且伴随能量变化。3.可逆反应中,如果正反应放热,其逆反应必然吸热。2019/1/25研修班56判断一个化学反应放热--对外释放能量或吸热--从外界吸收能量的方法,如果形成新的化学键所释放的能量大于破坏旧化学键所吸收的能量,反应开始后,会有一定的能量以热能电能或光能的形式对外释放能量,是 热的;如果形成新化学键所释放的能量小于破坏旧化学键所吸收的能量,则需要不断吸收能量,才能使反应持续进行,该反应是 热的。放吸1.化学键的方法2019/1/25研修班572.能量守恒的方法
如果反应物的总能量大于生成物的总能量,则反应
热。
如果反应物的总能量小于生成物的总能量,则反应
热。
CaCO3分解反应中,生成物的总能量 反应物的总能量。
石墨变为金刚石 要吸收能量,则 更稳定。
原子成键时能量会 。
1molH-H键形成会 436KJ能量 3.物质的能量越低,物质越稳定
4.需要加热才进行的反应,可能是吸热也可能是放热反应 如H2燃烧需要点燃,是放热反应。大于降低释放石墨练习放吸2019/1/25研修班58——化学反应的过程中伴随着能量变化,通常表现为热量的变化,还可表现为热能电能光能等其他形式的能概括·整合高温如2NH4Cl+Ba(OH)2·8H2O=BaCl2+2NH3 ↑+10H2O高温2019/1/25研修班59 吸收能量E1
旧化学键断裂
反应物 生成物
新的化学键形成
释放能量E2
E1 > E2 反应吸收能量E1 < E2 反应释放能量化学反应中的物质变化与能量变化2019/1/25研修班601、下列反应中,属于吸热反应的是( )
A.实验室制H2的反应 B.实验室制CO2的反应
C.水的分解反应 D.石灰石分解的反应 E.H2还原氧化铜
2、下列说法不正确的是( )
A.化学反应除了生成新物质外,还伴随着能量的变化
B.物质燃烧和中和反应均放出热量
C.分解反应肯定是吸热反应
D.化学反应是吸热还是放热决定于生成物具有的总能量和反应物具有的总能量
3.金刚石和石墨都是碳的单质,石墨在一定条件下可以转 化为金刚石。已知12g石墨完全转化为金刚石时,要吸收EkJ的能量,下列说法正确的是( )
A.金刚石与石墨互为同位素
B.石墨不如金刚石稳定
C.金刚石不如石墨稳定
D.等质量的石墨与金刚石完全燃烧,石墨放出的能量多练一练C、D、E CC课后作业P38.(3.4)
1.化学反应中物质变化的实质是 。
2.预测
水通电时会分解,为什么要通电?
原子在化学反应中重新组合时会释放或吸收能量原子是化学反应中的最小微粒。2019/1/25研修班6H2OH2O通电H2O2旧化学键断裂 水分子中氢原子和氧原子间的化学键断裂★这种相邻原子间的强相互作用称为化学键水是由 组成的,电解水时,水分中的氢原子和氧原子会重新组合,水分子中氢原子和氧原子之间存在着强的相互作用,要破坏这种强相互作用就要消耗能量,通电就是为水的分解提供能量的。水分子水分子之间也存在相互作用,但化学反应是原子的重新组合,要破坏原子间的相互作用,而不是破坏分子间的相互作用,水的蒸发会破坏水分子间的作用力。新化学键断裂 氢原子间形成新的化学键,氧原子间也形成新的化学键2019/1/25研修班7注 1.分子间不存在化学键水是由水分子组成的左边水分子中的氢原子与右边水分子中的氧原子
之间不存在化学键5.水分子中的2个氢原子间也不存在化学键6.化学键中既有相互吸引有有相互排斥作用2.不是一切物质中都存在化学键,
如He等任何稀有气体原子 间不存在化学键。3.化学键的形成原因是成键原子最外电子层未达稳
定结构。4.水中氢原子和氧原子间不是都存在化学键。如2019/1/25研修班8氢氢键、氧氧键H2O分子内 氢氧键氢氢键、氯氯键HCl分子内 氢氯键氮氮键、氢氢键氨分子内 氮氢键2019/1/25研修班9化学反应的实质:2.化学反应是原子的重新组合;3.从化学键的角度看,化学反应既有旧化学键的断裂又有 新化学键的形成。1.化学反应中有新物质生成4. 化学反应中一定既有物质的变化又有能量的变化4. 有化学键断裂的变化不一定是化学变化,如HCl或NaCl溶于水时的电离有化学键的断裂,不是化学变化,是物理变化。2019/1/25研修班10H2O 分子中,HCl分子中NaCl固体中都存在化学键,但NaCl固体中的化学键与H2O 分子中、HCl分子中的化学键有区别2.化学键的类型交流研讨 H2在Cl2中燃烧时, H2分子和Cl2分别获得能量,使各自的化学键断裂,分别生成H和Cl, H和Cl结合生成HCl分子,请根据核外电子排布规律讨论
H和Cl为什么有形成分子的趋势
HCl分子是怎样形成的2019/1/25研修班11Cl2气体分子H2 气体分子共价键的形成(以氢气在氯气中燃烧为例)分开后,她们为什么不高兴?让我们听听她们说些什么?探究1获得能量获得能量H 原子Cl 原子2019/1/25研修班12我只有一个电子,太少了我也少一个电子eH 原子Cl 原子2原子都未达稳定结构且都不易失电子2019/1/25研修班13二位好!我有一个好办法.你们每人拿出一个电子共用,就象共同分享快乐一样共同拥有.行吗?2019/1/25研修班14愿意H原子,你愿意拿出一个电子共用吗?Cl原子,你愿意拿出一个电子共用吗?我给你们点燃之后,你们要结合在一起,为人类做出自己的贡献.HCl2019/1/25研修班15H2+Cl2===2HCl点燃2019/1/25研修班16分析氯化氢的形成过程通过共用电子对2氢原子和氯原子各提供一个电子组成一对共用电子,使两者的最外电子层都达稳定结构,并产生强相互作用—即化学键,从而形成HCl分子。2019/1/25研修班17 ★原子之间通过共用电子所形成的化学键,叫做共价键。★共价键形成元素: 一般是非金属元素原子间的相互作用。
非金属元素可以是同种,也可以是不同种;如:H2、Cl2、HCl、CO2 等分子中均含有共价键。
不活泼金属元素也可形成共价键 ,如AlCl3
非金属元素间不一定只能形成共价键,如NH4Cl含离子键
通过共价键原子不仅可以形成分子也可以直接形成物质,如金刚石,SiO2,
金刚石、SiO2中不含分子, SiO2晶体由Si、O构成2019/1/25研修班18在HCl分子中, 吸引电子能力强于 ,共用电子对偏向 ,偏离 ,所以 显负价, 显正价,
有一个共用电子对偏向Cl,所以Cl最外电子层多了一个电子,显 价,
有一个共用电子对偏离H,即H最外电子层原有的一个电子偏离了H,显 价 ClH-1H Cl+1 ClH2019/1/25研修班19★化合物中共价键的成键元素的化合价是成键元素间共用电子对的数目如 下列分子中的原子都达8e-稳定结构的是
A PCl3 B PCl5 C CO2 D H2O★只含共价键的分子,由于成键原子的电性很弱,所以分子间的作用力是弱相互作用,即熔化或汽化只需破坏分子间作用力,不破坏化学键,因而液态氯化氢中只含HCl分子,但在水溶液中电离时共价键断裂,形成阴阳离子H+、Cl- ★共价键的形成原因:是成键原子由不稳定结构通过共用电子对相互作用后变成稳定结构。 ★共价键的成键方式:是通过共用电子对成键 ★共价键的成键微粒:是原子2019/1/25研修班20下列变化有共价键断裂的是( )
A碘升华 B干冰气化 C HCl溶于水
D溴蒸气被木炭吸附 E金刚石变为石墨
金刚石的熔点很高硬度很大,氯化氢的熔点 很低是因为:
金刚石是 构成的,
熔化时要破坏 。
氯化氢是 构成的,熔化
时只需破坏 。碳原子通过共价键共价键HCl分子HCl分子间作用力C E2019/1/25研修班21★氢分子的形成: H · ★氯化氢分子的形成:· H+→H ·+→H H ··共价键形成过程可用电子式表示如下)H﹣H(结构式)H﹣Cl(结构式)知识拓展电子式是一种由元素符号和用于表示该元素原子最外层电子的·或X组成的式子 CO2 N2 H2O H2O2的电子式
··C O ·· ·· O ·· ·· ·· ·· ··N ·· ·· ··NOH ··H ·· ·· ··OHHO ·· ·· ·· ·· ·· ·· ·· ·· ··2019/1/25研修班22键的极性特点非极性键:电子对不偏向任何原子,成键两原子不出现正负两极。成键原子的化合价为0电子对不偏移极性键:电子对偏向得电子能力强的原子,使成键的两原子电荷分布不均匀,一个带部分正电荷,为正极,另一个带部分负电荷,为负极电子对偏向Cl2019/1/25研修班23交流研讨
你已知道钠在氯气中燃烧生成氯化钠,看课本图2-1-7是金属钠氯气氯化钠及它们的微观结构示意图。
讨论
1.运用核外电子排布的知识解释氯化钠是怎样形成的?
2.运用化学键的知识分析这个反应的实质。由图可知金属钠、氯气、氯化钠分别由钠原子、氯气分子、Na+和Cl-构成,金属钠、氯化钠中没有分子存在2019/1/25研修班24最外层得到一个电子氯化钠的形成探究2失去最外层一个电子2019/1/25研修班252019/1/25研修班26氯化钠的形成过程演示2019/1/25研修班27Na和Cl最外层均未达8电子稳定结构
钠原子易失电子,失去最外层的一个电子形成Na+ ,氯原子易得电子,最外层的到Na原子的一个电子形成Cl- ,Na+和Cl-最外层均达8电子稳定结构,且Na+和Cl-带相反电荷,通过静电作用形成稳定的化合物氯化钠晶体晶体的形成原因:晶体中无分子是因为Na+周围可吸引6个Cl-, 而Cl-周围有6个Na+,如此向外延伸,形成晶体。★阴、阳离子通过静电作用形成的化学键叫做离子键。★阴离子的化合价=阴离子所带的电荷数=阴离子的原子得电子数
★阳离子的化合价=阳离子所带的电荷数=阳离子的原子失电子数
2019/1/25研修班284.哪些元素的原子之间可能形成离子键(成键条件) ?1.离子键的形成原因是什么?3.离子键的成键本质或方式是什么?2.形成离子键的微粒是什么?答: 是因为参与化学反应的成键原子的结构不稳定,易得、失电子形成阴、阳离子最外电子层达稳定结构。。 答:是阴、阳离子。答:阴、阳离子的静电作用(静电引力和斥力)。答:活泼金属元素与活泼非金属元素之间容易形成。第ⅠA族、
第ⅡA族的金属卤素(VⅡA)及O、S等交流·研讨如Na2 S、MgCl2 、 KI、 CaO等
注 阴阳离子的静电作用既有静电引力又有斥力
金属元素不一定形成离子键,如AlCl3
非金属元素不一定不能形成离子键,如NH4Cl
HCl溶于水HCl= H++Cl-不是离子键断裂,是共价键断裂。2019/1/25研修班292019/1/25研修班30NaCl晶体是由 构成,晶体的的熔点较高,是因为NaCl的熔化时,要破坏 ,需要较高的能量。
晶体中的离子键共价键N2的化学性质稳定是因为N2分子内部
存在很强的 ,很难被破坏。Na+和Cl-2019/1/25研修班31用 电子式 表示 离子化合物 的 形成过程 用电子式表示氯化钠的形成过程 用电子式表示氯化钙的形成过程 ··Na ·+→+用电子式表示Na2O2的形成过程 2Na ·+2· O · ·· ··Na+[ o ]2- ·· ·· : : O ·· ·· :Na+Na2O2中 阴阳离子的个数比为 。1:22个Na+1个O22-→2019/1/25研修班32(1)原子的电子式:常把其最外层电子数用小黑点“.”或小叉“×”来表示。(2)简单阳离子的电子式:用其阳离子的符号表示。多核阳离子类似阴离子表示方法
铵根离子:(3)阴离子的电子式:不但要画出最外层电子数,而且还应用于括号“[ ]”括起来,并在右上角标出“n-”电荷字样。电子式小结2019/1/25研修班33[ 练习] ⑴ 用电子式表示氧化镁的形成过程 ⑵ 用电子式表示硫化钾的形成过程 箭头左方相同的微粒可以合并,
箭头右方相同的微粒不可以合并。注
意· Mg ·+→+2K·→2019/1/25研修班34电子式 :元素符号周围用“ · ”或“×”来表示原子最外层电子的式子,叫电子式。H ·Na · ·Mg · ·Ca · 原子的电子式: 离子的电子式:H+Na+Mg2+Ca2+元素的性质与化学反应都与原子最外层电子有密切联系:2019/1/25研修班35 [ 练习] 写出下列微粒的电子式:
硫原子, 溴原子, 硫离子, 溴离子用电子式可以直观地表示出原子之间是怎样结合的,看到原子结构特点与键之间的关系。2019/1/25研修班36离子化合物的电子式:由阴、阳离子的电子式组成,但相同离子不能合并AB型AB2型A2B型书写时2019/1/25研修班37第2课时:化学键与物质构成复习提问?1.通过上节课的学习你是怎么理解“化学键”的?水气化变成水蒸气及金刚石变成石墨是否破坏化学键?2.化学键的有哪些主要类型?●化学键定义:相邻原子间强烈的相互作用●化学键分类●化学反应的实质——
旧化学键断裂和新化学键形成的过程2019/1/25研修班38●下面给出的都是你熟悉的物质请你利用所学知识分析它们的构成情况。 H、O共价键(极性) N、H共价键(极性) C、O共价键(极性) Ca2+ 、O2- K+ 、 Cl-离子键离子键 H共价键(非极性)构成物质的
微粒H2分子CO2分子NH3分子Ca2+O2-K+ Cl-H2O分子 HK+ OH-K+ OH-离子键 和共价键Na+ O22-Na+ O22- O离子键 和共价键H2SO4、HCl、Na2SO4、NH4Cl呢
2019/1/25研修班39由阴、阳离子通过离子键形成的化合物叫做离子化合物。如Na Cl 、KOH、 Na2 S、MgCl2 、 NH4Cl、 CaO等3.化学键与物质构成Na Cl 晶体结构模型2019/1/25研修班40注意:含有共价键的化合物不一定是共价
化合物,如NaOH、Na2SO4 、 NH4Cl等只含有含有共价键的化合物称为共价
化合物,如HCl、H2O、CO2、CH4、NH3 等
离子化合物、共价化合物的判别1.据化合物的性质
熔融态导电的化合物一定是离子化合物
熔化或溶于水不导电的化合物一定是共价化合物。
溶于水能电离为离子的化合物不一定是离子化合物
电解质可以是 化合物
离子化合物或共价化合物2019/1/25研修班412.据化学键的类型
(1)含离子键的化合物一定是离子化合物,离子化合物一定含离子键也可含共价键
(2)含离子键的物质一定是离子化合物
(3)含共价键的化合物不一定是共价化合物,也可以是离子化合物,如NaOH、Na2SO4 、 NH4Cl
(4)只含共价键的物质不一定是共价化合物,如H2分子
共价化合物一定不含离子键
(5)离子键只存在于离子化合物中,
共价键存在于共价化合物或非金属单质(除稀有气体单质)
中或部分离子化合物中,及原子团中,如OH-、CO32-、SO42-、NO3-等
练习
1.下列变化既无化学键断裂,又无化学键生成的是
有共价键断裂的是
A NaCl溶于水 B HCl溶于水 C 蔗糖溶于水 D 生石灰溶于水
2.下列属于共价化合物的是( ),含共价键的是( )
A Cl2 B P2O5 C NaCl D Ca(OH)2BABD2019/1/25研修班423.据物质的类别
酸类物质均属于共价化合物,强碱均属于离子化合物,
大多数盐类物质属于离子化合物(但AlCl3、FeCl3等例外,它们属于共价化合物)。 4.根据元素种类
离子化合物一般由活泼金属元素和非金属元素共同组成。
但NH4Cl等NH4盐不含金属元素的化合物也是离子化合物
共价化合物一般完全由非金属元素组成。
但AlCl3含金属元素也是共价化合物。2019/1/25研修班43小 结化学键 离子键
阴阳离子通过静电作用共价键
通过共用电子对化学变化的实质旧键断裂,新键生成共价化合物
只含有共价键离子化合物
含有离子键2019/1/25研修班44共 价 键离 子 键 成键微粒原 子阴、阳离子微 粒
间的作用成键元素范围存在的物质类型原子间通过共用电子对相互作用阴、阳离子间静电作用同种或不同种的非金属元素活泼金属(ⅠA、ⅡA)元素与 活泼非金属(ⅥA、ⅦA)元素离子化合物,如
NaCl 、Na2 S、MgCl2 、
NaOH、 Na2SO4或离子化合物如 NaOH、 NH4Cl共价化合物如HCl、CO2 归纳单质如H2、Cl2、O2 2019/1/25研修班45课堂练习·活动1.下列物质中含有离子键的是A.H2O B CaCl2 C. HCl D. Cl22、下列各组化合物中化学键类型不同的是1. NaCl和KF 2. H2O和NH3 3. CaF2和CsCl 4. CCl4和Na2O2019/1/25研修班463. 下列叙述正确的是
A.两个非金属原子间不可能形成离子键
B.非金属原子间不可能形成离子化合物
C.离子化合物中可能有共价键
D.共价化合物中可能有离子键(AC)4. 下列说法正确的是
A.含有共价键的化合物一定是共价化合物
B.分子中只有共价键的化合物一定是共价化合物
C.由共价键形成的物质一定是共价化合物
D. 只有非金属原子间才能形成共价键(B)2019/1/25研修班47 5.判断下列化合物是离子化合物 还是共价化合物离子化合物共价化合物CaCl2 SO2H2O MgO NaOH NH3 Na2SO4HCl2019/1/25研修班487、与Ne的核外电子排布相同的离子跟与Ar的核外电子排布相同的离子所形成的化合物是
A.Na2S B.CCl4
C.KCl D.KF AD6、下列化合物中,既含有离子键又含有共价键的是( )
A.NaOH B.NH4Cl
C.CH4 D.HNO3 A、B2019/1/25研修班49第3课时:化学键与化学反应中的能量变化【复习提问】1.木炭在氧气中燃烧除了发生物质变化之外,还有什么变化?为什么?
2.水在通电条件下发生的分解反应生成氢气和氧气是释放能量还是吸收能量? 3.请你推测:氢气在氧气中燃烧是生成水蒸气时 是释放能量还是吸收能量?【导课】本节课,我们将围绕这些问题,从 微观和宏观的角度来揭示这些秘密。2019/1/25研修班50实验二、锌粉与盐酸反应
取一小勺锌粉放入试管中,将温度计插入试管,再量取5ml盐酸倒入试管,观察温度计液柱的变化。第3课时:化学键与化学反应中的能量变化在化学反应中,反应物转变为生成物时所经历的旧化学键
的断裂,和新化学键的形成过程伴随着能量变化实验一、氢氧化钠与盐酸反应2019/1/25研修班51实验三、Ba(OH)2 · 8H2O晶体与NH4Cl晶体的反应在玻璃片上加少量的水,将一个小烧杯放在玻璃片上。称取Ba(OH)2.8H2O晶体18g、NH4Cl晶体6g都倒入烧杯中。用玻璃棒将Ba(OH)2.8H2O晶体与NH4Cl晶体搅拌使之混合均匀。约3min~5min后,用手小心地提起烧杯,看烧杯与玻璃片是否黏在一起。2019/1/25研修班52混合液的
温度升高中和反应是放热的
混合液的温度升高,有气泡产生该反应是放热反应烧杯温度降低使烧杯和玻璃片冻结,产生刺激性气味的气体 该反应是吸热反应2019/1/25研修班53【实验结论】每一个化学反应都伴随有能量的改变,有的对外释放能量,有的从外界吸收能量。2019/1/25研修班54信息:
破坏1molH2共价键
H2 2H
吸收436kJ能量 形成1molH2O的共价
H20
0.5molO2共价键断裂 键要释放930KJ能量
0.5O2 O
需吸收249KJ能量
问题:1.根据上述信息判断H2燃烧生成水蒸气时是释放能量还是吸收能量?
2.从化学键的角度分析化学反应中的能量变化的实质交流·研讨可知形成 1molH2共价键 能量 可知形成 1mol液态H2O的共价键 释放的能量 930KJ大于2019/1/25研修班55【分析】1. 由上面信息可知,1molH2的共价键断裂吸收能量436KJ,0.5molO2的共价键断裂吸收能量249KJ,两项共吸收能量685KJ。2molH与1molO形成1molH2O的共价键释放能量930KJ。在1molH2与0.5molO2生1molH2O的过程中,放出的能量比吸收的能量多245KJ。即H2燃烧生成水蒸气时是释放能量。2.化学反应过程中,破坏旧化学键,需要吸收能量来克服原子或离子间的相互作用,形成新化学键时,要释放能量,因此在化学反应中不仅有新物质生成,而且伴随能量变化。3.可逆反应中,如果正反应放热,其逆反应必然吸热。2019/1/25研修班56判断一个化学反应放热--对外释放能量或吸热--从外界吸收能量的方法,如果形成新的化学键所释放的能量大于破坏旧化学键所吸收的能量,反应开始后,会有一定的能量以热能电能或光能的形式对外释放能量,是 热的;如果形成新化学键所释放的能量小于破坏旧化学键所吸收的能量,则需要不断吸收能量,才能使反应持续进行,该反应是 热的。放吸1.化学键的方法2019/1/25研修班572.能量守恒的方法
如果反应物的总能量大于生成物的总能量,则反应
热。
如果反应物的总能量小于生成物的总能量,则反应
热。
CaCO3分解反应中,生成物的总能量 反应物的总能量。
石墨变为金刚石 要吸收能量,则 更稳定。
原子成键时能量会 。
1molH-H键形成会 436KJ能量 3.物质的能量越低,物质越稳定
4.需要加热才进行的反应,可能是吸热也可能是放热反应 如H2燃烧需要点燃,是放热反应。大于降低释放石墨练习放吸2019/1/25研修班58——化学反应的过程中伴随着能量变化,通常表现为热量的变化,还可表现为热能电能光能等其他形式的能概括·整合高温如2NH4Cl+Ba(OH)2·8H2O=BaCl2+2NH3 ↑+10H2O高温2019/1/25研修班59 吸收能量E1
旧化学键断裂
反应物 生成物
新的化学键形成
释放能量E2
E1 > E2 反应吸收能量E1 < E2 反应释放能量化学反应中的物质变化与能量变化2019/1/25研修班601、下列反应中,属于吸热反应的是( )
A.实验室制H2的反应 B.实验室制CO2的反应
C.水的分解反应 D.石灰石分解的反应 E.H2还原氧化铜
2、下列说法不正确的是( )
A.化学反应除了生成新物质外,还伴随着能量的变化
B.物质燃烧和中和反应均放出热量
C.分解反应肯定是吸热反应
D.化学反应是吸热还是放热决定于生成物具有的总能量和反应物具有的总能量
3.金刚石和石墨都是碳的单质,石墨在一定条件下可以转 化为金刚石。已知12g石墨完全转化为金刚石时,要吸收EkJ的能量,下列说法正确的是( )
A.金刚石与石墨互为同位素
B.石墨不如金刚石稳定
C.金刚石不如石墨稳定
D.等质量的石墨与金刚石完全燃烧,石墨放出的能量多练一练C、D、E CC课后作业P38.(3.4)
