第二节元素周期律与元素周期表
图片预览











文档简介
课件89张PPT。一、元素周期律
1.定义:元素的性质随着 的递增,呈现
变化的规律。
2.实质:原子 呈周期性变化决定元素性质的周期性变化。
二、元素周期表
1.原子序数
按照元素在周期表中的顺序给元素所编的序号,原子序数= = 。
2.形成
1869年,由俄国化学家 初步绘制完成。原子序数周期性核外电子排布核电荷数质子数门捷列夫(2)族( 个纵行, 个族)
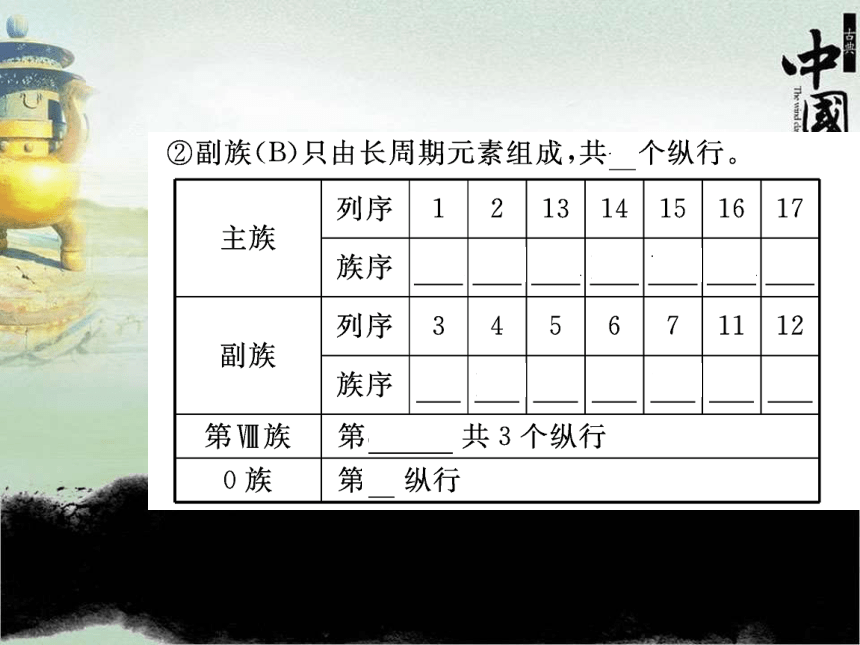
①主族(A):由 和 元素共同组成,主族序数= ②副族(B)只由长周期元素组成,共 个纵行。1816短周期长周期原子最外层电子数七(1)金属元素:位于分界线的 区域,包括所有的 元素和部分 元素。
(2)非金属元素:位于分界线的 区域,包括部分主族元素和 族元素。
(3)分界线附近元素的性质:位于分界线附近的元素既能表现出一定的 ,又能表现出一定的
(4)最强的非金属元素是 ,最强的金属元素是 。左下方过渡主族右上方0金属性非金属性。氟Cs(1)含元素种类最多的周期是第六周期,有32种元素,含元素种类最多的族是ⅢB族,共有32种元素。
(2)最外层有3个电子的原子一定位于ⅢA族。最外层有2个电子的原子可能位于ⅡA族、0族(He)、过渡金属区。(3)镧系和锕系:
镧系位于第六周期ⅢB族,共15种元素;
锕系位于第七周期ⅢB族,共15种元素。
(4)过渡元素:
包括7个副族和VⅢ族(第3~12共10个纵行),全部是金属元素,原子最外层电子数不超过2个(1~2个)。三、元素周期表中部分重要元素
1.ⅡA族元素
(1)元素名称及元素符号
包括 、锶(Sr)、钡 、镭(Ra),又称 元素。
(2)共同结构特点: 。
(3)共同的物理性质:单质均为 色金属;均具有良好的 ;含Ca、Sr、Ba元素的物质均有明显的焰色反应。铍(Be)、镁(Mg)、钙(Ca)(Ba)碱土金属原子最外层有2个电子银白导电性(4)共同的化学性质:都很活泼,易失 个电子,在化合物中显 价。
(5)自然界中的存在形态:均只以 存在。
(6)递变规律:从Be―→Ra氢氧化物的溶解性逐渐增大,硫酸盐的溶解性逐渐 。
2.ⅤA族元素
(1)元素名称及元素符号
包括氮 、 、 、锑(Sb)、铋(Bi)五种元素。+2化合态减小(N)磷(P)砷(As)2(3)ⅤA族元素特点
①原子最外层电子数为 。
②原子电子层数由 增加到 。
③非金属元素为 。
④金属元素为 。525N、P、AsSb、Bi3.过渡元素
(1)包括元素周期表中第 列的元素。
(2)最外层电子数为1或2,全为 元素。
(3)大部分过渡元素的单质 而有 ,具有良好的 ,且比较 ,与空气和水的反应缓慢或根本不反应。
(4)常温下只有 的单质为液态。3~12金属坚硬光泽导电性稳定汞4.镧系、锕系、超铀元素:
(1)镧系:元素第六周期中,57号元素镧(La)到71号元素镥(Lu)共15种元素,它们原子的电子层结构和性质十分相似,总称镧系元素。
(2)锕系:元素第七周期中,89号元素锕(Ac)到103号元素铹(Lr)共15种元素,它们原子的电子层结构和性质十分相似,称为锕系元素。
(3)超铀元素:在锕系元素中92号元素铀(U)以后的各种元素,多数是人工进行核反应制得的元素,这些元素叫做超铀元素。元素周期表的结构从1→8更迭两次。
简记为:“一八又一零,二、三主副分”,第2、3族是主副族的分界线,第一次是ⅠA、ⅡA后是ⅢB~VⅡB族和VⅢ族,第二次是ⅠB、ⅡB后是ⅢA~ⅦA族和零族。2.元素周期表中呈现的“序差”规律
(1)同一周期ⅡA族与ⅢA族元素的原子序数
①二、三周期(短周期)相差1;
②四、五周期(长周期)相差11;
③六、七周期(含镧系、锕系)相差25。(2)同主族上下相邻元素的原子序数的差值(左上右下规律)ⅠA、ⅡA族与上一周期元素种类数相同;ⅢA~0族与下一周期的元素种类数相同。例如:Na的原子序数为11,而第三周期元素种类数是8,所以K的原子序数为11+8=19;Cl的原子序数为17,Br所在第四周期元素种类数为18,故Br的原子序数为17+18=35。
即相邻周期,同一主族元素的原子序数可能相差2、8、18、32(差值为各周期元素种类数)。3.奇偶数规律
元素周期表中,原子序数为奇(或偶)数的元素,元素所在族序数及主要化合价一般也为奇(或偶)数(Ⅷ族元素除外)。已知X、Y、Z 3种主族元素在元素周期表中的相对位置如右图所示,设X的原子序数为a,则下列说法中不正确的是( )
A.Y与Z的原子序数之和可能为2a
B.Y的原子序数可能为a-17
C.Z的原子序数可能为a+31
D.X、Y、Z一定都是短周期元素【解析】 由于X、Y、Z均为主族元素,结合其位置关系和元素周期表的结构,故Y元素一定不在第一周期,即X、Y、Z不可能都在短周期,所以D错误;若Y、X、Z分别位于第三、四、五周期(或分别位于第四、五、六周期)的右方,则Y的原子序数为(a-17);若Y、X、Z分别位于元素周期表的第三、四、五周期的右方,则Y、Z的原子序数之和为2a;若Y、X、Z分别位于元素周期表的第四、五、六周期的右方,则Z的原子序数为(a+31)。【答案】 D【规律总结】 考生对元素周期表中同主族相邻元素的原子序数相差情况较熟悉,而对不相邻元素的原子序数相差情况则较陌生,此时必须分情况从不同周期的元素种类进行分析来确定。1.如果n为第ⅡA族中某元素原子序数,则原子序数为(n+1)的元素可能位于( )
A.ⅢA B.ⅣA
C.ⅢB D.ⅠA
解析:本题重点对周期表的结构进行考查,第ⅡA族后面的族既可能是ⅢB族,也可能是ⅢA族,故答案为A、C。答案:AC答案:A 比较粒子半径的大小1.阴上阳下规律
(1)稀有气体与同周期阴离子和下一周期阳离子的核外电子排布相同。
①与He原子电子层结构相同的离子:H-、Li+、Be2+。
②与Ne原子电子层结构相同的离子:N3-、O2-、F-、Na+、Mg2+、Al3+。
③与Ar原子电子层结构相同的离子:S2-、Cl-、K+、Ca2+。2.微粒半径大小
(1)原子半径
同一周期:左大右小(稀有气体大于同周期非金属原子半径,ⅠA族最大,ⅦA族最小);
同一主族:下大上小。
(2)离子半径
①同一元素的原子和离子,电子数越多,半径越大。如rCl->rCl;
rFe>rFe2+>rFe3+。简记为:“同核时,e大r大”。
②电子层结构相同的离子,质子数越多,半径越小。如
rH->rLi+>rBe2+;
rO2->rF->rNa+>rMg2+>rAl3+;
rS2->rCl->rK+>rCa2+。
简记为:“同壳时,z大r小”。
有时也称为:“阴上阳下,径小序大”规律即:
具有相同电子层结构的离子,阴离子元素在阳离子元素的上一个周期。且原子序数越大,微粒半径越小。如“Xm+”“Yn-”的电子层结构相同,则X元素在Y元素的下一个周期,故原子序数X>Y,离子半径Xm+③阴大阳小规律,包括三层含义
a.同一元素的原子和离子:
rF->rF;rNa>rNa+
b.同一周期的离子半径:阴离子>阳离子
rCl->rNa+;rO2->rLi+,故第三周期Al3+半径最小。
c.电子层结构相同的离子:阴离子>阳离子
rCl->rK+;rO2->rNa+。 A、B、C为三种短周期元素,A、B同周期,A、C最低价离子分别为A2-、C-,其离子半径A2->C-。B2+与C-具有相同的电子层结构,下列叙述一定不正确的是( )
A.它们的原子序数A>B>C
B.它们的原子半径C>B>A
C.离子半径A2->C->B2+
D.原子核外最外层上的电子数C>A>B
【解析】 根据“A、C最低价离子分别为A2-、C-”,可知A位于ⅥA族,C位于ⅦA族,C在A的右边;联系“A、B同周期”、“B2+与C-具有相同的电子层结构”可知A在C的左下方,B位于A的左侧。最后绘出它们的相对位置(如图)。由表可知:原子半径的大小顺序应该是B>A>C,B错;离子半径的大小顺序是A2->C->B2+,C正确。A、D也均正确。【答案】 B【方法技巧】 依据离子结构特点推断元素在周期表中的位置是解决此类问题的关键。把A、B、C等元素在周期表中定位后,它们的原子结构、电子层数、最外层电子数、元素最高正价以及原子半径、离子半径等递变规律都能顺利推断出来。3.(2009年浙江淳安高三联考)已知:aAn+、bB(n+1)+、cCn-、dD(n+1)-是具有相同的电子层结构的短周期元素形成的简单离子,下列叙述正确的是( )
A.原子半径:C>D>A>B
B.原子序数:b>a>c>d
C.离子半径:C>D>A>B
D.单质还原性:A>B>C>D答案:B元素在元素周期表中位置的推断1.根据核外电子排布规律
(1)最外层电子数等于或大于3(小于8)的一定是主族元素。
(2)最外层有1个或2个电子,则可能是ⅠA、ⅡA族元素又可能是副族、Ⅷ族或0族元素氦。
(3)最外层电子数比次外层电子数多的元素一定位于第二周期。 2.根据周期表结构与原子电子层结构的关系
核外电子层数=周期数(对于大部分元素来说)
主族序数=最外层电子数=最高正价=8-|最低负价|。
(1)族序数等于周期数的元素是H、Be、Al等。
(2)短周期中最高正价与最低负价代数和为零的是H(NaH中氢原子显-1价)、C、Si。(3)最高正价是最低负价绝对值3倍的短周期元素是S。
(4)除H外,原子半径最小的元素是F。
(5)最高正价不等于族序数的元素是O、F等。
(6)不易表现出正价的元素是O、F。3.根据稀有气体的原子序数推断元素在周期表中的位置
第1~6周期稀有气体元素的原子序数依次为2、10、18、36、54、86,可利用元素的原子序数与最相近稀有气体元素原子序数的差值来推断元素在元素周期表中的位置,可遵循“比大小,定周期;比差值,定族数”的原则。(1)若b-a=1~2,则B元素处于A元素的下一周期ⅠA或ⅡA族,如38号元素比第四周期氪的原子序数(36)多2,故该元素处在第五周期ⅡA族。
(2)若a-b=1~5,则B元素处于A元素所在周期的ⅢA~ⅦA族,如49号元素比第五周期的氙(54号)原子序数少5,因此该元素处在第五周期ⅢA族。1999年4月,核化学家在回旋加速器上用高 【答案】 D4.我国科研人员在兰州合成了镤元素的一种同位素镤239,并测知其原子核内有148个中子。现有A元素的一种同位素,比镤239的原子核少54个质子和100个中子。则A元素在元素周期表中的位置是( )
A.第三周期ⅠA族 B.第四周期ⅠA族
C.第五周期ⅠA族 D.第二周期ⅡA族答案:C1.短周期元素X、Y的原子序数相差7,下列有关判断错误的是( )
A.X和Y可能处于同一周期
B.X和Y可能处于相邻周期
C.X和Y可能处于同一主族
D.X和Y可能处于相邻主族答案:C2.X元素的阳离子和Y元素的阴离子具有与氩原子相同的电子层结构,下列叙述正确的是( )
A.X的原子序数比Y的小
B.X原子的最外层电子数比Y的多
C.X的原子半径比Y的大
D.X元素的最高化合价比Y的小解析:根据X元素的阳离子和Y元素的阴离子具有和氩原子相同的电子层结构可知:阴离子与其原子具有相同的电子层,而阳离子比其原子少一个电子层,则X、Y、Ar三原子在元素周期表中的大致位置为从上图知:X、Y在相邻的周期,Y在X元素的上一周期,是非金属元素,X的原子序数比Y的大,X是金属元素,其原子的最外层电子数比Y的少。X原子比Y原子的电子层结构多一层,且在元素周期表的左侧,故原子半径X>Y。X原子处在第四周期,可能为钾、钙等,阳离子的电子层结构与Ar的相同,X的最高化合价可能是+1、+2价等,Y元素处于第三周期,可能是P、S、Cl等,其最高化合价可能是+5、+6、+7等。显然,X元素的最高化合价比Y的小。答案:CD3.同主族两种元素原子的核外电子数的差值可能为( )
A.6 B.12
C.26 D.30
解析:同一主族相邻周期的两种元素的原子序数之差为2、8、8、18、18、32这几个数。此题两种元素的原子序数之差可能是这几个数或其中相邻几个数之和,所以选C项。答案:C4.(2009年山东莱阳一中)某元素的原子最外层有2个电子,则该元素是( )
A.金属元素 B.稀有气体元素
C.ⅡA族元素 D.以上叙述都可能答案:D5.原子的核电荷数小于18的某元素X,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数为2n2-1。下列有关元素X的说法中不正确的是( )
A.元素X能形成化学式为X(OH)3的碱
B.元素X可能形成化学式为KXO3的含氧酸钾盐
C.元素X原子的最外层电子数和核电荷数肯定为奇数
D.元素X能与某些金属元素形成化合物解析:核电荷数小于18的元素,电子层数可以为1、2、3,由最外层电子数为2n+1,可知电子层数为1不符合题意,当n=2时,最外层电子数为5、质子数为7,则为氮元素;当n=3时,最外层电子数为7、质子数为17,则为氯元素。所以两种元素均能形成化学式为KXO3的含氧酸钾盐,最外层电子数和核电荷数也均为奇数,这两种元素都是活泼的非金属元素,因而均能与某些金属元素形成化合物,不能形成化学式为X(OH)3的碱,所以A不正确。答案:A6.A、B、C为短周期元素,在元素周期表中所处的位置如右图所示。A、C两元素的原子核外电子数之和等于B原子的质子数。B原子核内质子数和中子数相等。
请填空:(1)写出A、B、C三种元素的名称__________、________、________。
(2)B元素位于元素周期表中第________周期______族。
(3)C的原子结构示意图为________,C的单质与H2O反应的化学方程式为__________________________________________。
(4)写出A的气态氢化物与B的最高价氧化物对应水化物反应的化学方程式__________________________________________。答案: 一、选择题(每小题5分,共50分)
1.已知下列元素的原子半径,
根据以上数据,磷原子的半径可能是( )
A.0.80×10-10m B.1.10×10-10m
C.1.20×10-10m D.0.70×10-10m
解析:Si、P、S位于第三周期从左至右,原子半径减小。答案:B2.三种短周期元素在周期表中的位置关系如图所示。下列说法正确的是( )
A.无法确定X、Y、Z各为何种元素
B.均为非金属元素
C.Y为氯元素
D.X元素形成的单质有很强的氧化性解析:三种都是短周期元素,由图知X必为第一周期零族元素He,则Y为F,Z为S,故A、C错,B项正确;He原子为最外层2电子稳定结构,性质稳定,既无强氧化性,也无强还原性,D项错。答案:B3.A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物显碱性,且碱性B>A;C、D两种元素对应的气态氢化物的稳定性C>D;E是这五种元素的简单离子中半径最小的。则它们的原子序数由小到大的顺序是( )
A.B<A<C<D<E B.A<E<B<C<D
C.E<B<A<C<D D.B<A<E<D<C答案:D4.(2010年合肥模拟)下列说法正确的是( )
A.原子最外层电子数等于或大于3的元素一定是非金属元素
B.原子最外层只有1个电子的元素一定是金属元素
C.最外层电子数比次外层电子数多的元素一定位于第二周期
D.某元素的离子最外层电子数与次外层电子数相同,该元素一定位于第三周期解析:A项,金属Al、Sn、Bi等最外层电子数等于或大于3;B项,H原子最外层只有一个电子,是非金属;C项,最外层电子数不能大于8,除第二周期元素外,原子的次外层电子数为8或18,故C项正确;D项,第四周期的K+、Ca2+的电子层结构 ,最外层电子数与次外层的相同。答案:C5.右表为元素周期表短
周期的一部分,下列有关A、B、C、D四种元素的叙述正确的是( )A.原子半径大小比较为A>B>C>D
B.生成的氢化物稳定性为A>B>C>D
C.A与C形成的阴离子可能有AC
D.A、B、C、D的单质常温下均不导电
解析:A项原子半径D>B,错;B项氢化物C最稳定,错;C项为CO正确;D项A的单质石墨导电。答案:C6.(2008年北京高考)X、Y均为元素周期表中前20号元素,其简单离子的电子层结构相同,下列说法正确的是( )
A.由mXa+与nYb-,得m+a=n-b
B.X2-的还原性一定大于Y-
C.X、Y一定不是同周期元素
D.若X的原子半径大于Y,则气态氢化物的稳定性HmX一定大于HnY解析:A项,X原子失去a个电子得Xa+,Y原子得到b个电子形成Yb-,二者的电子层结构相同,所以,m-a=n+b;B项,X与Y位于同一周期,且X位于Y的左边,Y的非金属性大于X,故X2-的还原性一定大于Y-;D项,HnY的稳定性大于HmX。答案:B7.(2010年湛江质检)有X、Y、Z三种短周期元素,X既能形成X+也可形成X-。Y、Z两元素的原子具有相同的电子层数,Y元素的L层上的电子数是K层电子数的2倍,Z元素最外层电子数是电子层数的3倍,下列说法正确的是( )
A.X、Y、Z三种元素有一种是金属元素
B.X、Y、Z三种元素可形成离子化合物C.X、Y、Z三种元素可形成多种酸分子
D.X、Y两种元素形成的分子种数不如X、Z两种元素形成的分子种数多解析:X能形成X+和X-为氢元素;Y为碳,Z为氧。A项、B项均不正确;C项三种元素可形成H2CO3、HCOOH、CH3COOH等,正确;D项X、Y形成烃种数多于H2O和H2O2。答案:C8.(2010年青岛模拟)目前,人类已经发现的非金属元素除稀有气体元素外共有16种,下列对这16种非金属元素的判断不正确的是( )
①都是主族元素,原子的最外层电子数都大于3
②单质在反应中都只能作氧化剂
③对应的含氧酸都是强酸④氢化物常温下都是气态,所以又叫气态氢化物
⑤气态氧化物与水反应都不会再生成气体
A.全部 B.只有①②
C.只有①②③④ D.只有①②④⑤解析:由H知①、②不正确,由H2CO3、H2SiO3知③不正确,由H2O知④不正确,由3NO2+H2O=2NO+HNO3知⑤不正确。答案:A9.下列说法正确的是( )
A.最外层电子数为次外层电子数一半的元素一定属于碱金属元素
B.元素周期表中从ⅢB族到ⅡB族之间10个纵行的元素都是金属元素
C.第ⅡA族与第ⅢA族元素的原子序数相差1或11或25
D.若主族元素的族序数为a,周期数为b,当
<1时,该元素为非金属元素解析:A中最外层电子数为次外层电子数一半的可能是Li、Si等,因此A不正确;B中实际上全部是副族元素,它们是过渡金属,因此B正确;C中如果在短周期,第ⅡA族与第ⅢA族元素的原子序数相差1,如果是长周期的第四、第五周期元素,第ⅡA族和第ⅢA族元素的原子序数相差11,如果是第六、第七周期元素,第ⅡA族与第ⅢA族元素的原子序数相差25(镧系、锕系各有15种元素收缩在一小格内),故C正确;D中采用举例法,例如Na元素中 <1,但它是金属元素。答案:BC10.下列说法中错误的是( )
A.任何原子及其离子,都是核外电子层数等于该元素在周期表中的周期数
B.在元素周期表中,从ⅢB族到ⅡB族的10个纵列中,所有的元素都是金属元素
C.除氦以外的所有稀有气体元素,原子的最外层电子数都是8
D.凡是同种元素的同位素,其各项物理性质、化学性质都相同答案:AD二、非选择题(共50分)
11.(12分)元素周期表中前7个周期完全排满时元素的种数如下表所示:
(1)第六、七周期完全排满时元素的种数比第四、五周期多了14种,其原因是________________________________________________________________________。
(2)周期表中________族所含元素最多,________族元素形成化合物最多。
(3)请分析周期数与元素种数的关系,然后预测第八周期最多可能含有的元素种数为________。(4)居里夫人发现的镭是元素周期表中第七周期的ⅡA族元素,下列关于镭的性质的描述中不正确的是______。
A.在化合物中呈+2价 B.氢氧化物呈两性
C.单质使水分解,放出氢气 D.碳酸盐难溶于水(2)Y的原子结构示意图是____________________________________________。
(3)T、X形成化合物T2X与T2X2的化学方程式分别为:
____________________________________________。答案:(1)O S Cl Na H答案: 14.(13分)元素周期表奥妙无穷,有关元素周期表的研究角度不断创新。
(1)从下表中可以看出,除H外,其余非金属元素原子________(填序号)。
a.最外层电子数都大于4
b.最外层电子数都大于电子层数(2)美俄科学家宣布他们制得了117号元素(位置见上表),按元素周期表中金属与非金属的分区,它应是一种________(填“金属”或“非金属”)元素。
(3)若117号元素的一种核素表示为X,则关于它的推测正确的是( )
a.这种原子的中子数为168
b.这种原子易与氢化合
c.KX是离子化合物
d.AgX易溶于水(4)随着科学技术的发展,不断有新的元素被发现。若把元素周期表中第七周期排满,则可以排布118种元素。某同学受镧系、锕系元素排列方式的启发,将元素周期表设计成下列更简明的形式,把118种元素全部排列在内,表中除A、B、C、D外每个位置只表示一种元素。则该表中A位置包含________(填数字)种元素。C位置中的元素是否全部是金属元素:________(选填“是”或“否”)。解析:(1)除H外,根据其他主族元素的最后一种非金属元素可推知,非金属元素最外层电子数都大于电子层数。(3)X的质量数为285,质子数为117,则中子数=285-117=168。(4)第四周期共18种元素,所以A位置包括11种元素。答案:(1)b (2)金属 (3)ac (4)11 是
1.定义:元素的性质随着 的递增,呈现
变化的规律。
2.实质:原子 呈周期性变化决定元素性质的周期性变化。
二、元素周期表
1.原子序数
按照元素在周期表中的顺序给元素所编的序号,原子序数= = 。
2.形成
1869年,由俄国化学家 初步绘制完成。原子序数周期性核外电子排布核电荷数质子数门捷列夫(2)族( 个纵行, 个族)
①主族(A):由 和 元素共同组成,主族序数= ②副族(B)只由长周期元素组成,共 个纵行。1816短周期长周期原子最外层电子数七(1)金属元素:位于分界线的 区域,包括所有的 元素和部分 元素。
(2)非金属元素:位于分界线的 区域,包括部分主族元素和 族元素。
(3)分界线附近元素的性质:位于分界线附近的元素既能表现出一定的 ,又能表现出一定的
(4)最强的非金属元素是 ,最强的金属元素是 。左下方过渡主族右上方0金属性非金属性。氟Cs(1)含元素种类最多的周期是第六周期,有32种元素,含元素种类最多的族是ⅢB族,共有32种元素。
(2)最外层有3个电子的原子一定位于ⅢA族。最外层有2个电子的原子可能位于ⅡA族、0族(He)、过渡金属区。(3)镧系和锕系:
镧系位于第六周期ⅢB族,共15种元素;
锕系位于第七周期ⅢB族,共15种元素。
(4)过渡元素:
包括7个副族和VⅢ族(第3~12共10个纵行),全部是金属元素,原子最外层电子数不超过2个(1~2个)。三、元素周期表中部分重要元素
1.ⅡA族元素
(1)元素名称及元素符号
包括 、锶(Sr)、钡 、镭(Ra),又称 元素。
(2)共同结构特点: 。
(3)共同的物理性质:单质均为 色金属;均具有良好的 ;含Ca、Sr、Ba元素的物质均有明显的焰色反应。铍(Be)、镁(Mg)、钙(Ca)(Ba)碱土金属原子最外层有2个电子银白导电性(4)共同的化学性质:都很活泼,易失 个电子,在化合物中显 价。
(5)自然界中的存在形态:均只以 存在。
(6)递变规律:从Be―→Ra氢氧化物的溶解性逐渐增大,硫酸盐的溶解性逐渐 。
2.ⅤA族元素
(1)元素名称及元素符号
包括氮 、 、 、锑(Sb)、铋(Bi)五种元素。+2化合态减小(N)磷(P)砷(As)2(3)ⅤA族元素特点
①原子最外层电子数为 。
②原子电子层数由 增加到 。
③非金属元素为 。
④金属元素为 。525N、P、AsSb、Bi3.过渡元素
(1)包括元素周期表中第 列的元素。
(2)最外层电子数为1或2,全为 元素。
(3)大部分过渡元素的单质 而有 ,具有良好的 ,且比较 ,与空气和水的反应缓慢或根本不反应。
(4)常温下只有 的单质为液态。3~12金属坚硬光泽导电性稳定汞4.镧系、锕系、超铀元素:
(1)镧系:元素第六周期中,57号元素镧(La)到71号元素镥(Lu)共15种元素,它们原子的电子层结构和性质十分相似,总称镧系元素。
(2)锕系:元素第七周期中,89号元素锕(Ac)到103号元素铹(Lr)共15种元素,它们原子的电子层结构和性质十分相似,称为锕系元素。
(3)超铀元素:在锕系元素中92号元素铀(U)以后的各种元素,多数是人工进行核反应制得的元素,这些元素叫做超铀元素。元素周期表的结构从1→8更迭两次。
简记为:“一八又一零,二、三主副分”,第2、3族是主副族的分界线,第一次是ⅠA、ⅡA后是ⅢB~VⅡB族和VⅢ族,第二次是ⅠB、ⅡB后是ⅢA~ⅦA族和零族。2.元素周期表中呈现的“序差”规律
(1)同一周期ⅡA族与ⅢA族元素的原子序数
①二、三周期(短周期)相差1;
②四、五周期(长周期)相差11;
③六、七周期(含镧系、锕系)相差25。(2)同主族上下相邻元素的原子序数的差值(左上右下规律)ⅠA、ⅡA族与上一周期元素种类数相同;ⅢA~0族与下一周期的元素种类数相同。例如:Na的原子序数为11,而第三周期元素种类数是8,所以K的原子序数为11+8=19;Cl的原子序数为17,Br所在第四周期元素种类数为18,故Br的原子序数为17+18=35。
即相邻周期,同一主族元素的原子序数可能相差2、8、18、32(差值为各周期元素种类数)。3.奇偶数规律
元素周期表中,原子序数为奇(或偶)数的元素,元素所在族序数及主要化合价一般也为奇(或偶)数(Ⅷ族元素除外)。已知X、Y、Z 3种主族元素在元素周期表中的相对位置如右图所示,设X的原子序数为a,则下列说法中不正确的是( )
A.Y与Z的原子序数之和可能为2a
B.Y的原子序数可能为a-17
C.Z的原子序数可能为a+31
D.X、Y、Z一定都是短周期元素【解析】 由于X、Y、Z均为主族元素,结合其位置关系和元素周期表的结构,故Y元素一定不在第一周期,即X、Y、Z不可能都在短周期,所以D错误;若Y、X、Z分别位于第三、四、五周期(或分别位于第四、五、六周期)的右方,则Y的原子序数为(a-17);若Y、X、Z分别位于元素周期表的第三、四、五周期的右方,则Y、Z的原子序数之和为2a;若Y、X、Z分别位于元素周期表的第四、五、六周期的右方,则Z的原子序数为(a+31)。【答案】 D【规律总结】 考生对元素周期表中同主族相邻元素的原子序数相差情况较熟悉,而对不相邻元素的原子序数相差情况则较陌生,此时必须分情况从不同周期的元素种类进行分析来确定。1.如果n为第ⅡA族中某元素原子序数,则原子序数为(n+1)的元素可能位于( )
A.ⅢA B.ⅣA
C.ⅢB D.ⅠA
解析:本题重点对周期表的结构进行考查,第ⅡA族后面的族既可能是ⅢB族,也可能是ⅢA族,故答案为A、C。答案:AC答案:A 比较粒子半径的大小1.阴上阳下规律
(1)稀有气体与同周期阴离子和下一周期阳离子的核外电子排布相同。
①与He原子电子层结构相同的离子:H-、Li+、Be2+。
②与Ne原子电子层结构相同的离子:N3-、O2-、F-、Na+、Mg2+、Al3+。
③与Ar原子电子层结构相同的离子:S2-、Cl-、K+、Ca2+。2.微粒半径大小
(1)原子半径
同一周期:左大右小(稀有气体大于同周期非金属原子半径,ⅠA族最大,ⅦA族最小);
同一主族:下大上小。
(2)离子半径
①同一元素的原子和离子,电子数越多,半径越大。如rCl->rCl;
rFe>rFe2+>rFe3+。简记为:“同核时,e大r大”。
②电子层结构相同的离子,质子数越多,半径越小。如
rH->rLi+>rBe2+;
rO2->rF->rNa+>rMg2+>rAl3+;
rS2->rCl->rK+>rCa2+。
简记为:“同壳时,z大r小”。
有时也称为:“阴上阳下,径小序大”规律即:
具有相同电子层结构的离子,阴离子元素在阳离子元素的上一个周期。且原子序数越大,微粒半径越小。如“Xm+”“Yn-”的电子层结构相同,则X元素在Y元素的下一个周期,故原子序数X>Y,离子半径Xm+
a.同一元素的原子和离子:
rF->rF;rNa>rNa+
b.同一周期的离子半径:阴离子>阳离子
rCl->rNa+;rO2->rLi+,故第三周期Al3+半径最小。
c.电子层结构相同的离子:阴离子>阳离子
rCl->rK+;rO2->rNa+。 A、B、C为三种短周期元素,A、B同周期,A、C最低价离子分别为A2-、C-,其离子半径A2->C-。B2+与C-具有相同的电子层结构,下列叙述一定不正确的是( )
A.它们的原子序数A>B>C
B.它们的原子半径C>B>A
C.离子半径A2->C->B2+
D.原子核外最外层上的电子数C>A>B
【解析】 根据“A、C最低价离子分别为A2-、C-”,可知A位于ⅥA族,C位于ⅦA族,C在A的右边;联系“A、B同周期”、“B2+与C-具有相同的电子层结构”可知A在C的左下方,B位于A的左侧。最后绘出它们的相对位置(如图)。由表可知:原子半径的大小顺序应该是B>A>C,B错;离子半径的大小顺序是A2->C->B2+,C正确。A、D也均正确。【答案】 B【方法技巧】 依据离子结构特点推断元素在周期表中的位置是解决此类问题的关键。把A、B、C等元素在周期表中定位后,它们的原子结构、电子层数、最外层电子数、元素最高正价以及原子半径、离子半径等递变规律都能顺利推断出来。3.(2009年浙江淳安高三联考)已知:aAn+、bB(n+1)+、cCn-、dD(n+1)-是具有相同的电子层结构的短周期元素形成的简单离子,下列叙述正确的是( )
A.原子半径:C>D>A>B
B.原子序数:b>a>c>d
C.离子半径:C>D>A>B
D.单质还原性:A>B>C>D答案:B元素在元素周期表中位置的推断1.根据核外电子排布规律
(1)最外层电子数等于或大于3(小于8)的一定是主族元素。
(2)最外层有1个或2个电子,则可能是ⅠA、ⅡA族元素又可能是副族、Ⅷ族或0族元素氦。
(3)最外层电子数比次外层电子数多的元素一定位于第二周期。 2.根据周期表结构与原子电子层结构的关系
核外电子层数=周期数(对于大部分元素来说)
主族序数=最外层电子数=最高正价=8-|最低负价|。
(1)族序数等于周期数的元素是H、Be、Al等。
(2)短周期中最高正价与最低负价代数和为零的是H(NaH中氢原子显-1价)、C、Si。(3)最高正价是最低负价绝对值3倍的短周期元素是S。
(4)除H外,原子半径最小的元素是F。
(5)最高正价不等于族序数的元素是O、F等。
(6)不易表现出正价的元素是O、F。3.根据稀有气体的原子序数推断元素在周期表中的位置
第1~6周期稀有气体元素的原子序数依次为2、10、18、36、54、86,可利用元素的原子序数与最相近稀有气体元素原子序数的差值来推断元素在元素周期表中的位置,可遵循“比大小,定周期;比差值,定族数”的原则。(1)若b-a=1~2,则B元素处于A元素的下一周期ⅠA或ⅡA族,如38号元素比第四周期氪的原子序数(36)多2,故该元素处在第五周期ⅡA族。
(2)若a-b=1~5,则B元素处于A元素所在周期的ⅢA~ⅦA族,如49号元素比第五周期的氙(54号)原子序数少5,因此该元素处在第五周期ⅢA族。1999年4月,核化学家在回旋加速器上用高 【答案】 D4.我国科研人员在兰州合成了镤元素的一种同位素镤239,并测知其原子核内有148个中子。现有A元素的一种同位素,比镤239的原子核少54个质子和100个中子。则A元素在元素周期表中的位置是( )
A.第三周期ⅠA族 B.第四周期ⅠA族
C.第五周期ⅠA族 D.第二周期ⅡA族答案:C1.短周期元素X、Y的原子序数相差7,下列有关判断错误的是( )
A.X和Y可能处于同一周期
B.X和Y可能处于相邻周期
C.X和Y可能处于同一主族
D.X和Y可能处于相邻主族答案:C2.X元素的阳离子和Y元素的阴离子具有与氩原子相同的电子层结构,下列叙述正确的是( )
A.X的原子序数比Y的小
B.X原子的最外层电子数比Y的多
C.X的原子半径比Y的大
D.X元素的最高化合价比Y的小解析:根据X元素的阳离子和Y元素的阴离子具有和氩原子相同的电子层结构可知:阴离子与其原子具有相同的电子层,而阳离子比其原子少一个电子层,则X、Y、Ar三原子在元素周期表中的大致位置为从上图知:X、Y在相邻的周期,Y在X元素的上一周期,是非金属元素,X的原子序数比Y的大,X是金属元素,其原子的最外层电子数比Y的少。X原子比Y原子的电子层结构多一层,且在元素周期表的左侧,故原子半径X>Y。X原子处在第四周期,可能为钾、钙等,阳离子的电子层结构与Ar的相同,X的最高化合价可能是+1、+2价等,Y元素处于第三周期,可能是P、S、Cl等,其最高化合价可能是+5、+6、+7等。显然,X元素的最高化合价比Y的小。答案:CD3.同主族两种元素原子的核外电子数的差值可能为( )
A.6 B.12
C.26 D.30
解析:同一主族相邻周期的两种元素的原子序数之差为2、8、8、18、18、32这几个数。此题两种元素的原子序数之差可能是这几个数或其中相邻几个数之和,所以选C项。答案:C4.(2009年山东莱阳一中)某元素的原子最外层有2个电子,则该元素是( )
A.金属元素 B.稀有气体元素
C.ⅡA族元素 D.以上叙述都可能答案:D5.原子的核电荷数小于18的某元素X,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数为2n2-1。下列有关元素X的说法中不正确的是( )
A.元素X能形成化学式为X(OH)3的碱
B.元素X可能形成化学式为KXO3的含氧酸钾盐
C.元素X原子的最外层电子数和核电荷数肯定为奇数
D.元素X能与某些金属元素形成化合物解析:核电荷数小于18的元素,电子层数可以为1、2、3,由最外层电子数为2n+1,可知电子层数为1不符合题意,当n=2时,最外层电子数为5、质子数为7,则为氮元素;当n=3时,最外层电子数为7、质子数为17,则为氯元素。所以两种元素均能形成化学式为KXO3的含氧酸钾盐,最外层电子数和核电荷数也均为奇数,这两种元素都是活泼的非金属元素,因而均能与某些金属元素形成化合物,不能形成化学式为X(OH)3的碱,所以A不正确。答案:A6.A、B、C为短周期元素,在元素周期表中所处的位置如右图所示。A、C两元素的原子核外电子数之和等于B原子的质子数。B原子核内质子数和中子数相等。
请填空:(1)写出A、B、C三种元素的名称__________、________、________。
(2)B元素位于元素周期表中第________周期______族。
(3)C的原子结构示意图为________,C的单质与H2O反应的化学方程式为__________________________________________。
(4)写出A的气态氢化物与B的最高价氧化物对应水化物反应的化学方程式__________________________________________。答案: 一、选择题(每小题5分,共50分)
1.已知下列元素的原子半径,
根据以上数据,磷原子的半径可能是( )
A.0.80×10-10m B.1.10×10-10m
C.1.20×10-10m D.0.70×10-10m
解析:Si、P、S位于第三周期从左至右,原子半径减小。答案:B2.三种短周期元素在周期表中的位置关系如图所示。下列说法正确的是( )
A.无法确定X、Y、Z各为何种元素
B.均为非金属元素
C.Y为氯元素
D.X元素形成的单质有很强的氧化性解析:三种都是短周期元素,由图知X必为第一周期零族元素He,则Y为F,Z为S,故A、C错,B项正确;He原子为最外层2电子稳定结构,性质稳定,既无强氧化性,也无强还原性,D项错。答案:B3.A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物显碱性,且碱性B>A;C、D两种元素对应的气态氢化物的稳定性C>D;E是这五种元素的简单离子中半径最小的。则它们的原子序数由小到大的顺序是( )
A.B<A<C<D<E B.A<E<B<C<D
C.E<B<A<C<D D.B<A<E<D<C答案:D4.(2010年合肥模拟)下列说法正确的是( )
A.原子最外层电子数等于或大于3的元素一定是非金属元素
B.原子最外层只有1个电子的元素一定是金属元素
C.最外层电子数比次外层电子数多的元素一定位于第二周期
D.某元素的离子最外层电子数与次外层电子数相同,该元素一定位于第三周期解析:A项,金属Al、Sn、Bi等最外层电子数等于或大于3;B项,H原子最外层只有一个电子,是非金属;C项,最外层电子数不能大于8,除第二周期元素外,原子的次外层电子数为8或18,故C项正确;D项,第四周期的K+、Ca2+的电子层结构 ,最外层电子数与次外层的相同。答案:C5.右表为元素周期表短
周期的一部分,下列有关A、B、C、D四种元素的叙述正确的是( )A.原子半径大小比较为A>B>C>D
B.生成的氢化物稳定性为A>B>C>D
C.A与C形成的阴离子可能有AC
D.A、B、C、D的单质常温下均不导电
解析:A项原子半径D>B,错;B项氢化物C最稳定,错;C项为CO正确;D项A的单质石墨导电。答案:C6.(2008年北京高考)X、Y均为元素周期表中前20号元素,其简单离子的电子层结构相同,下列说法正确的是( )
A.由mXa+与nYb-,得m+a=n-b
B.X2-的还原性一定大于Y-
C.X、Y一定不是同周期元素
D.若X的原子半径大于Y,则气态氢化物的稳定性HmX一定大于HnY解析:A项,X原子失去a个电子得Xa+,Y原子得到b个电子形成Yb-,二者的电子层结构相同,所以,m-a=n+b;B项,X与Y位于同一周期,且X位于Y的左边,Y的非金属性大于X,故X2-的还原性一定大于Y-;D项,HnY的稳定性大于HmX。答案:B7.(2010年湛江质检)有X、Y、Z三种短周期元素,X既能形成X+也可形成X-。Y、Z两元素的原子具有相同的电子层数,Y元素的L层上的电子数是K层电子数的2倍,Z元素最外层电子数是电子层数的3倍,下列说法正确的是( )
A.X、Y、Z三种元素有一种是金属元素
B.X、Y、Z三种元素可形成离子化合物C.X、Y、Z三种元素可形成多种酸分子
D.X、Y两种元素形成的分子种数不如X、Z两种元素形成的分子种数多解析:X能形成X+和X-为氢元素;Y为碳,Z为氧。A项、B项均不正确;C项三种元素可形成H2CO3、HCOOH、CH3COOH等,正确;D项X、Y形成烃种数多于H2O和H2O2。答案:C8.(2010年青岛模拟)目前,人类已经发现的非金属元素除稀有气体元素外共有16种,下列对这16种非金属元素的判断不正确的是( )
①都是主族元素,原子的最外层电子数都大于3
②单质在反应中都只能作氧化剂
③对应的含氧酸都是强酸④氢化物常温下都是气态,所以又叫气态氢化物
⑤气态氧化物与水反应都不会再生成气体
A.全部 B.只有①②
C.只有①②③④ D.只有①②④⑤解析:由H知①、②不正确,由H2CO3、H2SiO3知③不正确,由H2O知④不正确,由3NO2+H2O=2NO+HNO3知⑤不正确。答案:A9.下列说法正确的是( )
A.最外层电子数为次外层电子数一半的元素一定属于碱金属元素
B.元素周期表中从ⅢB族到ⅡB族之间10个纵行的元素都是金属元素
C.第ⅡA族与第ⅢA族元素的原子序数相差1或11或25
D.若主族元素的族序数为a,周期数为b,当
<1时,该元素为非金属元素解析:A中最外层电子数为次外层电子数一半的可能是Li、Si等,因此A不正确;B中实际上全部是副族元素,它们是过渡金属,因此B正确;C中如果在短周期,第ⅡA族与第ⅢA族元素的原子序数相差1,如果是长周期的第四、第五周期元素,第ⅡA族和第ⅢA族元素的原子序数相差11,如果是第六、第七周期元素,第ⅡA族与第ⅢA族元素的原子序数相差25(镧系、锕系各有15种元素收缩在一小格内),故C正确;D中采用举例法,例如Na元素中 <1,但它是金属元素。答案:BC10.下列说法中错误的是( )
A.任何原子及其离子,都是核外电子层数等于该元素在周期表中的周期数
B.在元素周期表中,从ⅢB族到ⅡB族的10个纵列中,所有的元素都是金属元素
C.除氦以外的所有稀有气体元素,原子的最外层电子数都是8
D.凡是同种元素的同位素,其各项物理性质、化学性质都相同答案:AD二、非选择题(共50分)
11.(12分)元素周期表中前7个周期完全排满时元素的种数如下表所示:
(1)第六、七周期完全排满时元素的种数比第四、五周期多了14种,其原因是________________________________________________________________________。
(2)周期表中________族所含元素最多,________族元素形成化合物最多。
(3)请分析周期数与元素种数的关系,然后预测第八周期最多可能含有的元素种数为________。(4)居里夫人发现的镭是元素周期表中第七周期的ⅡA族元素,下列关于镭的性质的描述中不正确的是______。
A.在化合物中呈+2价 B.氢氧化物呈两性
C.单质使水分解,放出氢气 D.碳酸盐难溶于水(2)Y的原子结构示意图是____________________________________________。
(3)T、X形成化合物T2X与T2X2的化学方程式分别为:
____________________________________________。答案:(1)O S Cl Na H答案: 14.(13分)元素周期表奥妙无穷,有关元素周期表的研究角度不断创新。
(1)从下表中可以看出,除H外,其余非金属元素原子________(填序号)。
a.最外层电子数都大于4
b.最外层电子数都大于电子层数(2)美俄科学家宣布他们制得了117号元素(位置见上表),按元素周期表中金属与非金属的分区,它应是一种________(填“金属”或“非金属”)元素。
(3)若117号元素的一种核素表示为X,则关于它的推测正确的是( )
a.这种原子的中子数为168
b.这种原子易与氢化合
c.KX是离子化合物
d.AgX易溶于水(4)随着科学技术的发展,不断有新的元素被发现。若把元素周期表中第七周期排满,则可以排布118种元素。某同学受镧系、锕系元素排列方式的启发,将元素周期表设计成下列更简明的形式,把118种元素全部排列在内,表中除A、B、C、D外每个位置只表示一种元素。则该表中A位置包含________(填数字)种元素。C位置中的元素是否全部是金属元素:________(选填“是”或“否”)。解析:(1)除H外,根据其他主族元素的最后一种非金属元素可推知,非金属元素最外层电子数都大于电子层数。(3)X的质量数为285,质子数为117,则中子数=285-117=168。(4)第四周期共18种元素,所以A位置包括11种元素。答案:(1)b (2)金属 (3)ac (4)11 是
