第一章 原子结构与元素周期律 第三节元素周期表的应用
文档属性
| 名称 | 第一章 原子结构与元素周期律 第三节元素周期表的应用 |

|
|
| 格式 | zip | ||
| 文件大小 | 328.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2013-03-25 00:00:00 | ||
图片预览







文档简介
课件29张PPT。鲁科版普通高中课程标准实验教科书 化学2(必修) 第一章
第三节元素周期表的应用
一、认识同周期元素性质的递变交流研讨:
1.第三周期元素的原子核外电子排布是如何递变的? 从左到右,最外层电子数逐渐增多。交流研讨:
2.尝试根据元素原子核外电子排布规律预测第三周期元素原子失电子能力或得电子能力的相对强弱。从左到右,随着原子序数递增,失电子能力逐渐减弱,得电子能力增强。
方法导引 P21
2、比较元素最高价氧化物对应水化物的碱性强弱。一般说来,碱性越强,元素原子失电子的能力越强。元素原子失电子能力的强弱,可以采用下列方法间接判断:
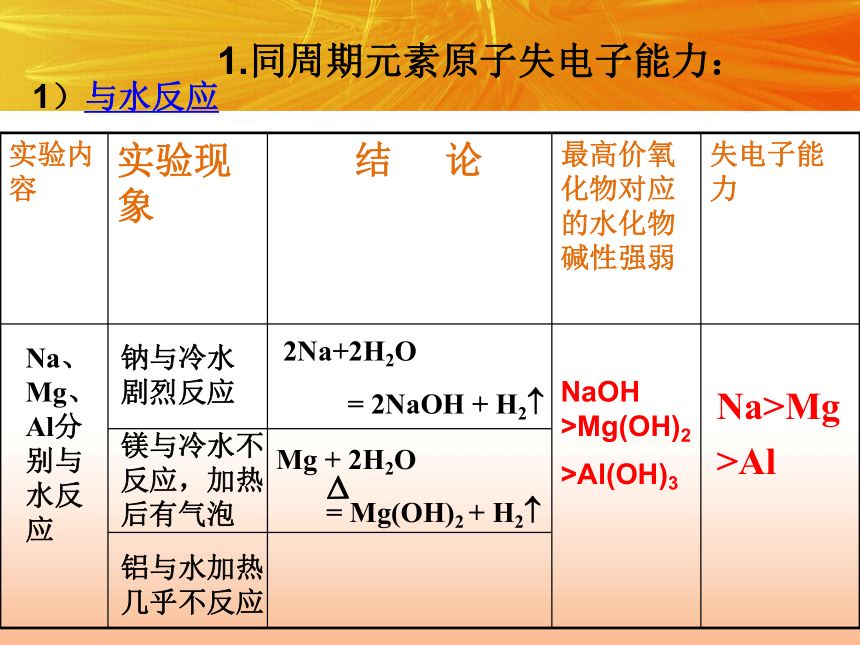
1、比较元素单质与水(或酸)反应置换出氢的难易程度。置换反应越容易发生,元素原子的失电子能力越强。1.同周期元素原子失电子能力:1)与水反应Na、Mg、Al分别与水反应钠与冷水剧烈反应镁与冷水不反应,加热后有气泡 铝与水加热几乎不反应2Na+2H2O
= 2NaOH + H2?Mg + 2H2O
= Mg(OH)2 + H2??Na>Mg
>AlNaOH
>Mg(OH)2
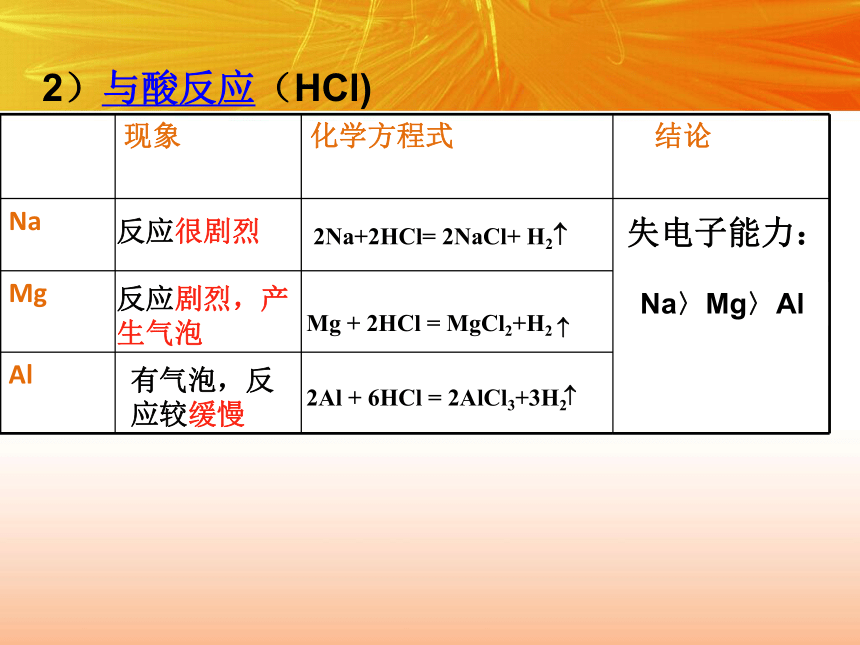
>Al(OH)3 2)与酸反应(HCl)反应剧烈,产生气泡有气泡,反应较缓慢失电子能力:Na〉Mg〉Al反应很剧烈Mg + 2HCl = MgCl2+H2?2Na+2HCl= 2NaCl+ H2?方法导引 P22
2、比较元素最高价氧化物对应水化物的酸性强弱。一般说来,酸性越强,元素原子得电子的能力越强。元素原子得电子能力的强弱,可以采用下列方法间接判断:1、比较元素单质与氢气化合的难易程度及气态氢化物的稳定性。一般说来,反应越容易进行,气态氢化物越稳定,元素原子得电子的能力越强。SiO2P2O5SO3Cl2O7H4SiO4H3PO4H2SO4HClO4弱酸中强酸强酸最强酸高温加热成磷蒸气加热点燃或
光照SiH4PH3H2SHCl从左到右,得电子能力逐渐增强3.同周期元素的递变规律同周期元素,从左到右:1)原子失电子能力逐渐 ,得电子
能力逐渐 。即a.同周期元素,从左到右:
金属性逐渐减弱,非金属性逐渐增强。减弱增强b.同周期元素,从左到右:
还原性逐渐减弱,氧化性逐渐增强。2)最高价氧化物对应的水化物,碱性逐
渐 ,酸性逐渐 。减弱增强3)氢化物的形成由 到 ,
氢化物的稳定性逐渐 。难易增强4)元素的最高正价由 价递增到 价,
最低负价由 价递增到 价。5)原子序数依次增加,原子半径逐渐
。+1+7-4-1减小同周期元素,从左到右:1、判断下列说法是否正确:
(1) C、N、O、F原子半径依次增大
(2) PH3、H2S、HCl 稳定性依次增强
(3)酸性:H3PO4 (4)甲、乙两种非金属元素与金属钠反应时, 甲得电子的数目多,所以甲活泼。课堂练习:错对错错(5)氢化物的稳定性: NH3(6)原子的还原性:Na>Mg>Al ( 7)原子的氧化性:C>N>O>F对错对2、已知X、Y、Z三种元素原子的电子层数相同,且原子序数XA、原子半径XB、得电子能力X、Y、Z逐渐减弱
C、最高价含氧酸酸性H3XO4D、气态氢化物的稳定性按照X、Y、Z顺序
减弱C知识总结: 同周期元素的递变规律增多减小减弱增强易难难易增强减弱增强金属性或还原性非金属性或氧化性交流研讨1、在元素周期表中,同主族元素原子的核外 电子排布有什么特点?
它对元素的性质有何影响?
从上到下,随着原子核外电子层数增多,原子半径增大,原子核对最外层电子的吸引力减小,元素原子失电子能力增强,得电子的能力减弱。最外层电子数相同,化学性质相似;
从上到下,电子层数逐渐增多二、预测同主族元素的性质1)相似性 7 7 7 7 0 +7 +7 +7 -1 -1 -1 -1 HF HCl HBr HI 无 HClO4 HBrO4 HIO42.第ⅦA族即卤族(F Cl Br I) F2 Cl2 Br2 I2 都具有氧化性2)递变性(从上到下:a. 电子层数逐渐增多,原子半径逐渐增大b. 卤族元素单质与氢气化合由____到____暗处光照或点燃200度加热不断高温加热爆炸剧烈缓慢缓慢很稳定稳定较不稳定很不稳定易难c. 气态氢化物的稳定性:HF>HCl>HBr>HId. 得电子能力:F>Cl>Br>Ie. 酸性:HClO4>HBrO4>HIO4F Cl Br I)3.第ⅠA族(Li Na K Rb Cs称为碱金属元素)1)碱金属元素的相似性a. 最外层电子数为1b. 最高化合价:+1C. 易失电子,最高价氧化物对应的水化物碱性强2)递变性 从上到下:a. 电子层数逐渐增多,原子半径逐渐增大b. 与水反应置换出氢的能力_______浮在水面上, 四处游动,熔成闪亮的火球,发出紫色的火焰,伴有轻微的爆炸现象浮、熔、游、响 2K+2H2O=2KOH+H2↑ 2Na+2H2O=2NaOH+H2↑ 逐渐增强c. 失电子能力:d.最高价氧化物对应的水化物碱性_________ 逐渐增强Li Na K Rb CsLi元素周期表中的什么位置?是哪种元素?最活泼非金属: F 最活泼金属:Cs在周期表中元素原子的变化规律随堂练习1 第四周期某主族元素的原子,它的最外电子层上有2个电子,下列关于此元素的叙述正确的是( )
A.原子半径比钾的原子半径大
B.氯化物难溶于水
C.原子半径比镁的原子半径大
D.碳酸盐难溶于水
2 下列各组中的性质比较正确的是( )
A.稳定性:NH3<PH3 < SiH4
B.酸性:HClO4 >H2SO4 > H3PO4
C.碱性:KOH < NaOH < Mg(OH)2
D.还原性:F- > Cl- > Br-C DB 3 下列氧化物按其形成的含氧酸酸性递增的顺序排列的是( )
A.SiO2 < CO2 < SO3 < P2O5
B.SiO2 < CO2 < P2O5 < SO3
C. CO2 < SiO2 < P2O5 < SO3
D. CO2 < P2O5 < SO3< SiO2B原子结构表中位置元素性质同位-化学性质相同周期表中元素位、构、性的关系【训练】1、由A、B两种元素组成的化合物,如果A、B两种元素的原子最外层电子数分别是1和6,则化合物的化学式可能是( BD )。
A、AB2 B.A2B C、AB D、A2B2
2、有X、Y、Z三种元素,其中X、Y属于同一主族,加热时,其单质都能与氢气形成气态氢化物H2X,H2Y。常温下,X单质为气态,X与Y可形成两种化合物YX2和YX3,Y、Z均在X的下一周期,而Z可与X生成化合物Z2X和Z2X2。试写出:
(1)元素名称X 氧 、Y 硫 、Z ;
(2)化合物Z2X2与H2X反应的化学方程式 ;
(3)两个由X、Y、Z三种元素所组成物质的化学式 。钠 1B Al SiGe As Sb Te 2 3 4 5 6 7ⅠAⅡAⅢAⅣAⅤAⅥAⅦA 0 Po At非金属性逐渐增强 金属性逐渐增强金属性逐渐增强 非金属性逐渐增强最活泼
的金属最活泼
的非金属CsF元素周期律及元素周期表
三大意义 ⑴ 学习和研究化学的规律和工具 ⑵ 研究发现新物质 ⑶ 论证了量变引起质变的规律性 预言新元素,寻找半导体材料、研究新农药,催化剂、耐高温耐腐蚀材料、超导材料、磁性材料、矿物、农药、制冷剂。1、砹是原子序数最大的卤族元素,推测砹和砹的化合物不可能具有的性质是( )。
A.砹是有色固体 B.砹易溶于有机溶剂
C.砹化氢很稳定 D.砹化银不溶于水课堂练习C课堂练习2、已知铍(Be)的原子序数为4。下列对铍及其化合物的叙述中,正确的是( )?
A.铍的原子半径大于硼的原子半径?
B.氯化铍化学式中铍原子的最外层电子数是8
C.氢氧化铍的碱性比氢氧化钙的弱?
D.单质铍跟冷水反应产生氢气? AC
第三节元素周期表的应用
一、认识同周期元素性质的递变交流研讨:
1.第三周期元素的原子核外电子排布是如何递变的? 从左到右,最外层电子数逐渐增多。交流研讨:
2.尝试根据元素原子核外电子排布规律预测第三周期元素原子失电子能力或得电子能力的相对强弱。从左到右,随着原子序数递增,失电子能力逐渐减弱,得电子能力增强。
方法导引 P21
2、比较元素最高价氧化物对应水化物的碱性强弱。一般说来,碱性越强,元素原子失电子的能力越强。元素原子失电子能力的强弱,可以采用下列方法间接判断:
1、比较元素单质与水(或酸)反应置换出氢的难易程度。置换反应越容易发生,元素原子的失电子能力越强。1.同周期元素原子失电子能力:1)与水反应Na、Mg、Al分别与水反应钠与冷水剧烈反应镁与冷水不反应,加热后有气泡 铝与水加热几乎不反应2Na+2H2O
= 2NaOH + H2?Mg + 2H2O
= Mg(OH)2 + H2??Na>Mg
>AlNaOH
>Mg(OH)2
>Al(OH)3 2)与酸反应(HCl)反应剧烈,产生气泡有气泡,反应较缓慢失电子能力:Na〉Mg〉Al反应很剧烈Mg + 2HCl = MgCl2+H2?2Na+2HCl= 2NaCl+ H2?方法导引 P22
2、比较元素最高价氧化物对应水化物的酸性强弱。一般说来,酸性越强,元素原子得电子的能力越强。元素原子得电子能力的强弱,可以采用下列方法间接判断:1、比较元素单质与氢气化合的难易程度及气态氢化物的稳定性。一般说来,反应越容易进行,气态氢化物越稳定,元素原子得电子的能力越强。SiO2P2O5SO3Cl2O7H4SiO4H3PO4H2SO4HClO4弱酸中强酸强酸最强酸高温加热成磷蒸气加热点燃或
光照SiH4PH3H2SHCl从左到右,得电子能力逐渐增强3.同周期元素的递变规律同周期元素,从左到右:1)原子失电子能力逐渐 ,得电子
能力逐渐 。即a.同周期元素,从左到右:
金属性逐渐减弱,非金属性逐渐增强。减弱增强b.同周期元素,从左到右:
还原性逐渐减弱,氧化性逐渐增强。2)最高价氧化物对应的水化物,碱性逐
渐 ,酸性逐渐 。减弱增强3)氢化物的形成由 到 ,
氢化物的稳定性逐渐 。难易增强4)元素的最高正价由 价递增到 价,
最低负价由 价递增到 价。5)原子序数依次增加,原子半径逐渐
。+1+7-4-1减小同周期元素,从左到右:1、判断下列说法是否正确:
(1) C、N、O、F原子半径依次增大
(2) PH3、H2S、HCl 稳定性依次增强
(3)酸性:H3PO4
C、最高价含氧酸酸性H3XO4
减弱C知识总结: 同周期元素的递变规律增多减小减弱增强易难难易增强减弱增强金属性或还原性非金属性或氧化性交流研讨1、在元素周期表中,同主族元素原子的核外 电子排布有什么特点?
它对元素的性质有何影响?
从上到下,随着原子核外电子层数增多,原子半径增大,原子核对最外层电子的吸引力减小,元素原子失电子能力增强,得电子的能力减弱。最外层电子数相同,化学性质相似;
从上到下,电子层数逐渐增多二、预测同主族元素的性质1)相似性 7 7 7 7 0 +7 +7 +7 -1 -1 -1 -1 HF HCl HBr HI 无 HClO4 HBrO4 HIO42.第ⅦA族即卤族(F Cl Br I) F2 Cl2 Br2 I2 都具有氧化性2)递变性(从上到下:a. 电子层数逐渐增多,原子半径逐渐增大b. 卤族元素单质与氢气化合由____到____暗处光照或点燃200度加热不断高温加热爆炸剧烈缓慢缓慢很稳定稳定较不稳定很不稳定易难c. 气态氢化物的稳定性:HF>HCl>HBr>HId. 得电子能力:F>Cl>Br>Ie. 酸性:HClO4>HBrO4>HIO4F Cl Br I)3.第ⅠA族(Li Na K Rb Cs称为碱金属元素)1)碱金属元素的相似性a. 最外层电子数为1b. 最高化合价:+1C. 易失电子,最高价氧化物对应的水化物碱性强2)递变性 从上到下:a. 电子层数逐渐增多,原子半径逐渐增大b. 与水反应置换出氢的能力_______浮在水面上, 四处游动,熔成闪亮的火球,发出紫色的火焰,伴有轻微的爆炸现象浮、熔、游、响 2K+2H2O=2KOH+H2↑ 2Na+2H2O=2NaOH+H2↑ 逐渐增强c. 失电子能力:d.最高价氧化物对应的水化物碱性_________ 逐渐增强Li Na K Rb CsLi
A.原子半径比钾的原子半径大
B.氯化物难溶于水
C.原子半径比镁的原子半径大
D.碳酸盐难溶于水
2 下列各组中的性质比较正确的是( )
A.稳定性:NH3<PH3 < SiH4
B.酸性:HClO4 >H2SO4 > H3PO4
C.碱性:KOH < NaOH < Mg(OH)2
D.还原性:F- > Cl- > Br-C DB 3 下列氧化物按其形成的含氧酸酸性递增的顺序排列的是( )
A.SiO2 < CO2 < SO3 < P2O5
B.SiO2 < CO2 < P2O5 < SO3
C. CO2 < SiO2 < P2O5 < SO3
D. CO2 < P2O5 < SO3< SiO2B原子结构表中位置元素性质同位-化学性质相同周期表中元素位、构、性的关系【训练】1、由A、B两种元素组成的化合物,如果A、B两种元素的原子最外层电子数分别是1和6,则化合物的化学式可能是( BD )。
A、AB2 B.A2B C、AB D、A2B2
2、有X、Y、Z三种元素,其中X、Y属于同一主族,加热时,其单质都能与氢气形成气态氢化物H2X,H2Y。常温下,X单质为气态,X与Y可形成两种化合物YX2和YX3,Y、Z均在X的下一周期,而Z可与X生成化合物Z2X和Z2X2。试写出:
(1)元素名称X 氧 、Y 硫 、Z ;
(2)化合物Z2X2与H2X反应的化学方程式 ;
(3)两个由X、Y、Z三种元素所组成物质的化学式 。钠 1B Al SiGe As Sb Te 2 3 4 5 6 7ⅠAⅡAⅢAⅣAⅤAⅥAⅦA 0 Po At非金属性逐渐增强 金属性逐渐增强金属性逐渐增强 非金属性逐渐增强最活泼
的金属最活泼
的非金属CsF元素周期律及元素周期表
三大意义 ⑴ 学习和研究化学的规律和工具 ⑵ 研究发现新物质 ⑶ 论证了量变引起质变的规律性 预言新元素,寻找半导体材料、研究新农药,催化剂、耐高温耐腐蚀材料、超导材料、磁性材料、矿物、农药、制冷剂。1、砹是原子序数最大的卤族元素,推测砹和砹的化合物不可能具有的性质是( )。
A.砹是有色固体 B.砹易溶于有机溶剂
C.砹化氢很稳定 D.砹化银不溶于水课堂练习C课堂练习2、已知铍(Be)的原子序数为4。下列对铍及其化合物的叙述中,正确的是( )?
A.铍的原子半径大于硼的原子半径?
B.氯化铍化学式中铍原子的最外层电子数是8
C.氢氧化铍的碱性比氢氧化钙的弱?
D.单质铍跟冷水反应产生氢气? AC
