7.3几种重要的盐课件—2021-2022学年九年级化学沪教版(全国)下册(共21张PPT)
文档属性
| 名称 | 7.3几种重要的盐课件—2021-2022学年九年级化学沪教版(全国)下册(共21张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 4.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-05-25 08:34:20 | ||
图片预览








文档简介
(共21张PPT)
几种重要的盐
1、复分解反应,是四大基本反应类型之一。
2、复分解反应是由两种化合物互相交换成分,生成另外两种化合物的反应。
3、复分解反应的实质是发生复分解反应的两种物质在水溶液中交换离子,结合成难电离的物质——沉淀、气体或弱电解质(最常见的为水),使溶液中离子浓度降低,化学反应即向着离子浓度降低的方向进行。可简记为AB+CD→AD+CB。
复分解反应的定义
复分解反应类型有哪些
1、碱性氧化物+酸→盐+水
例如:Fe2O3 + 6HCl =2FeCl3 + 3H2O
2、酸+碱→盐+水
例如:HCl + NaOH = NaCl +H2O
3、酸+盐→新盐+新酸
例如:H2SO4 + BaCl2 =BaSO4↓ + 2HCl
4、碱+盐→新盐+新碱
例如:Ca(OH)2 + Na2CO3 = CaCO3↓+ 2NaOH
复分解反应发生的条件:发生复分解反应的两种物质能在水溶液中交换离子,结合成难电离的物质(沉淀、气体或弱电解质)。2、碱性氧化物+酸:酸的酸性较强(如HCl、H2SO4、HNO3等),可发生反应。3、酸+碱(中和反应):当酸、碱都很弱时,不发生反应。4、酸+盐:强酸制弱酸;交换离子后有沉淀;强酸与碳酸盐反应;满足一个条件即可发生反应
复分解反应发生的条件
1.判断下列反应能否发生,能反应的写出反应方程式;不能反应的打×。
(1).Na2CO3+HCl-
(2).BaCl2+H2SO4-
(3).K2SO4+HCl-
(4).CaCO3+NaOH-
(5).HCl+NaOH-
×
应用一:判断复分解反应能否进行
×
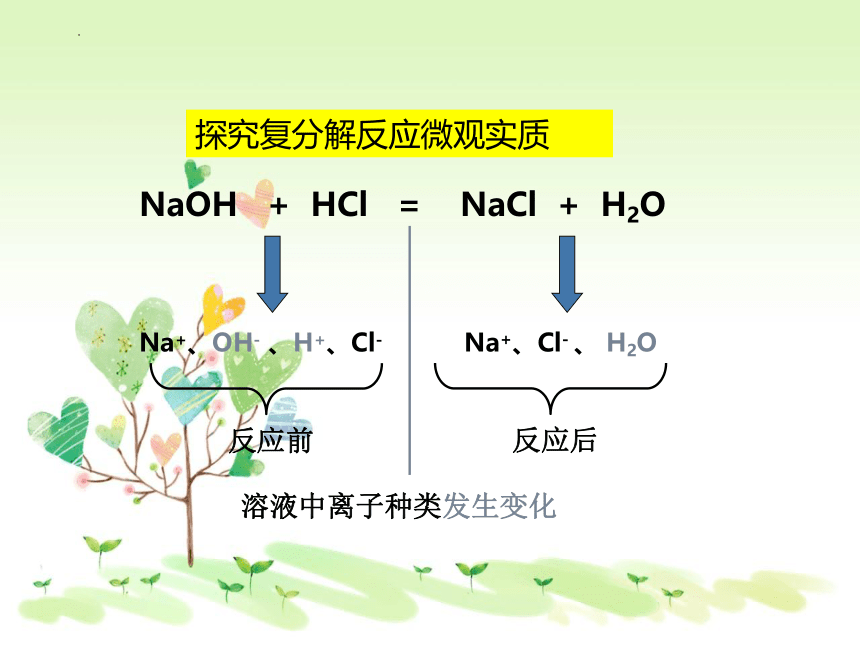
NaOH + HCl = NaCl + H2O
Na+、OH- 、H+、Cl-
反应前
Na+、Cl- 、 H2O
反应后
溶液中离子种类发生变化
探究复分解反应微观实质
复分解反应微观实质
酸、碱、盐溶液中的特殊阳离子和阴离子结合生成气体、沉淀、或水。
H+和OH-结合成H2O
Ba2+和SO42-结合成BaSO4
H+和CO32-结合成H2O和CO2
Ag+和Cl-结合成AgCl
Ca2+和CO32-结合成CaCO3
Ba2+和CO32-结合成BaCO3
Cu2+和OH-结合成Cu(OH)2
环节1
1.小调查:家里是如何处理厨余垃圾鸡蛋壳的?
2.鸡蛋壳可以生产补钙剂,请从化学的角度来分析:是否可行?
3.常见的补钙剂——醋酸钙[Ca(Ac)2],属于什么物质类别?
环节1
4.交流讨论:醋酸钙可能具有哪些性质?
易溶于水
颜色为白色
味道:涩味
与碳酸钠、碳酸钾等可溶性碳酸盐反应。
4.学生活动:选用合适的药品设计实验方案验证醋酸钙溶液呈碱性。
可利用:
酚酞试液、
石蕊试液、
pH试纸、
红色石蕊试纸
这些试剂来验证碱性。
环节1
鸡蛋壳(碳酸钙) + ? → 醋酸钙
资料:醋酸的化学式可以简写为HAc,在其水溶液中能电离出氢离子(H+)和醋酸根离子(Ac-)。
CaCO3+2HAc═Ca(Ac)2+H2O+CO2↑
环节2
环节3
反应后的溶液中有哪些溶质?
向反应后的溶液
加入碳酸钠溶液
气泡→碳酸钠与溶液中的醋酸反应
浑浊→猜想:碳酸钠与溶液中的醋酸钙反应
一定有醋酸钙,
可能含有醋酸。
环节3
Ca(Ac)2 + Na2CO3= CaCO3↓+ 2NaAc
实验:碳酸钠与醋酸钙反应
环节3
沉淀
清液
请你分析上层的清液中的溶质:一定有 ,
可能有 。
NaAc
Na2CO3或Ca(Ac)2
请选择合适的药品设计实验方案。
提供的药品:
酚酞试液
稀盐酸(HCl)
澄清石灰水[Ca(OH)2 ]
碳酸钾溶液(K2CO3)
氯化钠溶液(NaCl)
锌粒(Zn)
提出问题:利用5.3%的碳酸钠溶液设计实验粗略测定每包药品中醋酸钙的质量。
反应原理:Ca(Ac)2 + Na2CO3= CaCO3↓+ 2NaAc
环节4
思路1:Na2CO3的质量 → Ca(Ac)2的质量
思路2:CaCO3的质量 → Ca(Ac)2的质量
你能检测该数据是否属实吗?
环节4 粗略测定钙片中所含醋酸钙的质量
设计方案思路1:Na2CO3的质量 → Ca(Ac)2的质量
1.将样品加水溶解
2.将5.3%的碳酸钠逐滴滴入醋酸钙溶液中,直至 .
滴管中剩余的碳酸钠溶液应滴入 中。
5.3%的碳酸钠溶液
醋酸钙溶液
恰好完全反应
量筒
环节4 粗略测定钙片中所含醋酸钙的质量
设计方案思路2:CaCO3的质量 → Ca(Ac)2的质量
1.将样品加水溶解
2.将5.3%的碳酸钠逐滴滴入醋酸钙溶液中,直至 .
5.3%的碳酸钠溶液
醋酸钙溶液
3.过滤
4.对 进行 操作,称量质量。
滤液
滤渣
碳酸钠过量
滤渣
洗涤、烘干
环节4 粗略测定钙片中所含醋酸钙的质量
取一包“醋酸钙颗粒”样品,加入适量水配成溶液,向得到溶液中加入过量的5.3%的碳酸钠溶液至过量,过滤、洗涤、干燥后利用电子天平称量滤渣质量的数据如下表:
实验序号 滤渣质量/g 醋酸钙质量/g
1 0.48
2 0.44
3 0.45
试分析:引起三次实验数据差异的原因可能是什么?
0.76
0.70
0.71
滤渣未洗涤干净
滤渣未完全干燥
过滤时,滤渣未完全转移到漏斗内
滤渣未完全转移到天平上
鸡蛋壳——醋酸钙——丰富的应用
补钙胶囊
补钙颗粒
制作豆腐
融雪剂
制作固体酒精
治疗高磷血症
总结
盐
指示剂
酸
碱
盐
金属
谢谢
几种重要的盐
1、复分解反应,是四大基本反应类型之一。
2、复分解反应是由两种化合物互相交换成分,生成另外两种化合物的反应。
3、复分解反应的实质是发生复分解反应的两种物质在水溶液中交换离子,结合成难电离的物质——沉淀、气体或弱电解质(最常见的为水),使溶液中离子浓度降低,化学反应即向着离子浓度降低的方向进行。可简记为AB+CD→AD+CB。
复分解反应的定义
复分解反应类型有哪些
1、碱性氧化物+酸→盐+水
例如:Fe2O3 + 6HCl =2FeCl3 + 3H2O
2、酸+碱→盐+水
例如:HCl + NaOH = NaCl +H2O
3、酸+盐→新盐+新酸
例如:H2SO4 + BaCl2 =BaSO4↓ + 2HCl
4、碱+盐→新盐+新碱
例如:Ca(OH)2 + Na2CO3 = CaCO3↓+ 2NaOH
复分解反应发生的条件:发生复分解反应的两种物质能在水溶液中交换离子,结合成难电离的物质(沉淀、气体或弱电解质)。2、碱性氧化物+酸:酸的酸性较强(如HCl、H2SO4、HNO3等),可发生反应。3、酸+碱(中和反应):当酸、碱都很弱时,不发生反应。4、酸+盐:强酸制弱酸;交换离子后有沉淀;强酸与碳酸盐反应;满足一个条件即可发生反应
复分解反应发生的条件
1.判断下列反应能否发生,能反应的写出反应方程式;不能反应的打×。
(1).Na2CO3+HCl-
(2).BaCl2+H2SO4-
(3).K2SO4+HCl-
(4).CaCO3+NaOH-
(5).HCl+NaOH-
×
应用一:判断复分解反应能否进行
×
NaOH + HCl = NaCl + H2O
Na+、OH- 、H+、Cl-
反应前
Na+、Cl- 、 H2O
反应后
溶液中离子种类发生变化
探究复分解反应微观实质
复分解反应微观实质
酸、碱、盐溶液中的特殊阳离子和阴离子结合生成气体、沉淀、或水。
H+和OH-结合成H2O
Ba2+和SO42-结合成BaSO4
H+和CO32-结合成H2O和CO2
Ag+和Cl-结合成AgCl
Ca2+和CO32-结合成CaCO3
Ba2+和CO32-结合成BaCO3
Cu2+和OH-结合成Cu(OH)2
环节1
1.小调查:家里是如何处理厨余垃圾鸡蛋壳的?
2.鸡蛋壳可以生产补钙剂,请从化学的角度来分析:是否可行?
3.常见的补钙剂——醋酸钙[Ca(Ac)2],属于什么物质类别?
环节1
4.交流讨论:醋酸钙可能具有哪些性质?
易溶于水
颜色为白色
味道:涩味
与碳酸钠、碳酸钾等可溶性碳酸盐反应。
4.学生活动:选用合适的药品设计实验方案验证醋酸钙溶液呈碱性。
可利用:
酚酞试液、
石蕊试液、
pH试纸、
红色石蕊试纸
这些试剂来验证碱性。
环节1
鸡蛋壳(碳酸钙) + ? → 醋酸钙
资料:醋酸的化学式可以简写为HAc,在其水溶液中能电离出氢离子(H+)和醋酸根离子(Ac-)。
CaCO3+2HAc═Ca(Ac)2+H2O+CO2↑
环节2
环节3
反应后的溶液中有哪些溶质?
向反应后的溶液
加入碳酸钠溶液
气泡→碳酸钠与溶液中的醋酸反应
浑浊→猜想:碳酸钠与溶液中的醋酸钙反应
一定有醋酸钙,
可能含有醋酸。
环节3
Ca(Ac)2 + Na2CO3= CaCO3↓+ 2NaAc
实验:碳酸钠与醋酸钙反应
环节3
沉淀
清液
请你分析上层的清液中的溶质:一定有 ,
可能有 。
NaAc
Na2CO3或Ca(Ac)2
请选择合适的药品设计实验方案。
提供的药品:
酚酞试液
稀盐酸(HCl)
澄清石灰水[Ca(OH)2 ]
碳酸钾溶液(K2CO3)
氯化钠溶液(NaCl)
锌粒(Zn)
提出问题:利用5.3%的碳酸钠溶液设计实验粗略测定每包药品中醋酸钙的质量。
反应原理:Ca(Ac)2 + Na2CO3= CaCO3↓+ 2NaAc
环节4
思路1:Na2CO3的质量 → Ca(Ac)2的质量
思路2:CaCO3的质量 → Ca(Ac)2的质量
你能检测该数据是否属实吗?
环节4 粗略测定钙片中所含醋酸钙的质量
设计方案思路1:Na2CO3的质量 → Ca(Ac)2的质量
1.将样品加水溶解
2.将5.3%的碳酸钠逐滴滴入醋酸钙溶液中,直至 .
滴管中剩余的碳酸钠溶液应滴入 中。
5.3%的碳酸钠溶液
醋酸钙溶液
恰好完全反应
量筒
环节4 粗略测定钙片中所含醋酸钙的质量
设计方案思路2:CaCO3的质量 → Ca(Ac)2的质量
1.将样品加水溶解
2.将5.3%的碳酸钠逐滴滴入醋酸钙溶液中,直至 .
5.3%的碳酸钠溶液
醋酸钙溶液
3.过滤
4.对 进行 操作,称量质量。
滤液
滤渣
碳酸钠过量
滤渣
洗涤、烘干
环节4 粗略测定钙片中所含醋酸钙的质量
取一包“醋酸钙颗粒”样品,加入适量水配成溶液,向得到溶液中加入过量的5.3%的碳酸钠溶液至过量,过滤、洗涤、干燥后利用电子天平称量滤渣质量的数据如下表:
实验序号 滤渣质量/g 醋酸钙质量/g
1 0.48
2 0.44
3 0.45
试分析:引起三次实验数据差异的原因可能是什么?
0.76
0.70
0.71
滤渣未洗涤干净
滤渣未完全干燥
过滤时,滤渣未完全转移到漏斗内
滤渣未完全转移到天平上
鸡蛋壳——醋酸钙——丰富的应用
补钙胶囊
补钙颗粒
制作豆腐
融雪剂
制作固体酒精
治疗高磷血症
总结
盐
指示剂
酸
碱
盐
金属
谢谢
