浙教版科学八年级下册同步练习:第2章 微粒的模型与符号 单元复习小结(含答案)
文档属性
| 名称 | 浙教版科学八年级下册同步练习:第2章 微粒的模型与符号 单元复习小结(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 111.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2022-06-30 22:03:06 | ||
图片预览




文档简介
单元复习小结
本章知识清单
一、模型与符号
1.模型的概念:模型是所研究的系统、过程、事物或概念的一种表达形式。一个模型可以是一幅 、一张表或计算机图像,也可以是一个复杂的 或 的示意。
2.符号的概念:符号是指有一定意义的图形、文字。
二、构成物质的三种粒子
1.物质通常由 构成,如 等;但有些物质也可以由
直接构成,如 等;物质还可能由另一种粒子—— 构成。所以构成物质的粒子有 三大类。
2.分子与原子的区别和联系
项目 分子 原子
本质 区别 在化学变化中,分子可以再 在化学变化中,原子不可以再分
相同 点 质量和体积都很 ;都在不断地运动;微观粒子间都有间隔;都能够直接构成物质
联系 分子分成原子,原子按一定规律结合形成分子
三、原子的结构和模型
1.原子的结构
原子(呈电 性)
相关说明:
(1)原子核带的电荷数又叫 。
(2)由于整个原子不显电性,所以原子中各粒子的关系:核电荷数 质子数 核外电子数。
(3)原子中 的质量可以忽略不计,故原子的质量主要集中在 。
(4)质子、中子由 构成。
2.离子
(1)概念:带电的 或 。
(2)类型:带正电的叫阳离子,带负电的叫 离子。
3.元素和同位素
(1)元素:具有相同 数(即质子数)的一类原子的总称。
(2)同位素定义:原子核内的质子数相同、 数不相同的同类原子互为同位素原子。
四、组成物质的元素
1.单质、化合物概念的区别和联系
项目 单质 化合物
宏观 组成 元素 元素
微观 构成 同种原子或由同种原子构成的同一种分子 由不同种原子构成的同一种分子
共同点 都属于纯净物
2.符号:常见元素及元素符号
氢 碳 氮 氧 钠 镁 铝 硅 磷 硫
氯 钾 钙 铁 铜 锌 银 碘 钡 汞
3.地壳中含量居前四位的元素是 。
4.人体中所含比例最高的元素是 ,其次是 ,再次是 。
5.元素符号可代表的化学意义
例如:“C”宏观上表示 这种元素,微观上表示 个碳原子;而“2C”仅表示 。
五、元素周期表
1.概念:根据元素的原子结构和性质,科学家把已知的110多种元素按 由小到大科学有序地排列起来得到的表,叫元素周期表。
2.科学家:俄国化学家 制成了第一张元素周期表。
3.结构
(1)周期:元素周期表中每一横行叫作一个 。元素周期表中共有 个横行,表示
个周期。同一周期从左到右,各元素原子的 数逐渐增加。
(2)族:元素周期表中每一纵列叫作一个 。元素周期表中共有18个纵列,16个族。同族元素的 相似。
六、化学式
1.定义:用 来表示物质组成的式子。
2.化学式的意义(以CO2为例)
(1)宏观上可代表 这种物质。
(2)宏观上说明二氧化碳由 组成。
(3)微观上可代表一个 分子。
(4)微观上可说明一个二氧化碳分子是由 构成的。
七、元素的化合价
1.常见元素、原子团的化合价(用符号填写)
+1价: ;原子团 。
-1价: ;原子团 。
+2价: 。
-2价: ;原子团 。
+3价: 。
-3价:原子团 。
2.常见化合价的一般规则
(1)化合物中金属元素常显 价。
(2)非金属元素跟氧化合时显 价,如SO2;跟氢化合时常显 价,如H2S。
(3)单质中元素的化合价为 。
(4)在化合物中所有元素化合价的代数和为 。(最重要的一条规则)
(5)同种元素的化合价是可以变化的,如在FeCl2中Fe显 价,在FeCl3中Fe显
价。
八、相对原子质量与相对分子质量
1.相对原子质量:原子的质量很小,为了方便表示,就用相对原子质量来表示。若碳-12原子的质量为M g,氧原子的质量为N g,则氧原子的相对原子质量为 。
2.原子的质量与相对原子质量的关系
项目 原子的质量 相对原子质量
得出 途径与 性质 实验测出的;是一个原子的实际质量 比较得出的;是相对质量
单位 有单位(kg) 是一个比值,单位是“1”,常省略不写
联系 相对原子质量=
3.有关化学式的四种基本计算类型(以NH4NO3为例,写出具体步骤)
(1)NH4NO3的相对分子质量Mr= 。
(2)NH4NO3中各元素的质量比m(N)∶m(H)∶m(O)= 。
(3)NH4NO3中氮元素的质量分数为 。
(4)40 g NH4NO3中含氮元素的质量为 。
本章中考展示
一、选择题
1.(2020杭州改编)科学家合成了一种环状碳分子C18,这种分子具有广泛的应用前景。1个环状碳分子C18中共含有18个 ( )
A.原子
B.质子
C.中子
D.电子
2.(2021温州)2021年4月,我国科学家首次合成的铀-214是目前已知质量最小的铀原子,其相对原子质量为214,质子数是92。则铀-214原子的核外电子数为 ( )
A.92
B.122
C.214
D.306
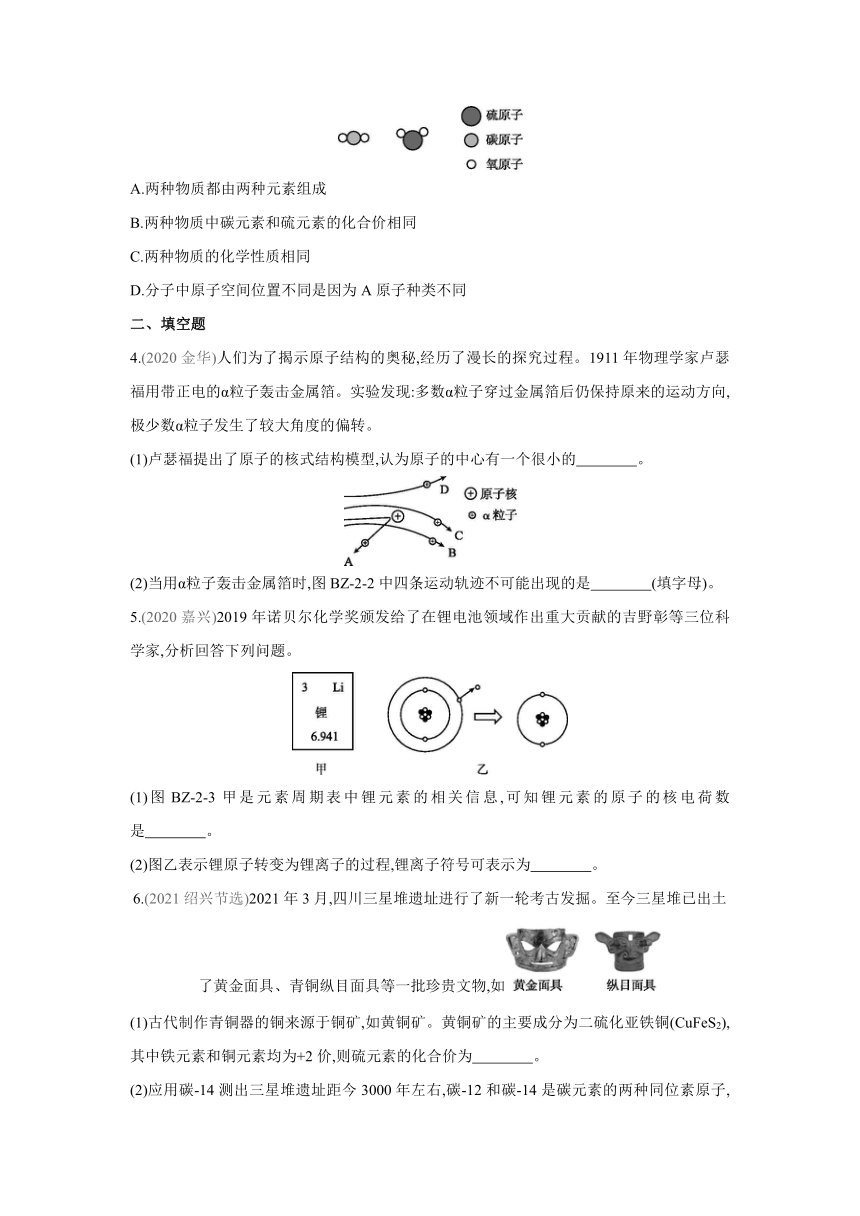
3.(2021湖州)二氧化碳和二氧化硫都是由AB2型分子构成的物质,但分子中A原子和B原子的空间位置不同,其模型如图BZ-2-1所示。根据此模型,下列叙述错误的是( )
A.两种物质都由两种元素组成
B.两种物质中碳元素和硫元素的化合价相同
C.两种物质的化学性质相同
D.分子中原子空间位置不同是因为A原子种类不同
二、填空题
4.(2020金华)人们为了揭示原子结构的奥秘,经历了漫长的探究过程。1911年物理学家卢瑟福用带正电的α粒子轰击金属箔。实验发现:多数α粒子穿过金属箔后仍保持原来的运动方向,极少数α粒子发生了较大角度的偏转。
(1)卢瑟福提出了原子的核式结构模型,认为原子的中心有一个很小的 。
(2)当用α粒子轰击金属箔时,图BZ-2-2中四条运动轨迹不可能出现的是 (填字母)。
5.(2020嘉兴)2019年诺贝尔化学奖颁发给了在锂电池领域作出重大贡献的吉野彰等三位科学家,分析回答下列问题。
(1)图BZ-2-3甲是元素周期表中锂元素的相关信息,可知锂元素的原子的核电荷数是 。
(2)图乙表示锂原子转变为锂离子的过程,锂离子符号可表示为 。
6.(2021绍兴节选)2021年3月,四川三星堆遗址进行了新一轮考古发掘。至今三星堆已出土了黄金面具、青铜纵目面具等一批珍贵文物,如
(1)古代制作青铜器的铜来源于铜矿,如黄铜矿。黄铜矿的主要成分为二硫化亚铁铜(CuFeS2),其中铁元素和铜元素均为+2价,则硫元素的化合价为 。
(2)应用碳-14测出三星堆遗址距今3000年左右,碳-12和碳-14是碳元素的两种同位素原子,它们的主要区别是原子核中的 数不同。
7.(2020宁波)覆盆子果实含有丰富的维生素、少量水杨酸以及钙、钾等元素,有“黄金水果”的美誉。其中的水杨酸常温下稳定,加热易分解,微溶于水,其水溶液呈酸性。
(1)覆盆子果实中的钙、钾等元素是以 (填“单质”或“化合物”)的形态存在的。
(2)水杨酸(C7H6O3)中碳元素和氧元素的质量比为 。
(3)水杨酸的上述性质中,属于物理性质的是 。
三、解答题
8.(2021绍兴节选)按我国政府要求,2021年1月1日起餐饮行业已禁用不可降解的一次性塑料吸管,取而代之的是一些可降解的环保吸管。环保纸吸管的主要成分是纤维素,化学式为(C6H10O5)n,而原来塑料吸管的主要成分是聚丙烯,化学式为(C3H6)n。
(1)纤维素分子中,氢、氧原子的个数比为 。
(2)计算32.4 g纤维素中所含碳元素质量与多少克聚丙烯中所含碳元素质量相同
9.(2021嘉兴)氕、氘、氚是氢的三种同位素原子,它们的原子结构模型如图BZ-2-6所示,相关信息如下表。试回答:
图BZ-2-6
名称 符号 相对原子质量
氕 H 1
氘 D 2
氚 T 3
(1)原子结构模型中的“”表示的粒子是 。
(2)超重水有一定的放射性。一个超重水分子由两个氚原子和一个氧原子构成,其化学式可表示为T2O,T2O中T的化合价为 。
(3)重水是由氘和氧组成的化合物,化学式可表示为D2O,重水和普通水化学性质相似。在海水中重水的质量约占0.02%,则100 t海水中所含氘的质量为多少
10.(2020台州节选)碰碰香是一种常见的室内盆栽植物,因触碰后可散发出令人舒适的香气而得名,其香气具有提神醒脑、驱避蚊虫的作用。
(1)在室内其他地方也能闻到碰碰香散发的香味,是因为 。
(2)碰碰香的香味物质中含量最多的是柠檬烯,其化学式为C10H16。计算:
①柠檬烯中碳元素、氢元素的质量比为 。
②柠檬烯中碳元素的质量分数为多少 (计算结果精确到0.1%)
答案
一、1.图 对象 过程
二、1.分子 水、二氧化碳、氧气 原子 铁、铜
离子 分子、原子、离子
2.分 小
三、1.中 负 正 质子 正 中子 不带
(1)核电荷数 (2)=(或等于) =(或等于)
(3)核外电子 原子核 (4)夸克
2.(1)原子 原子团 (2)阴
3.(1)核电荷 (2)中子
四、1.同种 不同种
2.H C N O Na Mg Al Si P S Cl K Ca Fe Cu Zn Ag I Ba Hg
3.氧、硅、铝、铁
4.氧 碳 氢
5.碳 1 2个碳原子
五、1.核电荷数 2.门捷列夫
3.(1)周期 7 7 核电荷(或质子)
(2)族 化学性质
六、1.元素符号
2.(1)二氧化碳 (2)碳元素和氧元素
(3)二氧化碳 (4)一个碳原子和两个氧原子
七、1.K、Na、Ag、H N F、Cl、Br、I
OH-、N Ca、Mg、Ba、Zn O、S
S、C Al P
2.(1)正 (2)正 负
(3)零 (4)零
(5)+2 +3
八、1.
3.(1)14×2+1×4+16×3=80
(2)(14×2)∶(1×4)∶(16×3)=7∶1∶12
(3)×100%=35%
(4)40 g×=14 g
本章中考展示
1.A 分子是由原子构成的,所以C18中18的含义是一个环状碳分子C18中含有18个碳原子。
2.A 原子中质子数=电子数,该原子质子数为92,则核外电子数也为92。
3.C
4.(1)原子核 (2)C
(2)带正电的α粒子靠近带正电的原子核应向相反的方向偏转,所以不可能出现C所示的情况。
5.(1)3 (2)Li+
(1)根据甲图可知,锂元素的原子序数为3,根据核电荷数=原子序数可知,锂元素的原子的核电荷数为3。(2)根据图乙可知,锂原子失去一个电子变为锂离子,因此锂离子带一个单位的正电荷,符号为Li+。
6.(1)-2 (2)中子
7.(1)化合物 (2)7∶4 (3)水杨酸微溶于水
(1)覆盆子果实中的钙、钾等元素是以化合物的形态存在的。(2)水杨酸(C7H6O3)中碳元素和氧元素的质量比为(7×12)∶(3×16)=7∶4。(3)物理性质从颜色、气味、状态、溶解性等方面去分析。
8.(1)2∶1
(2)解:设需要聚丙烯的质量为x。
32.4 g×=x×
x=16.8 g
答:32.4 g纤维素中所含碳元素质量与16.8 g聚丙烯所含碳元素质量相同。
9.(1)中子 (2)+1
(3)解:重水中氘的质量分数为×100%=20%。
100 t海水中所含氘的质量为100 t×0.02%×20%=0.004 t。
答:100 t海水中所含氘的质量为0.004 t。
(1)根据题图可知,三种原子中“”的个数不同,根据“同位素原子中子数不同”可知,它表示中子。(2)在T2O中氧元素的化合价为-2,根据正负化合价代数和为零得2x+(-2)=0,解得x=+1。
10.(1)分子在不停地做无规则运动(或扩散)
(2)①15∶2
②解:柠檬烯中碳元素的质量分数为×100%≈88.2%。
答:柠檬烯中碳元素的质量分数为88.2%。
本章知识清单
一、模型与符号
1.模型的概念:模型是所研究的系统、过程、事物或概念的一种表达形式。一个模型可以是一幅 、一张表或计算机图像,也可以是一个复杂的 或 的示意。
2.符号的概念:符号是指有一定意义的图形、文字。
二、构成物质的三种粒子
1.物质通常由 构成,如 等;但有些物质也可以由
直接构成,如 等;物质还可能由另一种粒子—— 构成。所以构成物质的粒子有 三大类。
2.分子与原子的区别和联系
项目 分子 原子
本质 区别 在化学变化中,分子可以再 在化学变化中,原子不可以再分
相同 点 质量和体积都很 ;都在不断地运动;微观粒子间都有间隔;都能够直接构成物质
联系 分子分成原子,原子按一定规律结合形成分子
三、原子的结构和模型
1.原子的结构
原子(呈电 性)
相关说明:
(1)原子核带的电荷数又叫 。
(2)由于整个原子不显电性,所以原子中各粒子的关系:核电荷数 质子数 核外电子数。
(3)原子中 的质量可以忽略不计,故原子的质量主要集中在 。
(4)质子、中子由 构成。
2.离子
(1)概念:带电的 或 。
(2)类型:带正电的叫阳离子,带负电的叫 离子。
3.元素和同位素
(1)元素:具有相同 数(即质子数)的一类原子的总称。
(2)同位素定义:原子核内的质子数相同、 数不相同的同类原子互为同位素原子。
四、组成物质的元素
1.单质、化合物概念的区别和联系
项目 单质 化合物
宏观 组成 元素 元素
微观 构成 同种原子或由同种原子构成的同一种分子 由不同种原子构成的同一种分子
共同点 都属于纯净物
2.符号:常见元素及元素符号
氢 碳 氮 氧 钠 镁 铝 硅 磷 硫
氯 钾 钙 铁 铜 锌 银 碘 钡 汞
3.地壳中含量居前四位的元素是 。
4.人体中所含比例最高的元素是 ,其次是 ,再次是 。
5.元素符号可代表的化学意义
例如:“C”宏观上表示 这种元素,微观上表示 个碳原子;而“2C”仅表示 。
五、元素周期表
1.概念:根据元素的原子结构和性质,科学家把已知的110多种元素按 由小到大科学有序地排列起来得到的表,叫元素周期表。
2.科学家:俄国化学家 制成了第一张元素周期表。
3.结构
(1)周期:元素周期表中每一横行叫作一个 。元素周期表中共有 个横行,表示
个周期。同一周期从左到右,各元素原子的 数逐渐增加。
(2)族:元素周期表中每一纵列叫作一个 。元素周期表中共有18个纵列,16个族。同族元素的 相似。
六、化学式
1.定义:用 来表示物质组成的式子。
2.化学式的意义(以CO2为例)
(1)宏观上可代表 这种物质。
(2)宏观上说明二氧化碳由 组成。
(3)微观上可代表一个 分子。
(4)微观上可说明一个二氧化碳分子是由 构成的。
七、元素的化合价
1.常见元素、原子团的化合价(用符号填写)
+1价: ;原子团 。
-1价: ;原子团 。
+2价: 。
-2价: ;原子团 。
+3价: 。
-3价:原子团 。
2.常见化合价的一般规则
(1)化合物中金属元素常显 价。
(2)非金属元素跟氧化合时显 价,如SO2;跟氢化合时常显 价,如H2S。
(3)单质中元素的化合价为 。
(4)在化合物中所有元素化合价的代数和为 。(最重要的一条规则)
(5)同种元素的化合价是可以变化的,如在FeCl2中Fe显 价,在FeCl3中Fe显
价。
八、相对原子质量与相对分子质量
1.相对原子质量:原子的质量很小,为了方便表示,就用相对原子质量来表示。若碳-12原子的质量为M g,氧原子的质量为N g,则氧原子的相对原子质量为 。
2.原子的质量与相对原子质量的关系
项目 原子的质量 相对原子质量
得出 途径与 性质 实验测出的;是一个原子的实际质量 比较得出的;是相对质量
单位 有单位(kg) 是一个比值,单位是“1”,常省略不写
联系 相对原子质量=
3.有关化学式的四种基本计算类型(以NH4NO3为例,写出具体步骤)
(1)NH4NO3的相对分子质量Mr= 。
(2)NH4NO3中各元素的质量比m(N)∶m(H)∶m(O)= 。
(3)NH4NO3中氮元素的质量分数为 。
(4)40 g NH4NO3中含氮元素的质量为 。
本章中考展示
一、选择题
1.(2020杭州改编)科学家合成了一种环状碳分子C18,这种分子具有广泛的应用前景。1个环状碳分子C18中共含有18个 ( )
A.原子
B.质子
C.中子
D.电子
2.(2021温州)2021年4月,我国科学家首次合成的铀-214是目前已知质量最小的铀原子,其相对原子质量为214,质子数是92。则铀-214原子的核外电子数为 ( )
A.92
B.122
C.214
D.306
3.(2021湖州)二氧化碳和二氧化硫都是由AB2型分子构成的物质,但分子中A原子和B原子的空间位置不同,其模型如图BZ-2-1所示。根据此模型,下列叙述错误的是( )
A.两种物质都由两种元素组成
B.两种物质中碳元素和硫元素的化合价相同
C.两种物质的化学性质相同
D.分子中原子空间位置不同是因为A原子种类不同
二、填空题
4.(2020金华)人们为了揭示原子结构的奥秘,经历了漫长的探究过程。1911年物理学家卢瑟福用带正电的α粒子轰击金属箔。实验发现:多数α粒子穿过金属箔后仍保持原来的运动方向,极少数α粒子发生了较大角度的偏转。
(1)卢瑟福提出了原子的核式结构模型,认为原子的中心有一个很小的 。
(2)当用α粒子轰击金属箔时,图BZ-2-2中四条运动轨迹不可能出现的是 (填字母)。
5.(2020嘉兴)2019年诺贝尔化学奖颁发给了在锂电池领域作出重大贡献的吉野彰等三位科学家,分析回答下列问题。
(1)图BZ-2-3甲是元素周期表中锂元素的相关信息,可知锂元素的原子的核电荷数是 。
(2)图乙表示锂原子转变为锂离子的过程,锂离子符号可表示为 。
6.(2021绍兴节选)2021年3月,四川三星堆遗址进行了新一轮考古发掘。至今三星堆已出土了黄金面具、青铜纵目面具等一批珍贵文物,如
(1)古代制作青铜器的铜来源于铜矿,如黄铜矿。黄铜矿的主要成分为二硫化亚铁铜(CuFeS2),其中铁元素和铜元素均为+2价,则硫元素的化合价为 。
(2)应用碳-14测出三星堆遗址距今3000年左右,碳-12和碳-14是碳元素的两种同位素原子,它们的主要区别是原子核中的 数不同。
7.(2020宁波)覆盆子果实含有丰富的维生素、少量水杨酸以及钙、钾等元素,有“黄金水果”的美誉。其中的水杨酸常温下稳定,加热易分解,微溶于水,其水溶液呈酸性。
(1)覆盆子果实中的钙、钾等元素是以 (填“单质”或“化合物”)的形态存在的。
(2)水杨酸(C7H6O3)中碳元素和氧元素的质量比为 。
(3)水杨酸的上述性质中,属于物理性质的是 。
三、解答题
8.(2021绍兴节选)按我国政府要求,2021年1月1日起餐饮行业已禁用不可降解的一次性塑料吸管,取而代之的是一些可降解的环保吸管。环保纸吸管的主要成分是纤维素,化学式为(C6H10O5)n,而原来塑料吸管的主要成分是聚丙烯,化学式为(C3H6)n。
(1)纤维素分子中,氢、氧原子的个数比为 。
(2)计算32.4 g纤维素中所含碳元素质量与多少克聚丙烯中所含碳元素质量相同
9.(2021嘉兴)氕、氘、氚是氢的三种同位素原子,它们的原子结构模型如图BZ-2-6所示,相关信息如下表。试回答:
图BZ-2-6
名称 符号 相对原子质量
氕 H 1
氘 D 2
氚 T 3
(1)原子结构模型中的“”表示的粒子是 。
(2)超重水有一定的放射性。一个超重水分子由两个氚原子和一个氧原子构成,其化学式可表示为T2O,T2O中T的化合价为 。
(3)重水是由氘和氧组成的化合物,化学式可表示为D2O,重水和普通水化学性质相似。在海水中重水的质量约占0.02%,则100 t海水中所含氘的质量为多少
10.(2020台州节选)碰碰香是一种常见的室内盆栽植物,因触碰后可散发出令人舒适的香气而得名,其香气具有提神醒脑、驱避蚊虫的作用。
(1)在室内其他地方也能闻到碰碰香散发的香味,是因为 。
(2)碰碰香的香味物质中含量最多的是柠檬烯,其化学式为C10H16。计算:
①柠檬烯中碳元素、氢元素的质量比为 。
②柠檬烯中碳元素的质量分数为多少 (计算结果精确到0.1%)
答案
一、1.图 对象 过程
二、1.分子 水、二氧化碳、氧气 原子 铁、铜
离子 分子、原子、离子
2.分 小
三、1.中 负 正 质子 正 中子 不带
(1)核电荷数 (2)=(或等于) =(或等于)
(3)核外电子 原子核 (4)夸克
2.(1)原子 原子团 (2)阴
3.(1)核电荷 (2)中子
四、1.同种 不同种
2.H C N O Na Mg Al Si P S Cl K Ca Fe Cu Zn Ag I Ba Hg
3.氧、硅、铝、铁
4.氧 碳 氢
5.碳 1 2个碳原子
五、1.核电荷数 2.门捷列夫
3.(1)周期 7 7 核电荷(或质子)
(2)族 化学性质
六、1.元素符号
2.(1)二氧化碳 (2)碳元素和氧元素
(3)二氧化碳 (4)一个碳原子和两个氧原子
七、1.K、Na、Ag、H N F、Cl、Br、I
OH-、N Ca、Mg、Ba、Zn O、S
S、C Al P
2.(1)正 (2)正 负
(3)零 (4)零
(5)+2 +3
八、1.
3.(1)14×2+1×4+16×3=80
(2)(14×2)∶(1×4)∶(16×3)=7∶1∶12
(3)×100%=35%
(4)40 g×=14 g
本章中考展示
1.A 分子是由原子构成的,所以C18中18的含义是一个环状碳分子C18中含有18个碳原子。
2.A 原子中质子数=电子数,该原子质子数为92,则核外电子数也为92。
3.C
4.(1)原子核 (2)C
(2)带正电的α粒子靠近带正电的原子核应向相反的方向偏转,所以不可能出现C所示的情况。
5.(1)3 (2)Li+
(1)根据甲图可知,锂元素的原子序数为3,根据核电荷数=原子序数可知,锂元素的原子的核电荷数为3。(2)根据图乙可知,锂原子失去一个电子变为锂离子,因此锂离子带一个单位的正电荷,符号为Li+。
6.(1)-2 (2)中子
7.(1)化合物 (2)7∶4 (3)水杨酸微溶于水
(1)覆盆子果实中的钙、钾等元素是以化合物的形态存在的。(2)水杨酸(C7H6O3)中碳元素和氧元素的质量比为(7×12)∶(3×16)=7∶4。(3)物理性质从颜色、气味、状态、溶解性等方面去分析。
8.(1)2∶1
(2)解:设需要聚丙烯的质量为x。
32.4 g×=x×
x=16.8 g
答:32.4 g纤维素中所含碳元素质量与16.8 g聚丙烯所含碳元素质量相同。
9.(1)中子 (2)+1
(3)解:重水中氘的质量分数为×100%=20%。
100 t海水中所含氘的质量为100 t×0.02%×20%=0.004 t。
答:100 t海水中所含氘的质量为0.004 t。
(1)根据题图可知,三种原子中“”的个数不同,根据“同位素原子中子数不同”可知,它表示中子。(2)在T2O中氧元素的化合价为-2,根据正负化合价代数和为零得2x+(-2)=0,解得x=+1。
10.(1)分子在不停地做无规则运动(或扩散)
(2)①15∶2
②解:柠檬烯中碳元素的质量分数为×100%≈88.2%。
答:柠檬烯中碳元素的质量分数为88.2%。
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
