浙教版科学八年级下册同步练习:第3章 空气与生命 单元复习小结(word 含答案)
文档属性
| 名称 | 浙教版科学八年级下册同步练习:第3章 空气与生命 单元复习小结(word 含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 272.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2022-06-30 00:00:00 | ||
图片预览




文档简介
单元复习小结
本章知识清单
一、空气
1.空气的成分
(1)各成分的体积分数
空气成分 氮气 氧气 稀有气体 二氧化碳 水蒸气等其他气体及杂质
体积分数 0.93% 0.04% 0.03%
(2)空气中氧气含量的测定
实验现象:①红磷(不能用木炭、硫黄、铁丝、镁条等代替)燃烧时有大量白烟生成,放出热量;
②冷却后,打开止水夹,进入集气瓶的水的体积约占原集气瓶内空气体积的 。
2.空气的利用
(1)氧气的两大主要用途: 、 。
(2)氮气的用途:如灯泡中充入氮气可延长使用寿命;氮气还是制造化肥、炸药的重要原料等。
(3)稀有气体的用途:常用作保护气;用于制电光源等。
二、燃烧、缓慢氧化及灭火与火灾自救
1.物质燃烧的条件:一是有 ,二是要有 ,三是 。
2.灭火的三种方法: 、 、 。
3.火灾中逃生的方法:用 毛巾捂住口鼻, 身体迅速逃离。
4.缓慢氧化:进行得非常缓慢,甚至在短期内不易察觉的氧化反应。如动植物的呼吸作用、食物的腐败、酒和醋的酿造、农家肥的腐熟、金属生锈等,都是缓慢氧化。
5.自燃:由 而引起的自发燃烧。
6.爆炸:如果燃烧以极快的速度在 的空间里发生,瞬间累积大量的热,使气体体积急剧地膨胀,就会引起爆炸。
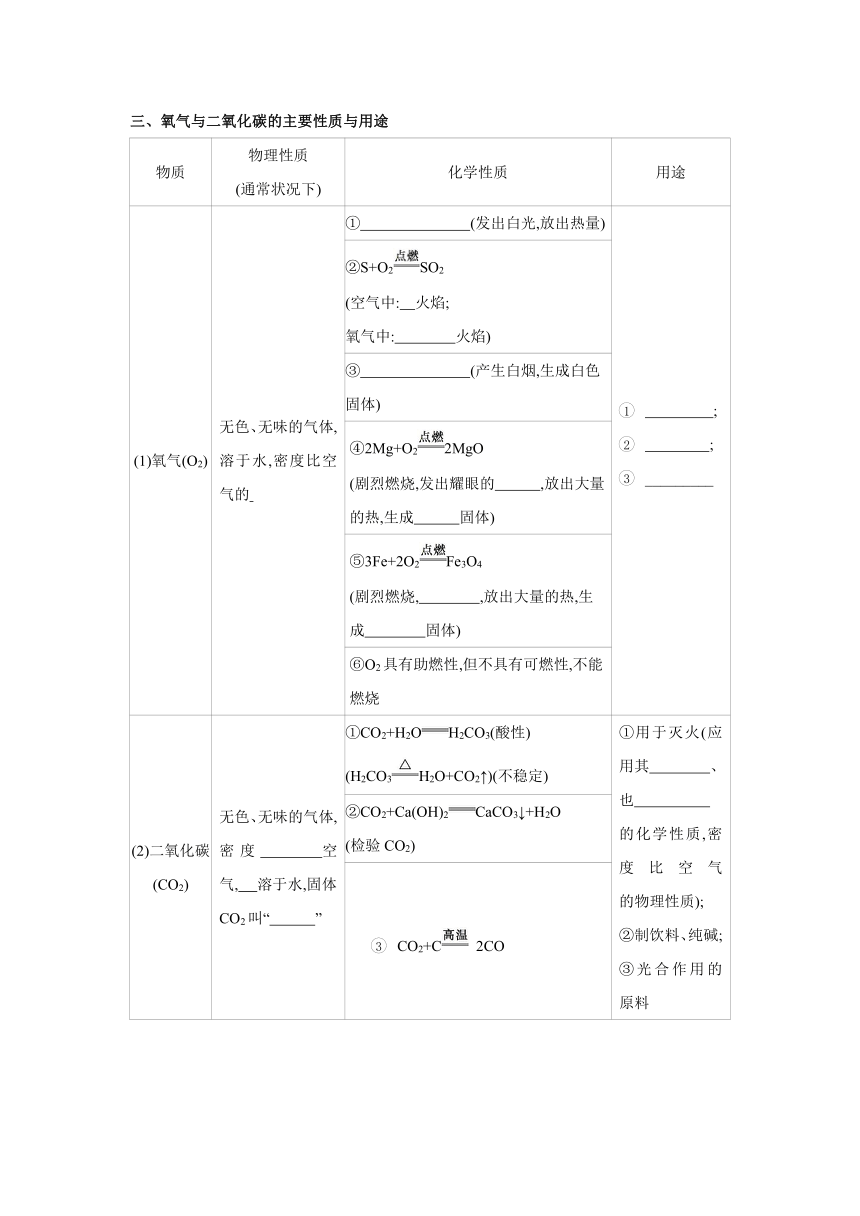
三、氧气与二氧化碳的主要性质与用途
物质 物理性质 (通常状况下) 化学性质 用途
(1)氧气(O2) 无色、无味的气体, 溶于水,密度比空气的 ① (发出白光,放出热量) ; ; _________
②S+O2SO2 (空气中: 火焰; 氧气中: 火焰)
③ (产生白烟,生成白色固体)
④2Mg+O22MgO (剧烈燃烧,发出耀眼的 ,放出大量的热,生成 固体)
⑤3Fe+2O2Fe3O4 (剧烈燃烧, ,放出大量的热,生成 固体)
⑥O2具有助燃性,但不具有可燃性,不能燃烧
(2)二氧化碳 (CO2) 无色、无味的气体,密度 空气, 溶于水,固体CO2叫“ ” ①CO2+H2OH2CO3(酸性) (H2CO3H2O+CO2↑)(不稳定) ①用于灭火(应用其 、也 的化学性质,密度比空气 的物理性质); ②制饮料、纯碱; ③光合作用的原料
②CO2+Ca(OH)2CaCO3↓+H2O (检验CO2)
CO2+C 2CO
四、氧气的制取
1.氧气的制取
药品 高锰酸钾(KMnO4)或氯酸钾(KClO3)和二氧化锰(MnO2)或过氧化氢溶液(H2O2)和二氧化锰
反应 原理 2KMnO4K2MnO4+MnO2+O2↑ 或2KClO32KCl+3O2↑ 或2H2O22H2O+O2↑
发生 装置 (部分)
收集 方法
检验
验满
放置 (填“正放”或“倒放”)
注意 事项 当用高锰酸钾或氯酸钾制取氧气时要注意以下几点: ①试管口要略向下倾斜(防止凝结在试管口的小水珠倒流至试管底部使试管炸裂) ②用排水法收集完氧气后,先撤导管后熄灭酒精灯(防止水槽中的水倒流,使试管炸裂)
2.催化剂
(1)定义:在化学反应里能改变物质的化学反应 ,而本身的 和
在反应前后没有发生变化。
(2)催化剂在工业上又叫 ,它在反应中起 作用。
五、化合反应与分解反应
基本反应类型 概念 通式 特点
化合反应 A+B+…C “多变一”
分解反应 AB+C+… “一变多”
六、质量守恒定律
1.定义:在化学反应中, 的各物质的质量总和等于反应后生成的各物质的质量总和,这个规律叫作质量守恒定律。质量守恒定律只适用于 。
2.原因:在一切化学反应中,反应前后
,所以反应前后各物质的质量总和相等。
七、化学方程式的书写规则
(1)以 为依据,写出反应物和生成物。
(2)要遵守 定律,即在化学方程式左、右两边各原子的种类与数目必须相等。
(3)说明反应条件和生成物的状态。如果一个反应在特定的条件下进行,如需点燃、加热(通常用“△”表示)、高温、通电、催化剂等,必须把条件写在等号的上方或下方(有催化剂同时需要点燃或加热时,催化剂写在等号上方)。
八、二氧化碳的制取
1.实验室制法
(1)实验药品: 和 。
(2)实验原理: 。
(3)实验装置:略。
(4)实验步骤:①检查装置的气密性;②将石灰石(或大理石)装入锥形瓶中;③塞紧双孔橡皮塞;④通过长颈漏斗向锥形瓶中加入稀盐酸;⑤收集气体。
2.工业制法:CaCO3CaO+CO2↑。
九、人体呼吸系统的组成及各器官的作用
呼吸系统的组成 各器官的作用
呼吸道 鼻 阻挡和粘住灰尘、细菌,还能温暖、湿润空气,感受气味刺激
前后略扁的管道,是空气和食物的共同通道
喉 由软骨做支架,保持气体畅通
气管和 支气管 支气管管壁覆盖着有纤毛的黏膜,能分泌黏液,粘住灰尘和细菌
主要的呼吸器官,由大量的肺泡组成,肺泡壁、毛细血管壁都很薄,仅由一层上皮细胞构成,肺泡周围布满毛细血管和弹性纤维,是气体交换的场所
十、光合作用与呼吸作用
项目 光合作用 呼吸作用
概念 指绿色植物通过 ,利用 ,把 和 转化成 的有机物,并释放 的过程 (主要指有氧呼吸)是指在 的参与下,通过细胞内有关酶的催化作用,把 等有机物氧化分解,生成 ,同时放出大量 的过程
场所
条件
原料
产物
实质 物质 将无机物合成有机物(合成有机物) 将有机物分解为无机物(分解有机物)
能量 光能转化为有机物中的化学能(储存能量) 有机物中的化学能转化为热能(释放能量)
意义 1.制造的有机物是构成地球上一切生物体的物质基础 2.通过光合作用将太阳能转化为化学能,并储存在制造的有机物中 3.维持大气成分的相对稳定 呼吸作用存在于一切生命体中,所释放的能量是一切生命活动的能量来源
十一、自然界的碳、氧循环
1.自然界氧循环的含义:指大自然中氧气的含量会由于生物的 和物质的燃烧等减少,但又会随着植物的 而增加,这样周而复始地进行循环,使大气中氧气的含量保持相对恒定的过程。
2.自然界碳循环的含义:大气中的二氧化碳通过植物的 被消耗,又随着动植物的 、有机物的燃烧以及生物腐烂分解等过程,源源不断地重新释放出来,结果使大气中被消耗的二氧化碳的量与重新释放出来的量大致相等。
3.温室效应
(1)产生原因: 的大量使用;乱砍滥伐森林。
(2)温室气体:如 等。
(3)减缓温室效应的措施:减少化石燃料的使用;开发新能源,如太阳能等;大量植树造林等。
十二、空气污染与保护
1.空气污染防治措施
(1)减少 排放量。
(2)合理规划工业区与非工业区。
(3)加大 力度。
2.空气质量指数是一种评价大气环境质量状况简单而直观的指标。目前计入空气质量指数的污染物有 、二氧化氮、颗粒物、 和一氧化碳等。
3.全球性大气环境问题
(1)酸雨
①定义:pH低于 的酸性降水,称为酸雨。酸雨中主要的有害物质是硫酸和硝酸。
②成因:雨、雪等在形成和降落过程中,吸收并溶解了空气中的 、氮氧化物等物质。
③危害:危害人体健康;使水域和土壤酸化;危害渔业等。
(2)臭氧层
①分布:主要分布在大气的 里。
②作用:吸收太阳光中大部分的 ,
对生物有保护作用。
③现状:地球南、北极上空相继出现 。
④保护措施:禁止生产和使用含 的化学物质。
本章中考展示
一、选择题
1.(2020绍兴)与图示微观变化相符的化学反应是 ( )
A.2CO+O22CO2 B.H2+CuOH2O+Cu
C.2H2+O22H2O D.H2CO3H2O+CO2↑
2.(2021丽水)相比于普通汽车,氢燃料电池车的排放物只有水,没有其他污染物,如图AZ-3-2是氢燃料电池内发生反应的微观示意图,从图中获得的信息正确的是 ( )
A.反应前后原子种类不变
B.反应前后分子种类不变
C.水分子的相对分子质量是18 g
D.水中氢元素和氧元素的质量比为2∶1
3.(2021丽水)我国宣布力争于2060年前实现“碳中和”,即二氧化碳的排放与吸收互相平衡(如图AZ-3-3),下列途径中属于吸收二氧化碳的是 ( )
A.绿色植物的光合作用
B.化石燃料的燃烧
C.微生物的氧化分解
D.生物的呼吸作用
4.(2020台州)下列化学反应中,属于化合反应的是 ( )
A.CaCO3CaO+CO2↑
B.H2O+CO2H2CO3
C.H2+CuOH2O+Cu
D.BaCl2+H2SO4BaSO4↓+2HCl
5.(2020台州)七氟丙烷(C3HF7)灭火剂容易汽化不留残渣,适用于电器、精密仪器、图书档案等灭火。根据上述信息可以推测七氟丙烷具有的性质是 ( )
A.导电性 B.腐蚀性
C.不助燃 D.沸点高
二、填空题
6.(2021宁波)家庭医药箱里有一瓶标签缺损的医用双氧水,为测定其溶质质量分数,小宁设计了如图AZ-3-4实验:在试管中放入一定量的二氧化锰,然后用注射器注入10 mL该医用双氧水,直到试管中不再有气泡产生,通过测量量筒中水的体积就可以大致计算出双氧水的质量分数。
(1)实验中用排水法测量氧气的体积是因为氧气具有 的性质。
(2)若俯视读得量筒中水的体积,则测得的双氧水质量分数将 。(填“偏大”“偏小”或“不变”)。
7.(2021嘉兴)火是文明的起源,人类取火的方法经过了漫长的演变过程。
(1)古人取火时,用火镰击打火石,产生的火花引燃可燃物,艾绒是一种常用的引燃物,主要是它的 ,因而容易点燃。
(2)1830年发明了火柴。原理是将白磷、硫、KClO3、MnO2混合,摩擦后发生KClO3分解等一系列反应,引燃火柴杆。推测KClO3在此过程中的作用是 ,使燃烧更剧烈。
8.(2020杭州)医用消毒酒精为75%的乙醇溶液,化工生产中可用A(主要成分的化学式为C8H18)作原料,经图AZ-3-5所示流程制取乙醇。
(1)步骤①的转化属于 (填“化学”或“物理”)变化。
(2)步骤②是乙烯和含两种元素的化合物B发生的化合反应,则B中所含元素是 。
三、实验探究题
9.(2021嘉兴)小嘉用H2O2溶液制取氧气时,在烧瓶中加入50 mL水及0.5 g MnO2,再往分液漏斗中加入30 mL 15%的H2O2溶液。为什么要加入50 mL 水呢 查阅资料发现:在不加入水时,若注入H2O2溶液速度过快,反应可能会因过于剧烈而引发事故。
[提出问题] 水是如何减缓该反应速度的呢
[建立假设] 水可以降低H2O2溶液浓度,从而减缓反应速度。
[实验方案] 他利用如图AZ-3-6装置,在相同条件下,分别用30 mL的1%、3%和7%的H2O2溶液进行实验,观察并比较。
[实验结论] 加水降低了H2O2溶液的浓度,使反应速度变慢。
[交流反思] (1)为了更好地比较反应的快慢,需控制三次实验中滴加H2O2溶液的 相同。
(2)判断产生氧气的速度时,可以通过观察产生气泡的快慢,还可以比较 。
[继续探究] 针对提出的问题,他又利用如图装置,用3%的H2O2溶液分别在0 ℃、20 ℃和60 ℃的条件下进行实验。进行该实验所基于的假设是
。
10.(2021丽水)建构合理的思维模型,既能促进深度学习,又能提高思维品质。小科建构了如图AZ-3-7所示“两组份混合物含量测定”的思维模型:
运用该模型对教材中“测定空气中氧气含量”的实验进行了再探究:忽略含量很低的其他物质,空气可以看成由氮气和氧气组成的两组份混合物。
[探究一] 根据沸点低的组份先汽化的性质,测定混合物中某组份的含量。
(1)将空气转变为液态空气,液氮先汽化。从建模角度分析,该操作属于上述思维模型中的 。
[探究二] 根据混合物中某组份发生化学反应,测定混合物中某组份的含量。
(2)按图AZ-3-8甲装置测定空气中氧气含量时,止水夹最合理的打开时间是 (填“反应刚结束时”或“冷却到室温时”)。
[交流评价] (3)已知:在氧气不充足时,碳与氧气反应生成一氧化碳,一氧化碳不溶于水且不与碱反应。小科用足量木炭替换红磷,等体积氢氧化钠浓溶液替换集气瓶中的水,规范操作后,测得的氧气含量将 (填“偏大”“偏小”或“不变”)。
[继续探究] (4)运用上述思维模型,小科又设计了图乙的实验装置,其“测定空气中氧气含量”的原理是 。
11.(2019温州)小明用大小不同的玻璃罩罩在两组点燃的蜡烛上(如图AZ-3-9甲),观察发现A组实验高处烛焰先熄灭,B组实验低处烛焰先熄灭。为了探究玻璃罩中烛焰熄灭顺序不同的原因,小明以A组为研究对象进行如下实验:
实验一:将6个盛有等量澄清石灰水的敞口容器固定在铁丝上,点燃蜡烛,立即用小玻璃罩罩上(如图乙),分别记下各容器内石灰水变浑浊所需的时间。多次重复实验获得数据如下表。
容器编号 1 2 3 4 5 6
平均时间/s 3.2 3.8 5.0 7.1 11.1 19.0
实验二:将3支温度计分别挂在小玻璃罩内不同位置(如图丙),点燃蜡烛,一段时间后发现温度计①示数明显增大,温度计②③示数增大不明显。
(1)根据实验一的结果,推测A组实验高处烛焰先熄灭的原因是 。
(2)实验二研究的问题是 。
(3)结合本实验的研究结果,对B组实验现象作出简要解释: 。
四、解答题
12.(2021丽水)土灶是我国古代劳动人民智慧的结晶,它通常以木柴、秸秆为燃料。目前,某市农村仍有使用土灶做饭的习惯。
小煦和小王在爷爷家看到不能移动的土灶(如图AZ-3-10甲),他们对土灶产生了好奇,了解到其内部结构如图乙所示:木柴添加通道与烟囱相连,通风道与木柴添加通道通过中间铁栅连通。于是分别设计了移动式土灶(如图丙和丁)。
(1)为使木柴充分燃烧,移动式土灶设计更合理的是 (填“丙”或“丁”)。
(2)土灶设计烟囱的作用是 。
(3)资料显示:1 kg干木柴在土灶中燃烧,能产生约12.5 g固体粉尘。从环境保护的角度,提出一条合理建议: 。
(4)干木柴的主要成分是纤维素[(C6H10O5)n],纤维素在空气中完全燃烧的化学方程式为(C6H10O5)n+6nO26nCO2+5nH2O。若干木柴中纤维素的质量分数为40.5%,则4000 g干木柴中的纤维素完全燃烧会产生二氧化碳多少克
答案
本章知识清单
一、1.(1)78% 21% (2)
2.(1)供给呼吸 支持燃烧
二、1.可燃物 助燃剂 温度达到该可燃物的着火点
2.隔离可燃物与火源 隔绝氧气(或空气) 降低温度到可燃物的着火点以下
3.湿 俯下 5.缓慢氧化 6.有限
三、(1)物理性质:不易 略大
化学性质:①C+O2CO2 ②淡蓝色 蓝紫色
③4P+5O22P2O5 ④白光 白色
⑤火星四射 黑色
用途:①供给呼吸 ②炼钢 ③气焊(合理即可)
(2)物理性质:大于 能 干冰
用途:①不燃烧 不支持燃烧 大
四、1.排水法 向上排空气法
将带火星的木条伸入集气瓶中,若木条复燃,则证明是氧气
用排水法收集时,若集气瓶口有气泡冒出,证明氧气已集满;用向上排空气法收集时,将带火星的木条放在集气瓶口,若木条复燃,则证明氧气已收集满 正放
2.(1)速率 质量 化学性质 (2)触媒 催化
五、由两种或两种以上的物质生成一种物质的反应
由一种物质生成两种或两种以上的物质的反应
六、1.参加化学反应 化学变化(反应)
2.原子的种类、数目和质量并没有改变
七、(1)客观事实 (2)质量守恒
八、1.(1)石灰石(或大理石) 稀盐酸
(2)CaCO3+2HClCaCl2+H2O+CO2↑
九、咽 肺
十、叶绿体 光能 二氧化碳 水 储存着能量
氧气 氧气 糖类 二氧化碳和水 能量
含有叶绿体的细胞中 任何活细胞内
在有光照条件下 有光无光都可以进行 二氧化碳、水 氧气、有机物
氧气、有机物 二氧化碳、水
十一、1.呼吸作用 光合作用
2.光合作用 呼吸作用
3.(1)化石燃料
(2)二氧化碳(其他合理答案也可)
十二、1.(1)污染物 (3)植树造林
2.二氧化硫 臭氧
3.(1)①5.6 ②二氧化硫
(2)①平流层 ②紫外线
③臭氧薄层(或臭氧空洞) ④氯氟烃
本章中考展示
1.A
2.A 反应前后原子种类不发生改变,分子种类一定发生改变;水分子的相对分子质量是18;水中氢元素和氧元素的质量比为1∶8。
3.A 绿色植物的光合作用可以吸收二氧化碳;化石燃料的燃烧、微生物的氧化分解、生物的呼吸作用都会消耗氧气,释放二氧化碳。
4.B 化合反应是两种或两种以上的物质反应生成一种新物质。
5.C 由所示信息知,可以灭火说明不助燃,可用于精密仪器灭火说明没有腐蚀性,容易汽化说明沸点低,适用于电器灭火说明不导电或导电性差。
6.(1)不易溶于水 (2)偏大
7.(1)着火点低 (2)提供氧气
8.(1)化学 (2)H、O
(1)物理变化和化学变化的区别是变化中是否有新物质生成。乙烯化学式为C2H4,是区别于A的新物质,故步骤①为化学变化。(2)根据质量守恒定律,乙烯(C2H4)与B发生化合反应生成乙醇(C2H5OH),则B一定含有氧元素,且B只含有两种元素,结合化学式,每个乙醇分子(C2H6O)比乙烯(C2H4)分子多2个氢原子和1个氧原子,故B中所含元素为氢、氧元素。
9.[交流反思] (1)速度
(2)相同时间内收集到氧气的体积(合理即可)
[继续探究] 水可以降低温度,减缓反应的速度
10.(1)分离转移 (2)冷却到室温时 (3)偏小
(4)铜和装置中的氧气反应,生成氧化铜固体。装置内的气体冷却到室温时,注射器内减少的体积即为装置内氧气的体积,氧气的体积与反应前装置内的总体积之比即为氧气的含量
(2)气体的体积容易受温度影响,若不冷却至室温,进入集气瓶的水的体积偏小,测出的氧气的体积就会偏小;为使结果更准确,测定空气中氧气含量时,止水夹要在冷却至室温时打开。(3)在氧气不充足时,碳与氧气反应生成一氧化碳,一氧化碳不溶于水且不与碱反应,则用足量木炭替换红磷,等体积氢氧化钠浓溶液替换集气瓶中的水,规范操作后,因碳燃烧会生成CO,使得测得的氧气含量将偏小。
11.(1)小玻璃罩中蜡烛燃烧产生的热的二氧化碳上升,在顶部聚积并逐渐下沉
(2)小玻璃罩中蜡烛燃烧对周围空气温度的影响
(3)大玻璃罩中蜡烛燃烧时,产生的热的二氧化碳上升,到一定高度后冷却,由于二氧化碳的密度比空气大,冷却后的二氧化碳从周围下沉,导致玻璃罩底部二氧化碳积聚并逐渐上升,所以B组实验低处烛焰先熄灭(叙述合理即可)
12.(1)丁
(2)有利于冷热空气形成对流,使可燃物充分燃烧,且有利于排出气体和烟尘
(3)加装除尘装置(或改进土灶结构,合理即可)
(4)解:设4000 g干木柴中的纤维素完全燃烧会产生二氧化碳的质量为x。
(C6H10O5)n+6nO26nCO2+5nH2O
162n 264n
4000 g×40.5% x
= x=2640 g
答:4000 g干木柴中的纤维素完全燃烧会产生二氧化碳2640 g。
本章知识清单
一、空气
1.空气的成分
(1)各成分的体积分数
空气成分 氮气 氧气 稀有气体 二氧化碳 水蒸气等其他气体及杂质
体积分数 0.93% 0.04% 0.03%
(2)空气中氧气含量的测定
实验现象:①红磷(不能用木炭、硫黄、铁丝、镁条等代替)燃烧时有大量白烟生成,放出热量;
②冷却后,打开止水夹,进入集气瓶的水的体积约占原集气瓶内空气体积的 。
2.空气的利用
(1)氧气的两大主要用途: 、 。
(2)氮气的用途:如灯泡中充入氮气可延长使用寿命;氮气还是制造化肥、炸药的重要原料等。
(3)稀有气体的用途:常用作保护气;用于制电光源等。
二、燃烧、缓慢氧化及灭火与火灾自救
1.物质燃烧的条件:一是有 ,二是要有 ,三是 。
2.灭火的三种方法: 、 、 。
3.火灾中逃生的方法:用 毛巾捂住口鼻, 身体迅速逃离。
4.缓慢氧化:进行得非常缓慢,甚至在短期内不易察觉的氧化反应。如动植物的呼吸作用、食物的腐败、酒和醋的酿造、农家肥的腐熟、金属生锈等,都是缓慢氧化。
5.自燃:由 而引起的自发燃烧。
6.爆炸:如果燃烧以极快的速度在 的空间里发生,瞬间累积大量的热,使气体体积急剧地膨胀,就会引起爆炸。
三、氧气与二氧化碳的主要性质与用途
物质 物理性质 (通常状况下) 化学性质 用途
(1)氧气(O2) 无色、无味的气体, 溶于水,密度比空气的 ① (发出白光,放出热量) ; ; _________
②S+O2SO2 (空气中: 火焰; 氧气中: 火焰)
③ (产生白烟,生成白色固体)
④2Mg+O22MgO (剧烈燃烧,发出耀眼的 ,放出大量的热,生成 固体)
⑤3Fe+2O2Fe3O4 (剧烈燃烧, ,放出大量的热,生成 固体)
⑥O2具有助燃性,但不具有可燃性,不能燃烧
(2)二氧化碳 (CO2) 无色、无味的气体,密度 空气, 溶于水,固体CO2叫“ ” ①CO2+H2OH2CO3(酸性) (H2CO3H2O+CO2↑)(不稳定) ①用于灭火(应用其 、也 的化学性质,密度比空气 的物理性质); ②制饮料、纯碱; ③光合作用的原料
②CO2+Ca(OH)2CaCO3↓+H2O (检验CO2)
CO2+C 2CO
四、氧气的制取
1.氧气的制取
药品 高锰酸钾(KMnO4)或氯酸钾(KClO3)和二氧化锰(MnO2)或过氧化氢溶液(H2O2)和二氧化锰
反应 原理 2KMnO4K2MnO4+MnO2+O2↑ 或2KClO32KCl+3O2↑ 或2H2O22H2O+O2↑
发生 装置 (部分)
收集 方法
检验
验满
放置 (填“正放”或“倒放”)
注意 事项 当用高锰酸钾或氯酸钾制取氧气时要注意以下几点: ①试管口要略向下倾斜(防止凝结在试管口的小水珠倒流至试管底部使试管炸裂) ②用排水法收集完氧气后,先撤导管后熄灭酒精灯(防止水槽中的水倒流,使试管炸裂)
2.催化剂
(1)定义:在化学反应里能改变物质的化学反应 ,而本身的 和
在反应前后没有发生变化。
(2)催化剂在工业上又叫 ,它在反应中起 作用。
五、化合反应与分解反应
基本反应类型 概念 通式 特点
化合反应 A+B+…C “多变一”
分解反应 AB+C+… “一变多”
六、质量守恒定律
1.定义:在化学反应中, 的各物质的质量总和等于反应后生成的各物质的质量总和,这个规律叫作质量守恒定律。质量守恒定律只适用于 。
2.原因:在一切化学反应中,反应前后
,所以反应前后各物质的质量总和相等。
七、化学方程式的书写规则
(1)以 为依据,写出反应物和生成物。
(2)要遵守 定律,即在化学方程式左、右两边各原子的种类与数目必须相等。
(3)说明反应条件和生成物的状态。如果一个反应在特定的条件下进行,如需点燃、加热(通常用“△”表示)、高温、通电、催化剂等,必须把条件写在等号的上方或下方(有催化剂同时需要点燃或加热时,催化剂写在等号上方)。
八、二氧化碳的制取
1.实验室制法
(1)实验药品: 和 。
(2)实验原理: 。
(3)实验装置:略。
(4)实验步骤:①检查装置的气密性;②将石灰石(或大理石)装入锥形瓶中;③塞紧双孔橡皮塞;④通过长颈漏斗向锥形瓶中加入稀盐酸;⑤收集气体。
2.工业制法:CaCO3CaO+CO2↑。
九、人体呼吸系统的组成及各器官的作用
呼吸系统的组成 各器官的作用
呼吸道 鼻 阻挡和粘住灰尘、细菌,还能温暖、湿润空气,感受气味刺激
前后略扁的管道,是空气和食物的共同通道
喉 由软骨做支架,保持气体畅通
气管和 支气管 支气管管壁覆盖着有纤毛的黏膜,能分泌黏液,粘住灰尘和细菌
主要的呼吸器官,由大量的肺泡组成,肺泡壁、毛细血管壁都很薄,仅由一层上皮细胞构成,肺泡周围布满毛细血管和弹性纤维,是气体交换的场所
十、光合作用与呼吸作用
项目 光合作用 呼吸作用
概念 指绿色植物通过 ,利用 ,把 和 转化成 的有机物,并释放 的过程 (主要指有氧呼吸)是指在 的参与下,通过细胞内有关酶的催化作用,把 等有机物氧化分解,生成 ,同时放出大量 的过程
场所
条件
原料
产物
实质 物质 将无机物合成有机物(合成有机物) 将有机物分解为无机物(分解有机物)
能量 光能转化为有机物中的化学能(储存能量) 有机物中的化学能转化为热能(释放能量)
意义 1.制造的有机物是构成地球上一切生物体的物质基础 2.通过光合作用将太阳能转化为化学能,并储存在制造的有机物中 3.维持大气成分的相对稳定 呼吸作用存在于一切生命体中,所释放的能量是一切生命活动的能量来源
十一、自然界的碳、氧循环
1.自然界氧循环的含义:指大自然中氧气的含量会由于生物的 和物质的燃烧等减少,但又会随着植物的 而增加,这样周而复始地进行循环,使大气中氧气的含量保持相对恒定的过程。
2.自然界碳循环的含义:大气中的二氧化碳通过植物的 被消耗,又随着动植物的 、有机物的燃烧以及生物腐烂分解等过程,源源不断地重新释放出来,结果使大气中被消耗的二氧化碳的量与重新释放出来的量大致相等。
3.温室效应
(1)产生原因: 的大量使用;乱砍滥伐森林。
(2)温室气体:如 等。
(3)减缓温室效应的措施:减少化石燃料的使用;开发新能源,如太阳能等;大量植树造林等。
十二、空气污染与保护
1.空气污染防治措施
(1)减少 排放量。
(2)合理规划工业区与非工业区。
(3)加大 力度。
2.空气质量指数是一种评价大气环境质量状况简单而直观的指标。目前计入空气质量指数的污染物有 、二氧化氮、颗粒物、 和一氧化碳等。
3.全球性大气环境问题
(1)酸雨
①定义:pH低于 的酸性降水,称为酸雨。酸雨中主要的有害物质是硫酸和硝酸。
②成因:雨、雪等在形成和降落过程中,吸收并溶解了空气中的 、氮氧化物等物质。
③危害:危害人体健康;使水域和土壤酸化;危害渔业等。
(2)臭氧层
①分布:主要分布在大气的 里。
②作用:吸收太阳光中大部分的 ,
对生物有保护作用。
③现状:地球南、北极上空相继出现 。
④保护措施:禁止生产和使用含 的化学物质。
本章中考展示
一、选择题
1.(2020绍兴)与图示微观变化相符的化学反应是 ( )
A.2CO+O22CO2 B.H2+CuOH2O+Cu
C.2H2+O22H2O D.H2CO3H2O+CO2↑
2.(2021丽水)相比于普通汽车,氢燃料电池车的排放物只有水,没有其他污染物,如图AZ-3-2是氢燃料电池内发生反应的微观示意图,从图中获得的信息正确的是 ( )
A.反应前后原子种类不变
B.反应前后分子种类不变
C.水分子的相对分子质量是18 g
D.水中氢元素和氧元素的质量比为2∶1
3.(2021丽水)我国宣布力争于2060年前实现“碳中和”,即二氧化碳的排放与吸收互相平衡(如图AZ-3-3),下列途径中属于吸收二氧化碳的是 ( )
A.绿色植物的光合作用
B.化石燃料的燃烧
C.微生物的氧化分解
D.生物的呼吸作用
4.(2020台州)下列化学反应中,属于化合反应的是 ( )
A.CaCO3CaO+CO2↑
B.H2O+CO2H2CO3
C.H2+CuOH2O+Cu
D.BaCl2+H2SO4BaSO4↓+2HCl
5.(2020台州)七氟丙烷(C3HF7)灭火剂容易汽化不留残渣,适用于电器、精密仪器、图书档案等灭火。根据上述信息可以推测七氟丙烷具有的性质是 ( )
A.导电性 B.腐蚀性
C.不助燃 D.沸点高
二、填空题
6.(2021宁波)家庭医药箱里有一瓶标签缺损的医用双氧水,为测定其溶质质量分数,小宁设计了如图AZ-3-4实验:在试管中放入一定量的二氧化锰,然后用注射器注入10 mL该医用双氧水,直到试管中不再有气泡产生,通过测量量筒中水的体积就可以大致计算出双氧水的质量分数。
(1)实验中用排水法测量氧气的体积是因为氧气具有 的性质。
(2)若俯视读得量筒中水的体积,则测得的双氧水质量分数将 。(填“偏大”“偏小”或“不变”)。
7.(2021嘉兴)火是文明的起源,人类取火的方法经过了漫长的演变过程。
(1)古人取火时,用火镰击打火石,产生的火花引燃可燃物,艾绒是一种常用的引燃物,主要是它的 ,因而容易点燃。
(2)1830年发明了火柴。原理是将白磷、硫、KClO3、MnO2混合,摩擦后发生KClO3分解等一系列反应,引燃火柴杆。推测KClO3在此过程中的作用是 ,使燃烧更剧烈。
8.(2020杭州)医用消毒酒精为75%的乙醇溶液,化工生产中可用A(主要成分的化学式为C8H18)作原料,经图AZ-3-5所示流程制取乙醇。
(1)步骤①的转化属于 (填“化学”或“物理”)变化。
(2)步骤②是乙烯和含两种元素的化合物B发生的化合反应,则B中所含元素是 。
三、实验探究题
9.(2021嘉兴)小嘉用H2O2溶液制取氧气时,在烧瓶中加入50 mL水及0.5 g MnO2,再往分液漏斗中加入30 mL 15%的H2O2溶液。为什么要加入50 mL 水呢 查阅资料发现:在不加入水时,若注入H2O2溶液速度过快,反应可能会因过于剧烈而引发事故。
[提出问题] 水是如何减缓该反应速度的呢
[建立假设] 水可以降低H2O2溶液浓度,从而减缓反应速度。
[实验方案] 他利用如图AZ-3-6装置,在相同条件下,分别用30 mL的1%、3%和7%的H2O2溶液进行实验,观察并比较。
[实验结论] 加水降低了H2O2溶液的浓度,使反应速度变慢。
[交流反思] (1)为了更好地比较反应的快慢,需控制三次实验中滴加H2O2溶液的 相同。
(2)判断产生氧气的速度时,可以通过观察产生气泡的快慢,还可以比较 。
[继续探究] 针对提出的问题,他又利用如图装置,用3%的H2O2溶液分别在0 ℃、20 ℃和60 ℃的条件下进行实验。进行该实验所基于的假设是
。
10.(2021丽水)建构合理的思维模型,既能促进深度学习,又能提高思维品质。小科建构了如图AZ-3-7所示“两组份混合物含量测定”的思维模型:
运用该模型对教材中“测定空气中氧气含量”的实验进行了再探究:忽略含量很低的其他物质,空气可以看成由氮气和氧气组成的两组份混合物。
[探究一] 根据沸点低的组份先汽化的性质,测定混合物中某组份的含量。
(1)将空气转变为液态空气,液氮先汽化。从建模角度分析,该操作属于上述思维模型中的 。
[探究二] 根据混合物中某组份发生化学反应,测定混合物中某组份的含量。
(2)按图AZ-3-8甲装置测定空气中氧气含量时,止水夹最合理的打开时间是 (填“反应刚结束时”或“冷却到室温时”)。
[交流评价] (3)已知:在氧气不充足时,碳与氧气反应生成一氧化碳,一氧化碳不溶于水且不与碱反应。小科用足量木炭替换红磷,等体积氢氧化钠浓溶液替换集气瓶中的水,规范操作后,测得的氧气含量将 (填“偏大”“偏小”或“不变”)。
[继续探究] (4)运用上述思维模型,小科又设计了图乙的实验装置,其“测定空气中氧气含量”的原理是 。
11.(2019温州)小明用大小不同的玻璃罩罩在两组点燃的蜡烛上(如图AZ-3-9甲),观察发现A组实验高处烛焰先熄灭,B组实验低处烛焰先熄灭。为了探究玻璃罩中烛焰熄灭顺序不同的原因,小明以A组为研究对象进行如下实验:
实验一:将6个盛有等量澄清石灰水的敞口容器固定在铁丝上,点燃蜡烛,立即用小玻璃罩罩上(如图乙),分别记下各容器内石灰水变浑浊所需的时间。多次重复实验获得数据如下表。
容器编号 1 2 3 4 5 6
平均时间/s 3.2 3.8 5.0 7.1 11.1 19.0
实验二:将3支温度计分别挂在小玻璃罩内不同位置(如图丙),点燃蜡烛,一段时间后发现温度计①示数明显增大,温度计②③示数增大不明显。
(1)根据实验一的结果,推测A组实验高处烛焰先熄灭的原因是 。
(2)实验二研究的问题是 。
(3)结合本实验的研究结果,对B组实验现象作出简要解释: 。
四、解答题
12.(2021丽水)土灶是我国古代劳动人民智慧的结晶,它通常以木柴、秸秆为燃料。目前,某市农村仍有使用土灶做饭的习惯。
小煦和小王在爷爷家看到不能移动的土灶(如图AZ-3-10甲),他们对土灶产生了好奇,了解到其内部结构如图乙所示:木柴添加通道与烟囱相连,通风道与木柴添加通道通过中间铁栅连通。于是分别设计了移动式土灶(如图丙和丁)。
(1)为使木柴充分燃烧,移动式土灶设计更合理的是 (填“丙”或“丁”)。
(2)土灶设计烟囱的作用是 。
(3)资料显示:1 kg干木柴在土灶中燃烧,能产生约12.5 g固体粉尘。从环境保护的角度,提出一条合理建议: 。
(4)干木柴的主要成分是纤维素[(C6H10O5)n],纤维素在空气中完全燃烧的化学方程式为(C6H10O5)n+6nO26nCO2+5nH2O。若干木柴中纤维素的质量分数为40.5%,则4000 g干木柴中的纤维素完全燃烧会产生二氧化碳多少克
答案
本章知识清单
一、1.(1)78% 21% (2)
2.(1)供给呼吸 支持燃烧
二、1.可燃物 助燃剂 温度达到该可燃物的着火点
2.隔离可燃物与火源 隔绝氧气(或空气) 降低温度到可燃物的着火点以下
3.湿 俯下 5.缓慢氧化 6.有限
三、(1)物理性质:不易 略大
化学性质:①C+O2CO2 ②淡蓝色 蓝紫色
③4P+5O22P2O5 ④白光 白色
⑤火星四射 黑色
用途:①供给呼吸 ②炼钢 ③气焊(合理即可)
(2)物理性质:大于 能 干冰
用途:①不燃烧 不支持燃烧 大
四、1.排水法 向上排空气法
将带火星的木条伸入集气瓶中,若木条复燃,则证明是氧气
用排水法收集时,若集气瓶口有气泡冒出,证明氧气已集满;用向上排空气法收集时,将带火星的木条放在集气瓶口,若木条复燃,则证明氧气已收集满 正放
2.(1)速率 质量 化学性质 (2)触媒 催化
五、由两种或两种以上的物质生成一种物质的反应
由一种物质生成两种或两种以上的物质的反应
六、1.参加化学反应 化学变化(反应)
2.原子的种类、数目和质量并没有改变
七、(1)客观事实 (2)质量守恒
八、1.(1)石灰石(或大理石) 稀盐酸
(2)CaCO3+2HClCaCl2+H2O+CO2↑
九、咽 肺
十、叶绿体 光能 二氧化碳 水 储存着能量
氧气 氧气 糖类 二氧化碳和水 能量
含有叶绿体的细胞中 任何活细胞内
在有光照条件下 有光无光都可以进行 二氧化碳、水 氧气、有机物
氧气、有机物 二氧化碳、水
十一、1.呼吸作用 光合作用
2.光合作用 呼吸作用
3.(1)化石燃料
(2)二氧化碳(其他合理答案也可)
十二、1.(1)污染物 (3)植树造林
2.二氧化硫 臭氧
3.(1)①5.6 ②二氧化硫
(2)①平流层 ②紫外线
③臭氧薄层(或臭氧空洞) ④氯氟烃
本章中考展示
1.A
2.A 反应前后原子种类不发生改变,分子种类一定发生改变;水分子的相对分子质量是18;水中氢元素和氧元素的质量比为1∶8。
3.A 绿色植物的光合作用可以吸收二氧化碳;化石燃料的燃烧、微生物的氧化分解、生物的呼吸作用都会消耗氧气,释放二氧化碳。
4.B 化合反应是两种或两种以上的物质反应生成一种新物质。
5.C 由所示信息知,可以灭火说明不助燃,可用于精密仪器灭火说明没有腐蚀性,容易汽化说明沸点低,适用于电器灭火说明不导电或导电性差。
6.(1)不易溶于水 (2)偏大
7.(1)着火点低 (2)提供氧气
8.(1)化学 (2)H、O
(1)物理变化和化学变化的区别是变化中是否有新物质生成。乙烯化学式为C2H4,是区别于A的新物质,故步骤①为化学变化。(2)根据质量守恒定律,乙烯(C2H4)与B发生化合反应生成乙醇(C2H5OH),则B一定含有氧元素,且B只含有两种元素,结合化学式,每个乙醇分子(C2H6O)比乙烯(C2H4)分子多2个氢原子和1个氧原子,故B中所含元素为氢、氧元素。
9.[交流反思] (1)速度
(2)相同时间内收集到氧气的体积(合理即可)
[继续探究] 水可以降低温度,减缓反应的速度
10.(1)分离转移 (2)冷却到室温时 (3)偏小
(4)铜和装置中的氧气反应,生成氧化铜固体。装置内的气体冷却到室温时,注射器内减少的体积即为装置内氧气的体积,氧气的体积与反应前装置内的总体积之比即为氧气的含量
(2)气体的体积容易受温度影响,若不冷却至室温,进入集气瓶的水的体积偏小,测出的氧气的体积就会偏小;为使结果更准确,测定空气中氧气含量时,止水夹要在冷却至室温时打开。(3)在氧气不充足时,碳与氧气反应生成一氧化碳,一氧化碳不溶于水且不与碱反应,则用足量木炭替换红磷,等体积氢氧化钠浓溶液替换集气瓶中的水,规范操作后,因碳燃烧会生成CO,使得测得的氧气含量将偏小。
11.(1)小玻璃罩中蜡烛燃烧产生的热的二氧化碳上升,在顶部聚积并逐渐下沉
(2)小玻璃罩中蜡烛燃烧对周围空气温度的影响
(3)大玻璃罩中蜡烛燃烧时,产生的热的二氧化碳上升,到一定高度后冷却,由于二氧化碳的密度比空气大,冷却后的二氧化碳从周围下沉,导致玻璃罩底部二氧化碳积聚并逐渐上升,所以B组实验低处烛焰先熄灭(叙述合理即可)
12.(1)丁
(2)有利于冷热空气形成对流,使可燃物充分燃烧,且有利于排出气体和烟尘
(3)加装除尘装置(或改进土灶结构,合理即可)
(4)解:设4000 g干木柴中的纤维素完全燃烧会产生二氧化碳的质量为x。
(C6H10O5)n+6nO26nCO2+5nH2O
162n 264n
4000 g×40.5% x
= x=2640 g
答:4000 g干木柴中的纤维素完全燃烧会产生二氧化碳2640 g。
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
