九年级化学沪教版(全国)下册7.2常见的酸和碱练习(word版 含答案)
文档属性
| 名称 | 九年级化学沪教版(全国)下册7.2常见的酸和碱练习(word版 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 215.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-16 06:51:01 | ||
图片预览


文档简介
7.2常见的酸和碱练习-2021-2022学年九年级化学沪教版(全国)下册
一、单选题
1.现有X、Y、Z三种金属,把X和Y分别放入稀硫酸中,仅X溶解并产生氢气;如果把Y和Z分别放入硝酸银溶液中,过一会儿,在Y表面有银析出,而Z没有变化。根据以上事实,对X、Y、Z三种金属活动性顺序判断正确的是
A.X >Y>(H)>Z B.X>(H)>Y>Z C.Y>(H)>X>Z D.Y>X> (H)>Z
2.下列四个图象能正确的反映对应的实验操作的是( )
A.向一定质量的饱和石灰水中不断加入生石灰
B.向等质量的锌、铁中滴加足量的且等质量分数的稀盐酸
C.向一定质量的氧化铜中通入一氧化碳气体并持续高温
D.向一定质量的氢氧化钾和硝酸钡的混合溶液中滴加稀硫酸
3.现有5种物质:①浓盐酸②烧碱③食盐④浓硫酸⑤铁把它们长期露置在空气中,其中发生化学变化且质量增加的是( )
A.①② B.②⑤ C.③④ D.③⑤
4.现有 X、Y、Z 三种金属,如果把 X、Y 和 Z 分别放入稀硫酸中,X 和 Z 溶解并产生气体,Y 无变化;如果把 X 放入 Z 的化合物溶液中,过一会儿,在 X 的表面有Z 析出。根据以上实验事实,判断 X、Y 和 Z 的金属活动性顺序是
A.X > Z > Y B.Y > Z > X C.X > Y > Z D.Z > X > Y
5.归纳、推理是学习化学的重要方法。下列说法不正确的是
A.不同种元素可以组成不同的物质,同一种元素也可以组成不同的物质
B.不同种元素最本质的区别是质子数不同
C.酸溶液可使紫色的石蕊溶液变红,能使紫色石蕊溶液变红的溶液是酸溶液
D.生铁和钢的性能不同,是因为它们的含碳量不同
6.有关中和反应的说法一定正确的是( )
A.反应物均须溶于水
B.有沉淀生成
C.有气体生成
D.有盐生成
7.通过学习化学,我们学会了从化学的视角认识水,下列对水的认识错误的是
A.水由氢气和氧气组成
B.冰中的水分子也在不断运动
C.硬水中含有较多可溶性钙、镁化合物
D.水可与生石灰发生化学反应
8.把一枚无锈铁钉放在硫酸铜溶液中,一段时间后,可出现的是
A.溶液蓝色变浅直至无色 B.铁钉表面析出红色物质
C.产生大量气泡 D.溶液质量增加
9.按如图所示装置,玻璃棒末端固定一团喷有酚酞溶液的脱脂棉Y。先加入物质X,再塞上带玻璃棒的橡胶塞。片刻后,能观察到喷有酚酞溶液的脱脂棉Y变红,则物质X可能是
A.浓盐酸 B.浓氨水
C.浓醋酸 D.浓氢氧化钠溶液
10.下图是常见的几个实验操作,其中正确的是
A.加热液体药品 B.放置盛氢气的集气瓶
C.稀释浓硫酸 D.试管的洗涤
二、填空题
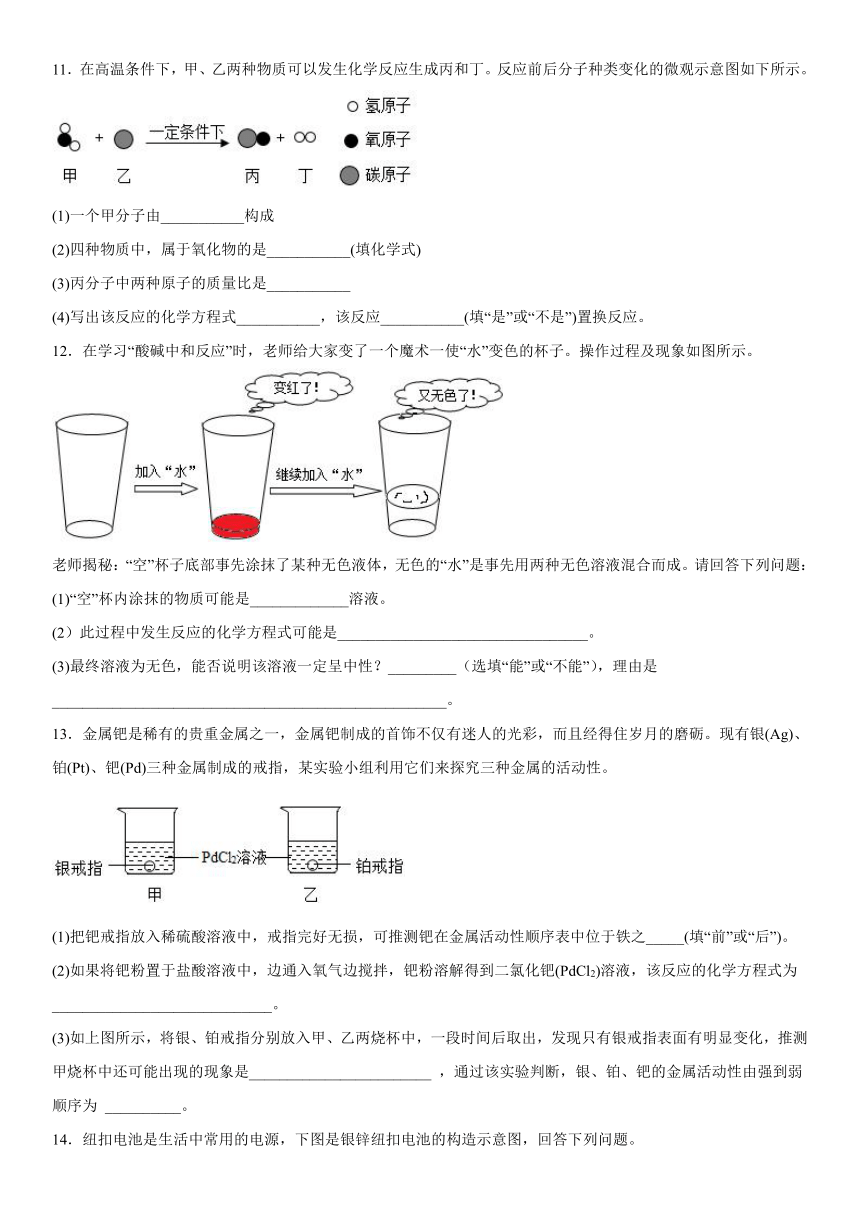
11.在高温条件下,甲、乙两种物质可以发生化学反应生成丙和丁。反应前后分子种类变化的微观示意图如下所示。
(1)一个甲分子由___________构成
(2)四种物质中,属于氧化物的是___________(填化学式)
(3)丙分子中两种原子的质量比是___________
(4)写出该反应的化学方程式___________,该反应___________(填“是”或“不是”)置换反应。
12.在学习“酸碱中和反应”时,老师给大家变了一个魔术一使“水”变色的杯子。操作过程及现象如图所示。
老师揭秘:“空”杯子底部事先涂抹了某种无色液体,无色的“水”是事先用两种无色溶液混合而成。请回答下列问题:
(1)“空”杯内涂抹的物质可能是_____________溶液。
(2)此过程中发生反应的化学方程式可能是_________________________________。
(3)最终溶液为无色,能否说明该溶液一定呈中性?_________(选填“能”或“不能”),理由是____________________________________________________。
13.金属钯是稀有的贵重金属之一,金属钯制成的首饰不仅有迷人的光彩,而且经得住岁月的磨砺。现有银(Ag)、铂(Pt)、钯(Pd)三种金属制成的戒指,某实验小组利用它们来探究三种金属的活动性。
(1)把钯戒指放入稀硫酸溶液中,戒指完好无损,可推测钯在金属活动性顺序表中位于铁之_____(填“前”或“后”)。
(2)如果将钯粉置于盐酸溶液中,边通入氧气边搅拌,钯粉溶解得到二氯化钯(PdCl2)溶液,该反应的化学方程式为 _____________________________。
(3)如上图所示,将银、铂戒指分别放入甲、乙两烧杯中,一段时间后取出,发现只有银戒指表面有明显变化,推测甲烧杯中还可能出现的现象是________________________ ,通过该实验判断,银、铂、钯的金属活动性由强到弱顺序为 __________。
14.纽扣电池是生活中常用的电源,下图是银锌纽扣电池的构造示意图,回答下列问题。
(1)纽扣电池的外壳可以加工得很薄,说明金属具有_____性。
(2)氧化银加热分解可以得到两种单质,其化学反应方程式为_______。
(3)该电池中涉及的铁、锌、银三种金属,它们的金属活动性由强到弱的顺序是_____,为了验证该结论,某同学向质量、外形相同的铁片、锌片、银片中分别加入足量15%的稀盐酸,以下现象中不能成为该结论证据的是________(填序号)。
A 银表面没有气泡生成
B 铁表面最终生成气体的总量比锌多
C 铁表面产生气泡的速率比锌慢
三、实验题
15.证明铁、铜、银金属活动性。请选择一种方案作答,若均作答,按第一个计分。
方案一 方案二
(1)发生反应的化学方程式为______。 (1)发生反应的化学方程式为______。
(2)能否实现目的及原因分别是______。 (2)观察到的现象是______。
16.进行如下实验,研究物质的性质。
(1)D中溶液变为红色,说明硫酸锌溶液显 _____ (填“酸性”或“碱性”)。
(2)溶液变为蓝色的有 _____ (填字母序号,下同)。
(3)作为空白对照实验的是 _____ 。
(4)再向B烧杯中加入适量石灰水,溶液变为紫色,用化学方程式解释其原因 _____ 。
四、计算题
17.生活中常见的铁制品大多为铁合金(成分为铁和碳)材料,而非纯铁,铁合金又因其含碳量不同分为生铁和钢(生铁含碳量为2%~4.3%,钢含碳量为0.03%~2%)。将一块质量为5.8 g的铁合金放入烧杯中,再向烧杯中加入98 g稀硫酸,恰好与铁合金中的铁完全反应,所得氢气的质量为0.2 g,通过计算回答:该铁合金是生铁还是钢?( 结果精确到0.1%)
18.造纸厂会产生含氢氧化钠的废水,需经处理呈中性后排放。为测定此废水中氢氧化钠的质量分数,小明取40 g废水样品加入到锥形瓶中,逐滴加入10%的稀硫酸,至恰好完全反应时,消耗稀硫酸49 g。计算废水中氢氧化钠的质量分数。
19.钢是铁的合金。为测定某钢样中铁的质量分数,取11.4g钢样,向其中加入稀硫酸,产生氢气的质量与加入稀硫酸的质量关系如图所示(不考虑钢样中其它成分与稀硫酸的反应)。
(1)钢_____(填“是”或“不是”)金属材料。
(2)计算此钢样中铁的质量分数。
参考答案:
1.B
2.B
3.B
4.A
5.C
6.D
7.A
8.B
9.B
10.D
11.(1)2个氢原子、1个氧原子
(2)H2O、CO
(3)3:4
(4) H2O+CCO+H2 是
12.(1) NaOH(或氢氧化钠) (2) NaOH +HCl=NaCl+H2O 不能 (3) 酚酞在酸性和中性条件下均显无色
13.(1) 后 2Pd+4HCl+O2=2PdCl2+2H2O (2) 有白色沉淀 (3) 银 钯 铂
14.(1) 延展性 (2) (3) 锌、铁、银 B
15. (1) Fe+H2SO4=FeSO4+H2↑ 不能,没有证明出铜和银的金属活动性 (2) Fe+CuSO4=FeSO4+Cu (3) 第一支试管中铁丝表面附着一层紫红色的固体,蓝色溶液逐渐变浅,第二支试管中无明显变化
16. (1) 酸性 (2)CE A (3) Ca(OH)2+2HCl=CaCl2+H2O
17.解:设铁合金中参加反应的铁的质量为x。
x=5.6 g
该铁合金中的含碳量=
因为2%<3.4%<4.3%,故该铁合金是生铁。
答:该铁合金是生铁。
18.10%
19.(1)是(2)98%.
一、单选题
1.现有X、Y、Z三种金属,把X和Y分别放入稀硫酸中,仅X溶解并产生氢气;如果把Y和Z分别放入硝酸银溶液中,过一会儿,在Y表面有银析出,而Z没有变化。根据以上事实,对X、Y、Z三种金属活动性顺序判断正确的是
A.X >Y>(H)>Z B.X>(H)>Y>Z C.Y>(H)>X>Z D.Y>X> (H)>Z
2.下列四个图象能正确的反映对应的实验操作的是( )
A.向一定质量的饱和石灰水中不断加入生石灰
B.向等质量的锌、铁中滴加足量的且等质量分数的稀盐酸
C.向一定质量的氧化铜中通入一氧化碳气体并持续高温
D.向一定质量的氢氧化钾和硝酸钡的混合溶液中滴加稀硫酸
3.现有5种物质:①浓盐酸②烧碱③食盐④浓硫酸⑤铁把它们长期露置在空气中,其中发生化学变化且质量增加的是( )
A.①② B.②⑤ C.③④ D.③⑤
4.现有 X、Y、Z 三种金属,如果把 X、Y 和 Z 分别放入稀硫酸中,X 和 Z 溶解并产生气体,Y 无变化;如果把 X 放入 Z 的化合物溶液中,过一会儿,在 X 的表面有Z 析出。根据以上实验事实,判断 X、Y 和 Z 的金属活动性顺序是
A.X > Z > Y B.Y > Z > X C.X > Y > Z D.Z > X > Y
5.归纳、推理是学习化学的重要方法。下列说法不正确的是
A.不同种元素可以组成不同的物质,同一种元素也可以组成不同的物质
B.不同种元素最本质的区别是质子数不同
C.酸溶液可使紫色的石蕊溶液变红,能使紫色石蕊溶液变红的溶液是酸溶液
D.生铁和钢的性能不同,是因为它们的含碳量不同
6.有关中和反应的说法一定正确的是( )
A.反应物均须溶于水
B.有沉淀生成
C.有气体生成
D.有盐生成
7.通过学习化学,我们学会了从化学的视角认识水,下列对水的认识错误的是
A.水由氢气和氧气组成
B.冰中的水分子也在不断运动
C.硬水中含有较多可溶性钙、镁化合物
D.水可与生石灰发生化学反应
8.把一枚无锈铁钉放在硫酸铜溶液中,一段时间后,可出现的是
A.溶液蓝色变浅直至无色 B.铁钉表面析出红色物质
C.产生大量气泡 D.溶液质量增加
9.按如图所示装置,玻璃棒末端固定一团喷有酚酞溶液的脱脂棉Y。先加入物质X,再塞上带玻璃棒的橡胶塞。片刻后,能观察到喷有酚酞溶液的脱脂棉Y变红,则物质X可能是
A.浓盐酸 B.浓氨水
C.浓醋酸 D.浓氢氧化钠溶液
10.下图是常见的几个实验操作,其中正确的是
A.加热液体药品 B.放置盛氢气的集气瓶
C.稀释浓硫酸 D.试管的洗涤
二、填空题
11.在高温条件下,甲、乙两种物质可以发生化学反应生成丙和丁。反应前后分子种类变化的微观示意图如下所示。
(1)一个甲分子由___________构成
(2)四种物质中,属于氧化物的是___________(填化学式)
(3)丙分子中两种原子的质量比是___________
(4)写出该反应的化学方程式___________,该反应___________(填“是”或“不是”)置换反应。
12.在学习“酸碱中和反应”时,老师给大家变了一个魔术一使“水”变色的杯子。操作过程及现象如图所示。
老师揭秘:“空”杯子底部事先涂抹了某种无色液体,无色的“水”是事先用两种无色溶液混合而成。请回答下列问题:
(1)“空”杯内涂抹的物质可能是_____________溶液。
(2)此过程中发生反应的化学方程式可能是_________________________________。
(3)最终溶液为无色,能否说明该溶液一定呈中性?_________(选填“能”或“不能”),理由是____________________________________________________。
13.金属钯是稀有的贵重金属之一,金属钯制成的首饰不仅有迷人的光彩,而且经得住岁月的磨砺。现有银(Ag)、铂(Pt)、钯(Pd)三种金属制成的戒指,某实验小组利用它们来探究三种金属的活动性。
(1)把钯戒指放入稀硫酸溶液中,戒指完好无损,可推测钯在金属活动性顺序表中位于铁之_____(填“前”或“后”)。
(2)如果将钯粉置于盐酸溶液中,边通入氧气边搅拌,钯粉溶解得到二氯化钯(PdCl2)溶液,该反应的化学方程式为 _____________________________。
(3)如上图所示,将银、铂戒指分别放入甲、乙两烧杯中,一段时间后取出,发现只有银戒指表面有明显变化,推测甲烧杯中还可能出现的现象是________________________ ,通过该实验判断,银、铂、钯的金属活动性由强到弱顺序为 __________。
14.纽扣电池是生活中常用的电源,下图是银锌纽扣电池的构造示意图,回答下列问题。
(1)纽扣电池的外壳可以加工得很薄,说明金属具有_____性。
(2)氧化银加热分解可以得到两种单质,其化学反应方程式为_______。
(3)该电池中涉及的铁、锌、银三种金属,它们的金属活动性由强到弱的顺序是_____,为了验证该结论,某同学向质量、外形相同的铁片、锌片、银片中分别加入足量15%的稀盐酸,以下现象中不能成为该结论证据的是________(填序号)。
A 银表面没有气泡生成
B 铁表面最终生成气体的总量比锌多
C 铁表面产生气泡的速率比锌慢
三、实验题
15.证明铁、铜、银金属活动性。请选择一种方案作答,若均作答,按第一个计分。
方案一 方案二
(1)发生反应的化学方程式为______。 (1)发生反应的化学方程式为______。
(2)能否实现目的及原因分别是______。 (2)观察到的现象是______。
16.进行如下实验,研究物质的性质。
(1)D中溶液变为红色,说明硫酸锌溶液显 _____ (填“酸性”或“碱性”)。
(2)溶液变为蓝色的有 _____ (填字母序号,下同)。
(3)作为空白对照实验的是 _____ 。
(4)再向B烧杯中加入适量石灰水,溶液变为紫色,用化学方程式解释其原因 _____ 。
四、计算题
17.生活中常见的铁制品大多为铁合金(成分为铁和碳)材料,而非纯铁,铁合金又因其含碳量不同分为生铁和钢(生铁含碳量为2%~4.3%,钢含碳量为0.03%~2%)。将一块质量为5.8 g的铁合金放入烧杯中,再向烧杯中加入98 g稀硫酸,恰好与铁合金中的铁完全反应,所得氢气的质量为0.2 g,通过计算回答:该铁合金是生铁还是钢?( 结果精确到0.1%)
18.造纸厂会产生含氢氧化钠的废水,需经处理呈中性后排放。为测定此废水中氢氧化钠的质量分数,小明取40 g废水样品加入到锥形瓶中,逐滴加入10%的稀硫酸,至恰好完全反应时,消耗稀硫酸49 g。计算废水中氢氧化钠的质量分数。
19.钢是铁的合金。为测定某钢样中铁的质量分数,取11.4g钢样,向其中加入稀硫酸,产生氢气的质量与加入稀硫酸的质量关系如图所示(不考虑钢样中其它成分与稀硫酸的反应)。
(1)钢_____(填“是”或“不是”)金属材料。
(2)计算此钢样中铁的质量分数。
参考答案:
1.B
2.B
3.B
4.A
5.C
6.D
7.A
8.B
9.B
10.D
11.(1)2个氢原子、1个氧原子
(2)H2O、CO
(3)3:4
(4) H2O+CCO+H2 是
12.(1) NaOH(或氢氧化钠) (2) NaOH +HCl=NaCl+H2O 不能 (3) 酚酞在酸性和中性条件下均显无色
13.(1) 后 2Pd+4HCl+O2=2PdCl2+2H2O (2) 有白色沉淀 (3) 银 钯 铂
14.(1) 延展性 (2) (3) 锌、铁、银 B
15. (1) Fe+H2SO4=FeSO4+H2↑ 不能,没有证明出铜和银的金属活动性 (2) Fe+CuSO4=FeSO4+Cu (3) 第一支试管中铁丝表面附着一层紫红色的固体,蓝色溶液逐渐变浅,第二支试管中无明显变化
16. (1) 酸性 (2)CE A (3) Ca(OH)2+2HCl=CaCl2+H2O
17.解:设铁合金中参加反应的铁的质量为x。
x=5.6 g
该铁合金中的含碳量=
因为2%<3.4%<4.3%,故该铁合金是生铁。
答:该铁合金是生铁。
18.10%
19.(1)是(2)98%.
