沪教版化学九年级下册第六章溶解现象复习课件(共46张PPT)
文档属性
| 名称 | 沪教版化学九年级下册第六章溶解现象复习课件(共46张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 700.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-18 08:09:35 | ||
图片预览











文档简介
(共46张PPT)
第六章 溶解现象
复习课件
0
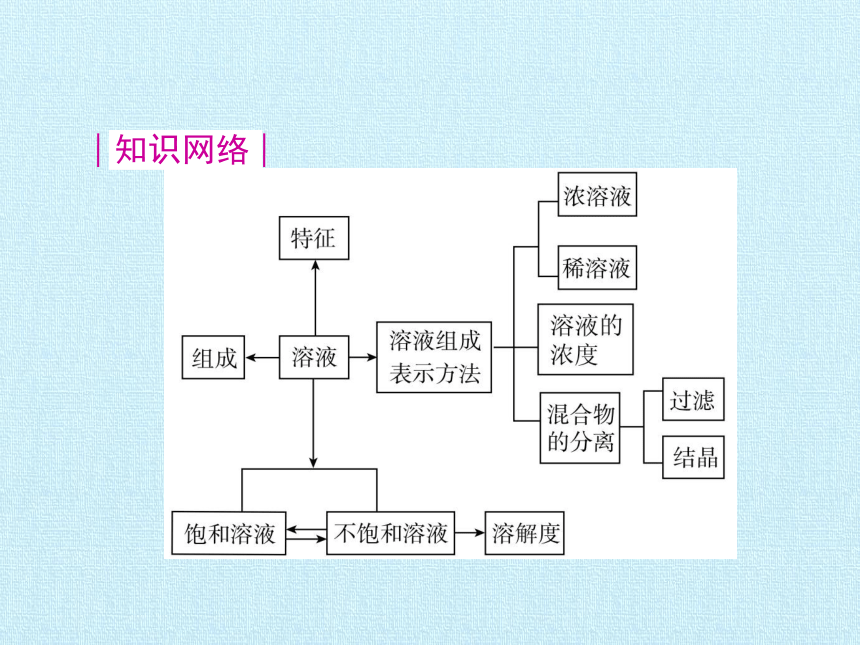
知识网络
考点聚焦
经典真题
知识网络
0
考点1 溶液的形成
1.溶液
(1)定义:溶液是_______________分散到___________里,形成_____的、_____的_______。
(2)特征:具有_____性、_____性,属于_____物。
溶质:______的物质,可以是__________________。
溶剂:_______________的物质。___是最常用的溶剂。
一种或几种物质
另一种物质
均一
稳定
混合物
均一
稳定
混合
被溶解
固体、液体或气体
能溶解其他物质
水
(3)组成
考点聚焦
2.乳浊液与乳化现象
(1)乳浊液:_______分散到液体里形成的_______;其特征是:_______、_______。
(2)乳化作用:洗涤剂使植物油在水中分散成无数细小的液滴,形成_______的现象;其特点是能_____存在。
小液滴
混合物
不均一
不稳定
乳浊液
稳定
0
3.溶解时的吸热或放热现象
(1)溶于水时,溶液温度明显升高的物质有:_______、__________等。
(2)溶于水时,溶液温度明显降低的物质有:_______等。
(3)溶于水时,溶液温度无明显变化的物质有:_______等。
浓硫酸
氢氧
化钠
硝酸铵
氯化钠
0
【思考感悟】1.均一、稳定、无色透明的液体一定是溶液吗?
提示:不一定。均一、稳定的液体可能是纯净物,如水;而溶液属于混合物;溶液不一定是无色的,如硫酸铜溶液就是蓝色溶液。
2.用汽油清洗衣服上的油污和用洗涤剂清洗油污的原理相同吗?为什么?
提示:不相同。汽油清洗油污属于溶解现象,洗涤剂清洗油污属于乳化现象。
0
考点2 溶解度
1.饱和溶液和不饱和溶液
(1)判断依据。
(2)二者转化的条件和方法。
增加
蒸发溶剂
降温
增加
升温
0
2.固体物质的溶解度
(1)“四要素”。
①条件:_________。
②标准:100g_____。
③状态:达到_________。
④实质:_____的质量,单位一般是___。
一定温度
溶剂
饱和状态
溶质
克
0
(2)影响因素。
①内因:___________的性质。②外因:_____
a.大多数物质的溶解度随温度升高而_________,如_____。
b.少数物质的溶解度受温度的影响_____,如_____。
c.极少数物质的溶解度随温度升高而_____,如________。
溶质和溶剂
温度
显著增大
KNO3
不大
NaCl
减小
Ca(OH)2
0
3.气体的溶解度
(1)定义:在压强为________、一定_____时,气体溶解在
______水中达到_________时的气体体积。
(2)影响因素。
①内因:___________的性质。
②外因:温度和压强。随温度的升高而_____,随压强的增大
而_____。
101kPa
温度
1体积
饱和状态
溶质和溶剂
减小
增大
0
【思考感悟】通过降低温度的方法可以使任意不饱和溶液转化为饱和溶液吗?
提示:不是。只有溶解度随温度降低而减小的物质才可以通过降温的方法将不饱和溶液转化为饱和溶液。
0
考点3 溶质的质量分数
1.溶质的质量分数
(1)概念。
溶液中溶质的质量分数是_________与_________之比。
(2)公式。
①
②溶液质量=_____质量+_____质量
=溶液体积×_________
=溶质质量÷_______________
③溶质质量=溶液质量×_______________
溶质质量
溶液质量
溶质
溶剂
溶液密度
溶质的质量分数
溶质的质量分数
0
2.配制一定质量分数的溶液
(1)实验用品:_________、_____、_____、_______、药匙等。
(2)实验步骤。
①_____、②___________、③_____、④装瓶贮存。
托盘天平
量筒
烧杯
玻璃棒
计算
称量或量取
溶解
0
【甄别·判断】
1.一种溶剂只能溶解一种溶质。( )
提示:一种溶剂可以溶解一种溶质,也可以同时溶解多种溶质,如海水中含有多种溶质。
2.稀溶液一定是不饱和溶液,浓溶液一定是饱和溶液。( )
提示:稀溶液不一定是不饱和溶液,如石灰水;浓溶液不一定是饱和溶液,如90%的浓硫酸等。
×
×
0
3.10%的食盐溶液中的“10%”指的是将10g食盐溶解于100g
水中所得的溶液。( )
提示:溶质的质量分数是指溶质质量与溶液质量之比,因此,
10%的含义是指每100g食盐溶液中含有10g食盐,90g水。
4.饱和溶液变为不饱和溶液溶质质量分数一定变小。( )
提示:若通过升温(溶剂不蒸发、溶质质量不变)使饱和溶液变为不饱和溶液,则溶质质量分数不变。
×
×
0
考点1 溶液的形成
【高频考点】溶液的形成;溶质、溶剂的判断;溶液的性质;溶解过程中的温度变化及应用;乳化作用及应用等。
1.(泰安中考)溶液在日常生活中应用广泛。下列对溶液的有关说法正确的是( )
A.溶液都是无色、透明的液体。 B.溶液中只能有一种溶质。
C.溶液中各部分密度不同。 D.溶液中各部分性质相同。
经典真题
0
【解析】选D。本题考查学生对溶液的理解能力。溶液指的是一种或几种物质分散到另一种物质里形成的均一、稳定的混合物;溶液具有均一性和稳定性。因此,A中溶液不一定是无色的,例如硫酸铜溶液是蓝色的;B中溶质可以有多种;C中与溶液的均一性相违背;D中与溶液的均一性相符合。
0
2.(泰州中考)下列洗涤方法中,利用乳化原理的是( )
A.用食醋除水垢 B.用稀盐酸除铁锈
C.用汽油清洗油渍 D.用洗洁精清洗油污
【解析】选D。本题考查乳化原理。解答本题的关键应明确乳化作用是洗涤剂将油污分解成小液滴分散到水中的过程。用食醋除水垢、用稀盐酸除铁锈都是利用物质间发生化学反应生成可溶性的物质,用汽油清洗油渍,是利用油渍能溶解于汽油中;只有用洗洁精清洗油污是利用乳化原理。
0
3.(眉山中考)某同学用25℃的水溶解一定量的NaCl,充分搅拌后发现杯底还有部分NaCl晶体没有溶解。然后该同学又用酒精灯加热至60℃,固体全部溶解。那么在加热前后,以下各量没有发生改变的是( )
A.NaCl的溶解度 B.溶质的质量
C.溶剂的质量 D.溶质的质量分数
0
【解析】选C。本题考查不同温度下同一物质的饱和溶液,解题关键是抓住不同温度下同一物质的溶解度不同。加热前后,氯化钠的溶解度不同,A错误;溶液升温后氯化钠全部溶解,溶液中的溶质的质量变大,B错误;溶液由25℃升温至60℃溶剂无变化,C正确;溶液中的溶质的质量变大,溶剂质量不变,所以溶质的质量分数变大,D错误。
0
考点2 溶解度及溶解度曲线
【高频考点】饱和溶液、不饱和溶液的概念、相互转化方法;溶解度的含义;溶解性判断、溶解度曲线的意义、应用等。
4.(烟台中考)某温度时,向一定量的饱和氢氧化钙溶液中加入少量生石灰,再恢复到原温,下列各相关量的变化图像正确的是( )
0
【解析】选C。本题考查用图像表示变化的能力,解答本题需明确两点:(1)氢氧化钙溶解度与温度的关系;(2)生石灰放入溶液后的变化情况。生石灰能与水反应生成氢氧化钙,溶剂质量会减少,A错误;反应过程中放热使溶液的温度升高,致使氢氧化钙的溶解度降低,B错误;因为饱和溶液中溶剂的量减少,溶质的质量随之减少,温度升高溶解度降低,使得溶质的质量也随之减少,温度恢复后,溶解度增大,溶质的质量又会增大,但小于开始时的质量,C正确;温度不变,溶解度不变,饱和溶液的溶质质量分数也相等,D错误。
0
5.(乐山中考)如图是X、Y、Z三种固体的溶解度曲线,下列有关说法中不正确的是( )
A.Z的溶解度随温度的升高而降低。
B.t1℃时,Y的溶解度大于Z的溶解度。
C.t3℃时,X的饱和溶液中溶质的质量分数为40%。
D.t2℃时,X的溶解度和Y的溶解度相等。
0
【解析】选C。本题通过分析溶解度曲线,考查溶解度的相关知识。关键是能从曲线图中得到正确的信息。观察图示知,X、Y的溶解度随温度的升高而增大,Z的溶解度随温度的升高而变小;t2℃时,X和Y的溶解度曲线相交,表明X的溶解度和Y的溶解度相等;t1℃时,X、Y、Z三种物质中,溶解度最大的是Y,其次是Z,最小的是X,Y的溶解度大于Z的溶解度,故A、B、D项说法皆正确;t3℃时,X的溶解度为100g,其饱和溶液中溶质的质量分数为100g/(100g+100g)×100%=50%,故C错。
0
6.(陕西中考)20℃时,将等质量的甲、乙两种固体物质,分别加入到盛有100g水的烧杯中,充分搅拌后现象如图1,加热到50℃时现象如图2,甲、乙两种物质的溶解度曲线如图3。请结合图示回答下列问题:
0
(1)图1中一定为饱和溶液的是______。
(2)图2中甲、乙两溶液中溶质质量分数的大小关系为______。
(3)图3中表示乙的溶解度曲线是_______;P点表示的含义是
___________________________________________________。
0
【解析】本题以溶解度为主题,结合图示主要考查饱和溶液的判断及溶解度曲线的认识。第(1)题因为图1中甲溶液中有未溶解的固体,所以甲一定是饱和溶液。第(2)题因为图2中是将等质量的甲、乙两种固体物质溶解到了100g水中,所以溶质的质量分数相等。由图1知20℃时,乙的溶解度大于甲的溶解度,结合图3知,N是乙的溶解度曲线;P点是两条曲线的交点,表示在30℃时,M、N两种物质的溶解度相等。
答案:(1)甲(2)相等(3)N30℃时,甲乙两种固体物质的溶解度相等。
0
考点3 溶液的配制
【高频考点】配制步骤;仪器选取;操作正误判断;误差分析等。
7.(泸州中考)欲配制100g质量分数为10%的氯化钠溶液,必须要的仪器组合是( )
①托盘天平②烧杯③玻璃棒④100mL量筒
A.①② B.①②③
C.①②③④ D.①②④
0
【解析】选C。本题考查配制一定质量分数的氯化钠溶液的步骤。需要明确一点,配制一定溶质质量分数的溶液的步骤是计算、称量、溶解、储存。称量时用到的仪器有:托盘天平、药匙、量筒;溶解时用到的仪器有:烧杯、玻璃棒。
0
8.(邵阳中考)某同学按如图所示的步骤配制好80g 6%的氯化钠溶液后,将烧杯中的溶液装入试剂瓶时,不慎洒出一部分,则对试剂瓶中溶液的判断正确的是( )
A.溶质的质量不变 B.溶剂的质量不变
C.溶液的质量不变 D.溶质的质量分数不变
0
【解析】选D。将烧杯中的溶液装入试剂瓶时,不慎洒出一部分,说明溶液已经配好,只是减少了一部分溶液。那么溶质和溶剂一定减少,但是溶液的溶质质量分数没有改变。故选D。
0
9.(滨州中考)实验室需要配制15%的氯化钠溶液50g。
(1)计算:需氯化钠的质量为_______。
(2)某同学按下图所示步骤依次操作:
0
其中操作错误的步骤是______(填字母序号);B中仪器的名称为_______;
E中玻璃棒的作用是_______。
(3)若上图A中砝码的质量为5g,游码的读数为2.5g,则小明称得的氯化钠质量实际为_______。
0
【解析】(1)本题主要考查配制一定溶质质量分数的溶液的步骤及误差分析。配制该溶液所需氯化钠的质量为50g×15%=7.5g;(2)使用托盘天平称量药品时应“左物右码”;量筒读数时视线应与凹液面的最低处保持水平。在此实验中玻璃棒的作用为搅拌,其目的为加速溶解;(3)托盘天平中左盘的质量=右盘的质量+游码的质量,因为称量时药品与砝码放反了,所以药品的实际质量为5g-2.5g=2.5g。
答案:(1)7.5g(2)A、B 量筒 加速溶解(3)2.5g
0
【中考链接】
1.中考地位及考查角度
溶液的配制是中考的命题常考点也是重点,重点考查配制溶液所需要的溶质、溶剂或溶液的量的计算、操作步骤、操作的正误判断、仪器的选取及误差原因分析等。
0
2.失分点及应对策略
仪器的选取、操作正误判断及误差判断和原因分析是学生的难点和失分点,解答此类题目时要明确:(1)明确所配制的溶液是固体和液体还是液体和液体,从而确定步骤和仪器;(2)明确造成所得溶液溶质质量分数偏大或偏小的原因,然后对照题目信息作出判断;(3)特别注意:量筒只能用于定量取用液体,不能用于配制溶液;托盘天平一般用于称取固体药品的质量,不用于称取液体的质量;搅拌时用玻璃棒而不能用温度计。
0
考点4 溶质质量分数及其计算
【高频考点】溶质质量、溶液质量和溶质质量分数之间的换算;溶液浓缩或稀释问题的计算;涉及溶液体积、密度的计算等
0
10.(肇庆中考)一种抗生素为粉末状固体,每瓶含0.5g,注射时应配成质量分数为20%的溶液,则使用时每瓶至少需加入蒸馏水( )
A.1.5mL B.2mL C.3mL D.4mL
【解析】选B。本题考查有关质量分数的计算。溶液的质量=溶质的质量÷溶质的质量分数=0.5g÷20%=2.5g;溶剂水的质量=溶液的质量-溶质的质量=2.5g-0.5g=2g;水的体积=水的质量÷水的密度=2g÷1g·mL-1=2mL。
0
11.(眉山中考)汽车、电动车一般使用铅酸蓄电池。某铅酸蓄电池使用的酸溶液是质量分数为20%的稀硫酸。请回答下列有关问题:
(1)若用100g质量分数为98%的浓硫酸(密度为1.84g·cm-3)配制该稀硫酸时,需要蒸馏水(密度为1g·cm-3)的体积为______mL(精确到0.1);
0
(2)该实验的主要步骤有计算、量取、稀释配制、装瓶并贴标签。请填写如图标签;
(3)用量筒量取浓硫酸时俯视读数,所配溶液溶质质量分数______20%(填“大于”“小于”或“等于”)。
0
【解析】本题考查溶液的配制和溶质质量分数的相关计算,解题的关键是依据溶液稀释前后溶液中溶质的质量不变进行计算及量筒俯视读数进行误差分析。(1)解:设需要蒸馏水的体积为xmL,100×98%=(100+1×x)×20%,x=390.0。(2)溶液的标签应标明溶液的名称和溶质的质量分数。(3)用量筒量取浓硫酸时俯视读数,实际量取的浓硫酸的体积偏小,因此所配溶液溶质质量分数小于20%。
0
答案:(1)390.0
(2)
(3)小于
0
12.(义乌中考)汽车蓄电池中稀硫酸的溶质质量分数为28%,密度为1.2克/厘米3。若要在实验室用溶质质量分数为98%的浓硫酸配制这种稀硫酸630克。求:
(1)630克稀硫酸的体积是多少毫升?
(2)需要浓硫酸多少克?
【解析】本题主要考查溶质质量分数的相关计算,解题关键是明确浓溶液配制稀溶液的过程中溶质的质量没有发生变化。
(1)根据V=m/ρ可以直接求出体积。
(2)根据稀释前后溶液中溶质的质量不变来求。
0
答案:解:(1)
(2)设需要浓硫酸为m则28%×630克=98%×m
m=180克
0
谢 谢
第六章 溶解现象
复习课件
0
知识网络
考点聚焦
经典真题
知识网络
0
考点1 溶液的形成
1.溶液
(1)定义:溶液是_______________分散到___________里,形成_____的、_____的_______。
(2)特征:具有_____性、_____性,属于_____物。
溶质:______的物质,可以是__________________。
溶剂:_______________的物质。___是最常用的溶剂。
一种或几种物质
另一种物质
均一
稳定
混合物
均一
稳定
混合
被溶解
固体、液体或气体
能溶解其他物质
水
(3)组成
考点聚焦
2.乳浊液与乳化现象
(1)乳浊液:_______分散到液体里形成的_______;其特征是:_______、_______。
(2)乳化作用:洗涤剂使植物油在水中分散成无数细小的液滴,形成_______的现象;其特点是能_____存在。
小液滴
混合物
不均一
不稳定
乳浊液
稳定
0
3.溶解时的吸热或放热现象
(1)溶于水时,溶液温度明显升高的物质有:_______、__________等。
(2)溶于水时,溶液温度明显降低的物质有:_______等。
(3)溶于水时,溶液温度无明显变化的物质有:_______等。
浓硫酸
氢氧
化钠
硝酸铵
氯化钠
0
【思考感悟】1.均一、稳定、无色透明的液体一定是溶液吗?
提示:不一定。均一、稳定的液体可能是纯净物,如水;而溶液属于混合物;溶液不一定是无色的,如硫酸铜溶液就是蓝色溶液。
2.用汽油清洗衣服上的油污和用洗涤剂清洗油污的原理相同吗?为什么?
提示:不相同。汽油清洗油污属于溶解现象,洗涤剂清洗油污属于乳化现象。
0
考点2 溶解度
1.饱和溶液和不饱和溶液
(1)判断依据。
(2)二者转化的条件和方法。
增加
蒸发溶剂
降温
增加
升温
0
2.固体物质的溶解度
(1)“四要素”。
①条件:_________。
②标准:100g_____。
③状态:达到_________。
④实质:_____的质量,单位一般是___。
一定温度
溶剂
饱和状态
溶质
克
0
(2)影响因素。
①内因:___________的性质。②外因:_____
a.大多数物质的溶解度随温度升高而_________,如_____。
b.少数物质的溶解度受温度的影响_____,如_____。
c.极少数物质的溶解度随温度升高而_____,如________。
溶质和溶剂
温度
显著增大
KNO3
不大
NaCl
减小
Ca(OH)2
0
3.气体的溶解度
(1)定义:在压强为________、一定_____时,气体溶解在
______水中达到_________时的气体体积。
(2)影响因素。
①内因:___________的性质。
②外因:温度和压强。随温度的升高而_____,随压强的增大
而_____。
101kPa
温度
1体积
饱和状态
溶质和溶剂
减小
增大
0
【思考感悟】通过降低温度的方法可以使任意不饱和溶液转化为饱和溶液吗?
提示:不是。只有溶解度随温度降低而减小的物质才可以通过降温的方法将不饱和溶液转化为饱和溶液。
0
考点3 溶质的质量分数
1.溶质的质量分数
(1)概念。
溶液中溶质的质量分数是_________与_________之比。
(2)公式。
①
②溶液质量=_____质量+_____质量
=溶液体积×_________
=溶质质量÷_______________
③溶质质量=溶液质量×_______________
溶质质量
溶液质量
溶质
溶剂
溶液密度
溶质的质量分数
溶质的质量分数
0
2.配制一定质量分数的溶液
(1)实验用品:_________、_____、_____、_______、药匙等。
(2)实验步骤。
①_____、②___________、③_____、④装瓶贮存。
托盘天平
量筒
烧杯
玻璃棒
计算
称量或量取
溶解
0
【甄别·判断】
1.一种溶剂只能溶解一种溶质。( )
提示:一种溶剂可以溶解一种溶质,也可以同时溶解多种溶质,如海水中含有多种溶质。
2.稀溶液一定是不饱和溶液,浓溶液一定是饱和溶液。( )
提示:稀溶液不一定是不饱和溶液,如石灰水;浓溶液不一定是饱和溶液,如90%的浓硫酸等。
×
×
0
3.10%的食盐溶液中的“10%”指的是将10g食盐溶解于100g
水中所得的溶液。( )
提示:溶质的质量分数是指溶质质量与溶液质量之比,因此,
10%的含义是指每100g食盐溶液中含有10g食盐,90g水。
4.饱和溶液变为不饱和溶液溶质质量分数一定变小。( )
提示:若通过升温(溶剂不蒸发、溶质质量不变)使饱和溶液变为不饱和溶液,则溶质质量分数不变。
×
×
0
考点1 溶液的形成
【高频考点】溶液的形成;溶质、溶剂的判断;溶液的性质;溶解过程中的温度变化及应用;乳化作用及应用等。
1.(泰安中考)溶液在日常生活中应用广泛。下列对溶液的有关说法正确的是( )
A.溶液都是无色、透明的液体。 B.溶液中只能有一种溶质。
C.溶液中各部分密度不同。 D.溶液中各部分性质相同。
经典真题
0
【解析】选D。本题考查学生对溶液的理解能力。溶液指的是一种或几种物质分散到另一种物质里形成的均一、稳定的混合物;溶液具有均一性和稳定性。因此,A中溶液不一定是无色的,例如硫酸铜溶液是蓝色的;B中溶质可以有多种;C中与溶液的均一性相违背;D中与溶液的均一性相符合。
0
2.(泰州中考)下列洗涤方法中,利用乳化原理的是( )
A.用食醋除水垢 B.用稀盐酸除铁锈
C.用汽油清洗油渍 D.用洗洁精清洗油污
【解析】选D。本题考查乳化原理。解答本题的关键应明确乳化作用是洗涤剂将油污分解成小液滴分散到水中的过程。用食醋除水垢、用稀盐酸除铁锈都是利用物质间发生化学反应生成可溶性的物质,用汽油清洗油渍,是利用油渍能溶解于汽油中;只有用洗洁精清洗油污是利用乳化原理。
0
3.(眉山中考)某同学用25℃的水溶解一定量的NaCl,充分搅拌后发现杯底还有部分NaCl晶体没有溶解。然后该同学又用酒精灯加热至60℃,固体全部溶解。那么在加热前后,以下各量没有发生改变的是( )
A.NaCl的溶解度 B.溶质的质量
C.溶剂的质量 D.溶质的质量分数
0
【解析】选C。本题考查不同温度下同一物质的饱和溶液,解题关键是抓住不同温度下同一物质的溶解度不同。加热前后,氯化钠的溶解度不同,A错误;溶液升温后氯化钠全部溶解,溶液中的溶质的质量变大,B错误;溶液由25℃升温至60℃溶剂无变化,C正确;溶液中的溶质的质量变大,溶剂质量不变,所以溶质的质量分数变大,D错误。
0
考点2 溶解度及溶解度曲线
【高频考点】饱和溶液、不饱和溶液的概念、相互转化方法;溶解度的含义;溶解性判断、溶解度曲线的意义、应用等。
4.(烟台中考)某温度时,向一定量的饱和氢氧化钙溶液中加入少量生石灰,再恢复到原温,下列各相关量的变化图像正确的是( )
0
【解析】选C。本题考查用图像表示变化的能力,解答本题需明确两点:(1)氢氧化钙溶解度与温度的关系;(2)生石灰放入溶液后的变化情况。生石灰能与水反应生成氢氧化钙,溶剂质量会减少,A错误;反应过程中放热使溶液的温度升高,致使氢氧化钙的溶解度降低,B错误;因为饱和溶液中溶剂的量减少,溶质的质量随之减少,温度升高溶解度降低,使得溶质的质量也随之减少,温度恢复后,溶解度增大,溶质的质量又会增大,但小于开始时的质量,C正确;温度不变,溶解度不变,饱和溶液的溶质质量分数也相等,D错误。
0
5.(乐山中考)如图是X、Y、Z三种固体的溶解度曲线,下列有关说法中不正确的是( )
A.Z的溶解度随温度的升高而降低。
B.t1℃时,Y的溶解度大于Z的溶解度。
C.t3℃时,X的饱和溶液中溶质的质量分数为40%。
D.t2℃时,X的溶解度和Y的溶解度相等。
0
【解析】选C。本题通过分析溶解度曲线,考查溶解度的相关知识。关键是能从曲线图中得到正确的信息。观察图示知,X、Y的溶解度随温度的升高而增大,Z的溶解度随温度的升高而变小;t2℃时,X和Y的溶解度曲线相交,表明X的溶解度和Y的溶解度相等;t1℃时,X、Y、Z三种物质中,溶解度最大的是Y,其次是Z,最小的是X,Y的溶解度大于Z的溶解度,故A、B、D项说法皆正确;t3℃时,X的溶解度为100g,其饱和溶液中溶质的质量分数为100g/(100g+100g)×100%=50%,故C错。
0
6.(陕西中考)20℃时,将等质量的甲、乙两种固体物质,分别加入到盛有100g水的烧杯中,充分搅拌后现象如图1,加热到50℃时现象如图2,甲、乙两种物质的溶解度曲线如图3。请结合图示回答下列问题:
0
(1)图1中一定为饱和溶液的是______。
(2)图2中甲、乙两溶液中溶质质量分数的大小关系为______。
(3)图3中表示乙的溶解度曲线是_______;P点表示的含义是
___________________________________________________。
0
【解析】本题以溶解度为主题,结合图示主要考查饱和溶液的判断及溶解度曲线的认识。第(1)题因为图1中甲溶液中有未溶解的固体,所以甲一定是饱和溶液。第(2)题因为图2中是将等质量的甲、乙两种固体物质溶解到了100g水中,所以溶质的质量分数相等。由图1知20℃时,乙的溶解度大于甲的溶解度,结合图3知,N是乙的溶解度曲线;P点是两条曲线的交点,表示在30℃时,M、N两种物质的溶解度相等。
答案:(1)甲(2)相等(3)N30℃时,甲乙两种固体物质的溶解度相等。
0
考点3 溶液的配制
【高频考点】配制步骤;仪器选取;操作正误判断;误差分析等。
7.(泸州中考)欲配制100g质量分数为10%的氯化钠溶液,必须要的仪器组合是( )
①托盘天平②烧杯③玻璃棒④100mL量筒
A.①② B.①②③
C.①②③④ D.①②④
0
【解析】选C。本题考查配制一定质量分数的氯化钠溶液的步骤。需要明确一点,配制一定溶质质量分数的溶液的步骤是计算、称量、溶解、储存。称量时用到的仪器有:托盘天平、药匙、量筒;溶解时用到的仪器有:烧杯、玻璃棒。
0
8.(邵阳中考)某同学按如图所示的步骤配制好80g 6%的氯化钠溶液后,将烧杯中的溶液装入试剂瓶时,不慎洒出一部分,则对试剂瓶中溶液的判断正确的是( )
A.溶质的质量不变 B.溶剂的质量不变
C.溶液的质量不变 D.溶质的质量分数不变
0
【解析】选D。将烧杯中的溶液装入试剂瓶时,不慎洒出一部分,说明溶液已经配好,只是减少了一部分溶液。那么溶质和溶剂一定减少,但是溶液的溶质质量分数没有改变。故选D。
0
9.(滨州中考)实验室需要配制15%的氯化钠溶液50g。
(1)计算:需氯化钠的质量为_______。
(2)某同学按下图所示步骤依次操作:
0
其中操作错误的步骤是______(填字母序号);B中仪器的名称为_______;
E中玻璃棒的作用是_______。
(3)若上图A中砝码的质量为5g,游码的读数为2.5g,则小明称得的氯化钠质量实际为_______。
0
【解析】(1)本题主要考查配制一定溶质质量分数的溶液的步骤及误差分析。配制该溶液所需氯化钠的质量为50g×15%=7.5g;(2)使用托盘天平称量药品时应“左物右码”;量筒读数时视线应与凹液面的最低处保持水平。在此实验中玻璃棒的作用为搅拌,其目的为加速溶解;(3)托盘天平中左盘的质量=右盘的质量+游码的质量,因为称量时药品与砝码放反了,所以药品的实际质量为5g-2.5g=2.5g。
答案:(1)7.5g(2)A、B 量筒 加速溶解(3)2.5g
0
【中考链接】
1.中考地位及考查角度
溶液的配制是中考的命题常考点也是重点,重点考查配制溶液所需要的溶质、溶剂或溶液的量的计算、操作步骤、操作的正误判断、仪器的选取及误差原因分析等。
0
2.失分点及应对策略
仪器的选取、操作正误判断及误差判断和原因分析是学生的难点和失分点,解答此类题目时要明确:(1)明确所配制的溶液是固体和液体还是液体和液体,从而确定步骤和仪器;(2)明确造成所得溶液溶质质量分数偏大或偏小的原因,然后对照题目信息作出判断;(3)特别注意:量筒只能用于定量取用液体,不能用于配制溶液;托盘天平一般用于称取固体药品的质量,不用于称取液体的质量;搅拌时用玻璃棒而不能用温度计。
0
考点4 溶质质量分数及其计算
【高频考点】溶质质量、溶液质量和溶质质量分数之间的换算;溶液浓缩或稀释问题的计算;涉及溶液体积、密度的计算等
0
10.(肇庆中考)一种抗生素为粉末状固体,每瓶含0.5g,注射时应配成质量分数为20%的溶液,则使用时每瓶至少需加入蒸馏水( )
A.1.5mL B.2mL C.3mL D.4mL
【解析】选B。本题考查有关质量分数的计算。溶液的质量=溶质的质量÷溶质的质量分数=0.5g÷20%=2.5g;溶剂水的质量=溶液的质量-溶质的质量=2.5g-0.5g=2g;水的体积=水的质量÷水的密度=2g÷1g·mL-1=2mL。
0
11.(眉山中考)汽车、电动车一般使用铅酸蓄电池。某铅酸蓄电池使用的酸溶液是质量分数为20%的稀硫酸。请回答下列有关问题:
(1)若用100g质量分数为98%的浓硫酸(密度为1.84g·cm-3)配制该稀硫酸时,需要蒸馏水(密度为1g·cm-3)的体积为______mL(精确到0.1);
0
(2)该实验的主要步骤有计算、量取、稀释配制、装瓶并贴标签。请填写如图标签;
(3)用量筒量取浓硫酸时俯视读数,所配溶液溶质质量分数______20%(填“大于”“小于”或“等于”)。
0
【解析】本题考查溶液的配制和溶质质量分数的相关计算,解题的关键是依据溶液稀释前后溶液中溶质的质量不变进行计算及量筒俯视读数进行误差分析。(1)解:设需要蒸馏水的体积为xmL,100×98%=(100+1×x)×20%,x=390.0。(2)溶液的标签应标明溶液的名称和溶质的质量分数。(3)用量筒量取浓硫酸时俯视读数,实际量取的浓硫酸的体积偏小,因此所配溶液溶质质量分数小于20%。
0
答案:(1)390.0
(2)
(3)小于
0
12.(义乌中考)汽车蓄电池中稀硫酸的溶质质量分数为28%,密度为1.2克/厘米3。若要在实验室用溶质质量分数为98%的浓硫酸配制这种稀硫酸630克。求:
(1)630克稀硫酸的体积是多少毫升?
(2)需要浓硫酸多少克?
【解析】本题主要考查溶质质量分数的相关计算,解题关键是明确浓溶液配制稀溶液的过程中溶质的质量没有发生变化。
(1)根据V=m/ρ可以直接求出体积。
(2)根据稀释前后溶液中溶质的质量不变来求。
0
答案:解:(1)
(2)设需要浓硫酸为m则28%×630克=98%×m
m=180克
0
谢 谢
