沪教版化学九年级下册第7章应用广泛的酸·碱·盐第3节几种重要的盐课件(共55张PPT)
文档属性
| 名称 | 沪教版化学九年级下册第7章应用广泛的酸·碱·盐第3节几种重要的盐课件(共55张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 5.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-18 17:30:54 | ||
图片预览








文档简介
(共55张PPT)
义务教育教科书(沪教版)九年级下册 第七章 第三节
几种重要的盐
NaCl
CaCO3
Al2(SO4)3
NaHCO3
(NH4)2SO4
它们在组成上的相同之处是什么?
它们都是由金属离子(或铵根离子)和酸根离子组成的。
观察下列物质的化学式及其电离方程式:
NH4Cl === NH4+ + Cl-
Na2CO3 === 2Na+ + CO32-
KNO3 === K+ + NO3-
Na2SO4 === 2Na+ + SO42 -
NaCl === Na+ + Cl-
BaCl2 === Ba2+ + 2Cl-
盐 = 金属离子(或铵根离子) + 酸根离子
一、什么是盐?
盐就是氯化钠,这个说法对吗?
不对,盐是一类化合物的总称,氯化钠是
盐类的一种。
盐类物质一定含有金属元素,这个说法对吗?
不对,盐类物质不一定都含有金属元素,
如(NH4)2SO4。
想一想
1、按溶解性
盐
可溶性盐
不溶性盐
2、按所含的阳离子或阴离子
KCl KNO3 K2SO4 等
盐
钾盐:
镁盐:
硝酸盐:
碳酸盐:
MgCl2 MgSO4 Mg(NO3 )2 等
KNO3 NaNO3 Mg(NO3 )2 等
K2CO3 Na2CO3 MgCO3 等
二、盐的分类:
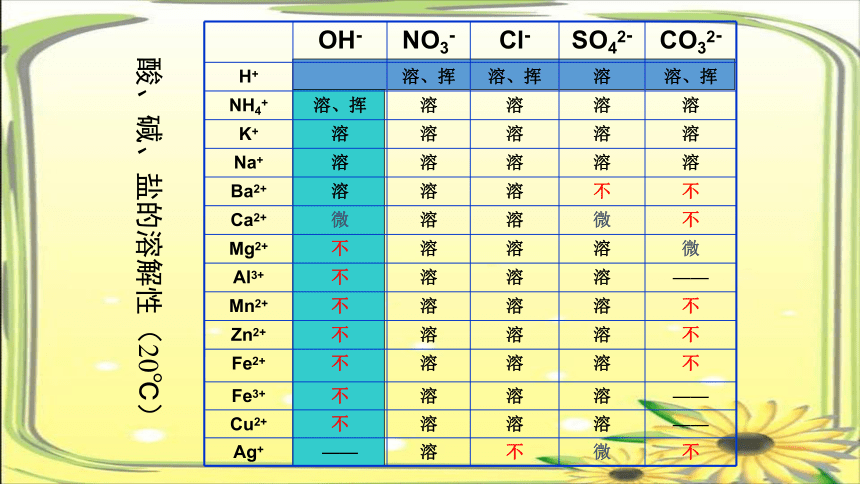
OH- NO3- Cl- SO42- CO32-
H+ 溶、挥 溶、挥 溶 溶、挥
NH4+ 溶、挥 溶 溶 溶 溶
K+ 溶 溶 溶 溶 溶
Na+ 溶 溶 溶 溶 溶
Ba2+ 溶 溶 溶 不 不
Ca2+ 微 溶 溶 微 不
Mg2+ 不 溶 溶 溶 微
Al3+ 不 溶 溶 溶 ——
Mn2+ 不 溶 溶 溶 不
Zn2+ 不 溶 溶 溶 不
Fe2+ 不 溶 溶 溶 不
Fe3+ 不 溶 溶 溶 ——
Cu2+ 不 溶 溶 溶 ——
Ag+ —— 溶 不 微 不
酸、碱、盐的溶解性(20℃)
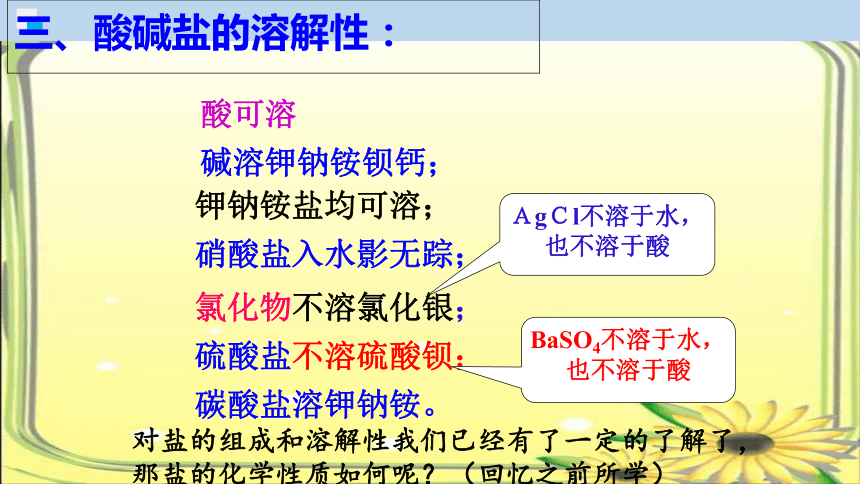
三、酸碱盐的溶解性:
钾钠铵盐均可溶;
硝酸盐入水影无踪;
氯化物不溶氯化银;
硫酸盐不溶硫酸钡;
碳酸盐溶钾钠铵。
AgCl不溶于水,也不溶于酸
BaSO4不溶于水,也不溶于酸
碱溶钾钠铵钡钙;
酸可溶
对盐的组成和溶解性我们已经有了一定的了解了,
那盐的化学性质如何呢?(回忆之前所学)
四、盐的化学性质:
1、盐与酸反应
CaCO3+2HCl = CaCl2+H2O+CO2 ↑
Na2CO3+2HCl = 2NaCl+H2O +CO2↑
HCl+AgNO3=AgCl↓+HNO3
H2SO4+BaCl2=BaSO4↓+2HCl
CuSO4+2NaOH = Cu(OH)2 ↓ +Na2SO4
FeCl3+3NaOH = Fe(OH)3↓+3NaCl
2、盐与碱反应
蓝色沉淀
红褐色沉淀
3、盐与盐反应
AgNO3+NaCl=AgCl↓+NaNO3
Na2SO4+BaCl2=BaSO4↓+2NaCl
Na2CO3+CaCl2=CaCO3↓+2NaCl
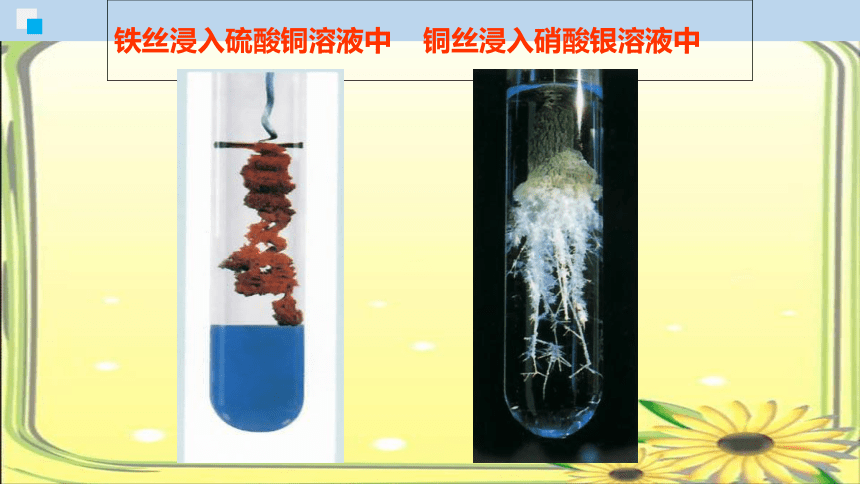
铁丝浸入硫酸铜溶液中 铜丝浸入硝酸银溶液中
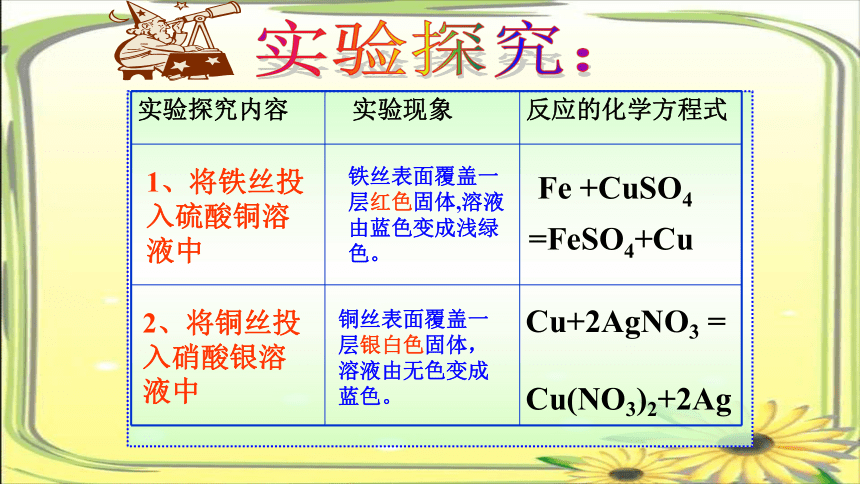
实验探究:
实验探究内容 实验现象 反应的化学方程式
1、将铁丝投 入硫酸铜溶液中
2、将铜丝投 入硝酸银溶液中
铁丝表面覆盖一层红色固体,溶液由蓝色变成浅绿色。
铜丝表面覆盖一层银白色固体,溶液由无色变成蓝色。
Fe +CuSO4
=FeSO4+Cu
Cu+2AgNO3 =
Cu(NO3)2+2Ag
4、盐与金属反应:
Fe +CuSO4 =FeSO4+Cu
Cu+2AgNO3 =Cu(NO3)2+2Ag
反应类型都是置换反应
活泼性较强的金属
可把活泼性较弱的金属
从其盐溶液中置换出来
思考:哪些物质间发生的反应属于复分解反应?
1、酸+金属氧化物→盐+水
2、酸+碱→盐+水
3、酸+盐→新酸+新盐
4、碱+盐→新碱+新盐
5、盐1+盐2→新盐1+新盐2
五、复分解反应发生的条件
⑵有沉淀析出
⑶有气体生成
⑴有水生成
三个条件只要满足一个,反应就能进行
生成物:
反应物:
当盐与碱、盐与盐反应时,反应物均要可溶。
Na+
Na+
CO32-
Cl-
H+
Cl-
H+
H2O
碳酸钠和稀盐酸反应
CO2
微观角度来看复分解反应的条件
Ca2+
CO32-
OH-
OH-
Na+
Na+
CaCO3
氢氧化钙与碳酸钠反应
微观角度来看复分解反应的条件
判断下列物质间能否发生化学反应,并写出有关反应的化学方程式:
(1)Na2CO3 + HCl
(2)BaCl2 + HNO3
(3)Na2SO4 + Ba(OH)2
(4)K2SO4 + NaOH
(5)Na2CO3+ Ca(OH)2
(6)CuSO4 + BaCl2
随堂练习:
=BaSO4↓+2NaOH
=BaSO4 ↓ +CuCl2
=2NaCl+H2O+CO2↑
2
≠
≠
=CaCO3 ↓ +2NaOH
今年的母亲节,小明在厨房里帮妈妈做饭时看到三种白色固体产生了疑问:
哪一个是食盐呢?
交流与讨论
1.食盐和纯碱是厨房中两种常见品,请结合所学化学知识和生活的常识说一说在厨房里如何来鉴别它们。
2.实验室里,如何来鉴别无色溶液氯化钠和碳酸钠呢?请讨论一下。
(1)无色酚酞、紫色石蕊、pH试纸。
(2)稀盐酸
(3)氢氧化钙
(4)氯化钙
想用实验来验证一下你的方案吗?
Na2CO3+2HCl=2NaCl+H2O+CO2↑
Na2CO3+CaCl2=2NaCl+CaCO3↓
Na2CO3 + Ca(OH)2=2NaOH+CaCO3↓
(2)你能写出碳酸钠分别与盐酸、氢氧化钙和氯化钙反应的化学方程式吗?
(3)同样是盐,氯化钠为什么就不行呢?
复分解反应
生成物中要有沉淀、气体或水,复分解反应才能发生。
复分解反应需要满足什么条件?
(1)选择上述实验方案,你主要考虑的是哪种盐的化学性质呢?
六、常见几种盐的用途
NaCl
Na2CO3
NaHCO3
生活 调味品等
农业 选种等
工业 化工原料等
老大—食盐—氯化钠
盐的应用
电解饱和的食盐水可以制得烧碱、氢气和氯气。从而制造更多的化工产品,创造更多的社会价值。试写出化学方程式:
2NaCl+2H2O = 2NaOH+H2↑+Cl2↑
通电
电解熔融氯化钠还可以制取金属钠,氯化钠是制造氯酸盐、次氯酸盐、漂白粉和侯氏制碱法的原料。
工业上的氯化钠
我国制碱工业的先驱——侯德榜
他是我国化学工业史上,一位杰出的科学家,堪称“国宝”。他就像一块坚硬的基石,托起了中国现代化学工业的大厦,他以独创的侯氏制碱法闻名于世界。
NaCl+H2O+NH3+CO2=NaHCO3+NH4Cl
2NaHCO3 Na2CO3+H2O+CO2↑
Na2CO3
玻璃
纺织
洗涤剂
制皂
造纸
老二——纯碱、苏打——碳酸钠
老三——小苏打——碳酸氢钠
4.碳酸钙
珊瑚
鸡蛋壳
大理石
珍珠
贝壳
水垢
思考:为什么那些含碳酸钙的石头建筑经过大火一烧就“粉身碎骨”了呢?
实 验 内 容 现象 结论
1 观察石灰石是否容易捏碎、敲碎:
观察灼烧后的固体物质是否容易捏碎、敲碎:
2 将未灼烧的石灰石放入盛水的A烧杯中:
将灼烧后的固体物质放入盛水的B烧杯中:
3 向A烧杯中滴加酚酞试液
向B烧杯中滴加酚酞试液
4
活动与探究
不容易
容 易
无变化
粉 碎
无变化
变 红
坚 硬
硬度变小
不与水作用
与水起作用
无Ca(OH)2
生成Ca(OH)2
取B烧杯中的少量清液,向其中通入CO2或滴加Na2CO3溶液
变浑浊
生成CaCO3
CaCO3
高温
CaO
+H2O
Ca(OH)2
+CO2
碳酸钙
氧化钙
氢氧化钙
生石灰
熟石灰
化学式:
化学名称:
从上述现象中,用你所学知识进行分析你可以得到哪些启示?
俗称:
变浑浊
加入酚酞变红
消石灰
石灰石
CaCO3
高温
熟石灰
Ca(OH)2
+CO2
+H2O
生石灰
CaO
总结:
“钙三角”的相互转化
(1)
(3)
(2)
写出它们相互转化的化学方程式
(生石灰)
CaCO3 CaO+CO2
高温
CaO+H2O Ca(OH)2
(熟石灰)
交流◆小结
Ca(OH)2+CO2=CaCO3 ↓ +H2O
(1)
(2)
(3)
农作物生长需要哪些营养元素呢?
CO(NH2)2
NH4H2PO4
NH4HCO3
Ca3(PO4)2
K2SO4
(NH4)2SO4
KNO3
NH4NO3
化肥大多数是盐
一、化肥种类
1. 氮肥
2. 磷肥
3. 钾肥
4.复合肥
N、P、K元素≥两种
七、化学肥料
肥料
化学肥料
农家肥料:如厩肥、人粪尿、绿肥等。
氮肥
磷肥
钾肥
复合肥料
对比化学肥料和农家肥料的一些特点
农家肥料 化学肥料
化学肥分含量
见效
低
高
慢
快
化肥 作用
1.氮肥 氨水NH3·H2O 铵态氮肥(如: NH4HCO3、NH4Cl、 NH4NO3) 硝态氮肥(如: NH4NO3、NaNO3 ) 有机氮肥如 尿素CO(NH2)2
使植物叶色浓绿
缺氮:叶片发黄
实验一 硫酸铵与熟石灰混合研磨
现象:
产生刺激性气味的气体
化学方程式:
(NH4)2SO4+Ca(OH)2=CaSO4+2H2O+2NH3 ↑
实验二 硫酸铵与氢氧化钠溶液
湿润的红色石蕊试纸变蓝
湿润的红色的石蕊试纸
NaOH溶液
有刺激性气味
化学方程式:
(NH4)2SO4+2NaOH==Na2SO4+2H2O+2NH3 ↑
总结:铵盐( NH4+)检验的方法:
取样
加碱研磨或共热
试纸变蓝
湿润的红色石蕊试纸
利于氨气逸出
NH4++OH- =NH3 ↑+H2O
铵态氮肥使用的注意点:
不能与碱性物质(如熟石灰、草木灰)混合使用以免降低肥效
K2CO3
溶液呈碱性
改良酸性土壤
铵盐和碱的反应:
硝酸铵与氢氧化钠
氯化铵与氢氧化钙
2NH4CI+Ca(OH)2==CaCI2+2H2O+2NH3 ↑
NH4NO3+NaOH==NaNO3+H2O+NH3 ↑
自然界中氮的固定:
途径一:有根瘤菌的豆科植物
途径二:雷雨肥庄稼
N2+O2 ===== 2NO
放电
或高温
常用化肥 在植物生活中的作用
2.磷肥 磷矿粉: [Ca2(PO4)3]、 过磷酸钙: [Ca(H2PO4)2和CaSO4]
根系发达,增强抗寒、抗旱能力。
缺磷:生长迟缓,植株矮小,叶片暗绿色。
常用化肥 在植物生活中的作用
3.钾肥 K2SO4、 KCl
使茎秆粗壮,增强抗病虫害和抗倒伏能力
复合肥:
磷酸二氢铵:
磷酸氢二铵:
硝酸钾:
磷酸铵:
NH4H2PO4
(NH4)2HPO4
KNO3
(NH4)3PO4
化肥的使用是利大于弊
还是弊大于利?
引起虫害
人们在农田中使用了大量的化肥,从而造成植物体内的营养物质过多,使害虫遇到了适宜自己大量繁殖的环境,从而引起虫害。
造成土壤板结,破坏土壤内部的空间结构。
污染地下水源,污染生活饮用水。
水的富营养化
八、化肥与环境
1. 有利:提高农作物产量
2. 不利:
(2)污染水体(使水中N、P含量升高,富营养化)
(3)污染大气(有NH3等不良气体放出)
(1)破坏土壤(使土壤酸化、板结)
课堂小结
1、盐的定义
2、盐的分类
3、盐的溶解性
4、盐的化学性质
一、盐
盐的化学性质
盐
+
金属
新盐
酸
新盐
碱
新盐
盐
新盐
新金属
+
新酸
+
新碱
+
+
新盐
二、复分解反应
1、特点:
AB
CD
+
互相交换成分
AD
CB
+
2、发生的条件
反应物:
有酸可不溶,无酸须可溶。
生成物:
有水,气体或沉淀产生。
同时
具备
三、常见几种盐的用途
四、化学肥料
义务教育教科书(沪教版)九年级下册 第七章 第三节
几种重要的盐
NaCl
CaCO3
Al2(SO4)3
NaHCO3
(NH4)2SO4
它们在组成上的相同之处是什么?
它们都是由金属离子(或铵根离子)和酸根离子组成的。
观察下列物质的化学式及其电离方程式:
NH4Cl === NH4+ + Cl-
Na2CO3 === 2Na+ + CO32-
KNO3 === K+ + NO3-
Na2SO4 === 2Na+ + SO42 -
NaCl === Na+ + Cl-
BaCl2 === Ba2+ + 2Cl-
盐 = 金属离子(或铵根离子) + 酸根离子
一、什么是盐?
盐就是氯化钠,这个说法对吗?
不对,盐是一类化合物的总称,氯化钠是
盐类的一种。
盐类物质一定含有金属元素,这个说法对吗?
不对,盐类物质不一定都含有金属元素,
如(NH4)2SO4。
想一想
1、按溶解性
盐
可溶性盐
不溶性盐
2、按所含的阳离子或阴离子
KCl KNO3 K2SO4 等
盐
钾盐:
镁盐:
硝酸盐:
碳酸盐:
MgCl2 MgSO4 Mg(NO3 )2 等
KNO3 NaNO3 Mg(NO3 )2 等
K2CO3 Na2CO3 MgCO3 等
二、盐的分类:
OH- NO3- Cl- SO42- CO32-
H+ 溶、挥 溶、挥 溶 溶、挥
NH4+ 溶、挥 溶 溶 溶 溶
K+ 溶 溶 溶 溶 溶
Na+ 溶 溶 溶 溶 溶
Ba2+ 溶 溶 溶 不 不
Ca2+ 微 溶 溶 微 不
Mg2+ 不 溶 溶 溶 微
Al3+ 不 溶 溶 溶 ——
Mn2+ 不 溶 溶 溶 不
Zn2+ 不 溶 溶 溶 不
Fe2+ 不 溶 溶 溶 不
Fe3+ 不 溶 溶 溶 ——
Cu2+ 不 溶 溶 溶 ——
Ag+ —— 溶 不 微 不
酸、碱、盐的溶解性(20℃)
三、酸碱盐的溶解性:
钾钠铵盐均可溶;
硝酸盐入水影无踪;
氯化物不溶氯化银;
硫酸盐不溶硫酸钡;
碳酸盐溶钾钠铵。
AgCl不溶于水,也不溶于酸
BaSO4不溶于水,也不溶于酸
碱溶钾钠铵钡钙;
酸可溶
对盐的组成和溶解性我们已经有了一定的了解了,
那盐的化学性质如何呢?(回忆之前所学)
四、盐的化学性质:
1、盐与酸反应
CaCO3+2HCl = CaCl2+H2O+CO2 ↑
Na2CO3+2HCl = 2NaCl+H2O +CO2↑
HCl+AgNO3=AgCl↓+HNO3
H2SO4+BaCl2=BaSO4↓+2HCl
CuSO4+2NaOH = Cu(OH)2 ↓ +Na2SO4
FeCl3+3NaOH = Fe(OH)3↓+3NaCl
2、盐与碱反应
蓝色沉淀
红褐色沉淀
3、盐与盐反应
AgNO3+NaCl=AgCl↓+NaNO3
Na2SO4+BaCl2=BaSO4↓+2NaCl
Na2CO3+CaCl2=CaCO3↓+2NaCl
铁丝浸入硫酸铜溶液中 铜丝浸入硝酸银溶液中
实验探究:
实验探究内容 实验现象 反应的化学方程式
1、将铁丝投 入硫酸铜溶液中
2、将铜丝投 入硝酸银溶液中
铁丝表面覆盖一层红色固体,溶液由蓝色变成浅绿色。
铜丝表面覆盖一层银白色固体,溶液由无色变成蓝色。
Fe +CuSO4
=FeSO4+Cu
Cu+2AgNO3 =
Cu(NO3)2+2Ag
4、盐与金属反应:
Fe +CuSO4 =FeSO4+Cu
Cu+2AgNO3 =Cu(NO3)2+2Ag
反应类型都是置换反应
活泼性较强的金属
可把活泼性较弱的金属
从其盐溶液中置换出来
思考:哪些物质间发生的反应属于复分解反应?
1、酸+金属氧化物→盐+水
2、酸+碱→盐+水
3、酸+盐→新酸+新盐
4、碱+盐→新碱+新盐
5、盐1+盐2→新盐1+新盐2
五、复分解反应发生的条件
⑵有沉淀析出
⑶有气体生成
⑴有水生成
三个条件只要满足一个,反应就能进行
生成物:
反应物:
当盐与碱、盐与盐反应时,反应物均要可溶。
Na+
Na+
CO32-
Cl-
H+
Cl-
H+
H2O
碳酸钠和稀盐酸反应
CO2
微观角度来看复分解反应的条件
Ca2+
CO32-
OH-
OH-
Na+
Na+
CaCO3
氢氧化钙与碳酸钠反应
微观角度来看复分解反应的条件
判断下列物质间能否发生化学反应,并写出有关反应的化学方程式:
(1)Na2CO3 + HCl
(2)BaCl2 + HNO3
(3)Na2SO4 + Ba(OH)2
(4)K2SO4 + NaOH
(5)Na2CO3+ Ca(OH)2
(6)CuSO4 + BaCl2
随堂练习:
=BaSO4↓+2NaOH
=BaSO4 ↓ +CuCl2
=2NaCl+H2O+CO2↑
2
≠
≠
=CaCO3 ↓ +2NaOH
今年的母亲节,小明在厨房里帮妈妈做饭时看到三种白色固体产生了疑问:
哪一个是食盐呢?
交流与讨论
1.食盐和纯碱是厨房中两种常见品,请结合所学化学知识和生活的常识说一说在厨房里如何来鉴别它们。
2.实验室里,如何来鉴别无色溶液氯化钠和碳酸钠呢?请讨论一下。
(1)无色酚酞、紫色石蕊、pH试纸。
(2)稀盐酸
(3)氢氧化钙
(4)氯化钙
想用实验来验证一下你的方案吗?
Na2CO3+2HCl=2NaCl+H2O+CO2↑
Na2CO3+CaCl2=2NaCl+CaCO3↓
Na2CO3 + Ca(OH)2=2NaOH+CaCO3↓
(2)你能写出碳酸钠分别与盐酸、氢氧化钙和氯化钙反应的化学方程式吗?
(3)同样是盐,氯化钠为什么就不行呢?
复分解反应
生成物中要有沉淀、气体或水,复分解反应才能发生。
复分解反应需要满足什么条件?
(1)选择上述实验方案,你主要考虑的是哪种盐的化学性质呢?
六、常见几种盐的用途
NaCl
Na2CO3
NaHCO3
生活 调味品等
农业 选种等
工业 化工原料等
老大—食盐—氯化钠
盐的应用
电解饱和的食盐水可以制得烧碱、氢气和氯气。从而制造更多的化工产品,创造更多的社会价值。试写出化学方程式:
2NaCl+2H2O = 2NaOH+H2↑+Cl2↑
通电
电解熔融氯化钠还可以制取金属钠,氯化钠是制造氯酸盐、次氯酸盐、漂白粉和侯氏制碱法的原料。
工业上的氯化钠
我国制碱工业的先驱——侯德榜
他是我国化学工业史上,一位杰出的科学家,堪称“国宝”。他就像一块坚硬的基石,托起了中国现代化学工业的大厦,他以独创的侯氏制碱法闻名于世界。
NaCl+H2O+NH3+CO2=NaHCO3+NH4Cl
2NaHCO3 Na2CO3+H2O+CO2↑
Na2CO3
玻璃
纺织
洗涤剂
制皂
造纸
老二——纯碱、苏打——碳酸钠
老三——小苏打——碳酸氢钠
4.碳酸钙
珊瑚
鸡蛋壳
大理石
珍珠
贝壳
水垢
思考:为什么那些含碳酸钙的石头建筑经过大火一烧就“粉身碎骨”了呢?
实 验 内 容 现象 结论
1 观察石灰石是否容易捏碎、敲碎:
观察灼烧后的固体物质是否容易捏碎、敲碎:
2 将未灼烧的石灰石放入盛水的A烧杯中:
将灼烧后的固体物质放入盛水的B烧杯中:
3 向A烧杯中滴加酚酞试液
向B烧杯中滴加酚酞试液
4
活动与探究
不容易
容 易
无变化
粉 碎
无变化
变 红
坚 硬
硬度变小
不与水作用
与水起作用
无Ca(OH)2
生成Ca(OH)2
取B烧杯中的少量清液,向其中通入CO2或滴加Na2CO3溶液
变浑浊
生成CaCO3
CaCO3
高温
CaO
+H2O
Ca(OH)2
+CO2
碳酸钙
氧化钙
氢氧化钙
生石灰
熟石灰
化学式:
化学名称:
从上述现象中,用你所学知识进行分析你可以得到哪些启示?
俗称:
变浑浊
加入酚酞变红
消石灰
石灰石
CaCO3
高温
熟石灰
Ca(OH)2
+CO2
+H2O
生石灰
CaO
总结:
“钙三角”的相互转化
(1)
(3)
(2)
写出它们相互转化的化学方程式
(生石灰)
CaCO3 CaO+CO2
高温
CaO+H2O Ca(OH)2
(熟石灰)
交流◆小结
Ca(OH)2+CO2=CaCO3 ↓ +H2O
(1)
(2)
(3)
农作物生长需要哪些营养元素呢?
CO(NH2)2
NH4H2PO4
NH4HCO3
Ca3(PO4)2
K2SO4
(NH4)2SO4
KNO3
NH4NO3
化肥大多数是盐
一、化肥种类
1. 氮肥
2. 磷肥
3. 钾肥
4.复合肥
N、P、K元素≥两种
七、化学肥料
肥料
化学肥料
农家肥料:如厩肥、人粪尿、绿肥等。
氮肥
磷肥
钾肥
复合肥料
对比化学肥料和农家肥料的一些特点
农家肥料 化学肥料
化学肥分含量
见效
低
高
慢
快
化肥 作用
1.氮肥 氨水NH3·H2O 铵态氮肥(如: NH4HCO3、NH4Cl、 NH4NO3) 硝态氮肥(如: NH4NO3、NaNO3 ) 有机氮肥如 尿素CO(NH2)2
使植物叶色浓绿
缺氮:叶片发黄
实验一 硫酸铵与熟石灰混合研磨
现象:
产生刺激性气味的气体
化学方程式:
(NH4)2SO4+Ca(OH)2=CaSO4+2H2O+2NH3 ↑
实验二 硫酸铵与氢氧化钠溶液
湿润的红色石蕊试纸变蓝
湿润的红色的石蕊试纸
NaOH溶液
有刺激性气味
化学方程式:
(NH4)2SO4+2NaOH==Na2SO4+2H2O+2NH3 ↑
总结:铵盐( NH4+)检验的方法:
取样
加碱研磨或共热
试纸变蓝
湿润的红色石蕊试纸
利于氨气逸出
NH4++OH- =NH3 ↑+H2O
铵态氮肥使用的注意点:
不能与碱性物质(如熟石灰、草木灰)混合使用以免降低肥效
K2CO3
溶液呈碱性
改良酸性土壤
铵盐和碱的反应:
硝酸铵与氢氧化钠
氯化铵与氢氧化钙
2NH4CI+Ca(OH)2==CaCI2+2H2O+2NH3 ↑
NH4NO3+NaOH==NaNO3+H2O+NH3 ↑
自然界中氮的固定:
途径一:有根瘤菌的豆科植物
途径二:雷雨肥庄稼
N2+O2 ===== 2NO
放电
或高温
常用化肥 在植物生活中的作用
2.磷肥 磷矿粉: [Ca2(PO4)3]、 过磷酸钙: [Ca(H2PO4)2和CaSO4]
根系发达,增强抗寒、抗旱能力。
缺磷:生长迟缓,植株矮小,叶片暗绿色。
常用化肥 在植物生活中的作用
3.钾肥 K2SO4、 KCl
使茎秆粗壮,增强抗病虫害和抗倒伏能力
复合肥:
磷酸二氢铵:
磷酸氢二铵:
硝酸钾:
磷酸铵:
NH4H2PO4
(NH4)2HPO4
KNO3
(NH4)3PO4
化肥的使用是利大于弊
还是弊大于利?
引起虫害
人们在农田中使用了大量的化肥,从而造成植物体内的营养物质过多,使害虫遇到了适宜自己大量繁殖的环境,从而引起虫害。
造成土壤板结,破坏土壤内部的空间结构。
污染地下水源,污染生活饮用水。
水的富营养化
八、化肥与环境
1. 有利:提高农作物产量
2. 不利:
(2)污染水体(使水中N、P含量升高,富营养化)
(3)污染大气(有NH3等不良气体放出)
(1)破坏土壤(使土壤酸化、板结)
课堂小结
1、盐的定义
2、盐的分类
3、盐的溶解性
4、盐的化学性质
一、盐
盐的化学性质
盐
+
金属
新盐
酸
新盐
碱
新盐
盐
新盐
新金属
+
新酸
+
新碱
+
+
新盐
二、复分解反应
1、特点:
AB
CD
+
互相交换成分
AD
CB
+
2、发生的条件
反应物:
有酸可不溶,无酸须可溶。
生成物:
有水,气体或沉淀产生。
同时
具备
三、常见几种盐的用途
四、化学肥料
