沪教版化学九年级下册第7章应用广泛的酸·碱·盐第3节几种重要的盐 课件(共39张PPT)
文档属性
| 名称 | 沪教版化学九年级下册第7章应用广泛的酸·碱·盐第3节几种重要的盐 课件(共39张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-19 11:36:03 | ||
图片预览











文档简介
(共39张PPT)
第3节 几种重要的盐
2、掌握几种常见的盐
3、掌握盐的性质
1、知道盐的概念,盐的溶解性规律,盐的分类
一、盐:
1、概念:电离时生成金属离子(含铵根离子)和酸根离子的化合物。
NaCl
Na+
+
+
+
+
+
Cl-
Na2CO3
2Na+
CO32-
MgSO4
Mg2+
SO42-
(NH4)2SO4
2NH4+
SO42-
Ba(NO3)2
Ba2+
2NO3-
盐电离的通式:RmAn
盐中金属离子所带的正电荷总数等于酸根离子所带的负电荷总数。
2、盐的溶解性规律:
(1)K盐、Na盐、铵盐、硝酸盐都溶于水;
(2)盐酸盐中只有AgCl不溶于水,也不溶于酸;
(3)硫酸盐中只有BaSO4不溶于水,也不溶于酸,CaSO4、Ag2SO4微溶于水;
(4)碳酸盐中除K、Na、NH4盐可溶,其余不溶;MgCO3微溶;
(5)磷酸盐同碳酸盐。
3、盐的分类
由金属离子(或铵根离子NH4+)与酸根离子组成的化合物。例如,NaCl、NH4NO3等。大部分盐类是离子化合物,属于强电解质。少数盐如醋酸铅、氯化汞等弱电解质。盐类在水中的溶解性不同,差别很大。一般说来钾盐、钠盐和硝酸盐都易溶于水,而碳酸盐、磷酸盐、氢硫酸盐(硫化物)大多不溶于水。盐可以跟某些金属发生置换反应,生成另一种盐和金属;盐还可以与酸、碱或其它种类的盐发生复分解反应,生成新的酸、碱和盐。
根据盐的组成和结构的不同,一般有如下的分类:
(1)根据盐组成中是否含有酸式酸根或氢氧根,可分为正盐、酸式盐和碱式盐。
正盐:组成中不含酸式酸根或氢氧根的盐,如NaCl、Na2CO3、KNO3等。
酸式盐:组成中含酸式酸根的盐,如NaHCO3、KHSO4、Ca(H2PO4)2等。
碱式盐:组成中含氢氧根的盐,如Mg(OH)Cl、Cu2(OH)2CO3等。
(2)按盐组成中的阳离子或阴离子的名称而定名的,如:
钠盐:NaCl、Na2CO3、Na2SO4、Na2S等。
钾盐:K2CO3、KNO3、KCl等。
硫酸盐:CuSO4、K2SO4、(NH4)2SO4等。
碳酸盐:Na2CO3、K2CO3、(NH4)2CO3等。
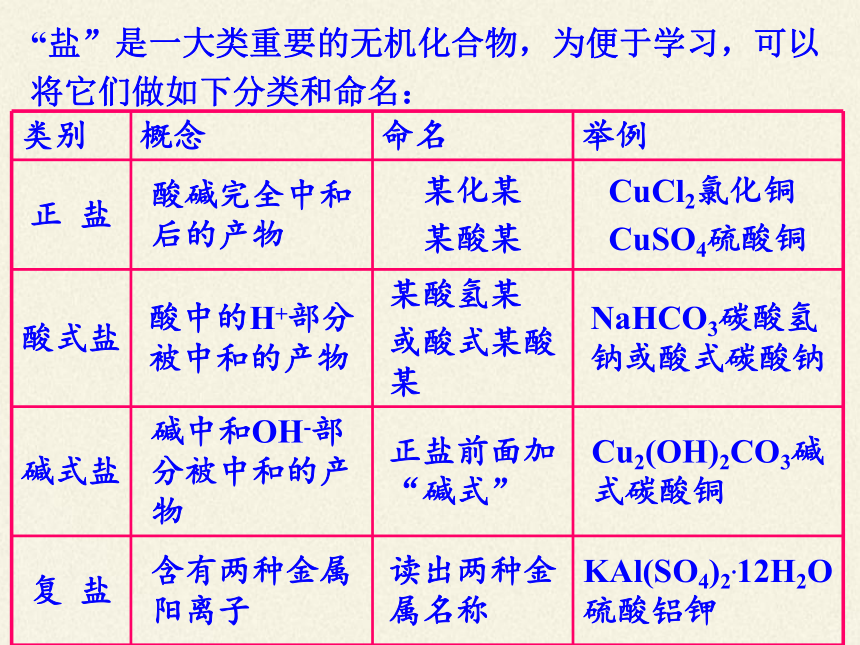
“盐”是一大类重要的无机化合物,为便于学习,可以将它们做如下分类和命名:
类别 概念 命名 举例
正 盐 酸碱完全中和后的产物 某化某 某酸某 CuCl2氯化铜
CuSO4硫酸铜
酸式盐 酸中的H+部分被中和的产物 某酸氢某 或酸式某酸某 NaHCO3碳酸氢钠或酸式碳酸钠
碱式盐 碱中和OH-部分被中和的产物 正盐前面加“碱式” Cu2(OH)2CO3碱式碳酸铜
复 盐 含有两种金属阳离子 读出两种金属名称 KAl(SO4)2.12H2O硫酸铝钾
形形色色的“盐”
说起“盐”,你可能马上就会想到食盐,的确,在物质的分类中,食盐属于“盐”类,然而化学上所说的盐具有更广泛的涵义。“盐”是指一大类化合物说的:凡是由金属离子(或铵离子NH4+)和酸根离子构成的化合物都叫盐。
“盐”不一定都有咸味,许多盐有其它味道,例如,醋酸铅是甜的(有毒!不能食用),氯化镁是苦的,碳酸钠是涩的,硫酸亚铁是酸的,而谷氨酸钠,就是大家所熟悉的味精,味道却十分鲜美!
形形色色的“盐”
如同食盐那样,许多盐都能溶于水,其水溶液有的是无色的,有的则呈现不同的美丽的颜色。你看,高锰酸钾溶液是紫色的,硫酸铜溶液是蓝色的,硫酸亚铁溶液是浅绿色的,铬酸钾溶液是黄色的。
一、NaCl的性质和用途
1、俗称:食盐
2、存在:海水、盐湖、盐井、盐矿
3、制取:晾晒—海水 煮—盐井水、盐湖水 开采—盐矿
4、物理性质:白色晶体,易溶于水,熔点高,不潮解(粗盐因含有CaCl2、MgCl2等易潮解)。
5、化学性质:NaCl+AgNO3===AgCl↓+NaNO3
6、用途:调味,腌渍食品,医疗上的生理盐水,重要的化工原料,制取Na2CO3、NaOH、Cl2和盐酸等。
小结: NaCl属于盐类,但盐不是食盐,
盐是一类物质的总称。
二、Na2CO3的性质和用途
1、俗名:纯碱、苏打
2、物理性质:是一种白色粉末状固体,易溶于水,其水溶液显碱性。
3、化学性质:
Na2CO3+Ca(OH)2===CaCO3↓+2NaOH (制备烧碱)
Na2CO3+2HCl===2NaCl+H2O+CO2↑
Na2CO3+BaCl2===BaCO3 ↓ +2NaCl
5、Na2CO3晶体(十水碳酸钠)
【性质:在常温下,放在干燥的空气里能失去结晶水变成粉末(风化)】
4、用途:用于玻璃,造纸,纺织和洗涤剂的生产等。
Na2CO3.10H2O===Na2CO3+10H2O (化学变化)
三、NaHCO3的性质和用途
1、俗名:小苏打
2、物理性质:白色粉末状固体,易溶于水
(水溶液显碱性)
3、化学性质:
2NaHCO3===Na2CO3+H2O+CO2↑(受热易分解)
NaHCO3+HCl===NaCl+H2O+CO2↑
NaHCO3+NaOH===Na2CO3+H2O
4、用途:在食品工业上用作食品添加剂,在医疗上是治疗胃酸过多的一种药剂。
△
四、CaCO3的性质和用途
1、大理石或石灰石的主要成分。
2、物理性质:白色固体,难溶于水
3、化学性质:
CaCO3====CaO+CO2↑
CaCO3+2HCl====CaCl2+H2O+CO2↑
高温
4、用途:建筑材料,补钙剂
五、CuSO4的性质和用途
1、物理性质: CuSO4白色粉末
CuSO4 5H2O为蓝色晶体,叫胆矾或蓝矾
2、化学性质:
CuSO4+5H2O==== CuSO4 5H2O
(可检验水的存在)
白色固体
蓝色固体
CuSO4 5H2O ==== CuSO4+5H2O
△
白色固体
蓝色固体
CuSO4+Fe====Cu+FeSO4(湿法冶金)
CuSO4+2NaOH====Na2SO4+Cu(OH)2↓
3、用途:配制农药、精炼铜、镀铜等。
二、盐
根据酸碱中和反应生成盐和水的事实,你能否说明盐的组成特点?除氯化钠外,你还知道哪些盐吗?你了解它们有哪些性质和用途吗?
根据下面所给出的盐的化学式,你能说出它们可以用哪些酸和碱反应得到吗?
硝酸钾KNO3 硫酸钾K2SO4
硫酸钙CaSO4 氯化钾KCl
观察思考
盐:由金属离子(含NH4+)和酸根离子构成的化合物。如NaCl、CaCl2、Na2SO4等。
依据盐的组成,可以把盐分成钾
盐、钠盐、钙盐等;也可以把盐分成
盐酸盐硫酸盐、硝酸盐、碳酸盐等。
请查阅课本附录四,说明:①钾盐、钠盐、铵盐、硝酸盐的溶解性;②碳酸盐的溶解性;③钙盐、钡盐、银盐的溶解性;BaSO4(钡餐的主要成分)、CaSO4(石膏的主要成分)和硝酸钾的溶解性。
盐 的 溶 解 性
a、钾盐、钠盐、铵盐、硝酸盐都易溶于水
b、盐酸盐中只有AgCl不溶于水
c、硫酸盐中只有BaSO4不溶于水
d、碳酸盐大部分不溶于水,除钾、钠、铵盐外
盐的化学性质
1、盐与酸反应
AgNO3+HCl = AgCl↓+HNO3
BaCl2+H2SO4 = BaSO4↓+2HCl
CaCO3+2HCl = CaCl2+CO2↑+H2O
(1) 盐 + 酸 → 新盐 + 新酸
碳酸盐都可以和酸(除CaCO3和稀硫酸外)反应,氯化银、硫酸钡不和酸反应。
2、盐与碱反应
CuSO4+2NaOH = Cu(OH)2 ↓ +Na2SO4
FeCl3+3NaOH = Fe(OH)3↓+3NaCl
(2)盐溶液 + 碱溶液 → 新盐 + 新碱
注意:反应物必须可溶,生成物中至少有一种沉淀
实验操作 现象
与金属的反应 Fe +CuSO4
Al+ CuSO4
Cu+AgNO3
铁钉表面有红色固体析出
铝片表面有红色固体析出
铜片表面有银白色固体析出
3、盐与某些金属反应
实验操作 化学方程式 结论
与金属的反应 Fe+CuSO4
Al+CuSO4
Cu+AgNO3
Fe + CuSO4 = FeSO4 +Cu
2Al+3CuSO4 = Al2(SO4)3+3Cu
Cu+2AgNO3 = Cu(NO3)2+2Ag
能与金属反应,生成另一种盐和金属
(3)盐溶液 + 金属 → 新盐 + 新金属
在金属活动顺序中,只有排在前面的金属才能把排在它后面的金属从它的盐溶液中置换出来。
主要应用:
1.金属的位置越靠前,它的活动性就越强
2.位于氢前的金属能置换出盐酸、稀硫酸中的氢
3.位于前面的金属能把位于后面的金属从它们的
盐溶液中置换出来
Sn
K
Ca
Na
Mg
Al
Zn
Fe
Pb
(H)
Cu
Hg
Ag
Pt
Au
金属活动性由强逐渐减弱
金属活动性顺序:
在金属活动性顺序中
实验操作 现象
与盐的作用 AgNO3+NaCl
Na2SO4+BaCl2
有白色沉淀生成
有白色沉淀生成
4、盐与另一种盐的反应
实验操作 化学方程式 结论
与盐的作用 AgNO3+NaCl 与盐的作用生成两种___
NaCl+AgNO3 = AgCl↓+NaNO3
Na2SO4+BaCl2
Na2SO4+BaCl2 = BaSO4↓+2NaCl
新盐
(4)盐溶液 + 盐溶液 → 新盐 + 新盐
注意:反应物必须可溶,生成物中至少有一种沉淀
盐的化学性质:
⑴盐溶液 + 金属 → 新盐 + 新金属
在金属活动顺序中,只有排在前面的金属才能把排在它后面的金属从它的盐溶液中置换出来。
⑵ 盐 + 酸 → 新盐 + 新酸
碳酸盐都可以和酸(除CaCO3和稀硫酸外)反应,氯化银、硫酸钡不和酸反应。
(3)盐溶液 + 碱溶液→ 新盐 + 新碱
(4)盐溶液 + 盐溶液 → 新盐 + 新盐
注意:(3)、(4)反应物必须可溶,生成物中至少有一种沉淀
知识点一、中和反应
C
【典例1】(邵阳中考)在做酸和碱中和反应的实验时,有时需借助指示剂颜色的变化判断反应是否发生、完成。向含有酚酞的NaOH溶液的烧杯中,不断滴入稀盐酸。此过程烧杯中溶液颜色的变化是( )
A.由红色变为蓝色 B.由蓝色变为红色
C.由红色变为无色 D.由无色变成红色
【典例2】(楚雄中考)根据复分解反应发生的条件,判断下列各组物质不能发生反应的一组是( )
A.Na2CO3溶液和CaCl2溶液
B.NaOH溶液和盐酸溶液
C.CuSO4溶液和BaCl2溶液
D.K2SO4溶液和NaCl溶液
D
知识点二、复分解反应
1、判断下列化合物属于盐的是( )
A、Na2O B、Mg(OH)2 C、H2SO4
D、NH4Cl E、Na2CO3
2、(烟台中考)把金属X放入CuCl2溶液中有红色物质析出,放入MgCl2溶液中无现象。则X、Cu、Mg三种金属活动性由强到弱的顺序正确的是( )
A.Mg、X、Cu B.Cu、X、Mg
C.Mg、Cu、X D.X、Mg、Cu
A
D E
3、下列反应,属于化合反应的是( ),属于分解反应的是( ),属于置换反应的是( ),属于复分解反应的是( ),属于中和反应的是( )
A、Fe + H2SO4 = FeSO4 + H2↑
B、H2CO3 = H2O + CO2↑
C、2NaOH + H2SO4 = Na2SO4 +2H2O
D、S + O2 === SO2
E、2NaOH + CuSO4 = Na2SO4 +Cu(OH)2↓
D
B
A
C E
C
点燃
4、下列四种金属中,有一种金属的盐溶液与其他三种金属都能发生置换反应,这种金属是( )
A.Fe B.Ag
C.Zn D.Cu
B
5、(龙岩中考)酸与碱作用生成盐和水的反应,叫做中和反应。它在工农业生产和日常生活中有广泛的用途。下列应用一定与中和反应原理无关的是( )
A.施用熟石灰改良酸性土壤
B.服用含Al(OH)3的药物治疗胃酸过多
C.用熟石灰和硫酸铜配制波尔多液
D.用NaOH溶液洗涤石油产品中的残余硫酸
C
6、有一包固体粉末,可能由CaCO3、Na2SO4、KNO3、CuSO4、BaCl2中的一种或几种组成,通过实验得到以下结果:
(1)将此固体粉末加到水中,得到白色沉淀,上层清液为无色;
(2)该白色沉淀不溶于稀硝酸。
从实验中判断,该粉末中一定含有 ,一定不含 ,可能含有 。
Na2SO4和BaCl2
CuSO4 和CaCO3
KNO3
1、中和反应:酸+碱→盐+水(放热)
2、盐的化学性质:
①盐 + 酸 → 新盐 + 新酸
②盐 + 碱 → 新盐 + 新碱
③盐 + 盐 → 新盐 + 新盐
④盐 + 金属→ 新盐 + 新金属
3、金属的活动性顺序
Sn
K
Ca
Na
Mg
Al
Zn
Fe
Pb
(H)
Cu
Hg
Ag
Pt
Au
金属活动性由强逐渐减弱
谢 谢
第3节 几种重要的盐
2、掌握几种常见的盐
3、掌握盐的性质
1、知道盐的概念,盐的溶解性规律,盐的分类
一、盐:
1、概念:电离时生成金属离子(含铵根离子)和酸根离子的化合物。
NaCl
Na+
+
+
+
+
+
Cl-
Na2CO3
2Na+
CO32-
MgSO4
Mg2+
SO42-
(NH4)2SO4
2NH4+
SO42-
Ba(NO3)2
Ba2+
2NO3-
盐电离的通式:RmAn
盐中金属离子所带的正电荷总数等于酸根离子所带的负电荷总数。
2、盐的溶解性规律:
(1)K盐、Na盐、铵盐、硝酸盐都溶于水;
(2)盐酸盐中只有AgCl不溶于水,也不溶于酸;
(3)硫酸盐中只有BaSO4不溶于水,也不溶于酸,CaSO4、Ag2SO4微溶于水;
(4)碳酸盐中除K、Na、NH4盐可溶,其余不溶;MgCO3微溶;
(5)磷酸盐同碳酸盐。
3、盐的分类
由金属离子(或铵根离子NH4+)与酸根离子组成的化合物。例如,NaCl、NH4NO3等。大部分盐类是离子化合物,属于强电解质。少数盐如醋酸铅、氯化汞等弱电解质。盐类在水中的溶解性不同,差别很大。一般说来钾盐、钠盐和硝酸盐都易溶于水,而碳酸盐、磷酸盐、氢硫酸盐(硫化物)大多不溶于水。盐可以跟某些金属发生置换反应,生成另一种盐和金属;盐还可以与酸、碱或其它种类的盐发生复分解反应,生成新的酸、碱和盐。
根据盐的组成和结构的不同,一般有如下的分类:
(1)根据盐组成中是否含有酸式酸根或氢氧根,可分为正盐、酸式盐和碱式盐。
正盐:组成中不含酸式酸根或氢氧根的盐,如NaCl、Na2CO3、KNO3等。
酸式盐:组成中含酸式酸根的盐,如NaHCO3、KHSO4、Ca(H2PO4)2等。
碱式盐:组成中含氢氧根的盐,如Mg(OH)Cl、Cu2(OH)2CO3等。
(2)按盐组成中的阳离子或阴离子的名称而定名的,如:
钠盐:NaCl、Na2CO3、Na2SO4、Na2S等。
钾盐:K2CO3、KNO3、KCl等。
硫酸盐:CuSO4、K2SO4、(NH4)2SO4等。
碳酸盐:Na2CO3、K2CO3、(NH4)2CO3等。
“盐”是一大类重要的无机化合物,为便于学习,可以将它们做如下分类和命名:
类别 概念 命名 举例
正 盐 酸碱完全中和后的产物 某化某 某酸某 CuCl2氯化铜
CuSO4硫酸铜
酸式盐 酸中的H+部分被中和的产物 某酸氢某 或酸式某酸某 NaHCO3碳酸氢钠或酸式碳酸钠
碱式盐 碱中和OH-部分被中和的产物 正盐前面加“碱式” Cu2(OH)2CO3碱式碳酸铜
复 盐 含有两种金属阳离子 读出两种金属名称 KAl(SO4)2.12H2O硫酸铝钾
形形色色的“盐”
说起“盐”,你可能马上就会想到食盐,的确,在物质的分类中,食盐属于“盐”类,然而化学上所说的盐具有更广泛的涵义。“盐”是指一大类化合物说的:凡是由金属离子(或铵离子NH4+)和酸根离子构成的化合物都叫盐。
“盐”不一定都有咸味,许多盐有其它味道,例如,醋酸铅是甜的(有毒!不能食用),氯化镁是苦的,碳酸钠是涩的,硫酸亚铁是酸的,而谷氨酸钠,就是大家所熟悉的味精,味道却十分鲜美!
形形色色的“盐”
如同食盐那样,许多盐都能溶于水,其水溶液有的是无色的,有的则呈现不同的美丽的颜色。你看,高锰酸钾溶液是紫色的,硫酸铜溶液是蓝色的,硫酸亚铁溶液是浅绿色的,铬酸钾溶液是黄色的。
一、NaCl的性质和用途
1、俗称:食盐
2、存在:海水、盐湖、盐井、盐矿
3、制取:晾晒—海水 煮—盐井水、盐湖水 开采—盐矿
4、物理性质:白色晶体,易溶于水,熔点高,不潮解(粗盐因含有CaCl2、MgCl2等易潮解)。
5、化学性质:NaCl+AgNO3===AgCl↓+NaNO3
6、用途:调味,腌渍食品,医疗上的生理盐水,重要的化工原料,制取Na2CO3、NaOH、Cl2和盐酸等。
小结: NaCl属于盐类,但盐不是食盐,
盐是一类物质的总称。
二、Na2CO3的性质和用途
1、俗名:纯碱、苏打
2、物理性质:是一种白色粉末状固体,易溶于水,其水溶液显碱性。
3、化学性质:
Na2CO3+Ca(OH)2===CaCO3↓+2NaOH (制备烧碱)
Na2CO3+2HCl===2NaCl+H2O+CO2↑
Na2CO3+BaCl2===BaCO3 ↓ +2NaCl
5、Na2CO3晶体(十水碳酸钠)
【性质:在常温下,放在干燥的空气里能失去结晶水变成粉末(风化)】
4、用途:用于玻璃,造纸,纺织和洗涤剂的生产等。
Na2CO3.10H2O===Na2CO3+10H2O (化学变化)
三、NaHCO3的性质和用途
1、俗名:小苏打
2、物理性质:白色粉末状固体,易溶于水
(水溶液显碱性)
3、化学性质:
2NaHCO3===Na2CO3+H2O+CO2↑(受热易分解)
NaHCO3+HCl===NaCl+H2O+CO2↑
NaHCO3+NaOH===Na2CO3+H2O
4、用途:在食品工业上用作食品添加剂,在医疗上是治疗胃酸过多的一种药剂。
△
四、CaCO3的性质和用途
1、大理石或石灰石的主要成分。
2、物理性质:白色固体,难溶于水
3、化学性质:
CaCO3====CaO+CO2↑
CaCO3+2HCl====CaCl2+H2O+CO2↑
高温
4、用途:建筑材料,补钙剂
五、CuSO4的性质和用途
1、物理性质: CuSO4白色粉末
CuSO4 5H2O为蓝色晶体,叫胆矾或蓝矾
2、化学性质:
CuSO4+5H2O==== CuSO4 5H2O
(可检验水的存在)
白色固体
蓝色固体
CuSO4 5H2O ==== CuSO4+5H2O
△
白色固体
蓝色固体
CuSO4+Fe====Cu+FeSO4(湿法冶金)
CuSO4+2NaOH====Na2SO4+Cu(OH)2↓
3、用途:配制农药、精炼铜、镀铜等。
二、盐
根据酸碱中和反应生成盐和水的事实,你能否说明盐的组成特点?除氯化钠外,你还知道哪些盐吗?你了解它们有哪些性质和用途吗?
根据下面所给出的盐的化学式,你能说出它们可以用哪些酸和碱反应得到吗?
硝酸钾KNO3 硫酸钾K2SO4
硫酸钙CaSO4 氯化钾KCl
观察思考
盐:由金属离子(含NH4+)和酸根离子构成的化合物。如NaCl、CaCl2、Na2SO4等。
依据盐的组成,可以把盐分成钾
盐、钠盐、钙盐等;也可以把盐分成
盐酸盐硫酸盐、硝酸盐、碳酸盐等。
请查阅课本附录四,说明:①钾盐、钠盐、铵盐、硝酸盐的溶解性;②碳酸盐的溶解性;③钙盐、钡盐、银盐的溶解性;BaSO4(钡餐的主要成分)、CaSO4(石膏的主要成分)和硝酸钾的溶解性。
盐 的 溶 解 性
a、钾盐、钠盐、铵盐、硝酸盐都易溶于水
b、盐酸盐中只有AgCl不溶于水
c、硫酸盐中只有BaSO4不溶于水
d、碳酸盐大部分不溶于水,除钾、钠、铵盐外
盐的化学性质
1、盐与酸反应
AgNO3+HCl = AgCl↓+HNO3
BaCl2+H2SO4 = BaSO4↓+2HCl
CaCO3+2HCl = CaCl2+CO2↑+H2O
(1) 盐 + 酸 → 新盐 + 新酸
碳酸盐都可以和酸(除CaCO3和稀硫酸外)反应,氯化银、硫酸钡不和酸反应。
2、盐与碱反应
CuSO4+2NaOH = Cu(OH)2 ↓ +Na2SO4
FeCl3+3NaOH = Fe(OH)3↓+3NaCl
(2)盐溶液 + 碱溶液 → 新盐 + 新碱
注意:反应物必须可溶,生成物中至少有一种沉淀
实验操作 现象
与金属的反应 Fe +CuSO4
Al+ CuSO4
Cu+AgNO3
铁钉表面有红色固体析出
铝片表面有红色固体析出
铜片表面有银白色固体析出
3、盐与某些金属反应
实验操作 化学方程式 结论
与金属的反应 Fe+CuSO4
Al+CuSO4
Cu+AgNO3
Fe + CuSO4 = FeSO4 +Cu
2Al+3CuSO4 = Al2(SO4)3+3Cu
Cu+2AgNO3 = Cu(NO3)2+2Ag
能与金属反应,生成另一种盐和金属
(3)盐溶液 + 金属 → 新盐 + 新金属
在金属活动顺序中,只有排在前面的金属才能把排在它后面的金属从它的盐溶液中置换出来。
主要应用:
1.金属的位置越靠前,它的活动性就越强
2.位于氢前的金属能置换出盐酸、稀硫酸中的氢
3.位于前面的金属能把位于后面的金属从它们的
盐溶液中置换出来
Sn
K
Ca
Na
Mg
Al
Zn
Fe
Pb
(H)
Cu
Hg
Ag
Pt
Au
金属活动性由强逐渐减弱
金属活动性顺序:
在金属活动性顺序中
实验操作 现象
与盐的作用 AgNO3+NaCl
Na2SO4+BaCl2
有白色沉淀生成
有白色沉淀生成
4、盐与另一种盐的反应
实验操作 化学方程式 结论
与盐的作用 AgNO3+NaCl 与盐的作用生成两种___
NaCl+AgNO3 = AgCl↓+NaNO3
Na2SO4+BaCl2
Na2SO4+BaCl2 = BaSO4↓+2NaCl
新盐
(4)盐溶液 + 盐溶液 → 新盐 + 新盐
注意:反应物必须可溶,生成物中至少有一种沉淀
盐的化学性质:
⑴盐溶液 + 金属 → 新盐 + 新金属
在金属活动顺序中,只有排在前面的金属才能把排在它后面的金属从它的盐溶液中置换出来。
⑵ 盐 + 酸 → 新盐 + 新酸
碳酸盐都可以和酸(除CaCO3和稀硫酸外)反应,氯化银、硫酸钡不和酸反应。
(3)盐溶液 + 碱溶液→ 新盐 + 新碱
(4)盐溶液 + 盐溶液 → 新盐 + 新盐
注意:(3)、(4)反应物必须可溶,生成物中至少有一种沉淀
知识点一、中和反应
C
【典例1】(邵阳中考)在做酸和碱中和反应的实验时,有时需借助指示剂颜色的变化判断反应是否发生、完成。向含有酚酞的NaOH溶液的烧杯中,不断滴入稀盐酸。此过程烧杯中溶液颜色的变化是( )
A.由红色变为蓝色 B.由蓝色变为红色
C.由红色变为无色 D.由无色变成红色
【典例2】(楚雄中考)根据复分解反应发生的条件,判断下列各组物质不能发生反应的一组是( )
A.Na2CO3溶液和CaCl2溶液
B.NaOH溶液和盐酸溶液
C.CuSO4溶液和BaCl2溶液
D.K2SO4溶液和NaCl溶液
D
知识点二、复分解反应
1、判断下列化合物属于盐的是( )
A、Na2O B、Mg(OH)2 C、H2SO4
D、NH4Cl E、Na2CO3
2、(烟台中考)把金属X放入CuCl2溶液中有红色物质析出,放入MgCl2溶液中无现象。则X、Cu、Mg三种金属活动性由强到弱的顺序正确的是( )
A.Mg、X、Cu B.Cu、X、Mg
C.Mg、Cu、X D.X、Mg、Cu
A
D E
3、下列反应,属于化合反应的是( ),属于分解反应的是( ),属于置换反应的是( ),属于复分解反应的是( ),属于中和反应的是( )
A、Fe + H2SO4 = FeSO4 + H2↑
B、H2CO3 = H2O + CO2↑
C、2NaOH + H2SO4 = Na2SO4 +2H2O
D、S + O2 === SO2
E、2NaOH + CuSO4 = Na2SO4 +Cu(OH)2↓
D
B
A
C E
C
点燃
4、下列四种金属中,有一种金属的盐溶液与其他三种金属都能发生置换反应,这种金属是( )
A.Fe B.Ag
C.Zn D.Cu
B
5、(龙岩中考)酸与碱作用生成盐和水的反应,叫做中和反应。它在工农业生产和日常生活中有广泛的用途。下列应用一定与中和反应原理无关的是( )
A.施用熟石灰改良酸性土壤
B.服用含Al(OH)3的药物治疗胃酸过多
C.用熟石灰和硫酸铜配制波尔多液
D.用NaOH溶液洗涤石油产品中的残余硫酸
C
6、有一包固体粉末,可能由CaCO3、Na2SO4、KNO3、CuSO4、BaCl2中的一种或几种组成,通过实验得到以下结果:
(1)将此固体粉末加到水中,得到白色沉淀,上层清液为无色;
(2)该白色沉淀不溶于稀硝酸。
从实验中判断,该粉末中一定含有 ,一定不含 ,可能含有 。
Na2SO4和BaCl2
CuSO4 和CaCO3
KNO3
1、中和反应:酸+碱→盐+水(放热)
2、盐的化学性质:
①盐 + 酸 → 新盐 + 新酸
②盐 + 碱 → 新盐 + 新碱
③盐 + 盐 → 新盐 + 新盐
④盐 + 金属→ 新盐 + 新金属
3、金属的活动性顺序
Sn
K
Ca
Na
Mg
Al
Zn
Fe
Pb
(H)
Cu
Hg
Ag
Pt
Au
金属活动性由强逐渐减弱
谢 谢
