沪教版化学九年级下册第6章溶解现象 复习课件(共25张PPT)
文档属性
| 名称 | 沪教版化学九年级下册第6章溶解现象 复习课件(共25张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 34.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-20 16:13:02 | ||
图片预览







文档简介
(共25张PPT)
整理与归纳
下列饮品中哪些属于溶液?
溶 液(一)
你的判断依据是?
均一、稳定的液体一定是溶液吗?
一、溶液的概念、特征、组成及性质
特征:
概念:
一种或多种物质以分子或离子形式均匀分散到另一种物质里,形成的均一、稳定的混合物。
组成
{
溶质
溶剂
均一、稳定、混合物
找一找,冰红茶中的溶质与溶剂
注意:溶液中溶剂只有一种,溶质可有多种。
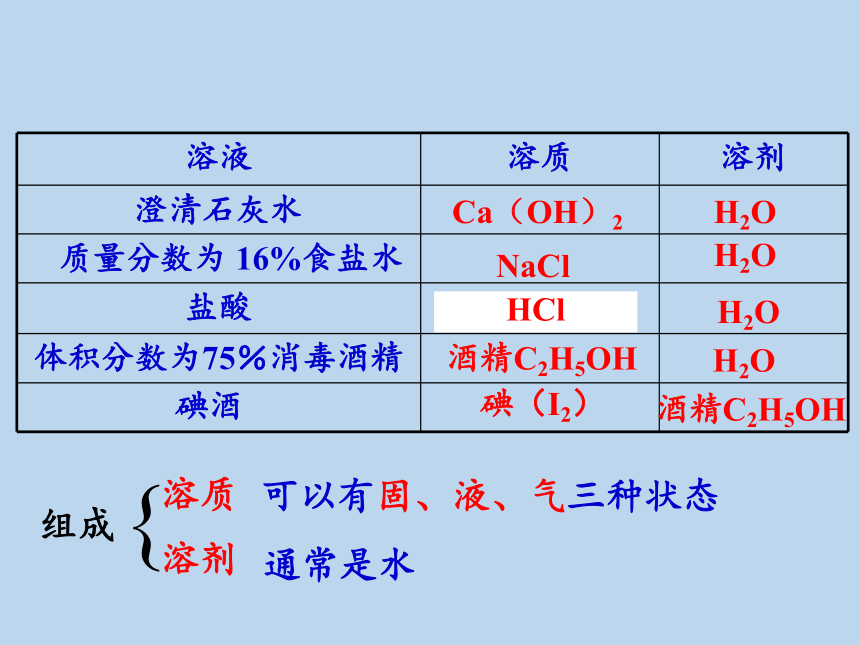
溶液 溶质 溶剂
澄清石灰水
质量分数为 16%食盐水
盐酸
体积分数为75%消毒酒精
Ca(OH)2
H2O
H2O
碘(I2)
酒精C2H5OH
NaCl
H2O
H2O
酒精C2H5OH
HCl
可以有固、液、气三种状态
组成
{
溶质
溶剂
通常是水
碘酒
溶液 溶质 溶剂
澄清石灰水
质量分数为 16%食盐水
盐酸
体积分数为75%消毒酒精
碘酒
Ca(OH)2
H2O
HCl
H2O
碘(I2)
酒精C2H5OH
NaCl
H2O
H2O
酒精C2H5OH
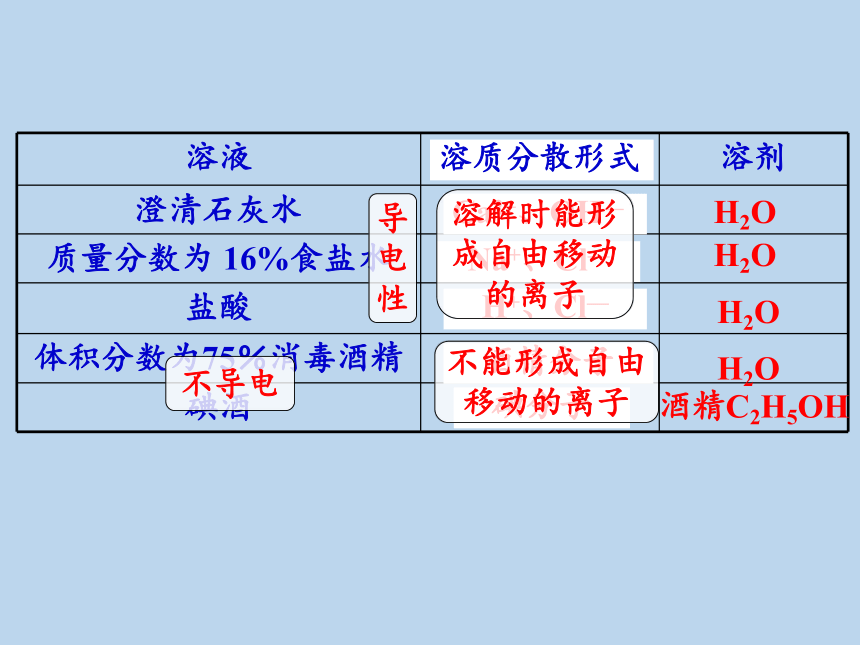
溶质分散形式
Ca2+、OH—
碘分子
H+、Cl—
Na+、Cl—
酒精分子
导
电
性
溶解时能形
成自由移动
的离子
不能形成自由
移动的离子
不导电
溶解过程中伴随的变化:
(2)颜色的变化:
(3)能量的变化:
(5)酸碱性的变化:
(1)导电性的变化:
(4)沸点和凝固点的变化:
气体溶解性
温度
压强
二、影响物质溶解性的因素
溶质种类
溶剂种类
固体
压 强
温 度
气体
二、影响物质溶解性的因素
与气体不同的是,大多数固体的溶解性随温度升高而增强,极少数固体(如Ca(OH)2)的溶解性随温度升高而降低。
饱和溶液:
一定温度下,溶质能无限制的溶解在一定量的溶剂里吗?
在 下、 里, 某种溶质的溶液,叫做 的饱和溶液
一定温度
一定量溶剂
不能再溶解
这种溶质
三、饱和溶液与不饱和溶液
KNO3饱和溶液→不饱和溶液方法:
①加水
②升高温度
讨论:
KNO3不饱和溶液→饱和溶液方法:
①加KNO3至饱和
③降低温度至饱和
②蒸发水至饱和
溶液的质量分数都改变了吗?
溶液的分类
饱和溶液
不饱和溶液
浓溶液
稀溶液
对于不同溶质,饱和溶液不一定是浓溶液,
不饱和溶液也不一定是稀溶液。
对于同种溶质,一定温度下,
饱和溶液比不饱和溶液浓。
医用0.9%生理盐水
实验室提供:足量的NaCl和蒸馏水、
100g溶质质量分数为20%溶液
实验室配制50g16%NaCl溶液
NaCl溶液
16%
四、溶液的配制
五、溶解度及溶解度曲线
一定温度
100g溶剂(一般指水)
饱和状态
溶质质量(单位为g)
固体溶解度的四要素:
定量表示溶解性的强弱程度:溶解度
下列关于溶解度的叙述中,正确的是
① 在20℃时,100g水中溶解了20gNaCl,因此在20℃时,NaCl的溶解度为20g;
②20℃时100gNaCl饱和溶液中含有26.5gNaCl,因此NaCl在20℃时的溶解度为26.5g;
③将36gNaCl溶于100g水中形成饱和溶液,NaCl的溶解度为36g;
④在20℃时,100g水中溶解36gNaCl达到饱和状态,因此NaCl在20℃时的溶解度为36g
⑤在20℃时,100g水最多能溶解36gNaCl ,而200g水最多能溶解72gNaCl ,因此NaCl的溶解度随溶剂质量增大而增大;
√
×
×
×
×
温度/℃ 10 20 30 40 50 60 80 100
溶解度/g KNO3 20.9 31.6 45.8 63.9 85.5 110 169 246
NaCl 35.8 36.0 36.3 36.6 37.0 37.3 38.4 39.8
下表是NaCl、KNO3在水中不同温度下的溶解度:
“36.0”的意义: 。
20℃,100g水中最多溶解36.0g氯化钠
五、溶解度及溶解度曲线
B
A
t/℃
S/g
t1
20
P
1、你能获得的信息
2、你能在t1时配制溶质质量分数为20%的A溶液吗
五、溶解度及溶解度曲线
0
B
A
t/℃
S/g
t1
20
30
t2
3、在t2时,等质量A和B饱和溶液降温至t1
①析出晶体 A________B
②所得溶液:
m液 A________B
ω A________B
m质 A________B
m剂 A________B
>
<
=
<
<
五、溶解度及溶解度曲线
4、在t2时,将25gA放在100g水中,形成A的______溶液(填“饱和”或“不饱和”)
降温至t1时,溶液状态将发生怎样变化?
不饱和
→饱和
→有晶体析出
降温至t1时,析出晶体_____g
5
五、溶解度及溶解度曲线
B
A
t/℃
S/g
t1
20
30
t2
不饱和
结晶法
降温结晶
蒸发结晶
六、混合物的分离
B
A
t/℃
S/g
t1
20
30
t2
如何提出下列物质(括号内为少量杂质):
A(B): ;
B(A): 。
降温结晶
蒸发结晶
过滤法:
分离难溶性固体和液体
总结与反思
本节课,你有哪些收获?
关于溶液还有哪些疑惑?
完成【当堂检测】
谢 谢
整理与归纳
下列饮品中哪些属于溶液?
溶 液(一)
你的判断依据是?
均一、稳定的液体一定是溶液吗?
一、溶液的概念、特征、组成及性质
特征:
概念:
一种或多种物质以分子或离子形式均匀分散到另一种物质里,形成的均一、稳定的混合物。
组成
{
溶质
溶剂
均一、稳定、混合物
找一找,冰红茶中的溶质与溶剂
注意:溶液中溶剂只有一种,溶质可有多种。
溶液 溶质 溶剂
澄清石灰水
质量分数为 16%食盐水
盐酸
体积分数为75%消毒酒精
Ca(OH)2
H2O
H2O
碘(I2)
酒精C2H5OH
NaCl
H2O
H2O
酒精C2H5OH
HCl
可以有固、液、气三种状态
组成
{
溶质
溶剂
通常是水
碘酒
溶液 溶质 溶剂
澄清石灰水
质量分数为 16%食盐水
盐酸
体积分数为75%消毒酒精
碘酒
Ca(OH)2
H2O
HCl
H2O
碘(I2)
酒精C2H5OH
NaCl
H2O
H2O
酒精C2H5OH
溶质分散形式
Ca2+、OH—
碘分子
H+、Cl—
Na+、Cl—
酒精分子
导
电
性
溶解时能形
成自由移动
的离子
不能形成自由
移动的离子
不导电
溶解过程中伴随的变化:
(2)颜色的变化:
(3)能量的变化:
(5)酸碱性的变化:
(1)导电性的变化:
(4)沸点和凝固点的变化:
气体溶解性
温度
压强
二、影响物质溶解性的因素
溶质种类
溶剂种类
固体
压 强
温 度
气体
二、影响物质溶解性的因素
与气体不同的是,大多数固体的溶解性随温度升高而增强,极少数固体(如Ca(OH)2)的溶解性随温度升高而降低。
饱和溶液:
一定温度下,溶质能无限制的溶解在一定量的溶剂里吗?
在 下、 里, 某种溶质的溶液,叫做 的饱和溶液
一定温度
一定量溶剂
不能再溶解
这种溶质
三、饱和溶液与不饱和溶液
KNO3饱和溶液→不饱和溶液方法:
①加水
②升高温度
讨论:
KNO3不饱和溶液→饱和溶液方法:
①加KNO3至饱和
③降低温度至饱和
②蒸发水至饱和
溶液的质量分数都改变了吗?
溶液的分类
饱和溶液
不饱和溶液
浓溶液
稀溶液
对于不同溶质,饱和溶液不一定是浓溶液,
不饱和溶液也不一定是稀溶液。
对于同种溶质,一定温度下,
饱和溶液比不饱和溶液浓。
医用0.9%生理盐水
实验室提供:足量的NaCl和蒸馏水、
100g溶质质量分数为20%溶液
实验室配制50g16%NaCl溶液
NaCl溶液
16%
四、溶液的配制
五、溶解度及溶解度曲线
一定温度
100g溶剂(一般指水)
饱和状态
溶质质量(单位为g)
固体溶解度的四要素:
定量表示溶解性的强弱程度:溶解度
下列关于溶解度的叙述中,正确的是
① 在20℃时,100g水中溶解了20gNaCl,因此在20℃时,NaCl的溶解度为20g;
②20℃时100gNaCl饱和溶液中含有26.5gNaCl,因此NaCl在20℃时的溶解度为26.5g;
③将36gNaCl溶于100g水中形成饱和溶液,NaCl的溶解度为36g;
④在20℃时,100g水中溶解36gNaCl达到饱和状态,因此NaCl在20℃时的溶解度为36g
⑤在20℃时,100g水最多能溶解36gNaCl ,而200g水最多能溶解72gNaCl ,因此NaCl的溶解度随溶剂质量增大而增大;
√
×
×
×
×
温度/℃ 10 20 30 40 50 60 80 100
溶解度/g KNO3 20.9 31.6 45.8 63.9 85.5 110 169 246
NaCl 35.8 36.0 36.3 36.6 37.0 37.3 38.4 39.8
下表是NaCl、KNO3在水中不同温度下的溶解度:
“36.0”的意义: 。
20℃,100g水中最多溶解36.0g氯化钠
五、溶解度及溶解度曲线
B
A
t/℃
S/g
t1
20
P
1、你能获得的信息
2、你能在t1时配制溶质质量分数为20%的A溶液吗
五、溶解度及溶解度曲线
0
B
A
t/℃
S/g
t1
20
30
t2
3、在t2时,等质量A和B饱和溶液降温至t1
①析出晶体 A________B
②所得溶液:
m液 A________B
ω A________B
m质 A________B
m剂 A________B
>
<
=
<
<
五、溶解度及溶解度曲线
4、在t2时,将25gA放在100g水中,形成A的______溶液(填“饱和”或“不饱和”)
降温至t1时,溶液状态将发生怎样变化?
不饱和
→饱和
→有晶体析出
降温至t1时,析出晶体_____g
5
五、溶解度及溶解度曲线
B
A
t/℃
S/g
t1
20
30
t2
不饱和
结晶法
降温结晶
蒸发结晶
六、混合物的分离
B
A
t/℃
S/g
t1
20
30
t2
如何提出下列物质(括号内为少量杂质):
A(B): ;
B(A): 。
降温结晶
蒸发结晶
过滤法:
分离难溶性固体和液体
总结与反思
本节课,你有哪些收获?
关于溶液还有哪些疑惑?
完成【当堂检测】
谢 谢
