必修2 第1章 第3节 元素周期表的应用
文档属性
| 名称 | 必修2 第1章 第3节 元素周期表的应用 |

|
|
| 格式 | zip | ||
| 文件大小 | 606.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2013-08-04 00:00:00 | ||
图片预览





文档简介
课件28张PPT。
热烈欢迎评委老师的到来,
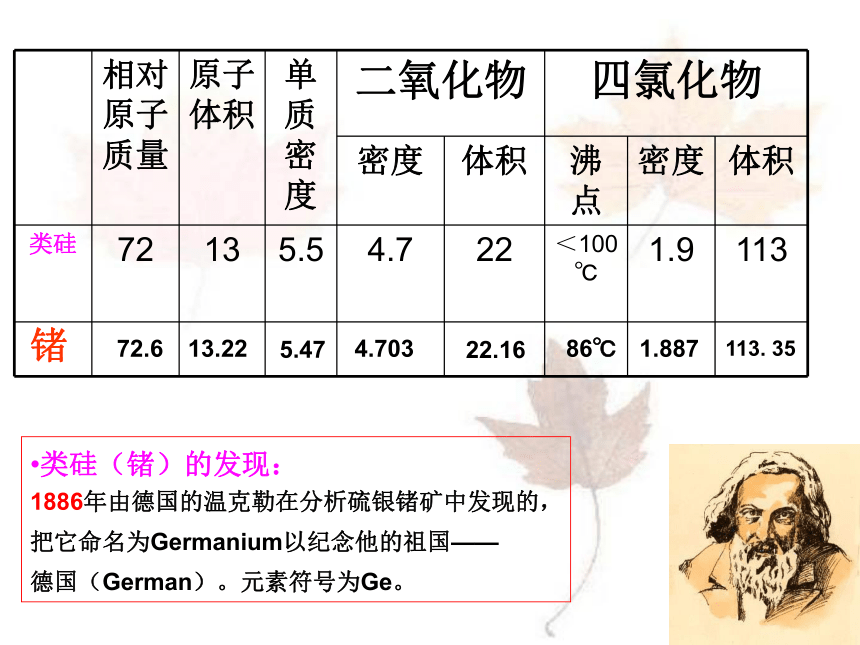
向在座的各位老师学习!类硅(锗)的发现: 1886年由德国的温克勒在分析硫银锗矿中发现的,
把它命名为Germanium以纪念他的祖国——
德国(German)。元素符号为Ge。锗72.613.225.474.70322.16
86℃1.887113. 35鲁科版普通高中课程标准实验教科书 化学2(必修)第一章 第三节 元素周期表的应用
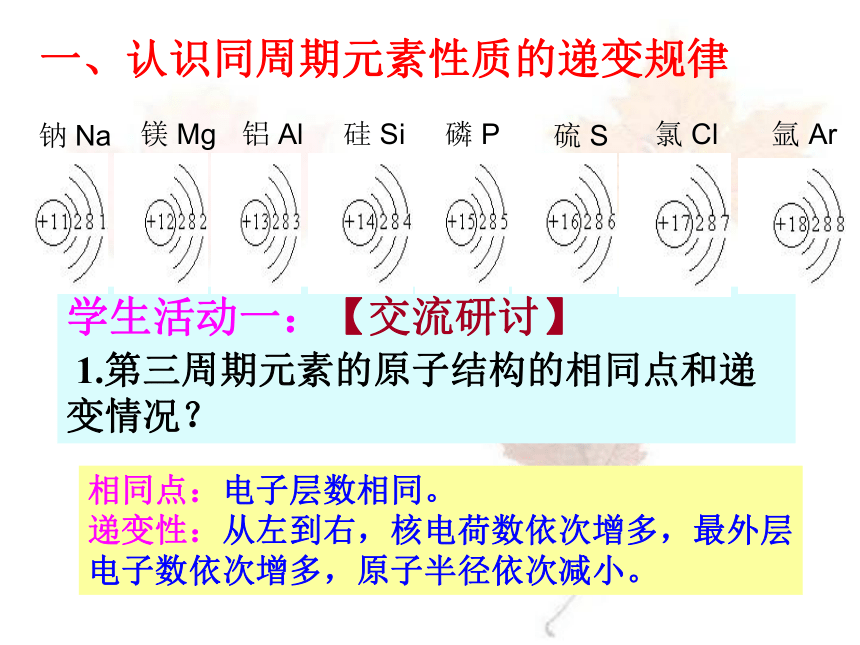
一、认识同周期元素性质的递变规律学生活动一:【交流研讨】
1.第三周期元素的原子结构的相同点和递变情况?相同点:电子层数相同。
递变性:从左到右,核电荷数依次增多,最外层电子数依次增多,原子半径依次减小。 【交流研讨】
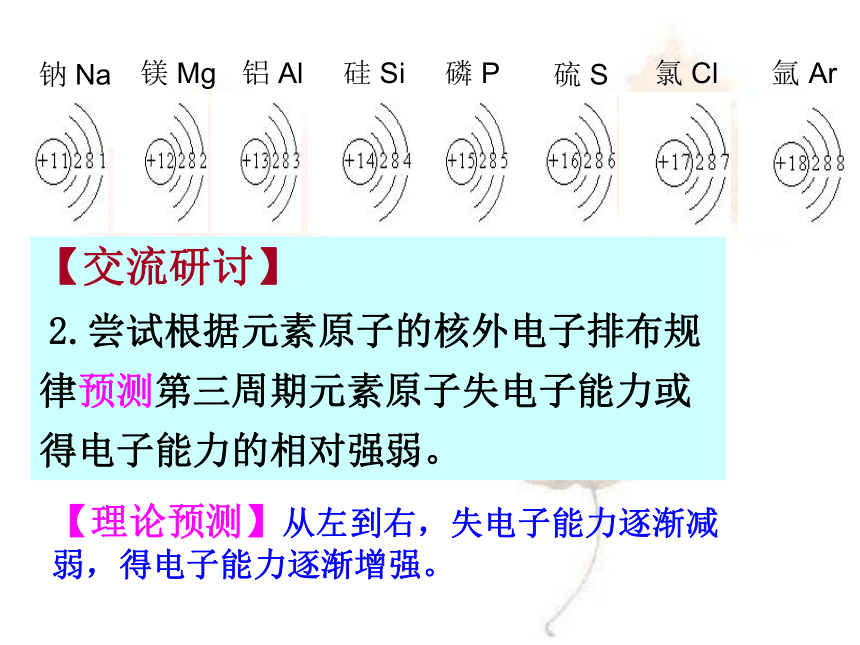
2.尝试根据元素原子的核外电子排布规律预测第三周期元素原子失电子能力或得电子能力的相对强弱。【理论预测】从左到右,失电子能力逐渐减 弱,得电子能力逐渐增强。
学生活动二:
【自行阅读“方法导引”,寻找实验途径】研究物质化学性质的一般方法:【实验探究】 钠、镁、铝失电子能力比较
试剂:面积相同的镁条和铝条,金属钠,酚酞溶液,MgCl2溶液,盐酸(1mol/L),NaOH溶液,AlCl3溶液,蒸馏水。
仪器:烧杯,试管,表面皿,酒精灯,
试管夹。
【讨论】学生代表提出实验设计方案。实验注意事项:
1、钠如何取用?
2、镁、铝与水反应时,看不到明显现象,可适当加热,加热至沸腾后立即停止加热,观察现象。
3、镁铝与盐酸反应时,盐酸取大约两滴管。
注意:1、照相、录影的同学注意抓拍;
2、及时将实验现象记录在学案上。实验一: 钠、镁、铝和水的反应
(学生汇报)学生活动三【实验探究】学生分组实验实验一: 钠、镁、铝和水的反应学生活动三【实验探究】学生分组实验、汇报结论:失电子能力 Na>Mg>Al? 向盛有已擦去表面氧化膜的镁条和铝片的试管中,各加入2mL 1mol/L的盐酸。实验二:镁、铝和盐酸的反应 金属性
Mg > AlMg + 2HCl = MgCl2+H22Al + 6HCl = 2AlCl3+3H2有气泡放出,镁反应剧烈有气泡放出,反应较剧烈白色沉淀Mg(OH)2白色沉淀Al(OH)3加NaOH溶液加NaOH溶液现象:沉淀不溶解沉淀溶解现象:与冷水反应剧烈热水较快;
与盐酸剧烈与盐酸反应较剧烈NaOHMg(OH)2Al(OH)3失电子能力: Na Mg Al强碱中强碱两性【通过实验,获取结论】 失电子能力逐渐减弱【激发兴趣,引发思考】
我们通过设计实验方案、实施实验方案验证了我们对Na、Mg、Al失电子能力的预测,那么,Si、P、S、Cl的得电子能力是否如我们所预测的一样依次增强?学生活动四:
【自行阅读“方法导引”和教材P21“阅读探究”,寻找信息,进行验证】【方法导引】 元素原子得电子能力的强弱,可以采用下列方法间接判断:
1、元素单质与氢气化合的难易程度,一般说来,反应越容易进行,元素原子得电子的能力越强。
2、比较气态氢化物的稳定性,气态氢化物越稳定,元素原子得电子的能力越强。
3、比较元素最高价氧化物对应水化物的酸性强弱。一般说来,酸性越强,元素原子得电子的能力越强。H4SiO4极弱酸H3PO4中强酸H2SO4强酸HClO4最强酸高温光照或点燃爆炸化合磷蒸气加热
【阅读、分析】教材P21页“阅读探究”【结论】得电子能力:Si P S Cl得电子能力逐渐增强稀有气体元素金属性逐渐减弱,非金属性逐渐增强同一周期,从左到右结论:这节课你有哪些收获? 学生活动五:
【总结】元素在周期表中的位置与性质的关系11Na 12Mg 13Al 14Si 15P 16S 17Cl 同周期,从左往右,核电荷数递增,原子半径逐渐减小,核对核外电子的吸引能力逐渐增强失电子的能力逐渐减弱,得电子的能力逐渐增强,金属性减弱, 非金属性增强。最高价氧化物的水化物碱性减弱, 酸性增强.气态氢化物稳定性逐渐增强结构位置性质1、下列说法正确的是:( )
A. C、N、O、F原子半径依次增大
B. NH3、H2O(g)、HF 稳定性依次增强
C. HClO比H2SO4酸性强。
D.甲、乙两种非金属元素与金属钠反应时, 甲得电子的数目多,所以甲活泼。B学生活动六:【课堂考考你】2、已知电子层数相同的三种元素X、Y、Z,其最高价含氧酸酸性:H3XO4 A、原子半径X B、得电子能力X、Y、Z逐渐减弱
C、单质与氢气反应按照X、Y、Z顺序越来越容易
D、气态氢化物的稳定性按照X、Y、Z顺序减弱C 【作业】
1、预习第二部分:预测同主族元素的
性质。
2、完成课本第28页第5题, 并思考:
判断元素原子失电子能力或者是得电
子能力的强弱还可以采用哪些方法?
谢谢大家!
祝同学们学习进步!
再见
热烈欢迎评委老师的到来,
向在座的各位老师学习!类硅(锗)的发现: 1886年由德国的温克勒在分析硫银锗矿中发现的,
把它命名为Germanium以纪念他的祖国——
德国(German)。元素符号为Ge。锗72.613.225.474.70322.16
86℃1.887113. 35鲁科版普通高中课程标准实验教科书 化学2(必修)第一章 第三节 元素周期表的应用
一、认识同周期元素性质的递变规律学生活动一:【交流研讨】
1.第三周期元素的原子结构的相同点和递变情况?相同点:电子层数相同。
递变性:从左到右,核电荷数依次增多,最外层电子数依次增多,原子半径依次减小。 【交流研讨】
2.尝试根据元素原子的核外电子排布规律预测第三周期元素原子失电子能力或得电子能力的相对强弱。【理论预测】从左到右,失电子能力逐渐减 弱,得电子能力逐渐增强。
学生活动二:
【自行阅读“方法导引”,寻找实验途径】研究物质化学性质的一般方法:【实验探究】 钠、镁、铝失电子能力比较
试剂:面积相同的镁条和铝条,金属钠,酚酞溶液,MgCl2溶液,盐酸(1mol/L),NaOH溶液,AlCl3溶液,蒸馏水。
仪器:烧杯,试管,表面皿,酒精灯,
试管夹。
【讨论】学生代表提出实验设计方案。实验注意事项:
1、钠如何取用?
2、镁、铝与水反应时,看不到明显现象,可适当加热,加热至沸腾后立即停止加热,观察现象。
3、镁铝与盐酸反应时,盐酸取大约两滴管。
注意:1、照相、录影的同学注意抓拍;
2、及时将实验现象记录在学案上。实验一: 钠、镁、铝和水的反应
(学生汇报)学生活动三【实验探究】学生分组实验实验一: 钠、镁、铝和水的反应学生活动三【实验探究】学生分组实验、汇报结论:失电子能力 Na>Mg>Al? 向盛有已擦去表面氧化膜的镁条和铝片的试管中,各加入2mL 1mol/L的盐酸。实验二:镁、铝和盐酸的反应 金属性
Mg > AlMg + 2HCl = MgCl2+H22Al + 6HCl = 2AlCl3+3H2有气泡放出,镁反应剧烈有气泡放出,反应较剧烈白色沉淀Mg(OH)2白色沉淀Al(OH)3加NaOH溶液加NaOH溶液现象:沉淀不溶解沉淀溶解现象:与冷水反应剧烈热水较快;
与盐酸剧烈与盐酸反应较剧烈NaOHMg(OH)2Al(OH)3失电子能力: Na Mg Al强碱中强碱两性【通过实验,获取结论】 失电子能力逐渐减弱【激发兴趣,引发思考】
我们通过设计实验方案、实施实验方案验证了我们对Na、Mg、Al失电子能力的预测,那么,Si、P、S、Cl的得电子能力是否如我们所预测的一样依次增强?学生活动四:
【自行阅读“方法导引”和教材P21“阅读探究”,寻找信息,进行验证】【方法导引】 元素原子得电子能力的强弱,可以采用下列方法间接判断:
1、元素单质与氢气化合的难易程度,一般说来,反应越容易进行,元素原子得电子的能力越强。
2、比较气态氢化物的稳定性,气态氢化物越稳定,元素原子得电子的能力越强。
3、比较元素最高价氧化物对应水化物的酸性强弱。一般说来,酸性越强,元素原子得电子的能力越强。H4SiO4极弱酸H3PO4中强酸H2SO4强酸HClO4最强酸高温光照或点燃爆炸化合磷蒸气加热
【阅读、分析】教材P21页“阅读探究”【结论】得电子能力:Si P S Cl得电子能力逐渐增强稀有气体元素金属性逐渐减弱,非金属性逐渐增强同一周期,从左到右结论:这节课你有哪些收获? 学生活动五:
【总结】元素在周期表中的位置与性质的关系11Na 12Mg 13Al 14Si 15P 16S 17Cl 同周期,从左往右,核电荷数递增,原子半径逐渐减小,核对核外电子的吸引能力逐渐增强失电子的能力逐渐减弱,得电子的能力逐渐增强,金属性减弱, 非金属性增强。最高价氧化物的水化物碱性减弱, 酸性增强.气态氢化物稳定性逐渐增强结构位置性质1、下列说法正确的是:( )
A. C、N、O、F原子半径依次增大
B. NH3、H2O(g)、HF 稳定性依次增强
C. HClO比H2SO4酸性强。
D.甲、乙两种非金属元素与金属钠反应时, 甲得电子的数目多,所以甲活泼。B学生活动六:【课堂考考你】2、已知电子层数相同的三种元素X、Y、Z,其最高价含氧酸酸性:H3XO4
C、单质与氢气反应按照X、Y、Z顺序越来越容易
D、气态氢化物的稳定性按照X、Y、Z顺序减弱C 【作业】
1、预习第二部分:预测同主族元素的
性质。
2、完成课本第28页第5题, 并思考:
判断元素原子失电子能力或者是得电
子能力的强弱还可以采用哪些方法?
谢谢大家!
祝同学们学习进步!
再见
