沪教版化学九年级下册第7章应用广泛的酸·碱·盐应用广泛的酸碱盐小专题复习课件(共28张PPT)
文档属性
| 名称 | 沪教版化学九年级下册第7章应用广泛的酸·碱·盐应用广泛的酸碱盐小专题复习课件(共28张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 919.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-23 07:00:36 | ||
图片预览





文档简介
(共28张PPT)
应用广泛的酸、碱、盐小专题复习
复 习 重 点
二.单质、氧化物、酸、碱、盐的 相互关系
一.酸、碱、盐的组成、分类
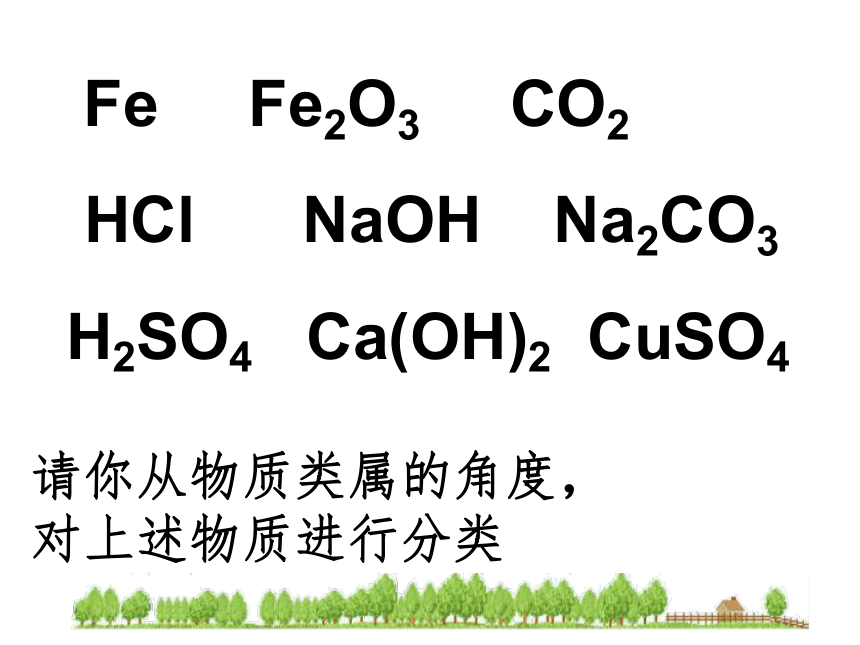
Fe Fe2O3 CO2
HCl NaOH Na2CO3
H2SO4 Ca(OH)2 CuSO4
请你从物质类属的角度,
对上述物质进行分类
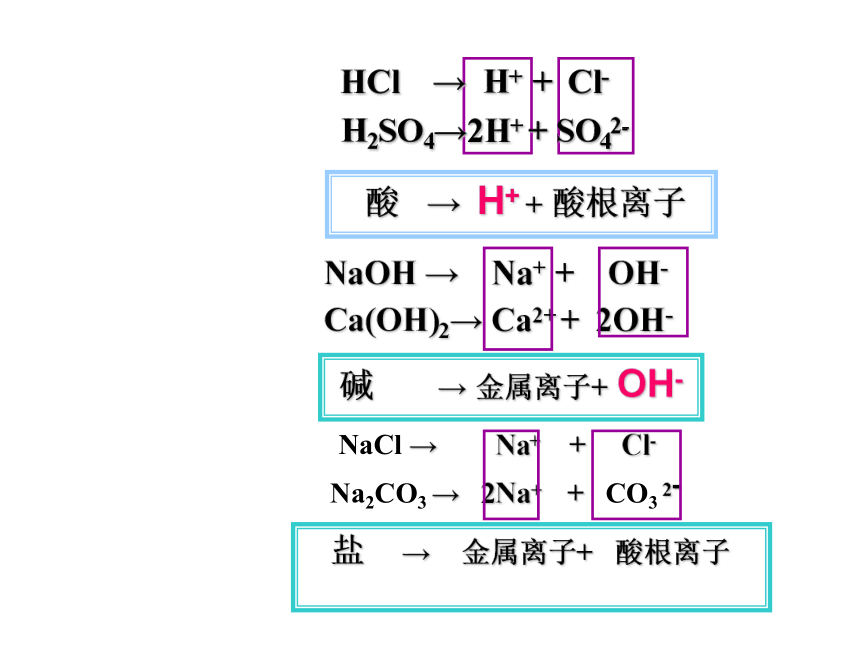
HCl → H+ + Cl-
H2SO4→2H+ + SO42-
NaOH → Na+ + OH-
Ca(OH)2→ Ca2+ + 2OH-
酸 → H+ + 酸根离子
碱 → 金属离子+ OH-
NaCl → Na+ + Cl-
盐 → 金属离子+ 酸根离子
Na2CO3 → 2Na+ + CO3 2-
HCl → H+ + Cl-
H2SO4→2H+ + SO42-
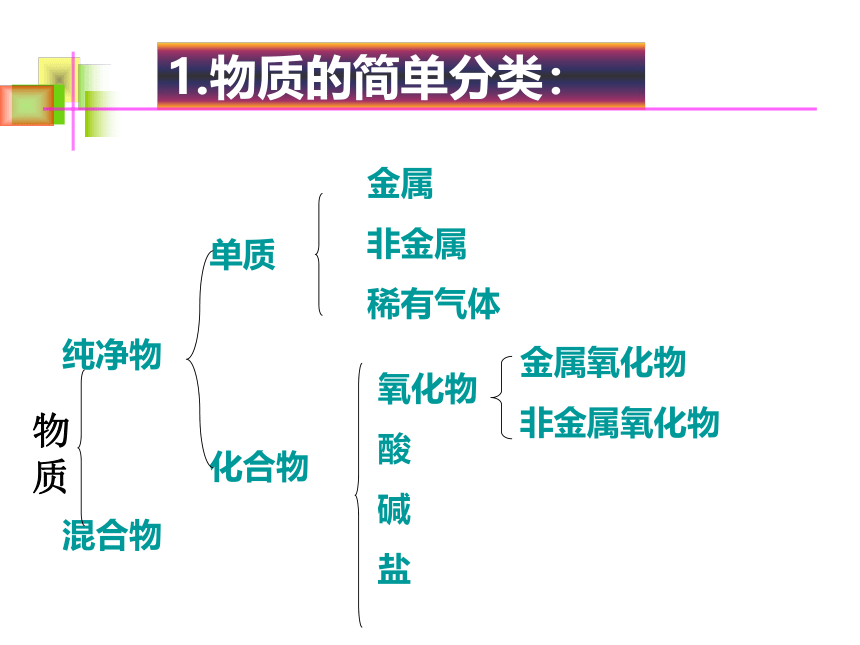
单质
化合物
金属
非金属
稀有气体
氧化物
酸
碱
盐
金属氧化物
非金属氧化物
1.物质的简单分类:
纯净物
混合物
物质
2.本章常见化合物:
氧化物:
酸:
碱:
盐:
CO2、SO2、CuO、Fe2O3
HCl、H2SO4、HNO3
NaOH、Ca(OH)2、NH3 H2O
Na2CO3 、NaCl、CuSO4
Fe Fe2O3 CO2
HCl NaOH Na2CO3
H2SO4 Ca(OH)2 CuSO4
请你在上述物质中归纳出H2SO4 与NaOH分别与哪些物质反应?
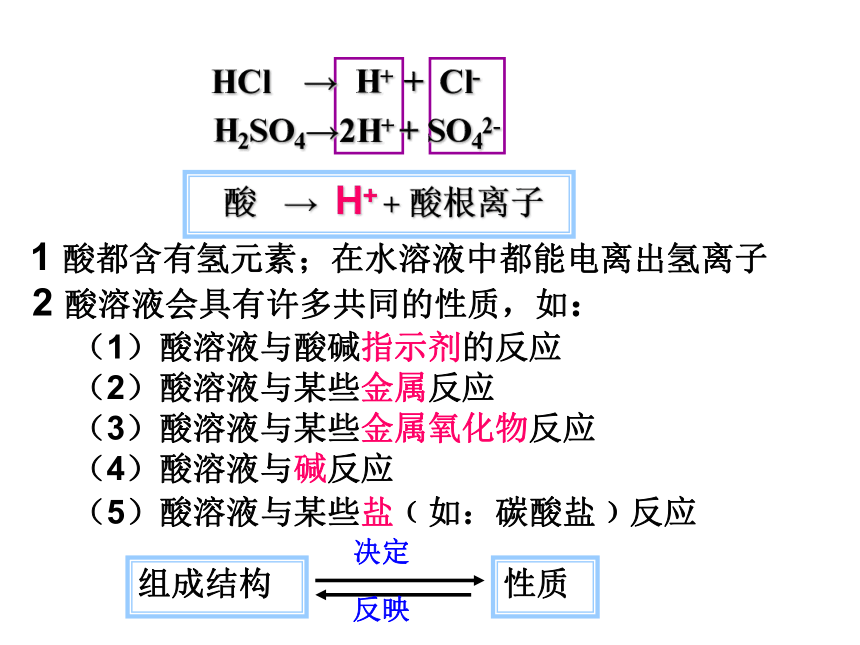
HCl → H+ + Cl-
H2SO4→2H+ + SO42-
酸 → H+ + 酸根离子
HCl → H+ + Cl-
H2SO4→2H+ + SO42-
(4)酸溶液与碱反应
1 酸都含有氢元素;在水溶液中都能电离出氢离子
2 酸溶液会具有许多共同的性质,如:
(1)酸溶液与酸碱指示剂的反应
(2)酸溶液与某些金属反应
(3)酸溶液与某些金属氧化物反应
组成结构
性质
决定
反映
(5)酸溶液与某些盐﹙如:碳酸盐﹚反应
Na2CO3+2HCl==2NaCl+H2O+CO2↑
CaCO3+2HCl==CaCl2+H2O+CO2↑
组成里含有CO32-的盐跟盐酸反应都能生成CO2,利用这种反应可鉴别CO32-。
例.下列生活经验不正确的是 ( )
A、用铝锅来盛放酸性物质
B、蒸馒头常用小苏打(NaHCO3)或纯碱 (Na2CO3)起发泡作用
C、用食醋除去水壶中的水垢
D、用稀盐酸除锈
1 碱都含有氢氧元素;
在水溶液中都能电离出氢氧根离子
2 碱溶液会具有许多共同的性质,如:
(1)碱溶液与酸碱指示剂的反应
(2)碱溶液与某些非金属氧化物反应
组成结构
性质
决定
反映
NaOH →Na+ + OH-
Ca(OH)2→ Ca2+ + 2OH-
碱 → 金属离子+ OH-
(4)碱溶液与某些盐反应
(3)碱溶液与酸反应
【例题】现有室温下,失去标签的两瓶体积相同的无色液体其中一瓶是稀盐酸,另一瓶是石灰水。如何鉴别?
组成上的差异→性质不同→有不同的现象
酸的通性
碱的通性
H+
OH-
有气体产生、沉淀生成、颜色变化、固体反应溶解
HCl
Ca(OH)2
利用酚酞试液鉴别稀盐酸和氢氧化钠溶液。
1.请描述现象与结论:
2.如果将两种溶液混合后,将出现什么现象,为什么?
为什么NaOH与HCl能发生反应?
HCl=H++Cl-
NaOH=Na++OH-
NaOH+HCl==NaCl+H2O
碱 酸 氯化钠 水
中和反应的实质:
H+
+
OH-
=
H2O
胃酸过多的病人可以服用斯达舒(主要成份是氢氧化铝)的原因是什么?请写出该反应化学方程式。
酸
使指示剂变色
活泼金属
金属氧化物
碱
某些盐
盐+水
盐+水
新盐+新酸
盐+氢气
复分解反应
碱
使指示剂变色
非金属氧化物
酸
某些盐
盐+水
新盐+新碱
盐+水
复分解反应
盐
某些金属
某些酸
某些碱
某些盐
请你模拟酸和碱的图示,以熟悉的物质为例,建构盐的关系图
用途广泛的酸碱盐
1.分类
2.性质
3.应用
酸
碱
盐
如图中甲、乙、丙、丁、戊分别为下述五种物质中的一种:CuSO4、H2SO4、Fe、Na2CO3、和Ca(OH)2,且图中相连两个环对应的物质(或其溶液)在常温条件下能发生化学反应.
(1)上述五种物质中: ①可用于农业生产改良酸性土壤的是______ ②能发生置换反应的一个化学方程式为_____
如图中甲、乙、丙、丁、戊分别为下述五种物质中的一种:CuSO4、H2SO4、Fe、Na2CO3、和Ca(OH)2,且图中相连两个环对应的物质(或其溶液)在常温条件下能发生化学反应.
(2)若图中乙为H2SO4: ①甲或丙能否为CuSO4 ? ②若乙与丁能发生中和反应,则丙为______
如图中甲、乙、丙、丁、戊分别为下述五种物质中的一种:CuSO4、H2SO4、Fe、Na2CO3、和Ca(OH)2,且图中相连两个环对应的物质(或其溶液)在常温条件下能发生化学反应.
(3)若丙为铁,则甲与戊反应的化学方程式为____
图为硫酸厂废水处理示意图,排污口流出的废水用碱液池流出的碱中和.工业生产中,在测定废水(假设只含硫酸)中硫酸的质量分数的基础上,通过调节碱液阀控制碱液的流量(单位时间排出碱液的量)达到中和废水的目的.
(1)已知:中和50 mL废水需要 1%
NaOH溶液40 mL.
试求:废水中硫酸的质量分数.
(假设废水和NaOH溶液的
密度均为1 g cm-3)
相对分子质量: NaOH—40 H2SO4 —98
(2)用1%的KOH溶液替代1 %的NaOH溶液,不仅可以中和废水、又可得到钾肥(K2SO4).若保持废水的流量不变并被完全中和,则KOH溶液的流量应该_____(填“大于”或“小于”)NaOH溶液的流量.
应用
广泛的
酸碱盐
盐
碱
酸
价值观
转化观
分类观
应用
性质
分类
作业:
1.复习本课内容
2.从分类观、转化观、价值观视角看酸碱盐的性质与转化
3.组成-性质-用途
的视角认识物质的
变化
应用广泛的酸、碱、盐小专题复习
复 习 重 点
二.单质、氧化物、酸、碱、盐的 相互关系
一.酸、碱、盐的组成、分类
Fe Fe2O3 CO2
HCl NaOH Na2CO3
H2SO4 Ca(OH)2 CuSO4
请你从物质类属的角度,
对上述物质进行分类
HCl → H+ + Cl-
H2SO4→2H+ + SO42-
NaOH → Na+ + OH-
Ca(OH)2→ Ca2+ + 2OH-
酸 → H+ + 酸根离子
碱 → 金属离子+ OH-
NaCl → Na+ + Cl-
盐 → 金属离子+ 酸根离子
Na2CO3 → 2Na+ + CO3 2-
HCl → H+ + Cl-
H2SO4→2H+ + SO42-
单质
化合物
金属
非金属
稀有气体
氧化物
酸
碱
盐
金属氧化物
非金属氧化物
1.物质的简单分类:
纯净物
混合物
物质
2.本章常见化合物:
氧化物:
酸:
碱:
盐:
CO2、SO2、CuO、Fe2O3
HCl、H2SO4、HNO3
NaOH、Ca(OH)2、NH3 H2O
Na2CO3 、NaCl、CuSO4
Fe Fe2O3 CO2
HCl NaOH Na2CO3
H2SO4 Ca(OH)2 CuSO4
请你在上述物质中归纳出H2SO4 与NaOH分别与哪些物质反应?
HCl → H+ + Cl-
H2SO4→2H+ + SO42-
酸 → H+ + 酸根离子
HCl → H+ + Cl-
H2SO4→2H+ + SO42-
(4)酸溶液与碱反应
1 酸都含有氢元素;在水溶液中都能电离出氢离子
2 酸溶液会具有许多共同的性质,如:
(1)酸溶液与酸碱指示剂的反应
(2)酸溶液与某些金属反应
(3)酸溶液与某些金属氧化物反应
组成结构
性质
决定
反映
(5)酸溶液与某些盐﹙如:碳酸盐﹚反应
Na2CO3+2HCl==2NaCl+H2O+CO2↑
CaCO3+2HCl==CaCl2+H2O+CO2↑
组成里含有CO32-的盐跟盐酸反应都能生成CO2,利用这种反应可鉴别CO32-。
例.下列生活经验不正确的是 ( )
A、用铝锅来盛放酸性物质
B、蒸馒头常用小苏打(NaHCO3)或纯碱 (Na2CO3)起发泡作用
C、用食醋除去水壶中的水垢
D、用稀盐酸除锈
1 碱都含有氢氧元素;
在水溶液中都能电离出氢氧根离子
2 碱溶液会具有许多共同的性质,如:
(1)碱溶液与酸碱指示剂的反应
(2)碱溶液与某些非金属氧化物反应
组成结构
性质
决定
反映
NaOH →Na+ + OH-
Ca(OH)2→ Ca2+ + 2OH-
碱 → 金属离子+ OH-
(4)碱溶液与某些盐反应
(3)碱溶液与酸反应
【例题】现有室温下,失去标签的两瓶体积相同的无色液体其中一瓶是稀盐酸,另一瓶是石灰水。如何鉴别?
组成上的差异→性质不同→有不同的现象
酸的通性
碱的通性
H+
OH-
有气体产生、沉淀生成、颜色变化、固体反应溶解
HCl
Ca(OH)2
利用酚酞试液鉴别稀盐酸和氢氧化钠溶液。
1.请描述现象与结论:
2.如果将两种溶液混合后,将出现什么现象,为什么?
为什么NaOH与HCl能发生反应?
HCl=H++Cl-
NaOH=Na++OH-
NaOH+HCl==NaCl+H2O
碱 酸 氯化钠 水
中和反应的实质:
H+
+
OH-
=
H2O
胃酸过多的病人可以服用斯达舒(主要成份是氢氧化铝)的原因是什么?请写出该反应化学方程式。
酸
使指示剂变色
活泼金属
金属氧化物
碱
某些盐
盐+水
盐+水
新盐+新酸
盐+氢气
复分解反应
碱
使指示剂变色
非金属氧化物
酸
某些盐
盐+水
新盐+新碱
盐+水
复分解反应
盐
某些金属
某些酸
某些碱
某些盐
请你模拟酸和碱的图示,以熟悉的物质为例,建构盐的关系图
用途广泛的酸碱盐
1.分类
2.性质
3.应用
酸
碱
盐
如图中甲、乙、丙、丁、戊分别为下述五种物质中的一种:CuSO4、H2SO4、Fe、Na2CO3、和Ca(OH)2,且图中相连两个环对应的物质(或其溶液)在常温条件下能发生化学反应.
(1)上述五种物质中: ①可用于农业生产改良酸性土壤的是______ ②能发生置换反应的一个化学方程式为_____
如图中甲、乙、丙、丁、戊分别为下述五种物质中的一种:CuSO4、H2SO4、Fe、Na2CO3、和Ca(OH)2,且图中相连两个环对应的物质(或其溶液)在常温条件下能发生化学反应.
(2)若图中乙为H2SO4: ①甲或丙能否为CuSO4 ? ②若乙与丁能发生中和反应,则丙为______
如图中甲、乙、丙、丁、戊分别为下述五种物质中的一种:CuSO4、H2SO4、Fe、Na2CO3、和Ca(OH)2,且图中相连两个环对应的物质(或其溶液)在常温条件下能发生化学反应.
(3)若丙为铁,则甲与戊反应的化学方程式为____
图为硫酸厂废水处理示意图,排污口流出的废水用碱液池流出的碱中和.工业生产中,在测定废水(假设只含硫酸)中硫酸的质量分数的基础上,通过调节碱液阀控制碱液的流量(单位时间排出碱液的量)达到中和废水的目的.
(1)已知:中和50 mL废水需要 1%
NaOH溶液40 mL.
试求:废水中硫酸的质量分数.
(假设废水和NaOH溶液的
密度均为1 g cm-3)
相对分子质量: NaOH—40 H2SO4 —98
(2)用1%的KOH溶液替代1 %的NaOH溶液,不仅可以中和废水、又可得到钾肥(K2SO4).若保持废水的流量不变并被完全中和,则KOH溶液的流量应该_____(填“大于”或“小于”)NaOH溶液的流量.
应用
广泛的
酸碱盐
盐
碱
酸
价值观
转化观
分类观
应用
性质
分类
作业:
1.复习本课内容
2.从分类观、转化观、价值观视角看酸碱盐的性质与转化
3.组成-性质-用途
的视角认识物质的
变化
