沪教版化学九年级下册 第6章 溶解现象 整理与归纳 教案(表格式)
文档属性
| 名称 | 沪教版化学九年级下册 第6章 溶解现象 整理与归纳 教案(表格式) |  | |
| 格式 | docx | ||
| 文件大小 | 26.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-11 09:33:57 | ||
图片预览


文档简介
第6章溶解现象复习课 教学设计
教学目标:
知识与技能:
1. 知道溶液的特征,认识物质溶于水时伴随能量的变化,了解水溶液的一些性质以及在生产生活中的重要应用价值。
2.会进行相关溶质质量分数的计算,初步学会配制一定溶质质量分数溶液。
3. 知道影响物质溶解性的因素,了解饱和溶液、不饱和溶液、溶解度的含义,会绘制和使用简单的溶解度曲线。了解结晶现象和获得晶体的常用方法。
过程与方法:
1. 构建知识网络,通过习题巩固所学知识,运用探究思维解决实际问题。
2. 学习从“质”和“量”两方面对溶液组成进行研究的方法。
情感态度与价值观:
1.系统认识溶液知识,发展合作、严谨的科学精神。
2. 了解溶液在生产、生活中的重要应用价值。
教学重难点:
1.饱和溶液以及不饱和溶液的转化。
2.利用溶解度、溶解度曲线解决实际问题。
教法:
引领学生对基础知识,基本技能进行梳理是必须的。应从溶液整个知识体系上归纳整理使零散知识网络化,中考考点习题化,强化概念理解,注重思维训练。
学法:
学生进行本章知识点归纳,抓住基础,积极参与,根据老师设计由浅入深,思考、讨论。
教学思路:
教学过程:
教学环节 教师活动 学生活动 设计意图
创设情境 我们一家外出旅游时,学校运动会时,都会带上一些饮料或是饮品:农夫山泉、银鹭花生奶、统一冰红茶、果粒橙、阿萨姆奶茶啊、苏打水、雪碧、穆斯利安酸奶等。 这些饮品中哪些是溶液? 农夫山泉、苏打水、雪碧、 冰红茶是溶液。 设置情境,问题驱动,充分调动学生知识储备,解决问题,获得成就感。
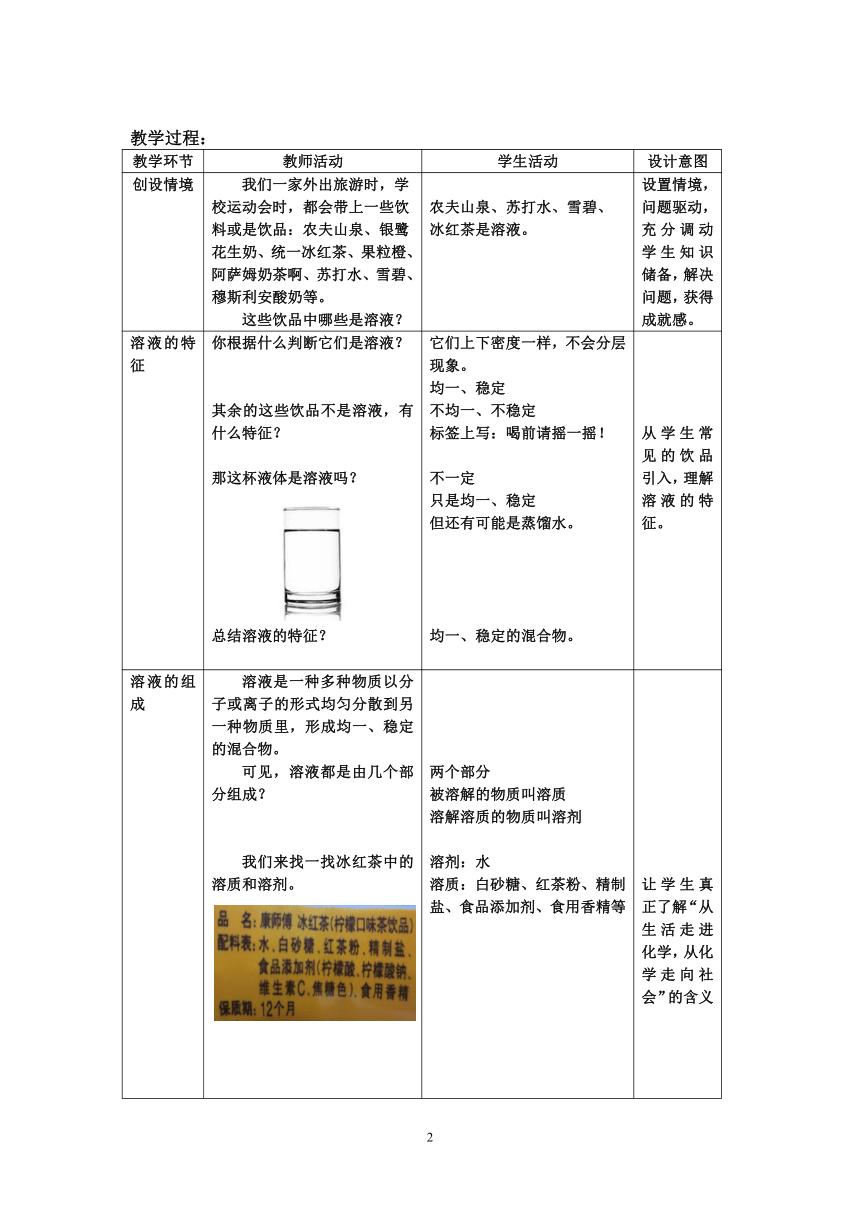
溶液的特征 你根据什么判断它们是溶液? 其余的这些饮品不是溶液,有什么特征? 那这杯液体是溶液吗? 总结溶液的特征? 它们上下密度一样,不会分层现象。 均一、稳定 不均一、不稳定 标签上写:喝前请摇一摇! 不一定 只是均一、稳定 但还有可能是蒸馏水。 均一、稳定的混合物。 从学生常见的饮品引入,理解溶液的特征。
溶液的组成 溶液是一种多种物质以分子或离子的形式均匀分散到另一种物质里,形成均一、稳定的混合物。 可见,溶液都是由几个部分组成? 我们来找一找冰红茶中的溶质和溶剂。 我们来看看实验室中的溶液: 如果这杯是澄清石灰水,溶质和溶剂? 如果这杯是食盐水,溶质和溶剂? 如果这杯是盐酸,溶质和溶剂? 如果这杯是酒精溶液,溶质和溶剂? 可见,溶质可以是固态、液态和气态三种状态,那溶剂只能是水? 那么这些溶质的分散形式? 氢氧化钙 氯化钠 氯化氢 酒精 电解水时,向水中加稀硫酸或是氢氧化钠溶液目的? 某些溶液能导电的原因? 某些溶液不能导电的原因? 两个部分 被溶解的物质叫溶质 溶解溶质的物质叫溶剂 溶剂:水 溶质:白砂糖、红茶粉、精制盐、食品添加剂、食用香精等 氢氧化钙 水 氯化钠 水 氯化氢 水 酒精 水 不一定 比如:碘酒的溶剂是酒精 钙离子和氢氧根离子 氯离子和钠离子 氢离子和氯离子 酒精分子 增强水的导电性 溶液中有自由移动的离子 溶液中没有自由移动的离子 让学生真正了解“从生活走进化学,从化学走向社会”的含义 创设讨论情境,激活学生的思维,使学生在轻松愉快的氛围中感知知识就在我们身边。
溶液的性质 物质在溶解过程中,除了导电性可能发生了变化,还伴随哪些变化? 水是无色的,溶液都是无色? 如果在水中分别加入硝酸铵、氢氧化钠和氯化钠,有什么变化? 可见,物质在溶解时,还伴随能量的变化。 冬天在汽车的水箱里加入乙二醇能防止水结冰,这是利用了什么原理? 大量的实验表明,少量的固体溶于水,还能使稀溶液的沸点升高。 我们再来看看农夫山泉的标签: 那我们推测雪碧显什么性? 不是 高锰酸钾溶液是紫红色 氯化铁溶液是黄色 氯化亚铁溶液是浅绿色 硫酸铜溶液是蓝色 硝酸铵溶于水吸热 氢氧化钠溶于水放热 降低了稀溶液的凝固点 农夫山泉略显碱性 雪碧显酸性 让学生有充分展现自我的机会
物质的溶解性 雪碧中的溶质和溶剂是什么? 在通常情况下,1L水中溶解1L的二氧化碳。在生产过程中,一般通过加压将二氧化碳溶解的更多。 可见,气体的溶解性和压强有关。 同时,我们喝完汽水会打嗝,请解释一下原因? 总结:影响气体溶解性的因素?还有吗? 我们知道: 二氧化碳能溶于水 氧气不易溶于水 氢气难溶于水 实验室收集二氧化碳一般不用排水法,但是可以在水上铺一层植物油,利用原理? 那么,影响固体物质的溶解性的因素? 与气体不同的是,大多数固体溶解性随温度升高而增强,极少数固体的溶解性随温度升高而减弱。 溶质是二氧化碳等 溶剂是水 压强越大,气体溶解能力越强 温度升高,气体溶解能力减弱 压强和温度 气体溶解性还与气体的性质有关。 二氧化碳能溶于水 但不溶于植物油 说明,气体溶解性还与溶剂性质有关。 溶质性质 溶剂性质 温度 引导学生确立“从生活走进化学,从化学走向社会”的学习意识。
溶液的分类 一定温度下,溶质能无限制的溶解在一定量的溶剂里吗? 如果这杯是硝酸钾溶液,它是饱和溶液还是不饱和溶液? 那这杯呢? 那如何将未溶解的硝酸钾溶解呢? 因此,只有指明“一定温度下”和“一定量的溶剂里”饱和溶液才有意义。 那这杯饱和溶液还能溶解其他物质? 从刚才的实验设计中可见饱和溶液和不饱和溶液之间是可以相互转化的。 根据溶液的状态可以将溶液分为饱和溶液和不饱和溶液;我们还可以根据溶液溶质的质量分数大小还可以分为浓溶液和稀溶液,那它们之间有什么内在的关系? 不会 会达到饱和状态 可能是饱和溶液 也可能是不饱和溶液 饱和溶液 里面还有未溶解的固体 升温 加水 可以加高锰酸钾试试 对不同的溶质来说,饱和溶液不一定是浓溶液,不饱和溶液也不一定是稀溶液。 在一定的温度下,同一种溶质的饱和溶液比不饱和溶液要浓。 让学生通过自己研究,培养总结归纳的能力。
溶液的配制 农业上用16%的食盐水选种,是饱和溶液还是不饱和溶液? 请你配制50g16%NaCl溶液, 实验室提供:足量的NaCl和蒸馏水、100g溶质质量分数为20%溶液你有哪些方法? 回顾溶液配制和溶液稀释的一般步骤和仪器。 不饱和溶液 方法1: 8gNaCl溶解在42g水中 方法2: 40g20% NaCl溶液加10g水稀释 结合化学学科特点,在学习方法和学习要求上,给予指导
溶解度及溶解度曲线 结晶方法 在20℃时,在100g水中最多能溶解36g氯化钠,可见20℃时,氯化钠的溶解度? 固体物质溶解度四要素? 固体物质溶解度随温度变化可以用列表法: 从表中可以获得哪些信息? 固体物质溶解度随温度变化除了可以用列表法还可以用坐标法。 我们以温度为横坐标,以溶解度为纵坐标,在坐标上先找到不同温度下相应溶解度的点,再用光滑的曲线将这些点连接起来,就是溶解度曲线。 (1)你能获得的信息 (2)你能在t1时配制溶质质量分数为20%的A溶液吗 (3)在t2时,等质量A和B饱和溶液降温至t1,析出晶体质量,所得溶液的质量,溶质质量、溶剂质量、溶质质量分数的大小? (4)在t2时,将25gA放在100g水中,形成A的______溶液(填“饱和”或“不饱和”) 降温至t1时,溶液状态将发生怎样变化? 降温结晶和蒸发结晶 A(B): B(A): 20g 一定温度 100g溶剂 达到饱和状态 溶质的质量 硝酸钾溶解度随温度升高而显著增大。 氯化钠溶解度随温度升高而缓慢增大。 t1时,A和B的溶解度都是20g t1时,A和B饱和溶液的溶质质量分数相等。 t1时,等量A和B的饱和溶液溶质质量相等。 不能 t1时,A的饱和溶液溶质质量分数是16.7% 析出晶体 A>B m液 A<B ω A=B m质 A<B m剂 A<B 不饱和 不饱和→饱和→有晶体析出 降温结晶 蒸发结晶 加深对溶解度的认识,树立学以致用的意识。
板书设计:
7
教学目标:
知识与技能:
1. 知道溶液的特征,认识物质溶于水时伴随能量的变化,了解水溶液的一些性质以及在生产生活中的重要应用价值。
2.会进行相关溶质质量分数的计算,初步学会配制一定溶质质量分数溶液。
3. 知道影响物质溶解性的因素,了解饱和溶液、不饱和溶液、溶解度的含义,会绘制和使用简单的溶解度曲线。了解结晶现象和获得晶体的常用方法。
过程与方法:
1. 构建知识网络,通过习题巩固所学知识,运用探究思维解决实际问题。
2. 学习从“质”和“量”两方面对溶液组成进行研究的方法。
情感态度与价值观:
1.系统认识溶液知识,发展合作、严谨的科学精神。
2. 了解溶液在生产、生活中的重要应用价值。
教学重难点:
1.饱和溶液以及不饱和溶液的转化。
2.利用溶解度、溶解度曲线解决实际问题。
教法:
引领学生对基础知识,基本技能进行梳理是必须的。应从溶液整个知识体系上归纳整理使零散知识网络化,中考考点习题化,强化概念理解,注重思维训练。
学法:
学生进行本章知识点归纳,抓住基础,积极参与,根据老师设计由浅入深,思考、讨论。
教学思路:
教学过程:
教学环节 教师活动 学生活动 设计意图
创设情境 我们一家外出旅游时,学校运动会时,都会带上一些饮料或是饮品:农夫山泉、银鹭花生奶、统一冰红茶、果粒橙、阿萨姆奶茶啊、苏打水、雪碧、穆斯利安酸奶等。 这些饮品中哪些是溶液? 农夫山泉、苏打水、雪碧、 冰红茶是溶液。 设置情境,问题驱动,充分调动学生知识储备,解决问题,获得成就感。
溶液的特征 你根据什么判断它们是溶液? 其余的这些饮品不是溶液,有什么特征? 那这杯液体是溶液吗? 总结溶液的特征? 它们上下密度一样,不会分层现象。 均一、稳定 不均一、不稳定 标签上写:喝前请摇一摇! 不一定 只是均一、稳定 但还有可能是蒸馏水。 均一、稳定的混合物。 从学生常见的饮品引入,理解溶液的特征。
溶液的组成 溶液是一种多种物质以分子或离子的形式均匀分散到另一种物质里,形成均一、稳定的混合物。 可见,溶液都是由几个部分组成? 我们来找一找冰红茶中的溶质和溶剂。 我们来看看实验室中的溶液: 如果这杯是澄清石灰水,溶质和溶剂? 如果这杯是食盐水,溶质和溶剂? 如果这杯是盐酸,溶质和溶剂? 如果这杯是酒精溶液,溶质和溶剂? 可见,溶质可以是固态、液态和气态三种状态,那溶剂只能是水? 那么这些溶质的分散形式? 氢氧化钙 氯化钠 氯化氢 酒精 电解水时,向水中加稀硫酸或是氢氧化钠溶液目的? 某些溶液能导电的原因? 某些溶液不能导电的原因? 两个部分 被溶解的物质叫溶质 溶解溶质的物质叫溶剂 溶剂:水 溶质:白砂糖、红茶粉、精制盐、食品添加剂、食用香精等 氢氧化钙 水 氯化钠 水 氯化氢 水 酒精 水 不一定 比如:碘酒的溶剂是酒精 钙离子和氢氧根离子 氯离子和钠离子 氢离子和氯离子 酒精分子 增强水的导电性 溶液中有自由移动的离子 溶液中没有自由移动的离子 让学生真正了解“从生活走进化学,从化学走向社会”的含义 创设讨论情境,激活学生的思维,使学生在轻松愉快的氛围中感知知识就在我们身边。
溶液的性质 物质在溶解过程中,除了导电性可能发生了变化,还伴随哪些变化? 水是无色的,溶液都是无色? 如果在水中分别加入硝酸铵、氢氧化钠和氯化钠,有什么变化? 可见,物质在溶解时,还伴随能量的变化。 冬天在汽车的水箱里加入乙二醇能防止水结冰,这是利用了什么原理? 大量的实验表明,少量的固体溶于水,还能使稀溶液的沸点升高。 我们再来看看农夫山泉的标签: 那我们推测雪碧显什么性? 不是 高锰酸钾溶液是紫红色 氯化铁溶液是黄色 氯化亚铁溶液是浅绿色 硫酸铜溶液是蓝色 硝酸铵溶于水吸热 氢氧化钠溶于水放热 降低了稀溶液的凝固点 农夫山泉略显碱性 雪碧显酸性 让学生有充分展现自我的机会
物质的溶解性 雪碧中的溶质和溶剂是什么? 在通常情况下,1L水中溶解1L的二氧化碳。在生产过程中,一般通过加压将二氧化碳溶解的更多。 可见,气体的溶解性和压强有关。 同时,我们喝完汽水会打嗝,请解释一下原因? 总结:影响气体溶解性的因素?还有吗? 我们知道: 二氧化碳能溶于水 氧气不易溶于水 氢气难溶于水 实验室收集二氧化碳一般不用排水法,但是可以在水上铺一层植物油,利用原理? 那么,影响固体物质的溶解性的因素? 与气体不同的是,大多数固体溶解性随温度升高而增强,极少数固体的溶解性随温度升高而减弱。 溶质是二氧化碳等 溶剂是水 压强越大,气体溶解能力越强 温度升高,气体溶解能力减弱 压强和温度 气体溶解性还与气体的性质有关。 二氧化碳能溶于水 但不溶于植物油 说明,气体溶解性还与溶剂性质有关。 溶质性质 溶剂性质 温度 引导学生确立“从生活走进化学,从化学走向社会”的学习意识。
溶液的分类 一定温度下,溶质能无限制的溶解在一定量的溶剂里吗? 如果这杯是硝酸钾溶液,它是饱和溶液还是不饱和溶液? 那这杯呢? 那如何将未溶解的硝酸钾溶解呢? 因此,只有指明“一定温度下”和“一定量的溶剂里”饱和溶液才有意义。 那这杯饱和溶液还能溶解其他物质? 从刚才的实验设计中可见饱和溶液和不饱和溶液之间是可以相互转化的。 根据溶液的状态可以将溶液分为饱和溶液和不饱和溶液;我们还可以根据溶液溶质的质量分数大小还可以分为浓溶液和稀溶液,那它们之间有什么内在的关系? 不会 会达到饱和状态 可能是饱和溶液 也可能是不饱和溶液 饱和溶液 里面还有未溶解的固体 升温 加水 可以加高锰酸钾试试 对不同的溶质来说,饱和溶液不一定是浓溶液,不饱和溶液也不一定是稀溶液。 在一定的温度下,同一种溶质的饱和溶液比不饱和溶液要浓。 让学生通过自己研究,培养总结归纳的能力。
溶液的配制 农业上用16%的食盐水选种,是饱和溶液还是不饱和溶液? 请你配制50g16%NaCl溶液, 实验室提供:足量的NaCl和蒸馏水、100g溶质质量分数为20%溶液你有哪些方法? 回顾溶液配制和溶液稀释的一般步骤和仪器。 不饱和溶液 方法1: 8gNaCl溶解在42g水中 方法2: 40g20% NaCl溶液加10g水稀释 结合化学学科特点,在学习方法和学习要求上,给予指导
溶解度及溶解度曲线 结晶方法 在20℃时,在100g水中最多能溶解36g氯化钠,可见20℃时,氯化钠的溶解度? 固体物质溶解度四要素? 固体物质溶解度随温度变化可以用列表法: 从表中可以获得哪些信息? 固体物质溶解度随温度变化除了可以用列表法还可以用坐标法。 我们以温度为横坐标,以溶解度为纵坐标,在坐标上先找到不同温度下相应溶解度的点,再用光滑的曲线将这些点连接起来,就是溶解度曲线。 (1)你能获得的信息 (2)你能在t1时配制溶质质量分数为20%的A溶液吗 (3)在t2时,等质量A和B饱和溶液降温至t1,析出晶体质量,所得溶液的质量,溶质质量、溶剂质量、溶质质量分数的大小? (4)在t2时,将25gA放在100g水中,形成A的______溶液(填“饱和”或“不饱和”) 降温至t1时,溶液状态将发生怎样变化? 降温结晶和蒸发结晶 A(B): B(A): 20g 一定温度 100g溶剂 达到饱和状态 溶质的质量 硝酸钾溶解度随温度升高而显著增大。 氯化钠溶解度随温度升高而缓慢增大。 t1时,A和B的溶解度都是20g t1时,A和B饱和溶液的溶质质量分数相等。 t1时,等量A和B的饱和溶液溶质质量相等。 不能 t1时,A的饱和溶液溶质质量分数是16.7% 析出晶体 A>B m液 A<B ω A=B m质 A<B m剂 A<B 不饱和 不饱和→饱和→有晶体析出 降温结晶 蒸发结晶 加深对溶解度的认识,树立学以致用的意识。
板书设计:
7
