沪教版化学九年级下册 第7章 应用广泛的酸·碱·盐 第2节 常见的酸和碱学案
文档属性
| 名称 | 沪教版化学九年级下册 第7章 应用广泛的酸·碱·盐 第2节 常见的酸和碱学案 | 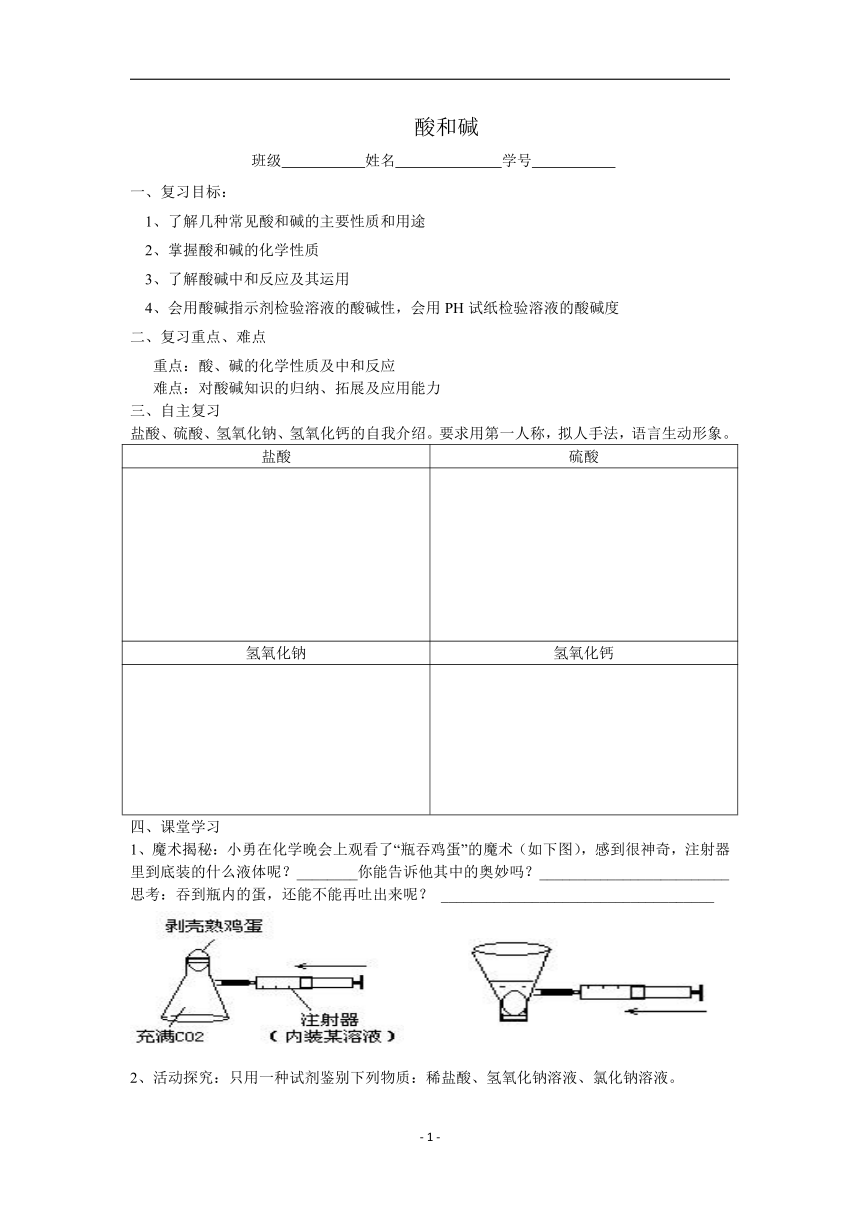 | |
| 格式 | docx | ||
| 文件大小 | 81.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-22 09:57:43 | ||
图片预览


文档简介
酸和碱
班级 姓名 学号
一、复习目标:
1、了解几种常见酸和碱的主要性质和用途
2、掌握酸和碱的化学性质
3、了解酸碱中和反应及其运用
4、会用酸碱指示剂检验溶液的酸碱性,会用PH试纸检验溶液的酸碱度
二、复习重点、难点
重点:酸、碱的化学性质及中和反应
难点:对酸碱知识的归纳、拓展及应用能力
三、自主复习
盐酸、硫酸、氢氧化钠、氢氧化钙的自我介绍。要求用第一人称,拟人手法,语言生动形象。
盐酸 硫酸
氢氧化钠 氢氧化钙
四、课堂学习
1、魔术揭秘:小勇在化学晚会上观看了“瓶吞鸡蛋”的魔术(如下图),感到很神奇,注射器里到底装的什么液体呢?________你能告诉他其中的奥妙吗?_________________________
思考:吞到瓶内的蛋,还能不能再吐出来呢? ____________________________________
2、活动探究:只用一种试剂鉴别下列物质:稀盐酸、氢氧化钠溶液、氯化钠溶液。
可选的试剂有:
练习.A、B、C、D各图中PH变化对应的是下列哪种操作?
(1)向稀硫酸中逐滴加入稀氢氧化钠溶液( ) (2)向水中不断通入二氧化碳( )(3)向氢氧化钠溶液中逐滴加水稀释( ) (4)向水中加生石灰( )
3、联系生活
(1)写出盐酸硫酸除铁锈的化学方程式:___________________________________,
______________________________________。
不能一直浸泡的原因:________________________,_____________________________。当看到________________现象时就不能继续浸泡了。
(2)硫酸工厂泄露,用什么处理?化学方程式:
(3)为什么“斯达舒”[主要成分为Al(OH)3]与“养怡谓动力”[主要成分为NaHCO3]可以用来治疗胃酸过多症?写出反应的化学方程式:
。
4、强化训练
1.某小山村有座硫酸厂,该厂每天排放大量含SO2的废气和酸性废水。当地的其它工厂和居民均用煤炭作燃料。只要下雨就下酸雨,对该村环境造成极大破坏。
(1)分析该村下酸雨的原因:_________
(2)村长召开村委会,提出了治理酸雨的下列措施,你认为其中不妥的是( )
A.立即关闭该硫酸厂 B.建议环保部门限令整改
C.将硫酸厂排出的废气中的SO2处理后排放 D.工厂和居民改用较清洁的燃料
(3)该硫酸工厂原来用氢氧化钠溶液中和所排废水中的硫酸,现改用氢氧化钾溶液中和以得到钾肥,若氢氧化钾溶液的溶质质量分数与原来氢氧化钠溶液的溶质质量分数相同,则此时碱流量阀调节的方法是( )
A.不用变动 B.减小流量 C.加大流量 D.无法确定
2.在一条鱼虾绝迹的小河边,有四座工厂:甲、乙、丙、丁。他们排放的废液里,每厂只有碳酸钠、氯化铁、氢氧化钙、盐酸的一种。某中学环保小组实地调查的情况如图。甲处的河水是乳白色的,乙处的河水是红褐色的,丙处的河水变清了,丁处的河水是清的,但有气泡产生。请推测这四座工厂废液里的污染物?
甲 乙
丙 丁
五、课堂反馈
1.下列物质中,属于同一种物质的是
A.烧碱 纯碱 火碱 B.石灰石 大理石 生石灰
C.冰 干冰 碳酸气 D.消石灰 熟石灰 氢氧化钙
2.下列有关物质用途的说法,错误的是
A.用氢氧化钠改良酸性土壤 B.用氢氧化铝治疗胃酸过多
C.用稀盐酸除金属表面的锈 D.用浓硫酸干燥CO2气体
3.下列物质不能由金属和酸直接反应制得的是
A.NaCl B.FeCl3 C.AlCl3 D.MgCl2
4.下列记录的实验现象与事实不符的是
A.氢氧化钠固体溶于水,水温升高 B.打开盛有浓硫酸的试剂瓶,瓶口产生白烟
C.加热饱和澄清石灰水,石灰水变浑浊 D.浓硫酸沿烧杯壁慢慢注入水中,水温升高
5.下图是稀盐酸和氢氧化钠溶液反应的pH变化曲线,以下说法正确的是
A. 该反应是稀盐酸滴入氢氧化钠溶液中
B. a g是指加入氢氧化钠固体质量
C.A点溶液的溶质为HCl和NaCl
D.B点表示稀盐酸和加入的NaOH溶液质量一定相同
6.下列物质之间的反应属于复分解反应的是
A.每条在空气中燃烧生成氧化镁
B.锌粒和稀硫酸反应生成氢气
C.氢氧化钠溶液和硫酸铜溶液混合生成氢氧化铜沉淀
D.氢氧化钾与二氧化碳反应
7.有四种澄清透明的溶液:①MgCl2溶液 ②Cu(NO3)2溶液 ③K2SO4溶液 ④KOH溶 液。不用其他试剂就可进行鉴别,鉴别出来的先后顺序是
A.④①②③ B.②④①③ C.③②①④ D.②①③④
8.有四种溶液:①1%的盐酸;②10%的盐酸;③NaCl的稀溶液;④1%的NaOH溶液;
⑤10%的NaOH的溶液,这五种溶液的pH按由小到大的顺序排列,正确的是
A.①<②<③<④<⑤ B.②<①<③<④<⑤
C.⑤<④<③<②<① D.②<①<④<③<⑤
9.下列各组物质在pH=14的某无色溶液中能大量共存,且溶液仍为无色的是
A.FeCl3 NaCl KNO3 B.NaCl NaOH NaNO3
C.Ca(OH)2 NaNO3 Na2CO3 D.KNO3 H2SO4 NaCl
10.现有氧化铁、稀硫酸、氢氧化钠溶液、氯化钡溶液和碳酸钾溶液五种物质,在常温下它们两两相互发生的化学反应有
A.4个 B.5个 C.6个 D.7个
六、课后练习
1.黄铜是以铜为主要元素,添加元素锌的合金。黄铜渣中约含Zn 7%、ZnO 31%、Cu 50%、CuO 5%,其余为杂质。处理黄铜渣可得到硫酸锌,其主要流程如下(杂质不溶于水、不参与反应):
(1)步骤Ⅰ中产生气体的化学方程式为 。
(2)溶液A中的金属阳离子有
(3)步骤Ⅰ、Ⅱ中均包含的操作名称为 ,此操作和步骤Ⅲ中的蒸发操作都要用到的玻璃仪器是 。
(4)溶液A (填“大于”、“小于”或“等于”)溶液C的质量。
2.在化学实验课上,老师为每组同学分别提供了一瓶氢氧化钠溶液,让他们用1%的稀盐酸来测定其溶质的质量分数(NaOH+HCl===NaCl+H2O).以下是几组同学的设想及做法:
(1)甲组同学的实验如图1所示:在烧杯中加入5g氢氧化钠溶液,滴入几滴酚酞溶液,用滴管慢慢滴入1%的稀盐酸,并不断搅拌,至溶液颜色恰好变为无色为止。
请回答:①酚酞溶液的作用是 ;
②边滴加稀盐酸,边要用玻璃棒不断搅拌的目的是 .
③当溶液颜色恰好变为无色时,共用去了稀盐酸7.3g,则甲组这瓶氢氧化钠溶液中溶质的质量分数为 (写出计算过程,结果用百分数表示)。
(2)乙组同学的设想是:在烧杯中加入一定量的氢氧化钠溶液,用滴管慢慢滴入1%的稀盐酸,并不断搅拌,通过用pH试纸多次测定溶液pH的办法,达到实验目的。
①下列使用pH试纸的方法正确的是 (填字母).
A.将pH试纸剪成几段节约使用 B.将pH试纸直接插入待测液中
C.将pH试纸放在干净的白瓷板上,用玻璃棒蘸取待测液滴在pH试纸上
D.将pH试纸润湿后放在玻璃片上,用玻璃棒蘸取待测液滴在pH试纸上
②由于用pH试纸需多次测定,较繁琐,且所测数值不够精确。在老师指导下,乙组同学取了5g氢氧化钠溶液进行了数字化实验,由计算机描绘出了整个实验过程中溶液pH的变化图象(简单表示为如图2)。
请回答:图2中a点表示的含义是 ;b点溶液中含有的阳离子有 (填离子符号);乙组同学要计算出本组这瓶氢氧化钠溶液中溶质的质量分数,除了要用到已有数据外,你认为还需要的数据是 。
- 4 -
班级 姓名 学号
一、复习目标:
1、了解几种常见酸和碱的主要性质和用途
2、掌握酸和碱的化学性质
3、了解酸碱中和反应及其运用
4、会用酸碱指示剂检验溶液的酸碱性,会用PH试纸检验溶液的酸碱度
二、复习重点、难点
重点:酸、碱的化学性质及中和反应
难点:对酸碱知识的归纳、拓展及应用能力
三、自主复习
盐酸、硫酸、氢氧化钠、氢氧化钙的自我介绍。要求用第一人称,拟人手法,语言生动形象。
盐酸 硫酸
氢氧化钠 氢氧化钙
四、课堂学习
1、魔术揭秘:小勇在化学晚会上观看了“瓶吞鸡蛋”的魔术(如下图),感到很神奇,注射器里到底装的什么液体呢?________你能告诉他其中的奥妙吗?_________________________
思考:吞到瓶内的蛋,还能不能再吐出来呢? ____________________________________
2、活动探究:只用一种试剂鉴别下列物质:稀盐酸、氢氧化钠溶液、氯化钠溶液。
可选的试剂有:
练习.A、B、C、D各图中PH变化对应的是下列哪种操作?
(1)向稀硫酸中逐滴加入稀氢氧化钠溶液( ) (2)向水中不断通入二氧化碳( )(3)向氢氧化钠溶液中逐滴加水稀释( ) (4)向水中加生石灰( )
3、联系生活
(1)写出盐酸硫酸除铁锈的化学方程式:___________________________________,
______________________________________。
不能一直浸泡的原因:________________________,_____________________________。当看到________________现象时就不能继续浸泡了。
(2)硫酸工厂泄露,用什么处理?化学方程式:
(3)为什么“斯达舒”[主要成分为Al(OH)3]与“养怡谓动力”[主要成分为NaHCO3]可以用来治疗胃酸过多症?写出反应的化学方程式:
。
4、强化训练
1.某小山村有座硫酸厂,该厂每天排放大量含SO2的废气和酸性废水。当地的其它工厂和居民均用煤炭作燃料。只要下雨就下酸雨,对该村环境造成极大破坏。
(1)分析该村下酸雨的原因:_________
(2)村长召开村委会,提出了治理酸雨的下列措施,你认为其中不妥的是( )
A.立即关闭该硫酸厂 B.建议环保部门限令整改
C.将硫酸厂排出的废气中的SO2处理后排放 D.工厂和居民改用较清洁的燃料
(3)该硫酸工厂原来用氢氧化钠溶液中和所排废水中的硫酸,现改用氢氧化钾溶液中和以得到钾肥,若氢氧化钾溶液的溶质质量分数与原来氢氧化钠溶液的溶质质量分数相同,则此时碱流量阀调节的方法是( )
A.不用变动 B.减小流量 C.加大流量 D.无法确定
2.在一条鱼虾绝迹的小河边,有四座工厂:甲、乙、丙、丁。他们排放的废液里,每厂只有碳酸钠、氯化铁、氢氧化钙、盐酸的一种。某中学环保小组实地调查的情况如图。甲处的河水是乳白色的,乙处的河水是红褐色的,丙处的河水变清了,丁处的河水是清的,但有气泡产生。请推测这四座工厂废液里的污染物?
甲 乙
丙 丁
五、课堂反馈
1.下列物质中,属于同一种物质的是
A.烧碱 纯碱 火碱 B.石灰石 大理石 生石灰
C.冰 干冰 碳酸气 D.消石灰 熟石灰 氢氧化钙
2.下列有关物质用途的说法,错误的是
A.用氢氧化钠改良酸性土壤 B.用氢氧化铝治疗胃酸过多
C.用稀盐酸除金属表面的锈 D.用浓硫酸干燥CO2气体
3.下列物质不能由金属和酸直接反应制得的是
A.NaCl B.FeCl3 C.AlCl3 D.MgCl2
4.下列记录的实验现象与事实不符的是
A.氢氧化钠固体溶于水,水温升高 B.打开盛有浓硫酸的试剂瓶,瓶口产生白烟
C.加热饱和澄清石灰水,石灰水变浑浊 D.浓硫酸沿烧杯壁慢慢注入水中,水温升高
5.下图是稀盐酸和氢氧化钠溶液反应的pH变化曲线,以下说法正确的是
A. 该反应是稀盐酸滴入氢氧化钠溶液中
B. a g是指加入氢氧化钠固体质量
C.A点溶液的溶质为HCl和NaCl
D.B点表示稀盐酸和加入的NaOH溶液质量一定相同
6.下列物质之间的反应属于复分解反应的是
A.每条在空气中燃烧生成氧化镁
B.锌粒和稀硫酸反应生成氢气
C.氢氧化钠溶液和硫酸铜溶液混合生成氢氧化铜沉淀
D.氢氧化钾与二氧化碳反应
7.有四种澄清透明的溶液:①MgCl2溶液 ②Cu(NO3)2溶液 ③K2SO4溶液 ④KOH溶 液。不用其他试剂就可进行鉴别,鉴别出来的先后顺序是
A.④①②③ B.②④①③ C.③②①④ D.②①③④
8.有四种溶液:①1%的盐酸;②10%的盐酸;③NaCl的稀溶液;④1%的NaOH溶液;
⑤10%的NaOH的溶液,这五种溶液的pH按由小到大的顺序排列,正确的是
A.①<②<③<④<⑤ B.②<①<③<④<⑤
C.⑤<④<③<②<① D.②<①<④<③<⑤
9.下列各组物质在pH=14的某无色溶液中能大量共存,且溶液仍为无色的是
A.FeCl3 NaCl KNO3 B.NaCl NaOH NaNO3
C.Ca(OH)2 NaNO3 Na2CO3 D.KNO3 H2SO4 NaCl
10.现有氧化铁、稀硫酸、氢氧化钠溶液、氯化钡溶液和碳酸钾溶液五种物质,在常温下它们两两相互发生的化学反应有
A.4个 B.5个 C.6个 D.7个
六、课后练习
1.黄铜是以铜为主要元素,添加元素锌的合金。黄铜渣中约含Zn 7%、ZnO 31%、Cu 50%、CuO 5%,其余为杂质。处理黄铜渣可得到硫酸锌,其主要流程如下(杂质不溶于水、不参与反应):
(1)步骤Ⅰ中产生气体的化学方程式为 。
(2)溶液A中的金属阳离子有
(3)步骤Ⅰ、Ⅱ中均包含的操作名称为 ,此操作和步骤Ⅲ中的蒸发操作都要用到的玻璃仪器是 。
(4)溶液A (填“大于”、“小于”或“等于”)溶液C的质量。
2.在化学实验课上,老师为每组同学分别提供了一瓶氢氧化钠溶液,让他们用1%的稀盐酸来测定其溶质的质量分数(NaOH+HCl===NaCl+H2O).以下是几组同学的设想及做法:
(1)甲组同学的实验如图1所示:在烧杯中加入5g氢氧化钠溶液,滴入几滴酚酞溶液,用滴管慢慢滴入1%的稀盐酸,并不断搅拌,至溶液颜色恰好变为无色为止。
请回答:①酚酞溶液的作用是 ;
②边滴加稀盐酸,边要用玻璃棒不断搅拌的目的是 .
③当溶液颜色恰好变为无色时,共用去了稀盐酸7.3g,则甲组这瓶氢氧化钠溶液中溶质的质量分数为 (写出计算过程,结果用百分数表示)。
(2)乙组同学的设想是:在烧杯中加入一定量的氢氧化钠溶液,用滴管慢慢滴入1%的稀盐酸,并不断搅拌,通过用pH试纸多次测定溶液pH的办法,达到实验目的。
①下列使用pH试纸的方法正确的是 (填字母).
A.将pH试纸剪成几段节约使用 B.将pH试纸直接插入待测液中
C.将pH试纸放在干净的白瓷板上,用玻璃棒蘸取待测液滴在pH试纸上
D.将pH试纸润湿后放在玻璃片上,用玻璃棒蘸取待测液滴在pH试纸上
②由于用pH试纸需多次测定,较繁琐,且所测数值不够精确。在老师指导下,乙组同学取了5g氢氧化钠溶液进行了数字化实验,由计算机描绘出了整个实验过程中溶液pH的变化图象(简单表示为如图2)。
请回答:图2中a点表示的含义是 ;b点溶液中含有的阳离子有 (填离子符号);乙组同学要计算出本组这瓶氢氧化钠溶液中溶质的质量分数,除了要用到已有数据外,你认为还需要的数据是 。
- 4 -
