沪教版化学九年级下册第6章溶解现象整理与归纳 课件(共17张PPT)
文档属性
| 名称 | 沪教版化学九年级下册第6章溶解现象整理与归纳 课件(共17张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-24 22:38:39 | ||
图片预览





文档简介
(共17张PPT)
整理与归纳
学习目标
1.了解饱和溶液的含义。
2.了解饱和溶液和不饱和溶液在一定条件下的相互转化。
3.了解溶解度的含义。
4.会利用溶解度表或溶解度曲线,查阅有关物质的溶解性或 溶解度。
5.了解结晶现象。
考 点 聚 焦
1 饱和溶液与不饱和溶液
1.概念:在一定______下,向______________里加入某种溶质,当溶质__________________时,所得的溶液叫作这种溶质的饱和溶液。反之叫不饱和溶液。
温度
一定量溶剂
不能继续溶解
2.判断方法
(1)当溶液中有固态溶质时,若固体__________________,
那么该溶液是饱和的;若固体________,那么该溶液是不饱和的。
(2)当溶液中没有固态溶质时,向溶液中加入少量相应的溶质,若__________,则原溶液是饱和的;若_____________,则原溶液是不饱和的。
(3)当溶液中有晶体析出时,析出晶体后的溶液一定是饱和溶液。
不再减少
减少
不溶解
继续溶解
饱和溶液
不饱和溶液
1、加溶剂
2、升温(大多数)
1、加溶质
2、恒温蒸发溶剂
3、降温(大多数)
3.相互转化(对大多数固体溶质来说)
0.05
0.10
0.15
0.20
90
70
40
0
10
20
50
60
80
100
30
溶解度/
g
0.05
0.10
0.15
0.20
90
70
40
0
10
20
50
60
80
100
30
温度/℃
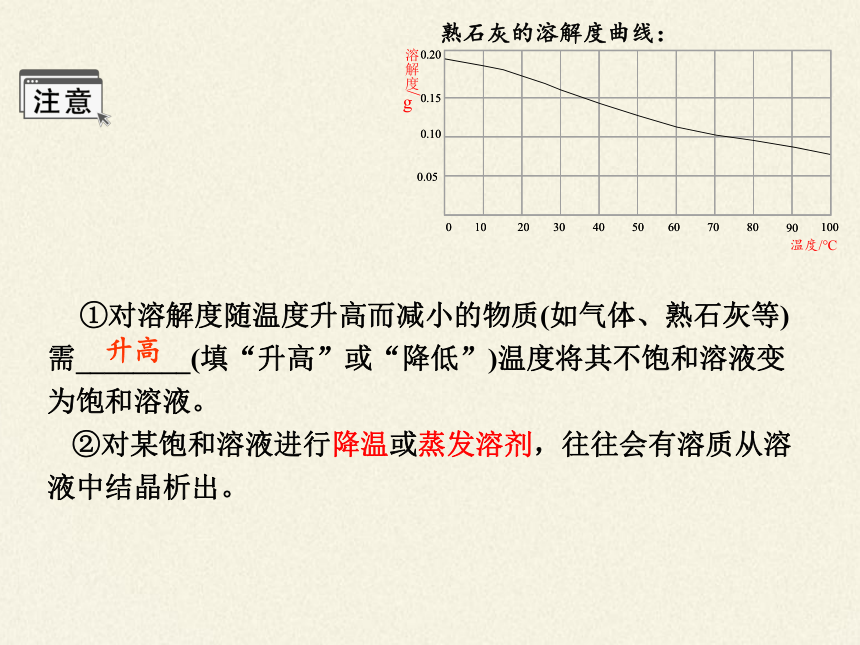
熟石灰的溶解度曲线:
①对溶解度随温度升高而减小的物质(如气体、熟石灰等)需________(填“升高”或“降低”)温度将其不饱和溶液变为饱和溶液。
②对某饱和溶液进行降温或蒸发溶剂,往往会有溶质从溶液中结晶析出。
升高
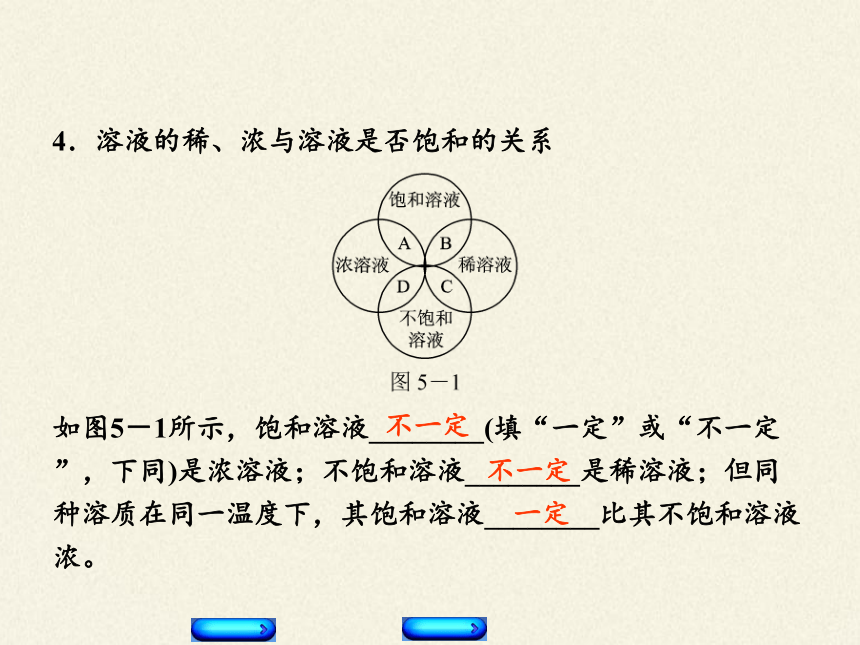
4.溶液的稀、浓与溶液是否饱和的关系
如图5-1所示,饱和溶液________(填“一定”或“不一定”,下同)是浓溶液;不饱和溶液________是稀溶液;但同种溶质在同一温度下,其饱和溶液________比其不饱和溶液浓。
不一定
不一定
一定
徐州考点探究
饱和溶液、不饱和溶液
命题角度:考查饱和溶液与不饱和溶液的判定方法及相互转化。
例1 A、B两个烧杯中盛有相同质量的水(其中A烧杯中水温为10 ℃,B烧杯中水温为30 ℃,不考虑溶解过程中温度的变化),分别在两个烧杯中加入10 g甲物质,充分溶解后所得现象如图5-2所示,下列说法正确的是( )
A
A.A烧杯中的溶液一定是饱和溶液
B.B烧杯中的溶液一定是不饱和溶液
C.若将A烧杯中的溶质全部溶解,可采 用降温的方法
D.升高温度可将甲的不饱和溶液变为饱和溶液
2 固体物质的溶解度
1.概念:在__________下,某固态物质在__________g
溶剂里达到________状态时所溶解的________,叫作这种物质在这种溶剂里的溶解度。
一定温度
100
饱和
质量
2.影响因素:①内因:溶质和溶剂的性质;②外因:主要是________。多数物质的溶解度随着温度的升高而增大,如________;少数物质的溶解度受温度的影响很小,如________;极少数物质的溶解度随温度的升高而减小,如__________。
温度
KNO3
NaCl
Ca(OH)2
3.溶解度与溶解性的关系
20℃时的溶解度/g >10 10~1 1~0.01 <0.01
溶解性 ______ 可溶 微溶 ______
易溶
难溶
3 气体的溶解度
影响因素:①内因:气体的性质;②外因:主要是温度和压强。温度越高,气体的溶解度________;压强越大,气体的溶解度________。
越小
越大
4 溶解度曲线
1.概念:指溶解度随温度变化的曲线。横坐标表示________,纵坐标表示__________。
2.应用:(1)查找某物质在不同温度下的____________。
(2)比较不同物质在________温度时的溶解度大小,若某温度下两种物质的溶解度曲线有交点,则在该温度下,两种物质的溶解度________。
(3)比较不同物质的溶解度受温度变化影响的大小,据此可以判断结晶的方法,溶解度受温度变化影响大(曲线向上且“陡”)的,常用____________的方法结晶。溶解度受温度变化影响小(曲线“平缓”)的,常用____________的方法结晶。
温度
溶解度
溶解度
相同
相等
降温
蒸发溶剂
溶解度曲线
命题角度:考查根据溶解度曲线图,查找溶解度,找到饱和溶液与不饱和溶液的转化方法。
例2 根据如图5-3所示的溶解度曲线判断,下列说法正确的是( )
C
A.甲物质的溶解度大于乙物质的溶解度
B.甲物质的不饱和溶液温度升高后变成饱和溶液
C.将t2 ℃时的甲、乙两物质的饱和溶液温度降低到t1 ℃时都会析出晶体
D.t2 ℃时,甲物质的饱和溶液和乙物质的饱和溶液中含有相等质量的溶质
饱和溶液、溶解度等的综合考查
命题角度:将饱和溶液、溶质质量分数、溶解度等知识融合在一起考查。
例3 20 ℃时,取甲、乙、丙、丁四种纯净物各20 g,分别加入到四个盛有50 g水的烧杯中,充分溶解,其溶解情况如下表:
物质 甲 乙 丙 丁
未溶解固体的质量/ g 4.2 2 0 9.2
下列说法正确的是( )
A.所得四杯溶液都是饱和溶液
B.丁溶液的溶质质量分数最大
C.20 ℃时四种物质溶解度的关系为:丙>乙>甲>丁
D.四杯溶液中溶剂的质量大小为:丙溶液>乙溶液>甲溶液>丁溶液
C
例4、请根据右图中a、b、c三种物质的溶解度曲线,回答下列问题:
⑴P点的含义是 。
⑵t2℃时,30 ga物质加入到50 g水中不断搅拌,能形成80 g溶液吗? (填“能”或“不能”)。
⑶将t2℃时的a、b、c三种物质的饱和溶液降温到t1℃时,溶液中溶质质量分数最小的是 。
⑷现有a、b、c三种物质的浓溶液,适用于海水晒盐原理进行结晶的是 。
t1℃时a、c两种物质的溶解度相等
不能
C
b
中考链接
(2015)如图是甲、乙两种固体物质的溶解度曲线
(1)由图可获得的一条信息是 .
(2)若乙中混有少量甲,提纯乙的方法是 :
(3)t2℃时,将不饱和的甲溶液,转化成该温度下的饱和溶液的一种方法是 .变化过程中,溶质的质量分数 (选填“增大”、 “减小”或“不变”).
(4)将等质量的甲、乙两种物质的溶液
由t2℃降温至t1℃时,析出晶体的质量 (选序号).
A.甲>乙 B.甲<乙 C.无法确定.
谢 谢
整理与归纳
学习目标
1.了解饱和溶液的含义。
2.了解饱和溶液和不饱和溶液在一定条件下的相互转化。
3.了解溶解度的含义。
4.会利用溶解度表或溶解度曲线,查阅有关物质的溶解性或 溶解度。
5.了解结晶现象。
考 点 聚 焦
1 饱和溶液与不饱和溶液
1.概念:在一定______下,向______________里加入某种溶质,当溶质__________________时,所得的溶液叫作这种溶质的饱和溶液。反之叫不饱和溶液。
温度
一定量溶剂
不能继续溶解
2.判断方法
(1)当溶液中有固态溶质时,若固体__________________,
那么该溶液是饱和的;若固体________,那么该溶液是不饱和的。
(2)当溶液中没有固态溶质时,向溶液中加入少量相应的溶质,若__________,则原溶液是饱和的;若_____________,则原溶液是不饱和的。
(3)当溶液中有晶体析出时,析出晶体后的溶液一定是饱和溶液。
不再减少
减少
不溶解
继续溶解
饱和溶液
不饱和溶液
1、加溶剂
2、升温(大多数)
1、加溶质
2、恒温蒸发溶剂
3、降温(大多数)
3.相互转化(对大多数固体溶质来说)
0.05
0.10
0.15
0.20
90
70
40
0
10
20
50
60
80
100
30
溶解度/
g
0.05
0.10
0.15
0.20
90
70
40
0
10
20
50
60
80
100
30
温度/℃
熟石灰的溶解度曲线:
①对溶解度随温度升高而减小的物质(如气体、熟石灰等)需________(填“升高”或“降低”)温度将其不饱和溶液变为饱和溶液。
②对某饱和溶液进行降温或蒸发溶剂,往往会有溶质从溶液中结晶析出。
升高
4.溶液的稀、浓与溶液是否饱和的关系
如图5-1所示,饱和溶液________(填“一定”或“不一定”,下同)是浓溶液;不饱和溶液________是稀溶液;但同种溶质在同一温度下,其饱和溶液________比其不饱和溶液浓。
不一定
不一定
一定
徐州考点探究
饱和溶液、不饱和溶液
命题角度:考查饱和溶液与不饱和溶液的判定方法及相互转化。
例1 A、B两个烧杯中盛有相同质量的水(其中A烧杯中水温为10 ℃,B烧杯中水温为30 ℃,不考虑溶解过程中温度的变化),分别在两个烧杯中加入10 g甲物质,充分溶解后所得现象如图5-2所示,下列说法正确的是( )
A
A.A烧杯中的溶液一定是饱和溶液
B.B烧杯中的溶液一定是不饱和溶液
C.若将A烧杯中的溶质全部溶解,可采 用降温的方法
D.升高温度可将甲的不饱和溶液变为饱和溶液
2 固体物质的溶解度
1.概念:在__________下,某固态物质在__________g
溶剂里达到________状态时所溶解的________,叫作这种物质在这种溶剂里的溶解度。
一定温度
100
饱和
质量
2.影响因素:①内因:溶质和溶剂的性质;②外因:主要是________。多数物质的溶解度随着温度的升高而增大,如________;少数物质的溶解度受温度的影响很小,如________;极少数物质的溶解度随温度的升高而减小,如__________。
温度
KNO3
NaCl
Ca(OH)2
3.溶解度与溶解性的关系
20℃时的溶解度/g >10 10~1 1~0.01 <0.01
溶解性 ______ 可溶 微溶 ______
易溶
难溶
3 气体的溶解度
影响因素:①内因:气体的性质;②外因:主要是温度和压强。温度越高,气体的溶解度________;压强越大,气体的溶解度________。
越小
越大
4 溶解度曲线
1.概念:指溶解度随温度变化的曲线。横坐标表示________,纵坐标表示__________。
2.应用:(1)查找某物质在不同温度下的____________。
(2)比较不同物质在________温度时的溶解度大小,若某温度下两种物质的溶解度曲线有交点,则在该温度下,两种物质的溶解度________。
(3)比较不同物质的溶解度受温度变化影响的大小,据此可以判断结晶的方法,溶解度受温度变化影响大(曲线向上且“陡”)的,常用____________的方法结晶。溶解度受温度变化影响小(曲线“平缓”)的,常用____________的方法结晶。
温度
溶解度
溶解度
相同
相等
降温
蒸发溶剂
溶解度曲线
命题角度:考查根据溶解度曲线图,查找溶解度,找到饱和溶液与不饱和溶液的转化方法。
例2 根据如图5-3所示的溶解度曲线判断,下列说法正确的是( )
C
A.甲物质的溶解度大于乙物质的溶解度
B.甲物质的不饱和溶液温度升高后变成饱和溶液
C.将t2 ℃时的甲、乙两物质的饱和溶液温度降低到t1 ℃时都会析出晶体
D.t2 ℃时,甲物质的饱和溶液和乙物质的饱和溶液中含有相等质量的溶质
饱和溶液、溶解度等的综合考查
命题角度:将饱和溶液、溶质质量分数、溶解度等知识融合在一起考查。
例3 20 ℃时,取甲、乙、丙、丁四种纯净物各20 g,分别加入到四个盛有50 g水的烧杯中,充分溶解,其溶解情况如下表:
物质 甲 乙 丙 丁
未溶解固体的质量/ g 4.2 2 0 9.2
下列说法正确的是( )
A.所得四杯溶液都是饱和溶液
B.丁溶液的溶质质量分数最大
C.20 ℃时四种物质溶解度的关系为:丙>乙>甲>丁
D.四杯溶液中溶剂的质量大小为:丙溶液>乙溶液>甲溶液>丁溶液
C
例4、请根据右图中a、b、c三种物质的溶解度曲线,回答下列问题:
⑴P点的含义是 。
⑵t2℃时,30 ga物质加入到50 g水中不断搅拌,能形成80 g溶液吗? (填“能”或“不能”)。
⑶将t2℃时的a、b、c三种物质的饱和溶液降温到t1℃时,溶液中溶质质量分数最小的是 。
⑷现有a、b、c三种物质的浓溶液,适用于海水晒盐原理进行结晶的是 。
t1℃时a、c两种物质的溶解度相等
不能
C
b
中考链接
(2015)如图是甲、乙两种固体物质的溶解度曲线
(1)由图可获得的一条信息是 .
(2)若乙中混有少量甲,提纯乙的方法是 :
(3)t2℃时,将不饱和的甲溶液,转化成该温度下的饱和溶液的一种方法是 .变化过程中,溶质的质量分数 (选填“增大”、 “减小”或“不变”).
(4)将等质量的甲、乙两种物质的溶液
由t2℃降温至t1℃时,析出晶体的质量 (选序号).
A.甲>乙 B.甲<乙 C.无法确定.
谢 谢
