沪教版化学九年级下册 第7章 应用广泛的酸·碱·盐基础实验8酸与碱的化学性质 课件(共13张PPT)
文档属性
| 名称 | 沪教版化学九年级下册 第7章 应用广泛的酸·碱·盐基础实验8酸与碱的化学性质 课件(共13张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-30 00:00:00 | ||
图片预览




文档简介
(共13张PPT)
基础实验8 酸与碱的化学性质
任务一
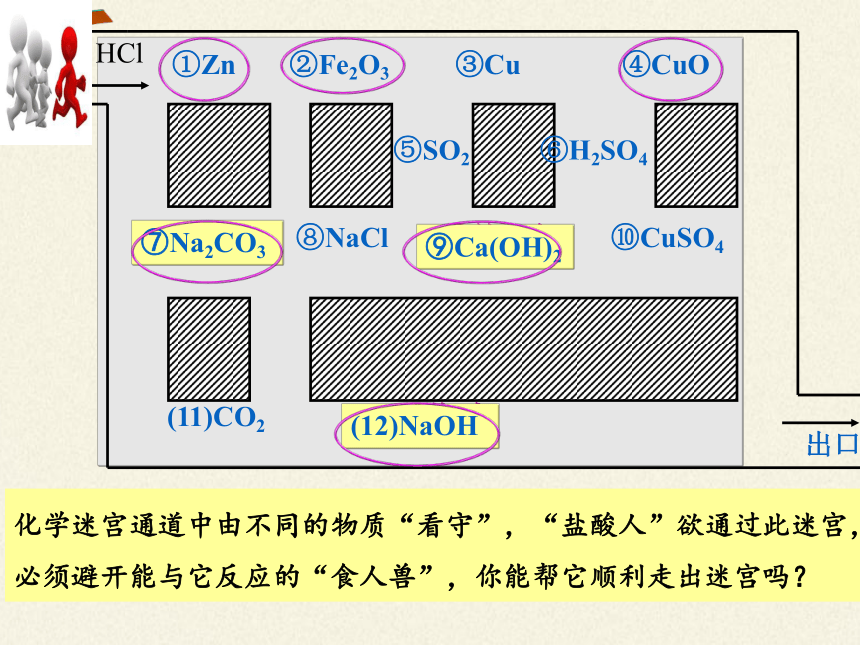
化学迷宫通道中由不同的物质“看守”,“盐酸人”欲通过此迷宫,必须避开能与它反应的“食人兽”,你能帮它顺利走出迷宫吗?
(11)CO2 (12) 烧碱
①Zn ②Fe2O3 ③Cu ④CuO
⑤SO2 ⑥H2SO4
⑦纯碱 ⑧NaCl ⑨熟石灰 ⑩CuSO4
出口
⑦Na2CO3
⑨Ca(OH)2
(12)NaOH
HCl
任务一
“食人兽” 与HCl反应的化学方程式
Zn
Fe2O3
CuO
Na2CO3
Ca(OH)2
NaOH
Zn + 2HCl = ZnCl2 + H2↑
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
CuO + 2HCl = CuCl2 + H2O
Na2CO3 +2HCl = 2NaCl +H2O + CO2↑
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
NaOH + HCl = NaCl + H2O
以上反应涉及哪些基本反应类型?
任务一
⑦Na2CO3
⑨Ca(OH)2
(12)NaOH
(11)CO2
①Zn ②Fe2O3 ③Cu ④CuO
⑤SO2 ⑥H2SO4
⑧NaCl ⑩CuSO4
出口
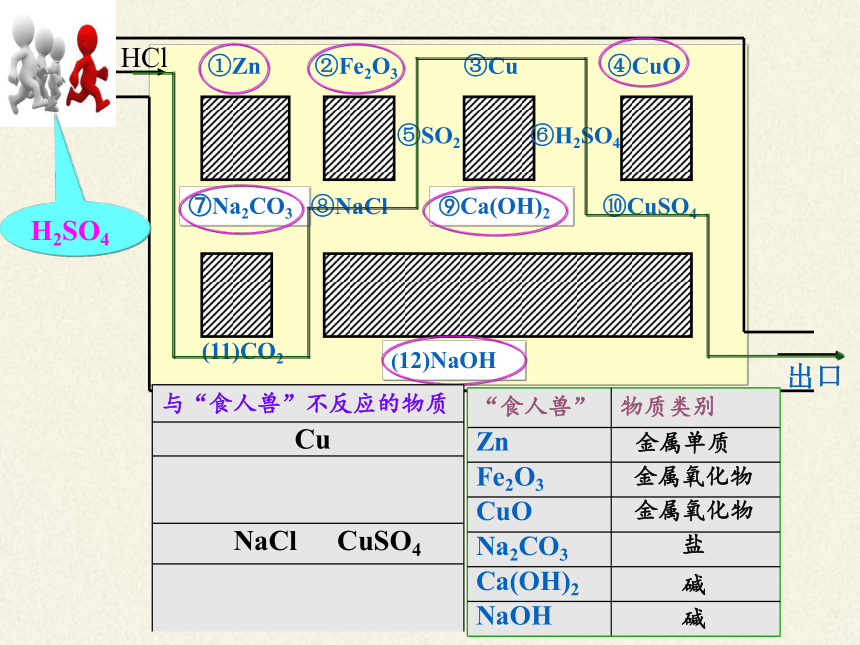
“食人兽” 物质类别
Zn
Fe2O3
CuO
Na2CO3
Ca(OH)2
NaOH
金属单质
金属氧化物
金属氧化物
盐
碱
碱
与“食人兽”不反应的物质
Cu
NaCl
CuSO4
HCl
H2SO4
“酸小人”
双手提金属和金属氧化物
双脚踩着碱和某些盐
头顶指示剂
金属
(活泼)
金属
氧化物
碱
某些 盐
指示剂
酸
实验台上有三瓶无标签的溶液:
HCl、NaOH、CuSO4,
你能用哪些方法将它们识别出来?
任务二
CuSO4
方法一:_________________________
方法二:_________________________
方法三:_________________________
方法四:_______________________________
方法五:____________________________________________
方法六:_________________________
方法七:_________________________
取少量样品于试管中,分别······
滴加酚酞试液或石蕊试液
测pH
加入锌(等活泼金属)
加入Fe2O3(生锈铁钉)或CuO粉末
加入少量Na2CO3粉末(或溶液)或CaCO3粉末
加入少量Ca(OH)2粉末
滴加CuSO4溶液
物质鉴别的一般方法
1、观察法:颜色、气味等
2、实验法:取样-----加试剂----现象分析-----得出结论
…… …… ……
小红同学进行酸碱中和反应的实验(如图所示)。她向氢氧化钠溶液中滴加一定量稀盐酸后,想起氢氧化钠溶液中事先没有滴加指示剂。为了确定盐酸与氢氧化钠的反应程度,她从烧杯中取了少量溶液于试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到试管中液体颜色没有变化。于是她对烧杯中的溶液进行了以下探究:
(1)【提出问题】该溶液中溶质是什么?
【猜想与假设】
猜想一:NaCl(即盐酸与氢氧化钠恰好完全反应)
猜想二:NaCl和NaOH(即氢氧化钠有剩余)
猜想三:NaCl和HCl(即盐酸有剩余)
小明同学却判定不可能“氢氧化钠有剩余”,
他的理由是
加入酚酞试液后不变色,说明溶液一定不显碱性,所以不可能“氢氧化钠有剩余”。
(2)他们共同设计了一个实验方案,欲对上述其两种可能情况进行验证。请根据相关内容填写下表
实验方法 可能观察到的现象 结论
将少量锌粒放人试管中,然后从烧杯中取适量溶液至试管中 如果 则盐酸过量
如果 则盐酸与氢氧化钠恰好完全反应
有气泡产生
没有气泡产生
(3)经过讨论,他们认为利用下列几种物质代替锌粒,也可以达到验证目的,你认为其中不正确的是(填序号)。( )
A.生锈的铁钉 B.碳酸钠粉末
C.硫酸钠粉末 D.氢氧化铜
(4)写出该反应的化学方程式
( 5)酸碱中和反应的实质是
C
NaOH+HCl=NaCl+H2O
OH-+H+=H2O
1、探究久置的Ca(OH)2成分时,滴入盐酸后,试管中剩余
的溶液中一定含有的溶质是______,可能还含有______
或______。设计实验检验其成分。
怎么正确处理反应后剩余的溶液?
.
课后思考
2. 若是Ca(OH)2要通过迷宫,能与盐酸同一路线吗?
它应避开哪些“食人兽” ________________
3.Ca(OH)2的路线能让NaOH安全通过吗?
4.请设计实验证明Zn、Fe、Cu三种金属的活动性强弱。
实验步骤 现象 结论
谢 谢
基础实验8 酸与碱的化学性质
任务一
化学迷宫通道中由不同的物质“看守”,“盐酸人”欲通过此迷宫,必须避开能与它反应的“食人兽”,你能帮它顺利走出迷宫吗?
(11)CO2 (12) 烧碱
①Zn ②Fe2O3 ③Cu ④CuO
⑤SO2 ⑥H2SO4
⑦纯碱 ⑧NaCl ⑨熟石灰 ⑩CuSO4
出口
⑦Na2CO3
⑨Ca(OH)2
(12)NaOH
HCl
任务一
“食人兽” 与HCl反应的化学方程式
Zn
Fe2O3
CuO
Na2CO3
Ca(OH)2
NaOH
Zn + 2HCl = ZnCl2 + H2↑
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
CuO + 2HCl = CuCl2 + H2O
Na2CO3 +2HCl = 2NaCl +H2O + CO2↑
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
NaOH + HCl = NaCl + H2O
以上反应涉及哪些基本反应类型?
任务一
⑦Na2CO3
⑨Ca(OH)2
(12)NaOH
(11)CO2
①Zn ②Fe2O3 ③Cu ④CuO
⑤SO2 ⑥H2SO4
⑧NaCl ⑩CuSO4
出口
“食人兽” 物质类别
Zn
Fe2O3
CuO
Na2CO3
Ca(OH)2
NaOH
金属单质
金属氧化物
金属氧化物
盐
碱
碱
与“食人兽”不反应的物质
Cu
NaCl
CuSO4
HCl
H2SO4
“酸小人”
双手提金属和金属氧化物
双脚踩着碱和某些盐
头顶指示剂
金属
(活泼)
金属
氧化物
碱
某些 盐
指示剂
酸
实验台上有三瓶无标签的溶液:
HCl、NaOH、CuSO4,
你能用哪些方法将它们识别出来?
任务二
CuSO4
方法一:_________________________
方法二:_________________________
方法三:_________________________
方法四:_______________________________
方法五:____________________________________________
方法六:_________________________
方法七:_________________________
取少量样品于试管中,分别······
滴加酚酞试液或石蕊试液
测pH
加入锌(等活泼金属)
加入Fe2O3(生锈铁钉)或CuO粉末
加入少量Na2CO3粉末(或溶液)或CaCO3粉末
加入少量Ca(OH)2粉末
滴加CuSO4溶液
物质鉴别的一般方法
1、观察法:颜色、气味等
2、实验法:取样-----加试剂----现象分析-----得出结论
…… …… ……
小红同学进行酸碱中和反应的实验(如图所示)。她向氢氧化钠溶液中滴加一定量稀盐酸后,想起氢氧化钠溶液中事先没有滴加指示剂。为了确定盐酸与氢氧化钠的反应程度,她从烧杯中取了少量溶液于试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到试管中液体颜色没有变化。于是她对烧杯中的溶液进行了以下探究:
(1)【提出问题】该溶液中溶质是什么?
【猜想与假设】
猜想一:NaCl(即盐酸与氢氧化钠恰好完全反应)
猜想二:NaCl和NaOH(即氢氧化钠有剩余)
猜想三:NaCl和HCl(即盐酸有剩余)
小明同学却判定不可能“氢氧化钠有剩余”,
他的理由是
加入酚酞试液后不变色,说明溶液一定不显碱性,所以不可能“氢氧化钠有剩余”。
(2)他们共同设计了一个实验方案,欲对上述其两种可能情况进行验证。请根据相关内容填写下表
实验方法 可能观察到的现象 结论
将少量锌粒放人试管中,然后从烧杯中取适量溶液至试管中 如果 则盐酸过量
如果 则盐酸与氢氧化钠恰好完全反应
有气泡产生
没有气泡产生
(3)经过讨论,他们认为利用下列几种物质代替锌粒,也可以达到验证目的,你认为其中不正确的是(填序号)。( )
A.生锈的铁钉 B.碳酸钠粉末
C.硫酸钠粉末 D.氢氧化铜
(4)写出该反应的化学方程式
( 5)酸碱中和反应的实质是
C
NaOH+HCl=NaCl+H2O
OH-+H+=H2O
1、探究久置的Ca(OH)2成分时,滴入盐酸后,试管中剩余
的溶液中一定含有的溶质是______,可能还含有______
或______。设计实验检验其成分。
怎么正确处理反应后剩余的溶液?
.
课后思考
2. 若是Ca(OH)2要通过迷宫,能与盐酸同一路线吗?
它应避开哪些“食人兽” ________________
3.Ca(OH)2的路线能让NaOH安全通过吗?
4.请设计实验证明Zn、Fe、Cu三种金属的活动性强弱。
实验步骤 现象 结论
谢 谢
