沪教版化学九年级下册第7章应用广泛的酸·碱·盐 第二节常见的酸和碱 课件(共17张PPT)
文档属性
| 名称 | 沪教版化学九年级下册第7章应用广泛的酸·碱·盐 第二节常见的酸和碱 课件(共17张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-30 20:48:55 | ||
图片预览





文档简介
(共17张PPT)
酸和碱
常见的酸和碱
生活中的一些物质含有酸
食醋中含有醋酸 汽车用铅蓄电池中含有硫酸
柠檬、柑橘等水果中含有柠檬酸
生活中的有些物质含有碱
氢氧化钠
熟石灰
回忆:
1、把二氧化碳通入紫色石蕊的试管中会看到什么现象?该现象说明了什么?
2、在右图的实验中,可
以看到什么现象?这说明
酚酞试液有什么性质?
那么其它 物质也
有这样的性质吗?
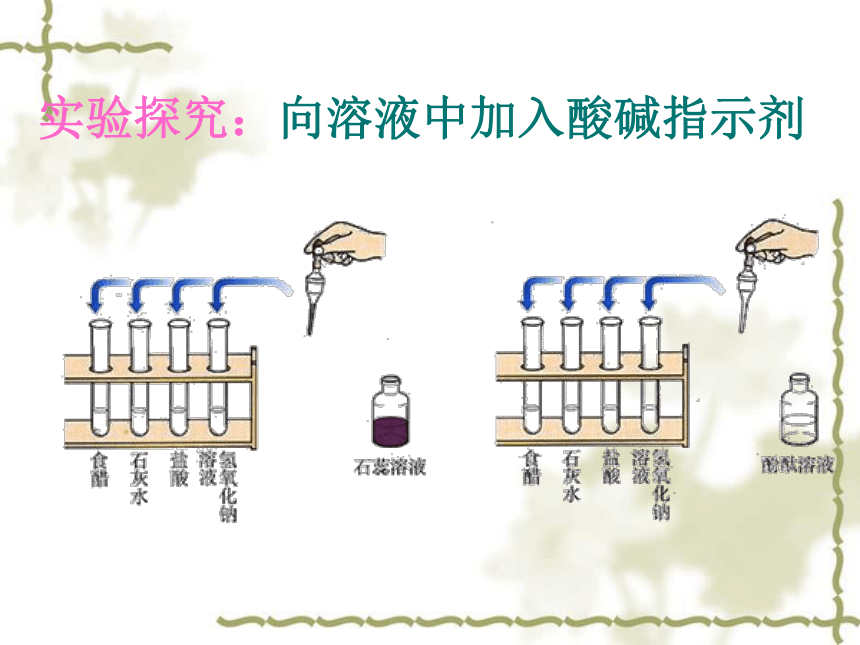
实验探究:向溶液中加入酸碱指示剂
加入紫色石蕊溶液后的颜色变化 加入无色酚酞溶液后的颜色变化
食醋
石灰水
盐酸
氢氧化钠
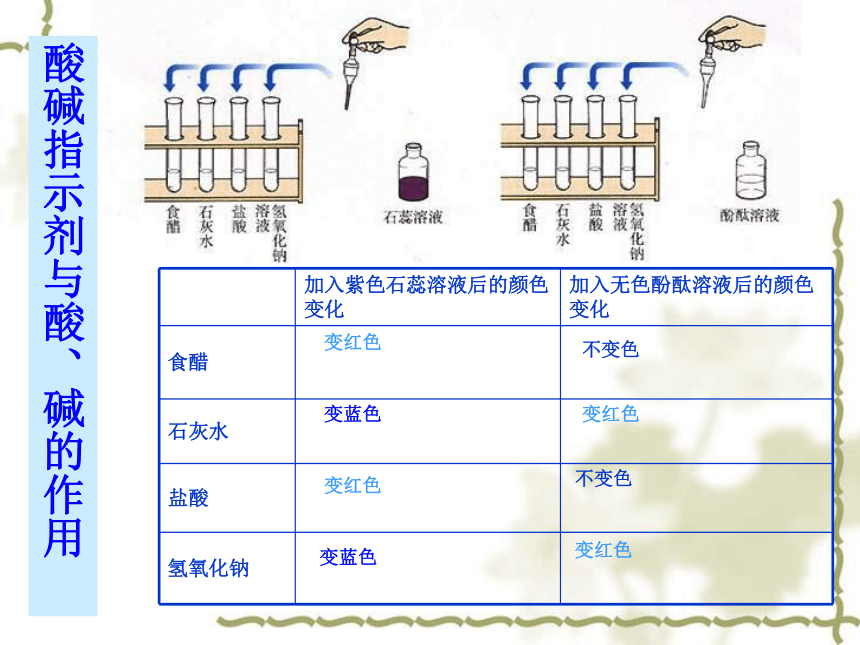
酸碱指示剂与酸、碱的作用
变红色
变红色
变红色
变红色
变蓝色
变蓝色
不变色
不变色
一、酸碱指示剂
像石蕊和酚酞这种能跟酸或碱的溶液起作用而显示不同颜色的物质,叫酸碱指示剂,通常也简称指示剂。
石蕊和酚酞是常见的两种酸碱指示剂
二﹑几种常见的酸
盐酸
HCl
硫酸
H2SO4
硝酸
HNO3
醋酸
CH3COOH
磷酸
H3PO4
实验10—2
(1)观察盐酸、硫酸的颜色和状态
(2)分别打开盛有盐酸、硫酸的试剂瓶的瓶盖,观察现象并闻气味。
盐酸 硫酸
颜色、状态
打开瓶盖后的现象
气味
无色液体
无色粘稠液体
在空气中会形成白雾
无明显变化
有刺激性气味
无气味
你的方案一:用紫色石蕊溶液
加紫色石蕊溶液 加无色酚酞溶液
稀盐酸
稀硫酸
规 律
酸的溶液能使紫色石蕊变成红色
酸的溶液不能使无色酚酞溶液变色
紫色石蕊变成溶液红色
紫色石蕊变成溶液红色
无色酚酞溶液不变色
无色酚酞溶液不变色
结论:酸能与指示剂反应
你的方案二:用较活泼的金属来鉴别
与稀盐酸反应 与稀硫酸反应
镁 现象
反应的化学方程式
锌 现象
反应的化学方程式
铁 现象
反应的化学方程式
铜 现象
结论:酸能与较活泼的金属反应产生氢气
不反应
不反应
反应非常剧烈,产生气泡
反应非常剧烈,产生气泡
反应速度适中,产生气泡
反应速度适中,产生气泡
反应比较慢,产生气泡
反应比较慢,产生气泡
Mg +2 HCl = MgCl2 + H2↑
Zn +2 HCl = ZnCl2 + H2↑
Zn + H2SO4 = ZnSO4 + H2↑
Mg + H2SO4 = MgSO4 + H2↑
Fe + H2SO4 = FeSO4 + H2↑
Fe +2 HCl = FeCl2 + H2↑
写出铝与盐酸和稀硫酸反应的方程式
我能写
你还想知道方案三吗?
2Al + 6HCl = 2AlCl3 + 3H2 ↑
2Al + 3H2SO4 = Al2(SO4 )3+ 3H2↑
问题:
1、同学们在日常生活中见到过或用到过哪些除铁锈的方法?
2、你能把这些方法用化学的眼光进行一下分类吗?
3、现请你用实验桌上的物质为锈铁钉除锈
小贴士:铁锈的主要成分是Fe2O3
刚才同学们在实验中观察到实验现象归纳起来有两种:
1、开始时观察到铁锈逐渐消失,溶液由无色慢慢变成黄色 。
2、开始时观察到铁锈逐渐消失,溶液由无色慢慢变成黄色,当铁锈消失以后,铁钉表面会冒出气泡。
这是为什么呢?
加入的酸量不同!
实验:将一根生锈的铁钉分别用细线系好放入盛有稀盐酸和稀硫酸的试管里,仔细观察一会儿,取出,用水洗净铁钉,铁钉表面和溶液颜色有什么变化
现 象 化学方程式
铁锈+盐酸 Fe2O3+6HCl=2FeCl3+3H2O
铁锈+硫酸 Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
铁锈消失溶液由无色变黄
铁锈消失溶液由无色变黄
讨论:
①上面几个反应中的生成物有什么共同之处
②利用上面的反应可以清除金属制品表面的锈,除锈时能否将金属制品长时间浸在酸中 为什么
根据上面的化学方程式特点,请你写出氧化铜与盐酸或硫酸反应的化学方程式,并回答方案三的内容及酸的性质。
CuO+2HCl=CuCl2+H2O
CuO+H2SO4=CuSO4+H2O
结论:酸能与金属氧化物反应有水生成
一、酸能使酸碱指示剂显示不同的颜色;
二、酸能与多种活泼金属反应,生成氢气;
三、酸能与某些金属氧化物反应,生成水。
酸有一些相似的化学性质:
你还有什么收获?
方法
从个别推导到一般
从具体到抽象
酸和碱
常见的酸和碱
生活中的一些物质含有酸
食醋中含有醋酸 汽车用铅蓄电池中含有硫酸
柠檬、柑橘等水果中含有柠檬酸
生活中的有些物质含有碱
氢氧化钠
熟石灰
回忆:
1、把二氧化碳通入紫色石蕊的试管中会看到什么现象?该现象说明了什么?
2、在右图的实验中,可
以看到什么现象?这说明
酚酞试液有什么性质?
那么其它 物质也
有这样的性质吗?
实验探究:向溶液中加入酸碱指示剂
加入紫色石蕊溶液后的颜色变化 加入无色酚酞溶液后的颜色变化
食醋
石灰水
盐酸
氢氧化钠
酸碱指示剂与酸、碱的作用
变红色
变红色
变红色
变红色
变蓝色
变蓝色
不变色
不变色
一、酸碱指示剂
像石蕊和酚酞这种能跟酸或碱的溶液起作用而显示不同颜色的物质,叫酸碱指示剂,通常也简称指示剂。
石蕊和酚酞是常见的两种酸碱指示剂
二﹑几种常见的酸
盐酸
HCl
硫酸
H2SO4
硝酸
HNO3
醋酸
CH3COOH
磷酸
H3PO4
实验10—2
(1)观察盐酸、硫酸的颜色和状态
(2)分别打开盛有盐酸、硫酸的试剂瓶的瓶盖,观察现象并闻气味。
盐酸 硫酸
颜色、状态
打开瓶盖后的现象
气味
无色液体
无色粘稠液体
在空气中会形成白雾
无明显变化
有刺激性气味
无气味
你的方案一:用紫色石蕊溶液
加紫色石蕊溶液 加无色酚酞溶液
稀盐酸
稀硫酸
规 律
酸的溶液能使紫色石蕊变成红色
酸的溶液不能使无色酚酞溶液变色
紫色石蕊变成溶液红色
紫色石蕊变成溶液红色
无色酚酞溶液不变色
无色酚酞溶液不变色
结论:酸能与指示剂反应
你的方案二:用较活泼的金属来鉴别
与稀盐酸反应 与稀硫酸反应
镁 现象
反应的化学方程式
锌 现象
反应的化学方程式
铁 现象
反应的化学方程式
铜 现象
结论:酸能与较活泼的金属反应产生氢气
不反应
不反应
反应非常剧烈,产生气泡
反应非常剧烈,产生气泡
反应速度适中,产生气泡
反应速度适中,产生气泡
反应比较慢,产生气泡
反应比较慢,产生气泡
Mg +2 HCl = MgCl2 + H2↑
Zn +2 HCl = ZnCl2 + H2↑
Zn + H2SO4 = ZnSO4 + H2↑
Mg + H2SO4 = MgSO4 + H2↑
Fe + H2SO4 = FeSO4 + H2↑
Fe +2 HCl = FeCl2 + H2↑
写出铝与盐酸和稀硫酸反应的方程式
我能写
你还想知道方案三吗?
2Al + 6HCl = 2AlCl3 + 3H2 ↑
2Al + 3H2SO4 = Al2(SO4 )3+ 3H2↑
问题:
1、同学们在日常生活中见到过或用到过哪些除铁锈的方法?
2、你能把这些方法用化学的眼光进行一下分类吗?
3、现请你用实验桌上的物质为锈铁钉除锈
小贴士:铁锈的主要成分是Fe2O3
刚才同学们在实验中观察到实验现象归纳起来有两种:
1、开始时观察到铁锈逐渐消失,溶液由无色慢慢变成黄色 。
2、开始时观察到铁锈逐渐消失,溶液由无色慢慢变成黄色,当铁锈消失以后,铁钉表面会冒出气泡。
这是为什么呢?
加入的酸量不同!
实验:将一根生锈的铁钉分别用细线系好放入盛有稀盐酸和稀硫酸的试管里,仔细观察一会儿,取出,用水洗净铁钉,铁钉表面和溶液颜色有什么变化
现 象 化学方程式
铁锈+盐酸 Fe2O3+6HCl=2FeCl3+3H2O
铁锈+硫酸 Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
铁锈消失溶液由无色变黄
铁锈消失溶液由无色变黄
讨论:
①上面几个反应中的生成物有什么共同之处
②利用上面的反应可以清除金属制品表面的锈,除锈时能否将金属制品长时间浸在酸中 为什么
根据上面的化学方程式特点,请你写出氧化铜与盐酸或硫酸反应的化学方程式,并回答方案三的内容及酸的性质。
CuO+2HCl=CuCl2+H2O
CuO+H2SO4=CuSO4+H2O
结论:酸能与金属氧化物反应有水生成
一、酸能使酸碱指示剂显示不同的颜色;
二、酸能与多种活泼金属反应,生成氢气;
三、酸能与某些金属氧化物反应,生成水。
酸有一些相似的化学性质:
你还有什么收获?
方法
从个别推导到一般
从具体到抽象
