沪教版化学九年级下册第6章溶解现象基础实验5配制一定溶质质量分数的氯化钠溶液课件(共22张PPT)
文档属性
| 名称 | 沪教版化学九年级下册第6章溶解现象基础实验5配制一定溶质质量分数的氯化钠溶液课件(共22张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 5.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-21 00:00:00 | ||
图片预览








文档简介
(共22张PPT)
基础实验5 配制一定溶质质量分数的氯化钠溶液
一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物。
2.特征:
(1)均一性:
(2)稳定性:
(3)混合物
1.定义:
是指溶液中各部分浓度、性质都相同。
是指外界条件(温度、压强等)不变时,溶液长期放置不会分层,也不会析出固体或放出气体。
“溶液” 知多少
溶液
(2)溶剂:能溶解其他物质的物质叫做溶剂。
氯化钠
溶质
水
溶剂
溶液
3.组成:
溶液由溶质和溶剂组成
(1)溶质:被溶解的物质叫做溶质。
(3)m溶液= m溶质+ m溶剂
“溶液” 知多少
(4) m溶质
溶质的质量分数= =————*100%
m溶液
氯化钠溶液
蔗糖溶液中的分子运动
食盐溶液中的离子运动
从宏观到微观世界
食盐、蔗糖在水中的怎样变化的呢?
蔗糖表面的分子在水分子的作用下,向水中扩散,在水中以分子形式分散在水分子的中间。
氯化钠在水分子的作用下,向水中扩散,在水中以离子形式(Na+、Cl-)存在于水分子的中间。
从宏观到微观世界
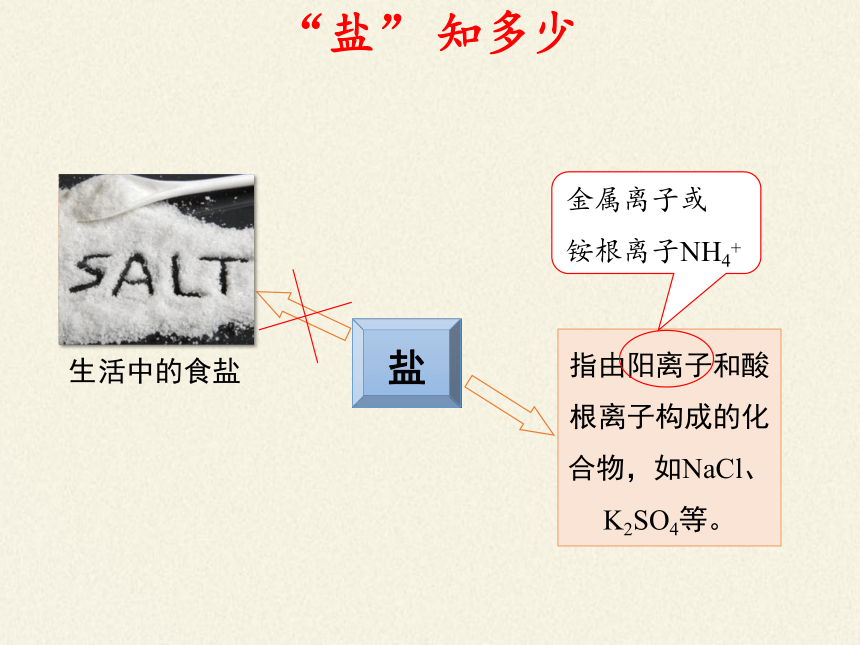
盐
生活中的食盐
指由阳离子和酸根离子构成的化合物,如NaCl、K2SO4等。
金属离子或
铵根离子NH4+
“盐” 知多少
常见的盐——氯化钠
(1)俗称:食盐;
(2)化学式:NaCl;
(3)性状:白色晶体,易溶于水,有咸味,溶液呈中性;
(4)主要来源:海水、盐湖、盐井、盐矿。
“氯化钠” 知多少
氯化钠是重要的调味品
氯化钠的用途
“氯化钠” 知多少
生理盐水
工业原料
选种
融雪剂
氯化钠具有广泛的用途
“氯化钠” 知多少
氯化钠是人的正常生理活动所不可缺少的。人体内所含的氯化钠大部分以离子形式存在于体液中。钠离子对维持细胞内外正常的水分分布和促进细胞内外的物质交换起主要作用;氯离子是胃液中的主要成分,具有促生盐酸、帮助消化和增进食欲的作用。每人每天约需3~5g食盐,但长期食用过多食盐不利于人体健康。
氯化钠的生理作用
“氯化钠” 知多少
·清晨喝一杯盐开水,可以治大便不通,喝盐开水还可以治喉咙痛、牙痛;
·每天用淡盐水开水漱口,可以预防各种口腔病;
·误食有毒物,喝一些盐开水,有解毒作用;
·豆腐易变质,如将食盐溶解在开水中,冷却后将豆腐浸入,即使在夏天,也可保存数月;
·花生油内含有水分,放久了会发臭,可将盐炒热,凉后,按40千克油1千克盐的比例,加入食盐,可以使花生油2~3年仍保持色香、味滑;
·鲜花插入稀盐水里,可数日不谢;
·新买的玻璃器皿,用盐煮一煮,不易破裂;
·洗有颜色的衣服时,先用5%盐水浸泡10分钟,然后再洗,则不易掉色;
·洗有汗渍的白衣服,先在5%的盐水中揉一揉,再用肥皂洗净,就不会出现黄色汗斑;
·将胡萝卜砸碎拌上盐,可擦去衣服上的血迹;
·铜器生锈或出现黑点,用盐可以擦掉。
食盐的妙用
1)分布 : 氯化钠在自然界中的分布很广,除海水里含有大量的氯化钠外,盐湖、盐井和盐矿中也蕴藏着氯化钠。
2.氯化钠在自然界中的分布与获取
“氯化钠” 从何而来
2)获取:通过晾晒海水或煮盐井水,盐湖水等,可以蒸发除去其水分,得到含有较多杂质的氯化钠晶体——粗盐。当有大量粗盐从海水、盐湖水等析出时,就会形成美丽的盐景。
“氯化钠” 从何而来
蒸发池
结晶池
海水
“海水晒盐” 过程
水分
蒸发
粗盐
母液
“粗盐”的由来
海水“晒盐”等方法得到的是粗盐,含有可溶性和不溶性杂质。
粗盐
精盐
?
“粗盐” 变“精盐”
粗盐提纯—去除粗盐中不溶性杂质
①溶解
②过滤
③蒸发
思考:上述过程中玻璃棒的用途分别是什么?
④转移
“粗盐” 变“精盐”
实验用品
蒸馏水
50mL
10mL
配制50克6%的NaCl溶液
注意药品的名称
左“物”右“码”
选用适合量程的量筒
在实验操作中应该注意哪些问题?
如何配制50克6%的NaCl溶液
思考
托盘天平使用
注意事项:
(1)使用前要调零
(2)两个托盘上各放一张大小相同的称量纸
(3)称量时遵循左物右码的原则
(4)用镊子夹取砝码应按照从大到小的顺序
(5)称量完毕应将砝码放回盒中,游码归零
实验步骤
配制50g溶质质量分数为6%的氯化钠溶液。
(1)计算:配制50g质量分数为6%的氯化钠溶液所需氯化钠和水的质量分别为:氯化钠 g;水 g
(2)称量:用托盘天平称量所需氯化钠,放入烧杯中。
(3)量取:用量筒量取所需的水(水的密度可近似看做1g/cm3),倒入盛有氯化钠的烧杯中。
(4)溶解:用玻璃棒搅拌,使氯化钠溶解。
3
47
(1)造成实际值偏小的可能原因
①溶质溶解的量变少了:溶质本身不纯;左码右物称量;天平空载时,指针向左偏;溶质有撒落;溶质没有完全溶解就装瓶存放了
②溶剂的量增多了:仰视量取;烧杯内壁上有水;试剂瓶内壁上有水
(2)造成实际值偏大的可能原因
①溶剂的量减少了: 俯视量取溶剂;量取的水没有完全转移到烧杯中
②溶质溶解的量变多了:天平空载时,指针向右偏;称量时,所用砝码已生锈或沾有油污
【问题与交流】
谢 谢
基础实验5 配制一定溶质质量分数的氯化钠溶液
一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物。
2.特征:
(1)均一性:
(2)稳定性:
(3)混合物
1.定义:
是指溶液中各部分浓度、性质都相同。
是指外界条件(温度、压强等)不变时,溶液长期放置不会分层,也不会析出固体或放出气体。
“溶液” 知多少
溶液
(2)溶剂:能溶解其他物质的物质叫做溶剂。
氯化钠
溶质
水
溶剂
溶液
3.组成:
溶液由溶质和溶剂组成
(1)溶质:被溶解的物质叫做溶质。
(3)m溶液= m溶质+ m溶剂
“溶液” 知多少
(4) m溶质
溶质的质量分数= =————*100%
m溶液
氯化钠溶液
蔗糖溶液中的分子运动
食盐溶液中的离子运动
从宏观到微观世界
食盐、蔗糖在水中的怎样变化的呢?
蔗糖表面的分子在水分子的作用下,向水中扩散,在水中以分子形式分散在水分子的中间。
氯化钠在水分子的作用下,向水中扩散,在水中以离子形式(Na+、Cl-)存在于水分子的中间。
从宏观到微观世界
盐
生活中的食盐
指由阳离子和酸根离子构成的化合物,如NaCl、K2SO4等。
金属离子或
铵根离子NH4+
“盐” 知多少
常见的盐——氯化钠
(1)俗称:食盐;
(2)化学式:NaCl;
(3)性状:白色晶体,易溶于水,有咸味,溶液呈中性;
(4)主要来源:海水、盐湖、盐井、盐矿。
“氯化钠” 知多少
氯化钠是重要的调味品
氯化钠的用途
“氯化钠” 知多少
生理盐水
工业原料
选种
融雪剂
氯化钠具有广泛的用途
“氯化钠” 知多少
氯化钠是人的正常生理活动所不可缺少的。人体内所含的氯化钠大部分以离子形式存在于体液中。钠离子对维持细胞内外正常的水分分布和促进细胞内外的物质交换起主要作用;氯离子是胃液中的主要成分,具有促生盐酸、帮助消化和增进食欲的作用。每人每天约需3~5g食盐,但长期食用过多食盐不利于人体健康。
氯化钠的生理作用
“氯化钠” 知多少
·清晨喝一杯盐开水,可以治大便不通,喝盐开水还可以治喉咙痛、牙痛;
·每天用淡盐水开水漱口,可以预防各种口腔病;
·误食有毒物,喝一些盐开水,有解毒作用;
·豆腐易变质,如将食盐溶解在开水中,冷却后将豆腐浸入,即使在夏天,也可保存数月;
·花生油内含有水分,放久了会发臭,可将盐炒热,凉后,按40千克油1千克盐的比例,加入食盐,可以使花生油2~3年仍保持色香、味滑;
·鲜花插入稀盐水里,可数日不谢;
·新买的玻璃器皿,用盐煮一煮,不易破裂;
·洗有颜色的衣服时,先用5%盐水浸泡10分钟,然后再洗,则不易掉色;
·洗有汗渍的白衣服,先在5%的盐水中揉一揉,再用肥皂洗净,就不会出现黄色汗斑;
·将胡萝卜砸碎拌上盐,可擦去衣服上的血迹;
·铜器生锈或出现黑点,用盐可以擦掉。
食盐的妙用
1)分布 : 氯化钠在自然界中的分布很广,除海水里含有大量的氯化钠外,盐湖、盐井和盐矿中也蕴藏着氯化钠。
2.氯化钠在自然界中的分布与获取
“氯化钠” 从何而来
2)获取:通过晾晒海水或煮盐井水,盐湖水等,可以蒸发除去其水分,得到含有较多杂质的氯化钠晶体——粗盐。当有大量粗盐从海水、盐湖水等析出时,就会形成美丽的盐景。
“氯化钠” 从何而来
蒸发池
结晶池
海水
“海水晒盐” 过程
水分
蒸发
粗盐
母液
“粗盐”的由来
海水“晒盐”等方法得到的是粗盐,含有可溶性和不溶性杂质。
粗盐
精盐
?
“粗盐” 变“精盐”
粗盐提纯—去除粗盐中不溶性杂质
①溶解
②过滤
③蒸发
思考:上述过程中玻璃棒的用途分别是什么?
④转移
“粗盐” 变“精盐”
实验用品
蒸馏水
50mL
10mL
配制50克6%的NaCl溶液
注意药品的名称
左“物”右“码”
选用适合量程的量筒
在实验操作中应该注意哪些问题?
如何配制50克6%的NaCl溶液
思考
托盘天平使用
注意事项:
(1)使用前要调零
(2)两个托盘上各放一张大小相同的称量纸
(3)称量时遵循左物右码的原则
(4)用镊子夹取砝码应按照从大到小的顺序
(5)称量完毕应将砝码放回盒中,游码归零
实验步骤
配制50g溶质质量分数为6%的氯化钠溶液。
(1)计算:配制50g质量分数为6%的氯化钠溶液所需氯化钠和水的质量分别为:氯化钠 g;水 g
(2)称量:用托盘天平称量所需氯化钠,放入烧杯中。
(3)量取:用量筒量取所需的水(水的密度可近似看做1g/cm3),倒入盛有氯化钠的烧杯中。
(4)溶解:用玻璃棒搅拌,使氯化钠溶解。
3
47
(1)造成实际值偏小的可能原因
①溶质溶解的量变少了:溶质本身不纯;左码右物称量;天平空载时,指针向左偏;溶质有撒落;溶质没有完全溶解就装瓶存放了
②溶剂的量增多了:仰视量取;烧杯内壁上有水;试剂瓶内壁上有水
(2)造成实际值偏大的可能原因
①溶剂的量减少了: 俯视量取溶剂;量取的水没有完全转移到烧杯中
②溶质溶解的量变多了:天平空载时,指针向右偏;称量时,所用砝码已生锈或沾有油污
【问题与交流】
谢 谢
