7.2.4 常见的碱-2022-2023学年九年级化学沪教版下册(共21张PPT)
文档属性
| 名称 | 7.2.4 常见的碱-2022-2023学年九年级化学沪教版下册(共21张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 548.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-23 21:05:33 | ||
图片预览






文档简介
(共21张PPT)
第二节 常见的酸和碱
第四课时
第7章 应用广泛的酸、碱、盐
学习目标
基础性目标
了解碱的含义,知道氢氧化钠和氢氧化钙的用途
拓展性目标
掌握氢氧化钠和氢氧化钙的化学性质及复分解反应
挑战性目标
鉴别氢氧化钠溶液和氢氧化钙溶液
家里的下水道堵塞,管道疏通剂能快速分解油脂、毛发等堵塞污物,这是什么物质这么厉害呢?
管道疏通剂的主要成分是次氯酸钠、氢氧化钠和碳酸钠,这些物质能与油脂、毛发等物质发生化学反应,进而疏通管道。
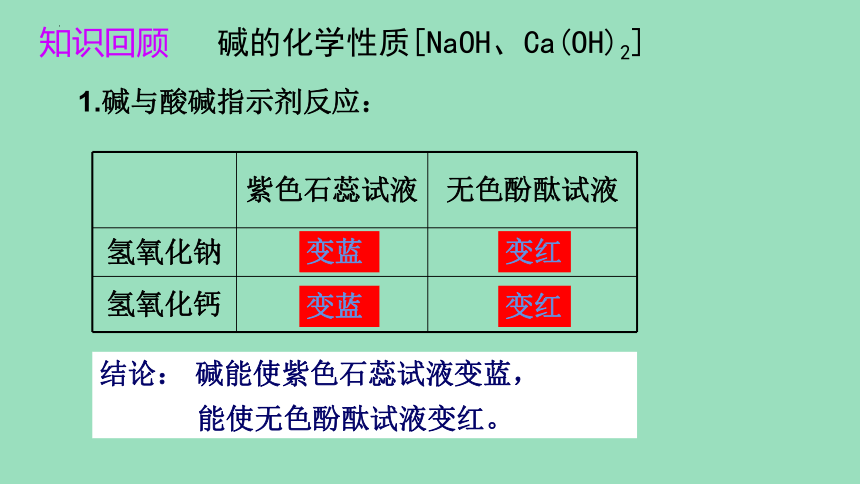
知识回顾 碱的化学性质[NaOH、Ca(OH)2]
1.碱与酸碱指示剂反应:
紫色石蕊试液 无色酚酞试液
氢氧化钠
氢氧化钙
变红
变红
变蓝
变蓝
结论: 碱能使紫色石蕊试液变蓝,
能使无色酚酞试液变红。
2.碱能与某些非金属氧化物反应
2NaOH + CO2 = Na2CO3 + H2O (吸收CO2)
Ca(OH)2+CO2 = CaCO3↓+H2O (检验CO2)
碱+某些非金属氧化物→盐+水(化合价不变化)
注:CO、NO属于非金属氧化物,但不与碱溶液反应。
现象
分析
CuSO4 + 2NaOH
= Cu(OH)2↓+ Na2SO4
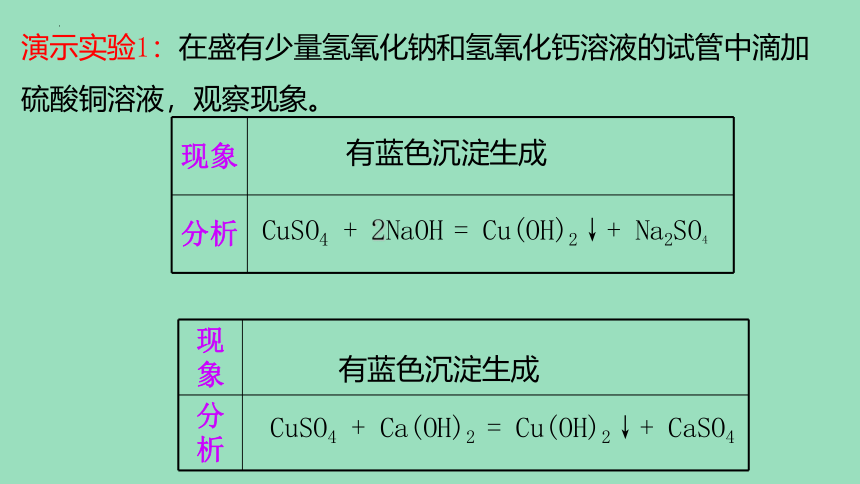
演示实验1:在盛有少量氢氧化钠和氢氧化钙溶液的试管中滴加硫酸铜溶液,观察现象。
有蓝色沉淀生成
现象
分析
有蓝色沉淀生成
CuSO4 + Ca(OH)2
= Cu(OH)2↓+ CaSO4
现象
分析
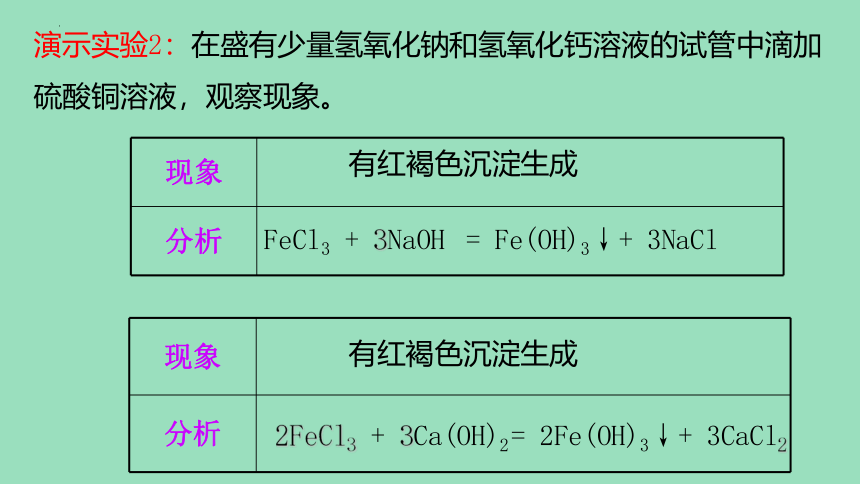
演示实验2:在盛有少量氢氧化钠和氢氧化钙溶液的试管中滴加硫酸铜溶液,观察现象。
有红褐色沉淀生成
现象
分析
2FeCl3 + 3Ca(OH)2
= 2Fe(OH)3↓+ 3CaCl2
有红褐色沉淀生成
FeCl3 + 3NaOH
= Fe(OH)3↓+ 3NaCl
探究实验:如何鉴别氢氧化钠和氢氧化钙溶液的反应
实验现象
反应方程式
实验步骤:分别取少量待测液体于A、B两支试管中,分别滴加少量碳酸钠溶液,观察现象。
A试管中有白色沉淀,B无明显现象
Ca(OH)2+ Na2CO3 = CaCO3↓+2NaOH
拓展:工业上用此法制氢氧化钠,又叫“土法制碱”
3.碱与盐反应
化学方程式
氢氧化钠+硫酸铜
氢氧化钠+氯化铁
氢氧化钙+硫酸铜
氢氧化钙+碳酸钠
2NaOH+CuSO4 = Na2SO4+Cu(OH)2↓
Ca(OH)2+Na2CO3 = CaCO3↓+2NaOH
Ca(OH)2+CuSO4 = CaSO4+Cu(OH)2↓
碱+盐→新盐+新碱(化合价不变化)
3NaOH + FeCl3 = Fe(OH)3↓+ 3NaCl
观察“碱+盐→新盐+新碱”这一类反应有何特点?
2NaOH+CuSO4 = Na2SO4+Cu(OH)2↓
Ca(OH)2+Na2CO3 = CaCO3↓+2NaOH
CaCO3+2HCl = CaCl2+H2O+CO2↑
酸+盐→新盐+新酸
学过的反应中还有没有这类特点的反应 ?
Na2CO3+2HCl = 2NaCl+H2O+CO2↑
酸+金属氧化物 → 盐+水
Fe2O3+6HCl=2FeCl3+3H2O
CuO+H2SO4=CuSO4+H2O
5、复分解反应
①定义: 两种化合物相互交换成分,生成两种新的化合物的一类反应。
(四种基本反应类型之一)
③判断:a 看反应物和生成物是不是两种化合物
b 两种反应物是不是交换了成分。
④特点:反应物之间交换成分,各物质中元素的化合价均不改变。(双交换 价不变)
② AB + CD ==== AD + CB
判断下列反应是否属于复分解反应 ?
1、Ca(OH)2+Na2CO3 = CaCO3 ↓ +2NaOH
2、(NH4)2SO4 + 2NaOH
= Na2SO4+ 2NH3↑+2H2O
3、Ca(OH)2 + H2SO4 = CaSO4 + 2H2O
4、SO2 +2NaOH = Na2SO3 + H2O
5、CaCO3+ 2HCl = CaCl2+ H2O + CO2↑
思考:观察下列碱的化学式,其组成特点是:
碱——都含有氢氧根离子
从溶液的观点分析,碱溶于水后都生成了自由移动的离子,分析以下碱溶液的微粒构成(水分子除外) ,你对碱的共同点又有哪些认识?
氢氧化钠 (NaOH) = 2OH-+ Na+
氢氧化钙 Ca(OH)2= 2OH- + Ca2+
氢氧化钾 (KOH) = OH -+ K+
氢氧化钡 Ba(OH)2= 2OH-+ Ba2+
氢氧根离子
金属离子
2、碱的共性:溶液中阴离子全部是氢氧根离子(OH-)的化合物
4、碱的通性
b、碱的通性
a、碱在水溶液中都能电离出OH-,因此碱溶液会具有许多共同的化学性质。
① 能使紫色石蕊试液变蓝,无色酚酞试液变红
② 碱 + 非金属氧化物 → 盐 + 水
③ 碱1 + 盐1 → 碱2 + 盐2
肥 皂
炼 油
造 纸
纺 织
印 染
含NaOH:除油污
氢氧化钠和氢氧化钙的用途
①氢氧化钠常用于制人造丝、造纸、炼油、纺织、 印染与橡胶工业。炉具清洁剂的主要成分是氢氧化钠。
②氢氧化钙常用于建筑业(砌砖、抹墙);农业上用来改良酸性土壤和配制农药波尔多液。
波尔多液的主要成分;
硫酸铜和氢氧化钙的混合溶液
1、在氯化铁溶液中滴入烧碱溶液,观察到的现象是( )
A.有白色沉淀 B.有红褐色沉淀
C.有气泡冒出 D.有蓝色沉淀产生
B
2、把纯水、稀硫酸和氢氧化钠三种无色液体区别开的最简单的方法是( )
A.滴入酚酞试液 B.滴入石蕊试液
C.滴入氯化钡溶液 D.通入二氧化碳气体
B
3、下列气体中,既能用固体NaOH干燥又能用浓H2SO4干燥的是( )
A.CO2 B.HCl C.SO2 D.O2
D
4、若将潮湿的空气依次通过烧碱溶液、浓硫酸和红热的铜网,将会依次除去空气中的_____、________、和________,最后剩余的气体主要是_______。
CO2
水蒸气
O2
N2
5、(2010·济宁中考)氢氧化钠是一种重要的化工原料,俗称 。氢氧化钠易吸收水分可用作某些气体的____剂,它的水溶液倒入充满C02气体的矿泉水瓶中,密闭、振荡,可以观察到 ,发生化学反应的方程式为 ,因此,氢氧化钠应密封保存。
干燥
瓶子变瘪
2NaOH+CO2═Na2CO3+H2O
火碱、烧碱、苛性钠
6、如图所示,装置气密性良好,弹簧夹处于关闭状态。
(1)若试管内为CO2气体,挤压胶头滴管
加入NaOH溶液,则试管内发生反应的化学
方程式是 ,
一段时间后,打开弹簧夹,气球 (
填“ a”或“b”)明显鼓起。
(2)若试管内为NaOH固体,挤压胶头滴管加入少量水,过一段时间后,打开弹簧夹,气球b (填“明显鼓起”“无变化”或“变瘪”)。
(3)关闭弹簧夹,若胶头滴管内为NaOH溶液,试管内为CuSO4溶液,挤压胶头滴管,出现的现象为
2NaOH+CO2==Na2CO3+H2O
a
明显鼓起
试管内有蓝色沉淀产生
5、欲除去NaOH溶液中的Na2CO3杂质,可选用下列试剂中( )
A.稀盐酸 B.CaCl2溶液
C.CO2气体 D.澄清石灰水
D
第二节 常见的酸和碱
第四课时
第7章 应用广泛的酸、碱、盐
学习目标
基础性目标
了解碱的含义,知道氢氧化钠和氢氧化钙的用途
拓展性目标
掌握氢氧化钠和氢氧化钙的化学性质及复分解反应
挑战性目标
鉴别氢氧化钠溶液和氢氧化钙溶液
家里的下水道堵塞,管道疏通剂能快速分解油脂、毛发等堵塞污物,这是什么物质这么厉害呢?
管道疏通剂的主要成分是次氯酸钠、氢氧化钠和碳酸钠,这些物质能与油脂、毛发等物质发生化学反应,进而疏通管道。
知识回顾 碱的化学性质[NaOH、Ca(OH)2]
1.碱与酸碱指示剂反应:
紫色石蕊试液 无色酚酞试液
氢氧化钠
氢氧化钙
变红
变红
变蓝
变蓝
结论: 碱能使紫色石蕊试液变蓝,
能使无色酚酞试液变红。
2.碱能与某些非金属氧化物反应
2NaOH + CO2 = Na2CO3 + H2O (吸收CO2)
Ca(OH)2+CO2 = CaCO3↓+H2O (检验CO2)
碱+某些非金属氧化物→盐+水(化合价不变化)
注:CO、NO属于非金属氧化物,但不与碱溶液反应。
现象
分析
CuSO4 + 2NaOH
= Cu(OH)2↓+ Na2SO4
演示实验1:在盛有少量氢氧化钠和氢氧化钙溶液的试管中滴加硫酸铜溶液,观察现象。
有蓝色沉淀生成
现象
分析
有蓝色沉淀生成
CuSO4 + Ca(OH)2
= Cu(OH)2↓+ CaSO4
现象
分析
演示实验2:在盛有少量氢氧化钠和氢氧化钙溶液的试管中滴加硫酸铜溶液,观察现象。
有红褐色沉淀生成
现象
分析
2FeCl3 + 3Ca(OH)2
= 2Fe(OH)3↓+ 3CaCl2
有红褐色沉淀生成
FeCl3 + 3NaOH
= Fe(OH)3↓+ 3NaCl
探究实验:如何鉴别氢氧化钠和氢氧化钙溶液的反应
实验现象
反应方程式
实验步骤:分别取少量待测液体于A、B两支试管中,分别滴加少量碳酸钠溶液,观察现象。
A试管中有白色沉淀,B无明显现象
Ca(OH)2+ Na2CO3 = CaCO3↓+2NaOH
拓展:工业上用此法制氢氧化钠,又叫“土法制碱”
3.碱与盐反应
化学方程式
氢氧化钠+硫酸铜
氢氧化钠+氯化铁
氢氧化钙+硫酸铜
氢氧化钙+碳酸钠
2NaOH+CuSO4 = Na2SO4+Cu(OH)2↓
Ca(OH)2+Na2CO3 = CaCO3↓+2NaOH
Ca(OH)2+CuSO4 = CaSO4+Cu(OH)2↓
碱+盐→新盐+新碱(化合价不变化)
3NaOH + FeCl3 = Fe(OH)3↓+ 3NaCl
观察“碱+盐→新盐+新碱”这一类反应有何特点?
2NaOH+CuSO4 = Na2SO4+Cu(OH)2↓
Ca(OH)2+Na2CO3 = CaCO3↓+2NaOH
CaCO3+2HCl = CaCl2+H2O+CO2↑
酸+盐→新盐+新酸
学过的反应中还有没有这类特点的反应 ?
Na2CO3+2HCl = 2NaCl+H2O+CO2↑
酸+金属氧化物 → 盐+水
Fe2O3+6HCl=2FeCl3+3H2O
CuO+H2SO4=CuSO4+H2O
5、复分解反应
①定义: 两种化合物相互交换成分,生成两种新的化合物的一类反应。
(四种基本反应类型之一)
③判断:a 看反应物和生成物是不是两种化合物
b 两种反应物是不是交换了成分。
④特点:反应物之间交换成分,各物质中元素的化合价均不改变。(双交换 价不变)
② AB + CD ==== AD + CB
判断下列反应是否属于复分解反应 ?
1、Ca(OH)2+Na2CO3 = CaCO3 ↓ +2NaOH
2、(NH4)2SO4 + 2NaOH
= Na2SO4+ 2NH3↑+2H2O
3、Ca(OH)2 + H2SO4 = CaSO4 + 2H2O
4、SO2 +2NaOH = Na2SO3 + H2O
5、CaCO3+ 2HCl = CaCl2+ H2O + CO2↑
思考:观察下列碱的化学式,其组成特点是:
碱——都含有氢氧根离子
从溶液的观点分析,碱溶于水后都生成了自由移动的离子,分析以下碱溶液的微粒构成(水分子除外) ,你对碱的共同点又有哪些认识?
氢氧化钠 (NaOH) = 2OH-+ Na+
氢氧化钙 Ca(OH)2= 2OH- + Ca2+
氢氧化钾 (KOH) = OH -+ K+
氢氧化钡 Ba(OH)2= 2OH-+ Ba2+
氢氧根离子
金属离子
2、碱的共性:溶液中阴离子全部是氢氧根离子(OH-)的化合物
4、碱的通性
b、碱的通性
a、碱在水溶液中都能电离出OH-,因此碱溶液会具有许多共同的化学性质。
① 能使紫色石蕊试液变蓝,无色酚酞试液变红
② 碱 + 非金属氧化物 → 盐 + 水
③ 碱1 + 盐1 → 碱2 + 盐2
肥 皂
炼 油
造 纸
纺 织
印 染
含NaOH:除油污
氢氧化钠和氢氧化钙的用途
①氢氧化钠常用于制人造丝、造纸、炼油、纺织、 印染与橡胶工业。炉具清洁剂的主要成分是氢氧化钠。
②氢氧化钙常用于建筑业(砌砖、抹墙);农业上用来改良酸性土壤和配制农药波尔多液。
波尔多液的主要成分;
硫酸铜和氢氧化钙的混合溶液
1、在氯化铁溶液中滴入烧碱溶液,观察到的现象是( )
A.有白色沉淀 B.有红褐色沉淀
C.有气泡冒出 D.有蓝色沉淀产生
B
2、把纯水、稀硫酸和氢氧化钠三种无色液体区别开的最简单的方法是( )
A.滴入酚酞试液 B.滴入石蕊试液
C.滴入氯化钡溶液 D.通入二氧化碳气体
B
3、下列气体中,既能用固体NaOH干燥又能用浓H2SO4干燥的是( )
A.CO2 B.HCl C.SO2 D.O2
D
4、若将潮湿的空气依次通过烧碱溶液、浓硫酸和红热的铜网,将会依次除去空气中的_____、________、和________,最后剩余的气体主要是_______。
CO2
水蒸气
O2
N2
5、(2010·济宁中考)氢氧化钠是一种重要的化工原料,俗称 。氢氧化钠易吸收水分可用作某些气体的____剂,它的水溶液倒入充满C02气体的矿泉水瓶中,密闭、振荡,可以观察到 ,发生化学反应的方程式为 ,因此,氢氧化钠应密封保存。
干燥
瓶子变瘪
2NaOH+CO2═Na2CO3+H2O
火碱、烧碱、苛性钠
6、如图所示,装置气密性良好,弹簧夹处于关闭状态。
(1)若试管内为CO2气体,挤压胶头滴管
加入NaOH溶液,则试管内发生反应的化学
方程式是 ,
一段时间后,打开弹簧夹,气球 (
填“ a”或“b”)明显鼓起。
(2)若试管内为NaOH固体,挤压胶头滴管加入少量水,过一段时间后,打开弹簧夹,气球b (填“明显鼓起”“无变化”或“变瘪”)。
(3)关闭弹簧夹,若胶头滴管内为NaOH溶液,试管内为CuSO4溶液,挤压胶头滴管,出现的现象为
2NaOH+CO2==Na2CO3+H2O
a
明显鼓起
试管内有蓝色沉淀产生
5、欲除去NaOH溶液中的Na2CO3杂质,可选用下列试剂中( )
A.稀盐酸 B.CaCl2溶液
C.CO2气体 D.澄清石灰水
D
