《志鸿全优设计》2013-2014学年高中化学鲁科版必修二单元目标检测:第一章 原子结构与元素周期律(含答案点拨)
文档属性
| 名称 | 《志鸿全优设计》2013-2014学年高中化学鲁科版必修二单元目标检测:第一章 原子结构与元素周期律(含答案点拨) |
|
|
| 格式 | zip | ||
| 文件大小 | 3.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-01-04 16:14:45 | ||
图片预览





文档简介
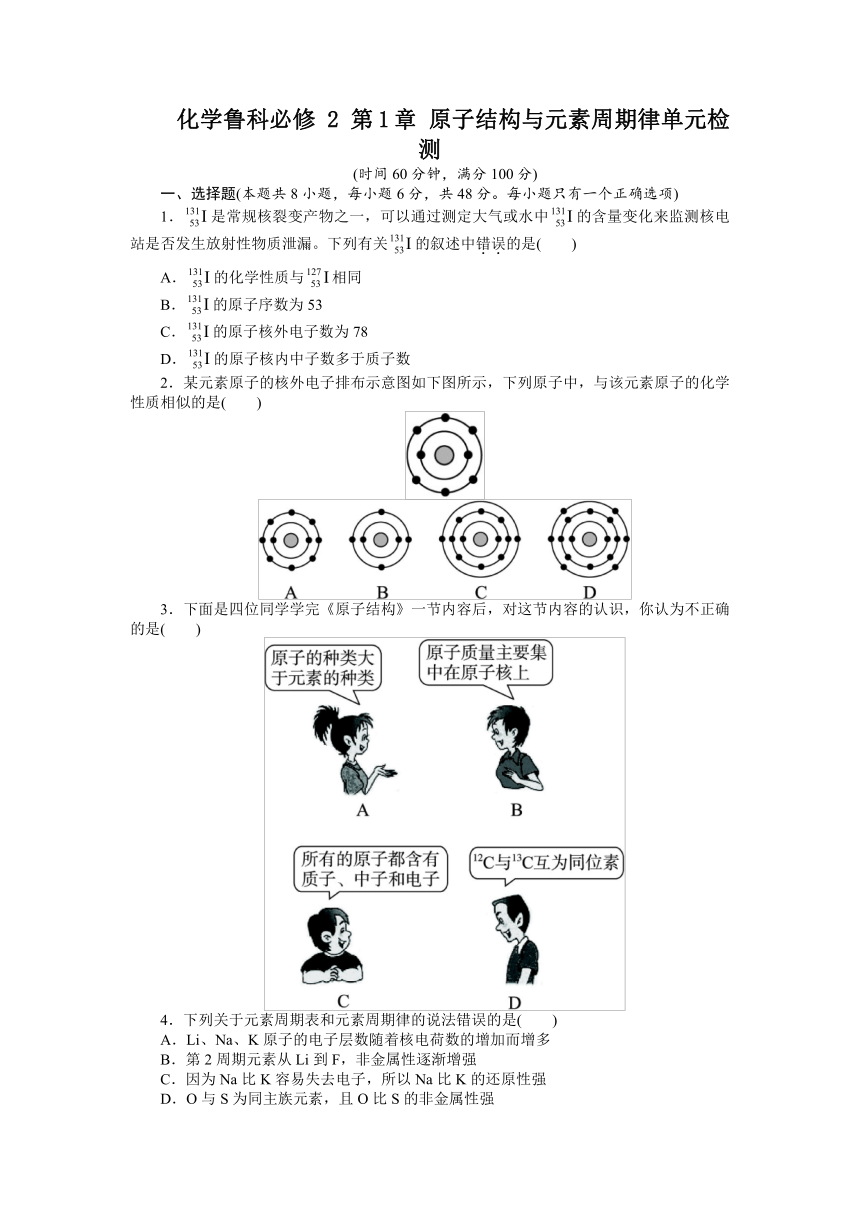
化学鲁科必修 2 第1章 原子结构与元素周期律单元检测
(时间60分钟,满分100分)
一、选择题(本题共8小题,每小题6分,共48分。每小题只有一个正确选项)
1.是常规核裂变产物之一,可以通过测定大气或水中的含量变化来监测核电站是否发生放射性物质泄漏。下列有关的叙述中错误的是( )
A.的化学性质与相同
B.的原子序数为53
C.的原子核外电子数为78
D.的原子核内中子数多于质子数
2.某元素原子的核外电子排布示意图如下图所示,下列原子中,与该元素原子的化学性质相似的是( )
3.下面是四位同学学完《原子结构》一节内容后,对这节内容的认识,你认为不正确的是( )
4.下列关于元素周期表和元素周期律的说法错误的是( )
A.Li、Na、K原子的电子层数随着核电荷数的增加而增多
B.第2周期元素从Li到F,非金属性逐渐增强
C.因为Na比K容易失去电子,所以Na比K的还原性强
D.O与S为同主族元素,且O比S的非金属性强
5.近年来,我国在超导体材料研究方面居于世界领先地位,铊(Tl)是超导体的组成成分之一,铊位于第6周期ⅢA族。下列对铊的性质的推导正确的是( )
①是易导电的银白色金属
②Tl(OH)3是两性氢氧化物
③Tl3+氧化能力比Al3+强
④单质能与稀硝酸反应生成硝酸盐
A.①④ B.②③
C.① D.④
6.短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是( )
A.最简单气态氢化物的热稳定性:R>Q
B.最高价氧化物对应水化物的酸性:Q<W
C.原子半径:T>Q>R
D.含T的盐中,T元素只能存在于阳离子中
7.下表是元素周期表的一部分,有关说法正确的是( )
A.e的氢化物比d的氢化物稳定
B.a、b、e三种元素的原子半径:e>b>a
C.六种元素中,c元素单质的化学性质最活泼
D.c、e、f的最高价氧化物对应的水化物的酸性依次增强
8.下列结论是从某同学的作业本上摘录的,其中你认为肯定正确的是( )
①微粒半径:S2->Cl>S>F
②氢化物的稳定性:HF>HCl>H2S>H2Se
③还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>HClO4>H2SeO4
⑥得电子能力:F>Cl>S>Se
A.①⑤ B.①③④
C.②④⑥ D.⑥
二、非选择题(本题共4小题,共52分)
9.(14分)Ⅰ.用表示原子:
(1)中性原子的中子数:N=______。
(2)阳离子的中子数:AXn+共有x个电子,则N=______。
(3)阴离子的中子数:AXn-共有x个电子,则N=______。
(4)中性分子中子数:12C16O2分子中,N=______。
(5)A2-原子核内有x个中子,其质量数为m,则n g A2-所含电子的物质的量为______ mol。
Ⅱ.有①、、 ②H2、D2、T2 ③石墨、金刚石 ④、、四组微粒或物质,回答下列问题:
(1)互为同位素的是________(填编号,下同)。
(2)互为同素异形体的是________。
(3)由①和④中微粒能结合成含三个原子的化合物,这些化合物的相对分子质量可能是__________,可能形成的水分子种类有:________种。
10.(14分)根据元素周期表1~20号元素的性质和递变规律,回答下列问题。
(1)属于金属元素的有______种,金属性最强的元素与氧反应生成的化合物有______(填两种化合物的化学式)。
(2)属于稀有气体的是______(填元素符号,下同)。
(3)形成化合物种类最多的两种元素是______。
(4)第3周期中,原子半径最大的是(稀有气体除外)______。
(5)推测Si、N最简单氢化物的稳定性:______大于______(填化学式)。
11.(12分)某学生在做同主族元素性质递变规律的实验时,自己设计了一套实验方案,并记录了有关的实验现象。现在请你帮助该学生整理并完成实验报告。
(1)实验目的:探究同一主族元素性质的递变规律。
(2)实验用品:
仪器:试管、胶头滴管
药品:氯水、溴水、溴化钠溶液、碘化钠溶液、四氯化碳。
(3)实验内容(在下表横线中填写相关内容):
序号
实验方案
实验现象
①
向盛有少量溴化钠溶液的试管中滴加少量新制的氯水,振荡,再注入少量四氯化碳,振荡后静置
液体分为两层,下层呈____色
②
向盛有少量碘化钾溶液的试管中滴加少量新制溴水,振荡,再注入少量四氯化碳,振荡后静置
液体分为两层,下层呈____色
(4)实验结论:______________________________________________________________。
(5)问题和讨论:
①上述两个实验中发生的反应的离子方程式分别为__________________、______________________。
②由于氟过于活泼,所以很难设计出一个简单的实验来验证其氧化性的强弱。试列举两项事实说明氟的非金属性比氯强:______________________、______________________。
12.(12分)
(1)在上面元素周期表中既有金属元素,又有非金属元素的区域为______(填序号)。
①A ②B ③C ④D
(2)有人认为形成化合物最多的元素不是ⅣA族的碳元素,而是另一种短周期元素,请你根据学过的化学知识判断这一元素是______。
(3)现有甲、乙两种短周期元素,室温下,甲元素的单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。
②甲、乙两元素相比较,金属性较强的是______(填名称),可以验证该结论的实验是______(填序号)。
A.将在空气中放置已久的这两种元素的块状单质分别放入热水中
B.将这两种元素的单质粉末分别和同浓度的盐酸反应
C.将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
D.比较这两种元素的气态氢化物的稳定性
参考答案
1.答案:C 解析:与互为同位素,二者的化学性质相同;的原子序数为53,原子核外电子数为53,中子数为131-53=78,则的原子核内中子数多于质子数。
2.答案:D 解析:最外层电子数相同的元素原子具有相似的化学性质,A最外层8个电子,B最外层4个电子,C最外层2个电子,D最外层6个电子。
3.答案:C 解析:由于有的元素可以形成几种质量数不同的核素,因此导致原子的种类大于元素的种类,即A的说法正确;原子核的体积虽然很小,但是由于电子的质量较小,故原子的质量主要集中在原子核上,即B的说法正确;并不是所有的原子都是由质子、中子、电子构成的,如就只由质子和电子构成,而没有中子,即C的说法是错误的;12C与13C同属于C元素,但是它们的中子数(或质量数)不同,故互为同位素,即D的说法是正确的。
4.答案:C 解析:同一主族元素随核电荷数的增加,电子层数逐渐增加,金属元素失电子能力增强,金属性增强,还原性增强;非金属元素得电子能力减弱,非金属性减弱,氧化性减弱。同一周期元素随核电荷数的增加,最外层电子数增多,金属性减弱,非金属性增强。
5.答案:A 解析:解此类题一定要熟悉元素性质及递变规律,根据元素在周期表的位置做出准确判断。Tl元素位于第6周期ⅢA族。根据元素性质递变规律:同主族元素,随原子序数的增大,失电子能力逐渐增强,金属离子的氧化性逐渐减弱,氧化物对应水化物的碱性逐渐增强。可判断①④正确。
6.答案:D 解析:根据题意,推出R为N元素,T为Al元素,Q为Si元素,W为S元素;选项A,非金属性N>Si,故热稳定性NH3>SiH4,A正确;选项B,H2SiO3的酸性小于H2SO4,B正确;选项C,原子半径Al>Si>N,C正确;选项D,铝元素可存在于铝离子中,也可存在于四羟基合铝酸根离子中。
7.答案:D 解析:根据同周期、同主族元素性质的递变规律可以判断各选项的正误。A项e、d元素同主族,且d在第2周期,e在第3周期,因此d的氢化物比e的氢化物稳定。B项中a、b、e三种元素同周期,故原子半径为a>b>e。六种元素的单质中c的单质(碳)化学性质最不活泼。得电子能力的强弱顺序: f>e>c,故它们的最高价氧化物对应的水化物的酸性依次增强。
8.答案:C 解析:先确定各元素在元素周期表中的位置,判断出非金属性的强弱,然后判断各项是否正确。①微粒半径的大小顺序应为:S2->S>Cl>F;③还原性顺序应为:S2->I->Br->Cl-;⑤酸性顺序应为:HClO4>H2SO4>H2SeO4;其余②④⑥的结论都是对的。
9.Ⅰ.(1)答案:A-Z
(2)答案:A-n-x
(3)答案:A-x+n
(4)答案:22
(5)答案:n(m-x+2)/m
Ⅱ.(1)答案:①④
(2)答案:③
(3)答案:18、19、20、21、22、23、24 18
10.(1)答案:7 K2O、K2O2(KO2也可以)
(2)答案:He、Ne、Ar
(3)答案:C、H
(4)答案:Na
(5)答案:NH3 SiH4
解析:短周期元素金属性最强的是金属钠,前20号元素金属性最强的为金属钾,从钠形成的氧化物,可以迁移得到钾的氧化物。
11.(1)答案:①橙红 ②紫红
(2)答案:同主族元素从上到下,原子的得电子能力逐渐减弱,即氧化性逐渐减弱
(3)答案:①Cl2+2Br-===Br2+2Cl- Br2+2I-===I2+2Br-
②HF的稳定性比HCl强 F2能置换出水中的氧,而Cl2不能置换出水中的氧(任答两项,其他合理答案也可)
解析:向NaBr溶液中加入氯水,发生反应:Cl2+2Br-===Br2+2Cl-,证明氧化性:Cl2>Br2,再加入CCl4后,振荡静置,溶液分层,上层近无色,下层呈橙红色;向KI溶液中加入溴水,发生反应:Br2+2I-===I2+2Br-,证明氧化性:Br2>I2,再加入CCl4后,振荡静置,溶液分层,上层近无色,下层呈紫红色。两个实验说明:同主族元素从上到下,原子的得电子能力逐渐减弱。
12.(1)答案:①③
(2)答案:H(或氢)
(3)答案:①见下表 ②镁 BC
解析:ⅠA族中有氢元素和碱金属元素,ⅥA族中有O、S、Se、Te(非金属元素)和Po(金属元素),过渡元素全部是金属元素,稀有气体元素全部是非金属元素。有机物种类远远超过无机物的种类,而组成有机物的最基本元素是C和H,我们通常说碳元素形成的化合物最多,但含碳的有机化合物同时都含有氢,氢在无机物中也大量存在。所以形成化合物种类最多的元素应当是H。(3)在冷的浓硫酸中钝化,且在空气中能形成致密的氧化膜,在短周期元素中只有铝,故甲为铝元素。乙元素原子核外M电子层与K电子层上的电子数相等,说明M层上有2个电子,乙元素原子核外电子排布是2、8、2,即12号元素镁、同周期从左向右,元素原子失电子能力逐渐减弱,故镁、铝相比,镁的失电子能力较强。镁的金属性比铝强,通常可通过与酸或水反应的速率快慢进行比较,也可根据其最高价氧化物对应水化物的碱性大小进行比较,所以选B、C两项。
《从社区看我家》(说课稿)
尊敬的各位专家、同仁:
大家好。我今天说课的题目是《从社区看我家》,共分为六个部分:教材分析、学情分析、教法学法、教学流程、板书设计和设计感悟。
一、教材分析
(一)教材地位和作用
《从社区看我家》一课是人教版七上第一单元第一课“我的家在哪里”的第1课时。作为全书的第一部分,旨在引导学生从认识个人生活的社区环境着眼,从身边熟悉的事物出发,逐步认识我们生活的世界。教材主要通过平面图和地图的方式来说明家在社区中的位置,阅读和使用地图是学生认识社会,以及生活中不可或缺的基础知识和基本技能,也是学习历史与社会课程的必备工具之一。
根据课标要求,结合教材内容和学生实际,我拟定了如下教学目标:
(二)教学目标
1.知识与能力:知道地图的三要素,运用地图确定方向及测定距离。
2.过程与方法:学生在绘制教室平面图等课堂活动中,通过比较、概括等思维过程,形成地图三要素的基本概念,进而学会解决实际问题。
3.情感态度价值观:通过体验性学习,激发学生学习地理问题的热情,同时培养学生的合作精神、让学生享受成功的喜悦。
(三)教学重难点
在教学目标和教材内容的指引下,结合学生知识储备,我拟定了如下教学重、难点:
重点:地图三要素的学习与运用。
难点:比例尺的学习与运用。
二、学情分析
初中学生好动、好奇、好表现;注意力易分散,爱发表见解,希望得到老师的表扬,所以一方面要创设学生感兴趣的情境,引发学生的兴趣,使他们的注意力始终集中在课堂上。另一方面要创造条件和机会,让学生发表见解,并且及时激励学生,发挥学生学习的主动性。
三、教法学法
我的教学总体构想是“教师搭台,学生唱戏” ,倡导学生主动学习,乐于探究。“教师搭台”是指我设置情景,通过问题的设计扮演好组织者和引路者的角色。 “学生唱戏”是指让学生分组讨论,合作探究读图,通过活动进行体验性学习,让学生真正成为课堂活动的主角。
四、说教学流程
(一)情境创设、导入新课
【课前准备】
即将召开家长会,布置学生预习本节内容,每人画一张学校平面图,帮助家长能准确找到自己的班级。
【设计意图】
通过预习让学生对地图的基本要素有初步的了解,同时也锻炼学生收集地理信息的能力。
上课时,请同学相互展示自己所画的平面图,并相互点评对方所绘平面图的完整性。
【设计意图】
由学生自己所画的平面图引入,会让学生对这部分知识感到亲切。同时通过点评让学生相互去发现对方所绘平面地图的完整性,这样既达到导入新课——地图的三要素的目的又激发学生学习本节课的兴趣。
(二)师生互动、突出重点
选两张学生画的有代表性的学校平面图
1、图例和注记
提问:同样所画是学校平面图,为什么教学楼A楼在两幅图中所画的不一样呢?
学生讨论,引出图例和注记。
图例——地图上用来表示各种地理事物的符号
注记——地图上用来说明符号的文字和数字(选择一幅地图解释哪些属于图例,哪些属于注记)
指导学生读图:观察“常用图例图”,并利用《世界政区图》和《世界地形图》去寻找这些图例,通过学和用,来加深印象。
【设计意图】
这部分知识较为简单,以学生为主体,通过观察法进行学习。以看图分析为主,同时培养学生读图、分析地图的能力。
2、方向
继续提问:同样所画是学校平面图,为什么操场和教学楼在两幅图中的相对位置不一样呢?
学生讨论,引出方向。(因为他们所站的观察角度不同即方向不同,所以两者的相对位置不一样)
一般定向法:学会肯定会说出“上北下南、左西右东”这一方向判定口诀,在学生回答的基础上给出没有任何方向指示的地图,叫学生说出指定的两地的相对方向。然后给出“地平面上八个方向图”。
指向标定向法:再给出一幅带有指向标的地图,指定两地叫学生判断相对方向,学生肯定会忽视指向标,从而回答错误,这时在地图上圈出“指向标”提醒学生,并告知口诀:指向标永远指向北方,然后从新判断两地相对位置。(南京站在中山陵什么方向)
经纬网定向法:给出一幅带有经纬网的地图,指定两地叫学生判断相对方向,因为之前没有学习过有关经纬线知识,所以,经纬网学生也是初次了解,因为在从地球仪上看世界要重点讲解经纬线,所以,本课仅让学生了解“经线指示南北方向,纬线指示东西方向”即可。
一般定向法:上北下南、左西右东
总结:方向的分类 指向标定向法:箭头总是指向北
经纬网定向法:经线指示南北方向、纬线指示东西方向
【设计意图】
这一部分教学主要是通过典型实例分析,让学生在学中练,在练中学,完成三幅地图中方向的判断,掌握
知识点,培养学生的识图、用图的能力。
师说明:因为比例尺的学习既是重点也是难点,所以将比例尺内容放在难点处讲解。
(三)合作探究、突破难点
3、比例尺
再次提问:同样是学校平面图,为什么操场在两幅图中大小不一样呢?
学生讨论,引出比例尺。
比例尺:比例尺表示图上距离比实地距离缩小的程度,地图上的比例尺也简称为“缩尺”。 图上距离
比例尺=
实地距离
合作探究活动:小组合作,量出教室的长和宽,按比例缩小画在纸上,画出教室的平面图,并标出比例尺大小。(分小组测量,共享数据,可以节省时间)
通过活动发现问题。
问题一:比例尺应该用何种形式表示?
学生在作图的过程中,教师通过观察发现,在表示比例尺时,学生有的用线段表示,有的用文字表示,还有的用数字表示。
小结:比例尺的三种表现形式,老师强调比例尺使用时要注意的事项,如数字式比例尺表示的是图上距离与实际距离的倍数关系,使用时两者单位要一致;线段和文字式比例尺须注明数值和单位。
问题二:比例尺大小对比
【课堂练习】:三种比例尺表示方法间的换算和比较。
(对学生进行学法指导:首先一律写成分数形式,其次换算成统一单位,最后比较分母,分母数字大比例尺则小,分母数字小比例尺则大。)
【拓展】:给出浙江省地图和中国地图,注明两幅图图幅大小相同,设计三个问题:
哪一幅地图表示的区域范围大?
杭州在两幅地图中的详细程度是否相同?
为什么会出现这种情况?
指导学生观察地图,解决三个问题,可以得出结论:
在图幅相同的情况下进行比较
比例尺
大
小
表示的范围
小
大
内容详略
详细
简略
【设计意图】
比例尺这部分内容是本节课的一个重难点,虽然学生知道比例尺,但是,对于比例尺中各项具体表示的内容很容易混淆。让学生自己动手测量、绘图,可以加深对比例尺定义的理解及发现因比例尺大小引起实地范围大小及内容详略程度不同。故而,采用活动教学。 从活动中发现问题,再讨论分析问题,最后由学生解决问题,体现学生的主体地位。
(四)拓展延伸、留有余味
作业设计:根据所学地图三要素知识,将自己所画的学校平面图修改完善,然后从班级中选出最好的一幅(图例和注记清楚,比例尺选用得当,方向清楚标明),复印发给每位同学家长,并注明姓名。
五、板书设计
图例和注记:常用图例
地 一般定向法:上北下南、左西右东
图 方向: 指向标定向法:指向标永远指向北方
“ 经纬网定向法:经线指示南北方向、纬线指示东西方向
语
言 公式 数字式
” 三种表示方法 线段式
文字式
比例尺: 比例尺大小对比
比例尺大小、地图实地范围大小、内容详略程度之间关系
六、设计感悟
本课设计与别人不一样,主要体现在以下几方面:
注重学生能力的提升:通过层层问题的设计,对学生进行思维引导,提升学生思考能力;指导学生
读图,培养读图能力等。
2、注重学生情感的升华:通过绘画学校平面图,感受体验性学习,激发学生学习地理知识的热情,通过选择最好的地图在家长会上使用并注明姓名,调动学生积极性,为荣誉而努力。
3、注重学生合作意识的培养:通过小组合作探究活动,增加学生合作意识,共同完成任务。
以上就是我对《从社区看我家》的说课设计,在讲述过程中如有不妥之处,敬请各位专家、同仁批评指正,谢谢大家。
(时间60分钟,满分100分)
一、选择题(本题共8小题,每小题6分,共48分。每小题只有一个正确选项)
1.是常规核裂变产物之一,可以通过测定大气或水中的含量变化来监测核电站是否发生放射性物质泄漏。下列有关的叙述中错误的是( )
A.的化学性质与相同
B.的原子序数为53
C.的原子核外电子数为78
D.的原子核内中子数多于质子数
2.某元素原子的核外电子排布示意图如下图所示,下列原子中,与该元素原子的化学性质相似的是( )
3.下面是四位同学学完《原子结构》一节内容后,对这节内容的认识,你认为不正确的是( )
4.下列关于元素周期表和元素周期律的说法错误的是( )
A.Li、Na、K原子的电子层数随着核电荷数的增加而增多
B.第2周期元素从Li到F,非金属性逐渐增强
C.因为Na比K容易失去电子,所以Na比K的还原性强
D.O与S为同主族元素,且O比S的非金属性强
5.近年来,我国在超导体材料研究方面居于世界领先地位,铊(Tl)是超导体的组成成分之一,铊位于第6周期ⅢA族。下列对铊的性质的推导正确的是( )
①是易导电的银白色金属
②Tl(OH)3是两性氢氧化物
③Tl3+氧化能力比Al3+强
④单质能与稀硝酸反应生成硝酸盐
A.①④ B.②③
C.① D.④
6.短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是( )
A.最简单气态氢化物的热稳定性:R>Q
B.最高价氧化物对应水化物的酸性:Q<W
C.原子半径:T>Q>R
D.含T的盐中,T元素只能存在于阳离子中
7.下表是元素周期表的一部分,有关说法正确的是( )
A.e的氢化物比d的氢化物稳定
B.a、b、e三种元素的原子半径:e>b>a
C.六种元素中,c元素单质的化学性质最活泼
D.c、e、f的最高价氧化物对应的水化物的酸性依次增强
8.下列结论是从某同学的作业本上摘录的,其中你认为肯定正确的是( )
①微粒半径:S2->Cl>S>F
②氢化物的稳定性:HF>HCl>H2S>H2Se
③还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>HClO4>H2SeO4
⑥得电子能力:F>Cl>S>Se
A.①⑤ B.①③④
C.②④⑥ D.⑥
二、非选择题(本题共4小题,共52分)
9.(14分)Ⅰ.用表示原子:
(1)中性原子的中子数:N=______。
(2)阳离子的中子数:AXn+共有x个电子,则N=______。
(3)阴离子的中子数:AXn-共有x个电子,则N=______。
(4)中性分子中子数:12C16O2分子中,N=______。
(5)A2-原子核内有x个中子,其质量数为m,则n g A2-所含电子的物质的量为______ mol。
Ⅱ.有①、、 ②H2、D2、T2 ③石墨、金刚石 ④、、四组微粒或物质,回答下列问题:
(1)互为同位素的是________(填编号,下同)。
(2)互为同素异形体的是________。
(3)由①和④中微粒能结合成含三个原子的化合物,这些化合物的相对分子质量可能是__________,可能形成的水分子种类有:________种。
10.(14分)根据元素周期表1~20号元素的性质和递变规律,回答下列问题。
(1)属于金属元素的有______种,金属性最强的元素与氧反应生成的化合物有______(填两种化合物的化学式)。
(2)属于稀有气体的是______(填元素符号,下同)。
(3)形成化合物种类最多的两种元素是______。
(4)第3周期中,原子半径最大的是(稀有气体除外)______。
(5)推测Si、N最简单氢化物的稳定性:______大于______(填化学式)。
11.(12分)某学生在做同主族元素性质递变规律的实验时,自己设计了一套实验方案,并记录了有关的实验现象。现在请你帮助该学生整理并完成实验报告。
(1)实验目的:探究同一主族元素性质的递变规律。
(2)实验用品:
仪器:试管、胶头滴管
药品:氯水、溴水、溴化钠溶液、碘化钠溶液、四氯化碳。
(3)实验内容(在下表横线中填写相关内容):
序号
实验方案
实验现象
①
向盛有少量溴化钠溶液的试管中滴加少量新制的氯水,振荡,再注入少量四氯化碳,振荡后静置
液体分为两层,下层呈____色
②
向盛有少量碘化钾溶液的试管中滴加少量新制溴水,振荡,再注入少量四氯化碳,振荡后静置
液体分为两层,下层呈____色
(4)实验结论:______________________________________________________________。
(5)问题和讨论:
①上述两个实验中发生的反应的离子方程式分别为__________________、______________________。
②由于氟过于活泼,所以很难设计出一个简单的实验来验证其氧化性的强弱。试列举两项事实说明氟的非金属性比氯强:______________________、______________________。
12.(12分)
(1)在上面元素周期表中既有金属元素,又有非金属元素的区域为______(填序号)。
①A ②B ③C ④D
(2)有人认为形成化合物最多的元素不是ⅣA族的碳元素,而是另一种短周期元素,请你根据学过的化学知识判断这一元素是______。
(3)现有甲、乙两种短周期元素,室温下,甲元素的单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。
②甲、乙两元素相比较,金属性较强的是______(填名称),可以验证该结论的实验是______(填序号)。
A.将在空气中放置已久的这两种元素的块状单质分别放入热水中
B.将这两种元素的单质粉末分别和同浓度的盐酸反应
C.将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
D.比较这两种元素的气态氢化物的稳定性
参考答案
1.答案:C 解析:与互为同位素,二者的化学性质相同;的原子序数为53,原子核外电子数为53,中子数为131-53=78,则的原子核内中子数多于质子数。
2.答案:D 解析:最外层电子数相同的元素原子具有相似的化学性质,A最外层8个电子,B最外层4个电子,C最外层2个电子,D最外层6个电子。
3.答案:C 解析:由于有的元素可以形成几种质量数不同的核素,因此导致原子的种类大于元素的种类,即A的说法正确;原子核的体积虽然很小,但是由于电子的质量较小,故原子的质量主要集中在原子核上,即B的说法正确;并不是所有的原子都是由质子、中子、电子构成的,如就只由质子和电子构成,而没有中子,即C的说法是错误的;12C与13C同属于C元素,但是它们的中子数(或质量数)不同,故互为同位素,即D的说法是正确的。
4.答案:C 解析:同一主族元素随核电荷数的增加,电子层数逐渐增加,金属元素失电子能力增强,金属性增强,还原性增强;非金属元素得电子能力减弱,非金属性减弱,氧化性减弱。同一周期元素随核电荷数的增加,最外层电子数增多,金属性减弱,非金属性增强。
5.答案:A 解析:解此类题一定要熟悉元素性质及递变规律,根据元素在周期表的位置做出准确判断。Tl元素位于第6周期ⅢA族。根据元素性质递变规律:同主族元素,随原子序数的增大,失电子能力逐渐增强,金属离子的氧化性逐渐减弱,氧化物对应水化物的碱性逐渐增强。可判断①④正确。
6.答案:D 解析:根据题意,推出R为N元素,T为Al元素,Q为Si元素,W为S元素;选项A,非金属性N>Si,故热稳定性NH3>SiH4,A正确;选项B,H2SiO3的酸性小于H2SO4,B正确;选项C,原子半径Al>Si>N,C正确;选项D,铝元素可存在于铝离子中,也可存在于四羟基合铝酸根离子中。
7.答案:D 解析:根据同周期、同主族元素性质的递变规律可以判断各选项的正误。A项e、d元素同主族,且d在第2周期,e在第3周期,因此d的氢化物比e的氢化物稳定。B项中a、b、e三种元素同周期,故原子半径为a>b>e。六种元素的单质中c的单质(碳)化学性质最不活泼。得电子能力的强弱顺序: f>e>c,故它们的最高价氧化物对应的水化物的酸性依次增强。
8.答案:C 解析:先确定各元素在元素周期表中的位置,判断出非金属性的强弱,然后判断各项是否正确。①微粒半径的大小顺序应为:S2->S>Cl>F;③还原性顺序应为:S2->I->Br->Cl-;⑤酸性顺序应为:HClO4>H2SO4>H2SeO4;其余②④⑥的结论都是对的。
9.Ⅰ.(1)答案:A-Z
(2)答案:A-n-x
(3)答案:A-x+n
(4)答案:22
(5)答案:n(m-x+2)/m
Ⅱ.(1)答案:①④
(2)答案:③
(3)答案:18、19、20、21、22、23、24 18
10.(1)答案:7 K2O、K2O2(KO2也可以)
(2)答案:He、Ne、Ar
(3)答案:C、H
(4)答案:Na
(5)答案:NH3 SiH4
解析:短周期元素金属性最强的是金属钠,前20号元素金属性最强的为金属钾,从钠形成的氧化物,可以迁移得到钾的氧化物。
11.(1)答案:①橙红 ②紫红
(2)答案:同主族元素从上到下,原子的得电子能力逐渐减弱,即氧化性逐渐减弱
(3)答案:①Cl2+2Br-===Br2+2Cl- Br2+2I-===I2+2Br-
②HF的稳定性比HCl强 F2能置换出水中的氧,而Cl2不能置换出水中的氧(任答两项,其他合理答案也可)
解析:向NaBr溶液中加入氯水,发生反应:Cl2+2Br-===Br2+2Cl-,证明氧化性:Cl2>Br2,再加入CCl4后,振荡静置,溶液分层,上层近无色,下层呈橙红色;向KI溶液中加入溴水,发生反应:Br2+2I-===I2+2Br-,证明氧化性:Br2>I2,再加入CCl4后,振荡静置,溶液分层,上层近无色,下层呈紫红色。两个实验说明:同主族元素从上到下,原子的得电子能力逐渐减弱。
12.(1)答案:①③
(2)答案:H(或氢)
(3)答案:①见下表 ②镁 BC
解析:ⅠA族中有氢元素和碱金属元素,ⅥA族中有O、S、Se、Te(非金属元素)和Po(金属元素),过渡元素全部是金属元素,稀有气体元素全部是非金属元素。有机物种类远远超过无机物的种类,而组成有机物的最基本元素是C和H,我们通常说碳元素形成的化合物最多,但含碳的有机化合物同时都含有氢,氢在无机物中也大量存在。所以形成化合物种类最多的元素应当是H。(3)在冷的浓硫酸中钝化,且在空气中能形成致密的氧化膜,在短周期元素中只有铝,故甲为铝元素。乙元素原子核外M电子层与K电子层上的电子数相等,说明M层上有2个电子,乙元素原子核外电子排布是2、8、2,即12号元素镁、同周期从左向右,元素原子失电子能力逐渐减弱,故镁、铝相比,镁的失电子能力较强。镁的金属性比铝强,通常可通过与酸或水反应的速率快慢进行比较,也可根据其最高价氧化物对应水化物的碱性大小进行比较,所以选B、C两项。
《从社区看我家》(说课稿)
尊敬的各位专家、同仁:
大家好。我今天说课的题目是《从社区看我家》,共分为六个部分:教材分析、学情分析、教法学法、教学流程、板书设计和设计感悟。
一、教材分析
(一)教材地位和作用
《从社区看我家》一课是人教版七上第一单元第一课“我的家在哪里”的第1课时。作为全书的第一部分,旨在引导学生从认识个人生活的社区环境着眼,从身边熟悉的事物出发,逐步认识我们生活的世界。教材主要通过平面图和地图的方式来说明家在社区中的位置,阅读和使用地图是学生认识社会,以及生活中不可或缺的基础知识和基本技能,也是学习历史与社会课程的必备工具之一。
根据课标要求,结合教材内容和学生实际,我拟定了如下教学目标:
(二)教学目标
1.知识与能力:知道地图的三要素,运用地图确定方向及测定距离。
2.过程与方法:学生在绘制教室平面图等课堂活动中,通过比较、概括等思维过程,形成地图三要素的基本概念,进而学会解决实际问题。
3.情感态度价值观:通过体验性学习,激发学生学习地理问题的热情,同时培养学生的合作精神、让学生享受成功的喜悦。
(三)教学重难点
在教学目标和教材内容的指引下,结合学生知识储备,我拟定了如下教学重、难点:
重点:地图三要素的学习与运用。
难点:比例尺的学习与运用。
二、学情分析
初中学生好动、好奇、好表现;注意力易分散,爱发表见解,希望得到老师的表扬,所以一方面要创设学生感兴趣的情境,引发学生的兴趣,使他们的注意力始终集中在课堂上。另一方面要创造条件和机会,让学生发表见解,并且及时激励学生,发挥学生学习的主动性。
三、教法学法
我的教学总体构想是“教师搭台,学生唱戏” ,倡导学生主动学习,乐于探究。“教师搭台”是指我设置情景,通过问题的设计扮演好组织者和引路者的角色。 “学生唱戏”是指让学生分组讨论,合作探究读图,通过活动进行体验性学习,让学生真正成为课堂活动的主角。
四、说教学流程
(一)情境创设、导入新课
【课前准备】
即将召开家长会,布置学生预习本节内容,每人画一张学校平面图,帮助家长能准确找到自己的班级。
【设计意图】
通过预习让学生对地图的基本要素有初步的了解,同时也锻炼学生收集地理信息的能力。
上课时,请同学相互展示自己所画的平面图,并相互点评对方所绘平面图的完整性。
【设计意图】
由学生自己所画的平面图引入,会让学生对这部分知识感到亲切。同时通过点评让学生相互去发现对方所绘平面地图的完整性,这样既达到导入新课——地图的三要素的目的又激发学生学习本节课的兴趣。
(二)师生互动、突出重点
选两张学生画的有代表性的学校平面图
1、图例和注记
提问:同样所画是学校平面图,为什么教学楼A楼在两幅图中所画的不一样呢?
学生讨论,引出图例和注记。
图例——地图上用来表示各种地理事物的符号
注记——地图上用来说明符号的文字和数字(选择一幅地图解释哪些属于图例,哪些属于注记)
指导学生读图:观察“常用图例图”,并利用《世界政区图》和《世界地形图》去寻找这些图例,通过学和用,来加深印象。
【设计意图】
这部分知识较为简单,以学生为主体,通过观察法进行学习。以看图分析为主,同时培养学生读图、分析地图的能力。
2、方向
继续提问:同样所画是学校平面图,为什么操场和教学楼在两幅图中的相对位置不一样呢?
学生讨论,引出方向。(因为他们所站的观察角度不同即方向不同,所以两者的相对位置不一样)
一般定向法:学会肯定会说出“上北下南、左西右东”这一方向判定口诀,在学生回答的基础上给出没有任何方向指示的地图,叫学生说出指定的两地的相对方向。然后给出“地平面上八个方向图”。
指向标定向法:再给出一幅带有指向标的地图,指定两地叫学生判断相对方向,学生肯定会忽视指向标,从而回答错误,这时在地图上圈出“指向标”提醒学生,并告知口诀:指向标永远指向北方,然后从新判断两地相对位置。(南京站在中山陵什么方向)
经纬网定向法:给出一幅带有经纬网的地图,指定两地叫学生判断相对方向,因为之前没有学习过有关经纬线知识,所以,经纬网学生也是初次了解,因为在从地球仪上看世界要重点讲解经纬线,所以,本课仅让学生了解“经线指示南北方向,纬线指示东西方向”即可。
一般定向法:上北下南、左西右东
总结:方向的分类 指向标定向法:箭头总是指向北
经纬网定向法:经线指示南北方向、纬线指示东西方向
【设计意图】
这一部分教学主要是通过典型实例分析,让学生在学中练,在练中学,完成三幅地图中方向的判断,掌握
知识点,培养学生的识图、用图的能力。
师说明:因为比例尺的学习既是重点也是难点,所以将比例尺内容放在难点处讲解。
(三)合作探究、突破难点
3、比例尺
再次提问:同样是学校平面图,为什么操场在两幅图中大小不一样呢?
学生讨论,引出比例尺。
比例尺:比例尺表示图上距离比实地距离缩小的程度,地图上的比例尺也简称为“缩尺”。 图上距离
比例尺=
实地距离
合作探究活动:小组合作,量出教室的长和宽,按比例缩小画在纸上,画出教室的平面图,并标出比例尺大小。(分小组测量,共享数据,可以节省时间)
通过活动发现问题。
问题一:比例尺应该用何种形式表示?
学生在作图的过程中,教师通过观察发现,在表示比例尺时,学生有的用线段表示,有的用文字表示,还有的用数字表示。
小结:比例尺的三种表现形式,老师强调比例尺使用时要注意的事项,如数字式比例尺表示的是图上距离与实际距离的倍数关系,使用时两者单位要一致;线段和文字式比例尺须注明数值和单位。
问题二:比例尺大小对比
【课堂练习】:三种比例尺表示方法间的换算和比较。
(对学生进行学法指导:首先一律写成分数形式,其次换算成统一单位,最后比较分母,分母数字大比例尺则小,分母数字小比例尺则大。)
【拓展】:给出浙江省地图和中国地图,注明两幅图图幅大小相同,设计三个问题:
哪一幅地图表示的区域范围大?
杭州在两幅地图中的详细程度是否相同?
为什么会出现这种情况?
指导学生观察地图,解决三个问题,可以得出结论:
在图幅相同的情况下进行比较
比例尺
大
小
表示的范围
小
大
内容详略
详细
简略
【设计意图】
比例尺这部分内容是本节课的一个重难点,虽然学生知道比例尺,但是,对于比例尺中各项具体表示的内容很容易混淆。让学生自己动手测量、绘图,可以加深对比例尺定义的理解及发现因比例尺大小引起实地范围大小及内容详略程度不同。故而,采用活动教学。 从活动中发现问题,再讨论分析问题,最后由学生解决问题,体现学生的主体地位。
(四)拓展延伸、留有余味
作业设计:根据所学地图三要素知识,将自己所画的学校平面图修改完善,然后从班级中选出最好的一幅(图例和注记清楚,比例尺选用得当,方向清楚标明),复印发给每位同学家长,并注明姓名。
五、板书设计
图例和注记:常用图例
地 一般定向法:上北下南、左西右东
图 方向: 指向标定向法:指向标永远指向北方
“ 经纬网定向法:经线指示南北方向、纬线指示东西方向
语
言 公式 数字式
” 三种表示方法 线段式
文字式
比例尺: 比例尺大小对比
比例尺大小、地图实地范围大小、内容详略程度之间关系
六、设计感悟
本课设计与别人不一样,主要体现在以下几方面:
注重学生能力的提升:通过层层问题的设计,对学生进行思维引导,提升学生思考能力;指导学生
读图,培养读图能力等。
2、注重学生情感的升华:通过绘画学校平面图,感受体验性学习,激发学生学习地理知识的热情,通过选择最好的地图在家长会上使用并注明姓名,调动学生积极性,为荣誉而努力。
3、注重学生合作意识的培养:通过小组合作探究活动,增加学生合作意识,共同完成任务。
以上就是我对《从社区看我家》的说课设计,在讲述过程中如有不妥之处,敬请各位专家、同仁批评指正,谢谢大家。
