基础实验6粗盐的初步提纯同步练习沪教版化学九年级下册(含答案)
文档属性
| 名称 | 基础实验6粗盐的初步提纯同步练习沪教版化学九年级下册(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 151.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-16 12:56:36 | ||
图片预览



文档简介
基础实验6粗盐的初步提纯
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.食盐是重要的调味品,精盐是由粗盐提纯而来,在提纯过程中通常不需要的操作是
A.蒸发 B.吸附 C.过滤 D.溶解
2.下列物质中,属于纯净物的是
A.碘酒 B.海水 C.白磷 D.粗盐
3.完成“一定溶质质量分数的氯化钠溶液的配制”和“粗盐中难溶性杂质的去除”两个实验,都必需用到的仪器是
A.玻璃棒 B.酒精灯
C.漏斗 D.试管
4.“粗盐中难溶性杂质的去除”的实验中,下列操作正确的是
A.取用 B.溶解
C.过滤 D.蒸发
5.粗盐提纯实验中的一些操作,包含化学变化的是
A.量取液体 B.称量固体 C.过滤 D.点燃酒精灯
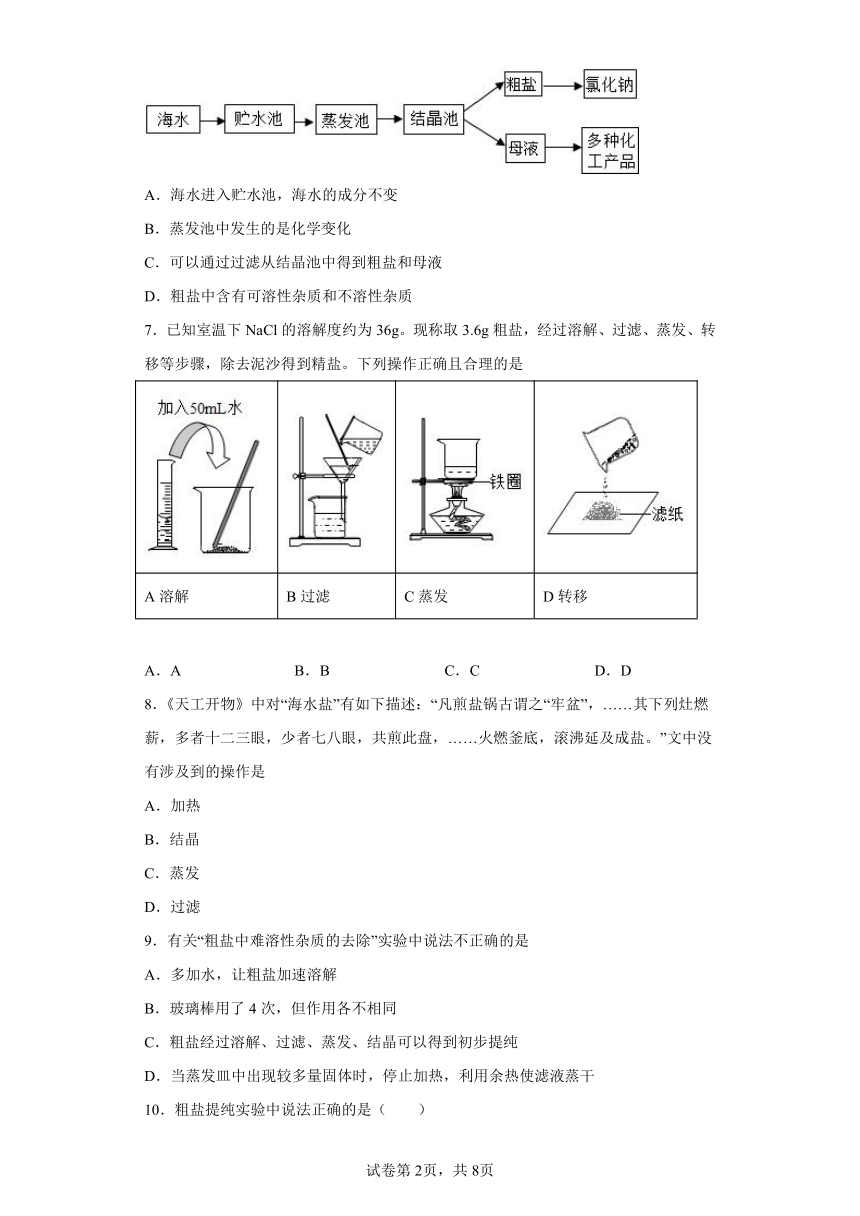
6.如图是利用海水提取粗盐的过程,有关该过程的说法不正确的是
A.海水进入贮水池,海水的成分不变
B.蒸发池中发生的是化学变化
C.可以通过过滤从结晶池中得到粗盐和母液
D.粗盐中含有可溶性杂质和不溶性杂质
7.已知室温下NaCl的溶解度约为36g。现称取3.6g粗盐,经过溶解、过滤、蒸发、转移等步骤,除去泥沙得到精盐。下列操作正确且合理的是
A溶解 B过滤 C蒸发 D转移
A.A B.B C.C D.D
8.《天工开物》中对“海水盐”有如下描述:“凡煎盐锅古谓之“牢盆”,……其下列灶燃薪,多者十二三眼,少者七八眼,共煎此盘,……火燃釜底,滚沸延及成盐。”文中没有涉及到的操作是
A.加热
B.结晶
C.蒸发
D.过滤
9.有关“粗盐中难溶性杂质的去除”实验中说法不正确的是
A.多加水,让粗盐加速溶解
B.玻璃棒用了4次,但作用各不相同
C.粗盐经过溶解、过滤、蒸发、结晶可以得到初步提纯
D.当蒸发皿中出现较多量固体时,停止加热,利用余热使滤液蒸干
10.粗盐提纯实验中说法正确的是( )
A.溶解时为了让粗盐加速溶解,尽可能的多加入一些水
B.过滤时玻璃棒必须靠在滤纸上方的漏斗壁上以防止滤纸破损
C.蒸发时需要将滤液全部蒸干后停止加热
D.粗盐可以直接放在烧杯中进行称量
二、判断题
11.计算粗盐中精盐的产率公式是:产率=精盐质量/粗盐质量×100%( )
12.粗盐提纯实验中,蒸发时液滴飞溅,导致产率偏高( )
13.粗盐提纯的溶解、过滤、蒸发、计算产率中,都会用到玻璃棒且玻璃棒的作用各不相同( )
14.粗盐经过溶解、过滤、蒸发、结晶得到的精盐仍为混合物( )
15.除去粗盐中的沙子实验,实验结束后称量所得的精盐,产率偏高,其可能原因是蒸发时未充分蒸干固体( )
三、填空题
16.下面是“粗盐中难溶性杂质的去除”的实验操作示意图:
(1)仪器a的名称____________;
(2)操作A中托盘两边各放一张大小相同的纸片,其作用是__________;
(3)操作B中还需要用到的仪器是________;
(4)操作 C过滤时倒入液体的液面要低于滤纸边缘主要是为了防止 (填序号)______;
A.过滤速度慢 B.滤纸破损 C.杂质未经过滤就进入滤液
(5)图中部分操作有错误,其中有的错误会导致精盐产率明显偏低,其原因是_____________________。
17.粗盐提纯各操作注意事项:
(1)称量时:______使用时要调节平衡,读数要准确,取药品要规范,不撒落。
(2)溶解时:搅拌要匀速,不能过快,防止______。
(3)过滤时:要规范装置和操作,做到“______”。
(4)蒸发时:不断搅拌,防止______;______时,停止加热。
转移时:要全部转移进行准确称量。
18.利用海水提取粗盐的过程如下图所示,回答有关问题:
(1)一定质量的海水,通过贮水池引入到蒸发池中,在没有引入结晶池之前的蒸发过程中,蒸发池中氯化钠的质量会__________(填“增大”、“不变”或“减小”),析出晶体后得到的母液是氯化钠的__________(填“饱和”或“不饱和”)。
(2)粗盐中含有的难溶性杂质,在实验室里可以通过溶解、过滤、蒸发等操作将其去除,这些操作中都会用到玻璃棒,其中在过滤操作中玻璃棒的作用是__________(填“引流”或“加快溶解”)。
(3)用氯化钠固体配制100g质量分数为6%的氯化钠溶液。
①配制时,涉及以下实验步骤:A.称量及量取B.计算C.溶解D.装瓶贴标签。其正确的实验步骤顺序是__________。(填字母)
②将已配好的100g质量分数为6%的氯化钠溶液变成质量分数为16%的氯化钠溶液,需要再加NaCl的质量是__________g(计算结果精确到0.1)
19.溶液与人类生产、生活密切相关。
(1)下列物质中,由分子构成的是_________(填字母,下同),溶于水后在溶液中以离子形式存在的是_________。
A 蔗糖 B 氯化氢 C 氯化钠 D 硫酸钠
(2)下图是三种常见固体的溶解度曲线。
下列说法中,正确的是_________(填字母)。
A 通过加热能让Ca(OH)2的饱和溶液变为不饱和溶液
B NaCl中混有少量KNO3,通常采用冷却热的饱和溶液的方法提纯NaCl
C 10℃时,在等质量的KNO3溶液和NaCl溶液中,溶质的质量分数前者小于后者
D 60℃时,将等质量的KNO3和NaCl配成饱和溶液,需要水的质量前者小于后者
(3)20℃时,把67g氯化钾的饱和溶液稀释为质量分数为20%的氯化钾溶液(已知20℃时氯化钾的溶解度是34g),实验步骤如下。
①计算:需要水的质量是_________g。
②量取:用_________量取所需的水,倒入盛有67g氯化钾的饱和溶液的烧杯中。
③混匀:用玻璃棒搅拌,使溶液混合均匀。
④存储:把配制好的溶液装入试剂瓶中,盖好瓶塞并贴上标签(标签中应包括药品名称和_________),放到试剂柜中。
(4)去除粗盐中的难溶性杂质,实验步骤依次为溶解、过滤、_________、计算产率。称取5.0g粗盐,逐渐加入10mL水中,直到不再溶解,剩余粗盐1.0g,经提纯后得到精盐3.3g,则精盐的产率为_________。
20.请从两题中任选一个作答。
A.配制质量分数为6%的氯化钠溶液 B.粗盐中难溶性杂质的去除
(1)量取时需要用到的仪器有_______(填序号)。 (2)溶解过程中,用玻璃棒不断搅拌的目的是_______。 (1)过滤时需要用到的仪器有_______(填序号)。 (2)蒸发过程中,用玻璃棒不断搅拌的目的是_______。
可供选择的仪器:①烧杯②蒸发皿③托盘天平④酒精灯⑤量筒⑥漏斗⑦玻璃棒⑧胶头滴管⑨铁架台⑩药匙
四、综合应用题
21.食用的食盐大多来自海水晾晒。海水经蒸发结晶后可获得含有少量泥沙和杂质的粗盐。 请根据实验回答下列问题
(1)在“蒸发结晶”的操作中,玻璃棒的作用是_____,当蒸发皿中出现_____ 时,应停止加热。
(2)若得到 NaCl 的产率比实际值偏低,则可能的原因是(填序号)_____。
a.蒸发时未充分蒸干 b.溶解含有泥沙的 NaCl 时,加入的水量不足
c.蒸发时有液体溅出 d.把固体从蒸发皿转移到天平上称量时,有较多固体粘在了蒸发皿上
(3)粗盐提纯后得到的“精盐”中还含有少量可溶性杂质Na2SO4、CaCl2、MgCl2。实验小组的同学设计了以 下实验方案来除去可溶性杂质。
①操作 a 的名称是_____。
②加入“过量 BaCl2 溶液时”,发生反应的化学方程式是_____。 加入过量碳酸钠溶液除了能除去粗盐中的氯化钙外,还有一个作用是_____。
③若不经操作a,直接向Ⅲ中加入过量稀盐酸,所得的溶液中溶质有_____(填化学式)。
22.同学们在实验室对含有泥沙的粗盐进行提纯,实验的基本流程如下:
(1)操作②的名称是______;
(2)操作①②③都要用到的一种玻璃仪器是_____,在操作③中,使用这种玻璃仪器的目的是____________.
(3)计算所获得的氯化钠产率,发现产率偏低,由实验不当导致的可能原因是_______(只写一种原因).
(4)用提纯所得的氯化钠溶液配制100g6%的氯化钠溶液,若实际所配溶液溶质质量分数大于6%,可能的原因是________(填字母编号).
a、称量氯化钠所用天平砝码沾有杂质;b、用量筒取水时俯视读数;c、用量筒取水时仰视读数;d、配制溶液的烧杯用蒸馏水润洗过
(5)若用6%的氯化钠溶液(密度为1.04g/cm3),配制16g质量分数为3%的氯化钠溶液,需要6%的氯化钠溶液______ml(结果保留小数点后一位).
23.海洋中蕴含着丰富的资源,海洋资源开发前景十分广阔。
(1)海水晒盐得到的粗盐中往往含有不溶性杂质,将这些不溶性杂质除去的主要实验步骤有:
①溶解;
②______(填操作名称);
③蒸发结晶。
(2)下列有关海洋化学资源的叙述中,错误的是______(填序号)。
A.海水中含量最多的阴离子为
B.海水淡化过程主要发生了化学变化
C.海底矿物中的可燃冰是一种清洁能源
D.潮汐能是有着广阔开发前景的新能源
(3)海水提取出粗盐后的母液中,还含有较多的氯化镁,在工业上用卤水和石灰乳为原料制备金属镁的转化过程如图所示:
①在上述过程Ⅲ中,所发生的化学反应属于______(填“置换”“复分解”“化合”或“分解”)反应。
②海水或卤水中本来就含有氯化镁,从海水中提取MgCl2时,经历了“MgCl2→Mg(OH)2→MgCl2”的转化过程,请分析这样做的目的是______。
(4)室温下,向盛有一定质量氢氧化镁固体的烧杯中逐滴加入溶质的质量分数为10%的稀盐酸,测得难溶固体物质的质量与所滴入稀盐酸的质量关系曲线如图所示。试回答下列问题:
①当滴入10%的稀盐酸73 g时(即A点),烧杯中溶液里含有的溶质是______(写化学式)。
②当滴入10%的稀盐酸146 g时(即B点),试通过计算,求此时烧杯中所得不饱和溶液的质量。______(计算结果精确至0.1 g)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
2.C
3.A
4.B
5.D
6.B
7.B
8.D
9.A
10.D
11.正确
12.错误
13.正确
14.正确
15.正确
16.铁架台 防止腐蚀天平的托盘 胶头滴管 C 在蒸发操作是没有用玻璃棒搅拌,造成液滴飞溅,溶质的质量减小
17.(1)托盘天平
(2)有液体溅出
(3)一贴二低三靠
(4) 局部温度过高,造成液滴飞溅 出现较多固体
18.(1) 不变 饱和
(2)引流
(3) BACD 11.9
19.AB BCD D 18 量筒 溶液中溶质的质量分数 蒸发 82.5%
20.⑤⑧##⑧⑤ 搅拌,加速固体溶解 ①⑥⑦⑨ 使液体受热均匀,防止液滴飞溅
21.搅拌 较多量固体 BCD 过滤 Na2SO4+BaCl2=BaSO4↓+2NaCl 除去过量的氯化钡 NaCl、MgCl2、CaCl2、BaCl2、HCl
22.过滤 玻璃棒 防止液体外溅 蒸发溶液时液体外溅了一部分等 ab##ba 7.7
23.(1)过滤
(2)AB
(3) 分解 富集提纯,得到更多的氯化镁
(4) MgCl2 解:146 g 10%的稀盐酸中HCl的质量为
设Mg(OH)2的质量为x。
所得溶液的质量为
答:所得溶液的质量为157.6 g。
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.食盐是重要的调味品,精盐是由粗盐提纯而来,在提纯过程中通常不需要的操作是
A.蒸发 B.吸附 C.过滤 D.溶解
2.下列物质中,属于纯净物的是
A.碘酒 B.海水 C.白磷 D.粗盐
3.完成“一定溶质质量分数的氯化钠溶液的配制”和“粗盐中难溶性杂质的去除”两个实验,都必需用到的仪器是
A.玻璃棒 B.酒精灯
C.漏斗 D.试管
4.“粗盐中难溶性杂质的去除”的实验中,下列操作正确的是
A.取用 B.溶解
C.过滤 D.蒸发
5.粗盐提纯实验中的一些操作,包含化学变化的是
A.量取液体 B.称量固体 C.过滤 D.点燃酒精灯
6.如图是利用海水提取粗盐的过程,有关该过程的说法不正确的是
A.海水进入贮水池,海水的成分不变
B.蒸发池中发生的是化学变化
C.可以通过过滤从结晶池中得到粗盐和母液
D.粗盐中含有可溶性杂质和不溶性杂质
7.已知室温下NaCl的溶解度约为36g。现称取3.6g粗盐,经过溶解、过滤、蒸发、转移等步骤,除去泥沙得到精盐。下列操作正确且合理的是
A溶解 B过滤 C蒸发 D转移
A.A B.B C.C D.D
8.《天工开物》中对“海水盐”有如下描述:“凡煎盐锅古谓之“牢盆”,……其下列灶燃薪,多者十二三眼,少者七八眼,共煎此盘,……火燃釜底,滚沸延及成盐。”文中没有涉及到的操作是
A.加热
B.结晶
C.蒸发
D.过滤
9.有关“粗盐中难溶性杂质的去除”实验中说法不正确的是
A.多加水,让粗盐加速溶解
B.玻璃棒用了4次,但作用各不相同
C.粗盐经过溶解、过滤、蒸发、结晶可以得到初步提纯
D.当蒸发皿中出现较多量固体时,停止加热,利用余热使滤液蒸干
10.粗盐提纯实验中说法正确的是( )
A.溶解时为了让粗盐加速溶解,尽可能的多加入一些水
B.过滤时玻璃棒必须靠在滤纸上方的漏斗壁上以防止滤纸破损
C.蒸发时需要将滤液全部蒸干后停止加热
D.粗盐可以直接放在烧杯中进行称量
二、判断题
11.计算粗盐中精盐的产率公式是:产率=精盐质量/粗盐质量×100%( )
12.粗盐提纯实验中,蒸发时液滴飞溅,导致产率偏高( )
13.粗盐提纯的溶解、过滤、蒸发、计算产率中,都会用到玻璃棒且玻璃棒的作用各不相同( )
14.粗盐经过溶解、过滤、蒸发、结晶得到的精盐仍为混合物( )
15.除去粗盐中的沙子实验,实验结束后称量所得的精盐,产率偏高,其可能原因是蒸发时未充分蒸干固体( )
三、填空题
16.下面是“粗盐中难溶性杂质的去除”的实验操作示意图:
(1)仪器a的名称____________;
(2)操作A中托盘两边各放一张大小相同的纸片,其作用是__________;
(3)操作B中还需要用到的仪器是________;
(4)操作 C过滤时倒入液体的液面要低于滤纸边缘主要是为了防止 (填序号)______;
A.过滤速度慢 B.滤纸破损 C.杂质未经过滤就进入滤液
(5)图中部分操作有错误,其中有的错误会导致精盐产率明显偏低,其原因是_____________________。
17.粗盐提纯各操作注意事项:
(1)称量时:______使用时要调节平衡,读数要准确,取药品要规范,不撒落。
(2)溶解时:搅拌要匀速,不能过快,防止______。
(3)过滤时:要规范装置和操作,做到“______”。
(4)蒸发时:不断搅拌,防止______;______时,停止加热。
转移时:要全部转移进行准确称量。
18.利用海水提取粗盐的过程如下图所示,回答有关问题:
(1)一定质量的海水,通过贮水池引入到蒸发池中,在没有引入结晶池之前的蒸发过程中,蒸发池中氯化钠的质量会__________(填“增大”、“不变”或“减小”),析出晶体后得到的母液是氯化钠的__________(填“饱和”或“不饱和”)。
(2)粗盐中含有的难溶性杂质,在实验室里可以通过溶解、过滤、蒸发等操作将其去除,这些操作中都会用到玻璃棒,其中在过滤操作中玻璃棒的作用是__________(填“引流”或“加快溶解”)。
(3)用氯化钠固体配制100g质量分数为6%的氯化钠溶液。
①配制时,涉及以下实验步骤:A.称量及量取B.计算C.溶解D.装瓶贴标签。其正确的实验步骤顺序是__________。(填字母)
②将已配好的100g质量分数为6%的氯化钠溶液变成质量分数为16%的氯化钠溶液,需要再加NaCl的质量是__________g(计算结果精确到0.1)
19.溶液与人类生产、生活密切相关。
(1)下列物质中,由分子构成的是_________(填字母,下同),溶于水后在溶液中以离子形式存在的是_________。
A 蔗糖 B 氯化氢 C 氯化钠 D 硫酸钠
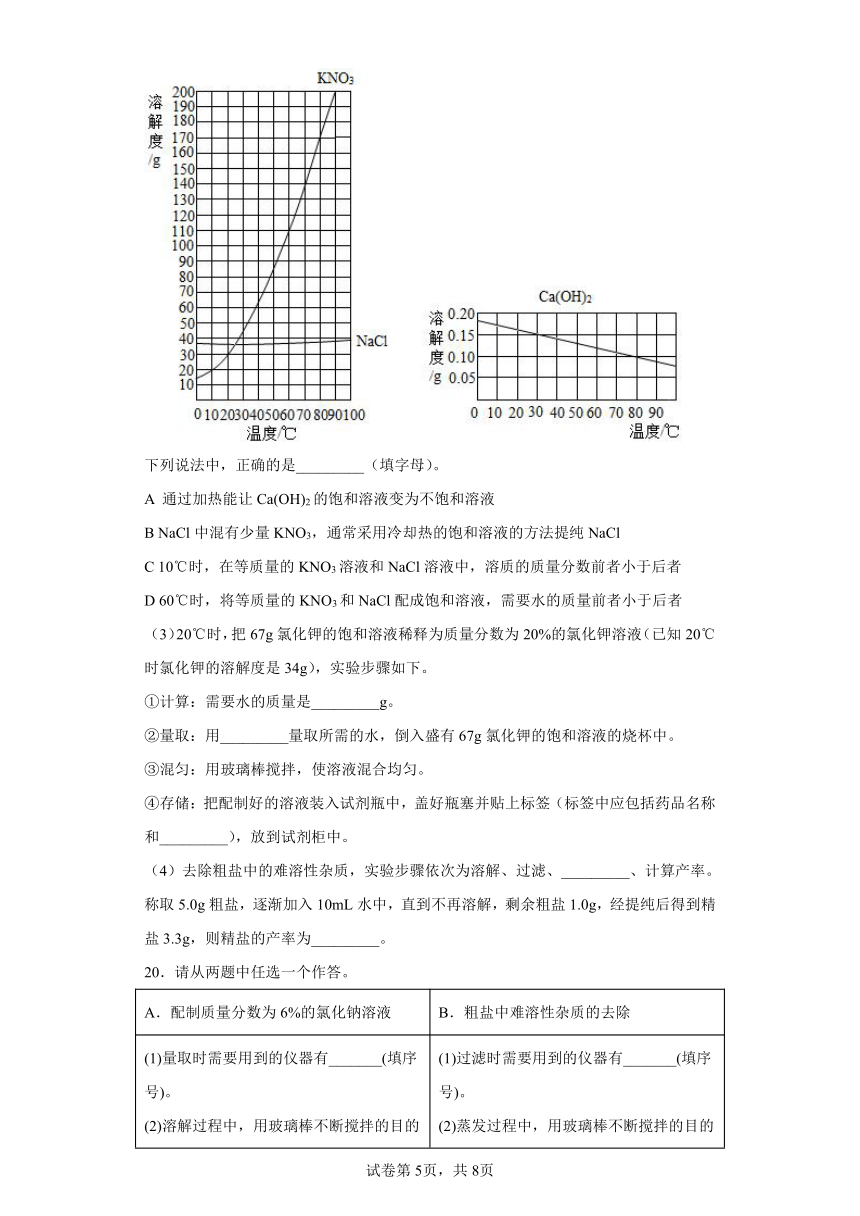
(2)下图是三种常见固体的溶解度曲线。
下列说法中,正确的是_________(填字母)。
A 通过加热能让Ca(OH)2的饱和溶液变为不饱和溶液
B NaCl中混有少量KNO3,通常采用冷却热的饱和溶液的方法提纯NaCl
C 10℃时,在等质量的KNO3溶液和NaCl溶液中,溶质的质量分数前者小于后者
D 60℃时,将等质量的KNO3和NaCl配成饱和溶液,需要水的质量前者小于后者
(3)20℃时,把67g氯化钾的饱和溶液稀释为质量分数为20%的氯化钾溶液(已知20℃时氯化钾的溶解度是34g),实验步骤如下。
①计算:需要水的质量是_________g。
②量取:用_________量取所需的水,倒入盛有67g氯化钾的饱和溶液的烧杯中。
③混匀:用玻璃棒搅拌,使溶液混合均匀。
④存储:把配制好的溶液装入试剂瓶中,盖好瓶塞并贴上标签(标签中应包括药品名称和_________),放到试剂柜中。
(4)去除粗盐中的难溶性杂质,实验步骤依次为溶解、过滤、_________、计算产率。称取5.0g粗盐,逐渐加入10mL水中,直到不再溶解,剩余粗盐1.0g,经提纯后得到精盐3.3g,则精盐的产率为_________。
20.请从两题中任选一个作答。
A.配制质量分数为6%的氯化钠溶液 B.粗盐中难溶性杂质的去除
(1)量取时需要用到的仪器有_______(填序号)。 (2)溶解过程中,用玻璃棒不断搅拌的目的是_______。 (1)过滤时需要用到的仪器有_______(填序号)。 (2)蒸发过程中,用玻璃棒不断搅拌的目的是_______。
可供选择的仪器:①烧杯②蒸发皿③托盘天平④酒精灯⑤量筒⑥漏斗⑦玻璃棒⑧胶头滴管⑨铁架台⑩药匙
四、综合应用题
21.食用的食盐大多来自海水晾晒。海水经蒸发结晶后可获得含有少量泥沙和杂质的粗盐。 请根据实验回答下列问题
(1)在“蒸发结晶”的操作中,玻璃棒的作用是_____,当蒸发皿中出现_____ 时,应停止加热。
(2)若得到 NaCl 的产率比实际值偏低,则可能的原因是(填序号)_____。
a.蒸发时未充分蒸干 b.溶解含有泥沙的 NaCl 时,加入的水量不足
c.蒸发时有液体溅出 d.把固体从蒸发皿转移到天平上称量时,有较多固体粘在了蒸发皿上
(3)粗盐提纯后得到的“精盐”中还含有少量可溶性杂质Na2SO4、CaCl2、MgCl2。实验小组的同学设计了以 下实验方案来除去可溶性杂质。
①操作 a 的名称是_____。
②加入“过量 BaCl2 溶液时”,发生反应的化学方程式是_____。 加入过量碳酸钠溶液除了能除去粗盐中的氯化钙外,还有一个作用是_____。
③若不经操作a,直接向Ⅲ中加入过量稀盐酸,所得的溶液中溶质有_____(填化学式)。
22.同学们在实验室对含有泥沙的粗盐进行提纯,实验的基本流程如下:
(1)操作②的名称是______;
(2)操作①②③都要用到的一种玻璃仪器是_____,在操作③中,使用这种玻璃仪器的目的是____________.
(3)计算所获得的氯化钠产率,发现产率偏低,由实验不当导致的可能原因是_______(只写一种原因).
(4)用提纯所得的氯化钠溶液配制100g6%的氯化钠溶液,若实际所配溶液溶质质量分数大于6%,可能的原因是________(填字母编号).
a、称量氯化钠所用天平砝码沾有杂质;b、用量筒取水时俯视读数;c、用量筒取水时仰视读数;d、配制溶液的烧杯用蒸馏水润洗过
(5)若用6%的氯化钠溶液(密度为1.04g/cm3),配制16g质量分数为3%的氯化钠溶液,需要6%的氯化钠溶液______ml(结果保留小数点后一位).
23.海洋中蕴含着丰富的资源,海洋资源开发前景十分广阔。
(1)海水晒盐得到的粗盐中往往含有不溶性杂质,将这些不溶性杂质除去的主要实验步骤有:
①溶解;
②______(填操作名称);
③蒸发结晶。
(2)下列有关海洋化学资源的叙述中,错误的是______(填序号)。
A.海水中含量最多的阴离子为
B.海水淡化过程主要发生了化学变化
C.海底矿物中的可燃冰是一种清洁能源
D.潮汐能是有着广阔开发前景的新能源
(3)海水提取出粗盐后的母液中,还含有较多的氯化镁,在工业上用卤水和石灰乳为原料制备金属镁的转化过程如图所示:
①在上述过程Ⅲ中,所发生的化学反应属于______(填“置换”“复分解”“化合”或“分解”)反应。
②海水或卤水中本来就含有氯化镁,从海水中提取MgCl2时,经历了“MgCl2→Mg(OH)2→MgCl2”的转化过程,请分析这样做的目的是______。
(4)室温下,向盛有一定质量氢氧化镁固体的烧杯中逐滴加入溶质的质量分数为10%的稀盐酸,测得难溶固体物质的质量与所滴入稀盐酸的质量关系曲线如图所示。试回答下列问题:
①当滴入10%的稀盐酸73 g时(即A点),烧杯中溶液里含有的溶质是______(写化学式)。
②当滴入10%的稀盐酸146 g时(即B点),试通过计算,求此时烧杯中所得不饱和溶液的质量。______(计算结果精确至0.1 g)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
2.C
3.A
4.B
5.D
6.B
7.B
8.D
9.A
10.D
11.正确
12.错误
13.正确
14.正确
15.正确
16.铁架台 防止腐蚀天平的托盘 胶头滴管 C 在蒸发操作是没有用玻璃棒搅拌,造成液滴飞溅,溶质的质量减小
17.(1)托盘天平
(2)有液体溅出
(3)一贴二低三靠
(4) 局部温度过高,造成液滴飞溅 出现较多固体
18.(1) 不变 饱和
(2)引流
(3) BACD 11.9
19.AB BCD D 18 量筒 溶液中溶质的质量分数 蒸发 82.5%
20.⑤⑧##⑧⑤ 搅拌,加速固体溶解 ①⑥⑦⑨ 使液体受热均匀,防止液滴飞溅
21.搅拌 较多量固体 BCD 过滤 Na2SO4+BaCl2=BaSO4↓+2NaCl 除去过量的氯化钡 NaCl、MgCl2、CaCl2、BaCl2、HCl
22.过滤 玻璃棒 防止液体外溅 蒸发溶液时液体外溅了一部分等 ab##ba 7.7
23.(1)过滤
(2)AB
(3) 分解 富集提纯,得到更多的氯化镁
(4) MgCl2 解:146 g 10%的稀盐酸中HCl的质量为
设Mg(OH)2的质量为x。
所得溶液的质量为
答:所得溶液的质量为157.6 g。
答案第1页,共2页
答案第1页,共2页
