【同步练习】沪教版初三化学下册 第6章《溶解现象》6.3.2 溶解度和结晶(含解析)
文档属性
| 名称 | 【同步练习】沪教版初三化学下册 第6章《溶解现象》6.3.2 溶解度和结晶(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 450.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-30 18:44:43 | ||
图片预览




文档简介
第04讲 溶解度和结晶
一、固体溶解度
(1)概念:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量。
(2)四要素:①一定温度下;②100g溶剂;③达到饱和状态;④所溶解溶质的质量,单位为g。
(3)影响因素
①内因:溶质和溶剂的性质。
②外因:温度。
a.多数固体物质的溶解度随温度的升高而增大,如KNO3;
b.少数固体物质的溶解度随温度变化的影响很小,如NaCl;
c.极少数固体物质的溶解度随温度的升高而减小,如Ca(OH)2。
(4)溶解度的相对大小(20℃)
溶解度/g <0.01 0.01~1 1~10 >10
一般称为 难溶 微溶 可溶 易溶
二、固体溶解度曲线
(1)意义
图1 图2
内容 意义
曲线(如图1曲线甲) 表示物质的溶解度受温度影响的变化趋势
曲线上方的点(如图1点C) 表示溶液饱和且有未溶解的固体
曲线下方的点(如图1点A) 表示溶液为不饱和溶液
曲线上的点(如图1点B) 表示物质在对应温度时的溶解度
曲线交点(如图2点d) 表示几种物质在某温度时的溶解度相等
(2)应用
①判断某物质在不同温度下的溶解度。
②比较不同物质在同一温度时的溶解度。
③比较不同物质的溶解度受温度变化影响的大小。
④判断物质的溶解度受温度影响的变化趋势。
⑤判断某物质的饱和溶液与不饱和溶液的转化方法。
⑥确定混合物的分离、提纯方法。
三、结晶
1.蒸发结晶(蒸发溶剂):适用于溶解度受温度变化不大的固体
2.降温结晶(冷却热饱和溶液):适用于溶解度随温度变化较大的固体
(1)对于所有固体溶质的溶液,都可用“蒸发溶剂法”;
(2)对于形如的溶质的溶液,还可用“降温结晶法”;
(3)对于形如的溶质的溶液,一般只采用“蒸发溶剂法”;
(4)对于形如的溶质的溶液,还可用“升温结晶法”。
3.
(a)t3℃时A的溶解度为 80g ;
(b)P点的的含义 在该温度时,A和C的溶解度相同;
(c)N点为 t3℃时A的不饱和溶液 ,可通过 加入A物质 、 降温、 蒸发溶剂 的方法使它变为饱和;
(d)t1℃时A、B、C、溶解度由大到小的顺序C>B>A;
(e)从A溶液中获取A晶体可用降温结晶 的方法获取晶体;
(f)从B的溶液中获取晶体,适宜采用蒸发结晶的方法获取晶体;
(g)t2℃ 时A、B、C的饱和溶液各W克,降温到t1℃会析出晶体的有A和B 无晶体析出的有 C ,所得溶液中溶质的质量分数由小到大依次为 A(h)除去A中的泥沙用 过滤法;分离A与B(含量少)的混合物,用结晶法。
四、气体溶解度
(1)定义:通常是指该气体的压强为101kPa和一定温度时,溶解在1体积水里达到饱和状态时的气体体积。
(2)影响因素
①内因:气体和溶剂本身的性质。
②外因:温度、压强。
一般来说,温度越高,气体的溶解度越小;压强越大,气体的溶解度越大。
题型一:固体溶解度
【例1】60℃时,硝酸钾的溶解度为110g,该温度下硝酸钾饱和溶液中有关质量关系正确的是
A.溶质质量:溶剂质量=10:11 B.溶剂质量:溶液质量=11:21
C.溶质质量:溶剂质量=11:10 D.溶液质量:溶质质量=21:10
【例2】下列对“50℃,氯化铵的溶解度是50g”理解错误的是( )
A. 50℃,100g水中最多溶解50g氯化铵
B. 氯化铵的溶解度何时都是50g
C. 50℃,氯化铵的饱和溶液中溶质溶剂之比是1:2
D. 50℃,氯化铵的溶液中溶质的质量分数最大是33.3%
题型二:溶解度曲线
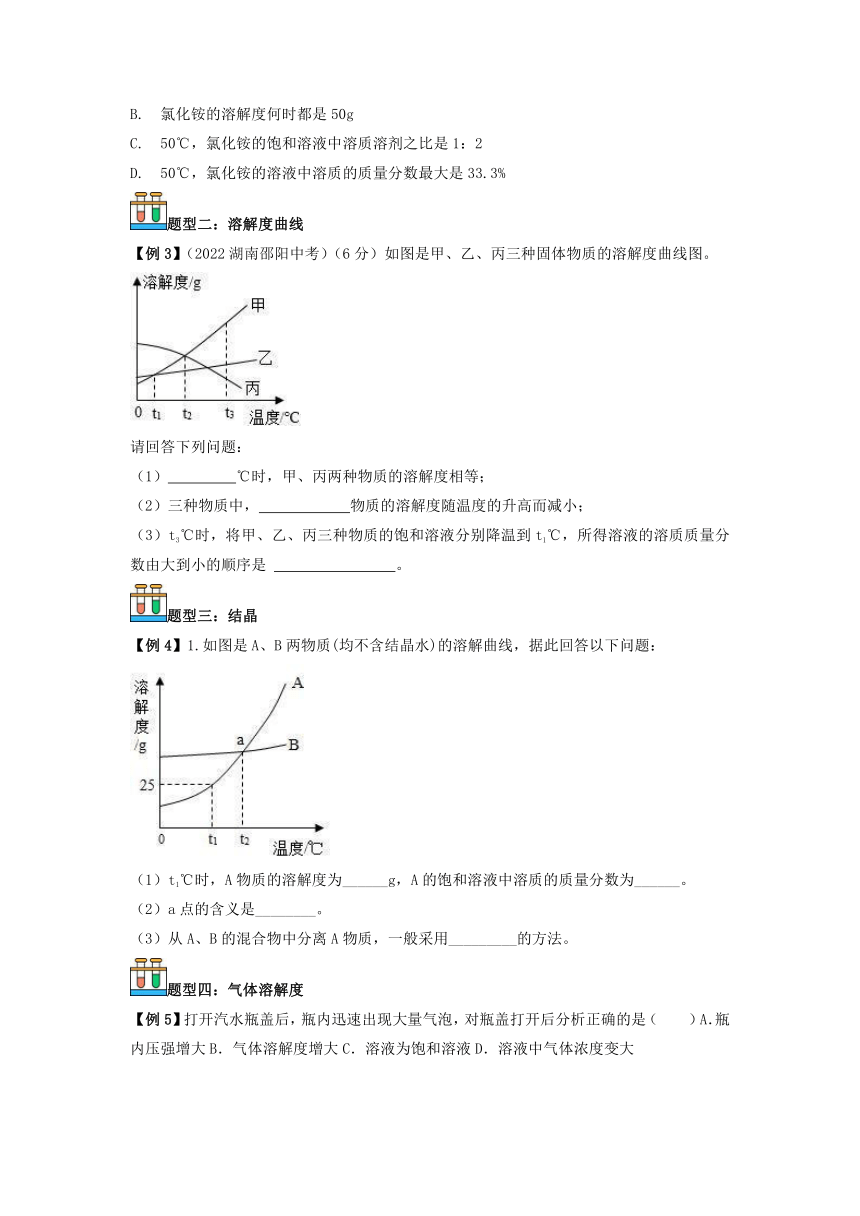
【例3】(2022湖南邵阳中考)(6分)如图是甲、乙、丙三种固体物质的溶解度曲线图。
请回答下列问题:
(1) ℃时,甲、丙两种物质的溶解度相等;
(2)三种物质中, 物质的溶解度随温度的升高而减小;
(3)t3℃时,将甲、乙、丙三种物质的饱和溶液分别降温到t1℃,所得溶液的溶质质量分数由大到小的顺序是 。
题型三:结晶
【例4】1.如图是A、B两物质(均不含结晶水)的溶解曲线,据此回答以下问题:
(1)t1℃时,A物质的溶解度为______g,A的饱和溶液中溶质的质量分数为______。
(2)a点的含义是________。
(3)从A、B的混合物中分离A物质,一般采用_________的方法。
题型四:气体溶解度
【例5】打开汽水瓶盖后,瓶内迅速出现大量气泡,对瓶盖打开后分析正确的是( )A.瓶内压强增大B.气体溶解度增大C.溶液为饱和溶液D.溶液中气体浓度变大
1.不同温度下KNO3的溶解度如下表所示。下列说法正确的是
温度/℃ 20 30 40
溶解度/g 31.6 45.8 63.9
A. 20℃时,100gKNO3饱和溶液中溶质质量为31.6g
B. 30℃时,100gKNO3饱和溶液的溶质质量分数为45.8%
C. 30℃时,将50gKNO3放入100g水中得到150g溶液
D. 40℃时,100g水最多溶解63.9gKNO3
2.20℃时,把36克氯化钠放入64克水中,使其充分溶解(20℃时氯化钠的溶解度为36克)。对所得溶液的有关说法错误的是( )
A.该溶液是饱和溶液 B.溶液中Na+和Cl-个数一定相等
C.溶液的质量为100克 D.溶质与溶剂质量比为9:25
3.(2022浙江杭州中考)40℃时恒温蒸发一杯不饱和食盐水至有晶体析出,此过程中不发生变化的是( )
A.溶剂的质量 B.溶质的质量
C.溶液中溶质的质量分数 D.食盐的溶解度
4.一定温度下,向一定量的水中,逐渐加入硝酸钾固体,下列图像符合溶液中溶质质量变化规律的是
A B C D
5.下列关于a、b数值的比较,其中a一定小于b的是
A.某物质的溶解度在低温时为ag,高温时为bg
B.同一饱和溶液中,溶质的质量分数为a%,溶解度为bg
C.某物质的饱和溶液中溶质的质量分数为a%,同一温度下,向其中加入少量该物质后,溶质的质量分数为b%
D.不饱和溶液中溶质的质量分数为a%,饱和溶液中溶质的质量分数为b%
6.甲物质的溶解度曲线图如图所示,下列说法中正确的是
A.甲物质的溶解度随温度的升高而增大
B.甲物质的溶解度是102g
C.20℃时,50g水中加入15g甲物质充分溶解可得到65g溶液
D.70℃时,甲的饱和溶液升高温度或降低温度,都有晶体析出
7.室温时,不饱和的食盐水在空气中露置一段时间后,有少量晶体析出。对此下列说法不正确的是( )
A.溶液的质量减少 B.溶质的质量减少
C.溶质的质量分数减小 D.溶液变成饱和溶液
8.一定温度下,向图Ⅰ烧杯中加入一定量的水,如图Ⅱ所示,所得溶液与原溶液相比,下列判断一定正确的是( )
A.所得溶液是饱和溶液 B.溶质的质量分数变大
C.溶质的质量增加 D.溶质的溶解度变大
9.物质X在40℃、80℃时的溶解度分别为60g/100g水、90g/100g水。甲、乙、丙、丁四个烧杯中均盛有100g水,对应温度下加入X的质量如图,充分溶解后,对所得溶液说法正确的是
A.甲、乙中的溶液含有相同质量的溶质
B.甲、丙中的溶液溶质的质量分数相等
C.乙中溶液升温至80℃,溶质质量分数增大
D.丁中溶液降温至40℃,析出X的质量为60g
10.KNO3的溶解度曲线如下图所示。下列说法错误的是
A.0~60 ℃,KNO3的溶解度随温度升高而增大
B.60 ℃时的KNO3饱和溶液降温至20 ℃,有晶体析出
C.20 ℃,100 g水中最多能溶解31.6 g KNO3
D.60 ℃时,可配制溶质质量分数为60%的KNO3溶液
11.硝酸钾的溶解度曲线如图所示,将100g60℃的KNO3饱和溶液分别进行如下操作后,,所得溶液与原溶液相比,变化结果完全正确的是
选项 操作 溶质质量 溶液质量 溶质的质量分数 KNO3的溶解度
A 升温 变大 变大 不变 变大
B 降温 变小 变小 不变 变小
C 加入KNO3固体 不变 变大 变大 变大
D 恒温蒸发部分水 变小 变小 不变 不变
12.下列因素中不会影响气体物质溶解度的是( )
A. 溶剂的量 B. 温度 C. 溶质的种类 D. 压强
13.如图所示,给饱和澄清石灰水加热。下列叙述错误的是( )。
A. 溶液由澄清变浑浊 B. 氢氧化钙的溶解度随温度的升高而增大
C. 溶液仍为饱和溶液 D. 溶液中溶质的质量分数减小
14.(2022广东中考)根据下图,判断下列说法正确的是( )
A. t1℃时,50g甲能完全溶于50g水 B. 乙的溶解度随温度升高而降低
C. t2℃时,丙和丁的溶解度相同 D. 加压或升温能增加戊的溶解度
15.如图,室温下,盛水的烧杯内放置两支分别盛有等质量KNO3溶液和饱和石灰水的试管甲和乙,向烧杯内的水中加入NH4NO3固体后,甲中未观察到明显现象。下列说法正确的是
A.乙中溶液一定变浑浊 B.甲中溶液一定变成饱和溶液
C.乙中溶液溶质的质量分数一定变小 D.甲、乙中溶液质量一定相等
16. (2022湖南荆州中考)以下是KNO3和NaCl在不同温度时的溶解度和对应的溶解度曲线。请回答:
温度/℃ 0 10 20 30 40 50 60
溶解度/g KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110
NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3
(1)代表KNO3溶解度曲线的是 _____(填“甲”或“乙”)。
(2)若KNO3中混有少量NaCl,可采用 _____的方法提纯KNO3。
(3)t1的范围为_________(填标号)。
A.10~20 B. 20~30 C. 30~40 D. 50~60
(4)t2℃时,将等质量的KNO3的饱和溶液和NaCl的饱和溶液分别降温到t1℃,所得溶液中溶质的质量m(KNO3) _____m(NaCl)(填“>”或“<”或“=”)。
第04讲 溶解度和结晶
一、固体溶解度
(1)概念:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量。
(2)四要素:①一定温度下;②100g溶剂;③达到饱和状态;④所溶解溶质的质量,单位为g。
(3)影响因素
①内因:溶质和溶剂的性质。
②外因:温度。
a.多数固体物质的溶解度随温度的升高而增大,如KNO3;
b.少数固体物质的溶解度随温度变化的影响很小,如NaCl;
c.极少数固体物质的溶解度随温度的升高而减小,如Ca(OH)2。
(4)溶解度的相对大小(20℃)
溶解度/g <0.01 0.01~1 1~10 >10
一般称为 难溶 微溶 可溶 易溶
二、固体溶解度曲线
(1)意义
图1 图2
内容 意义
曲线(如图1曲线甲) 表示物质的溶解度受温度影响的变化趋势
曲线上方的点(如图1点C) 表示溶液饱和且有未溶解的固体
曲线下方的点(如图1点A) 表示溶液为不饱和溶液
曲线上的点(如图1点B) 表示物质在对应温度时的溶解度
曲线交点(如图2点d) 表示几种物质在某温度时的溶解度相等
(2)应用
①判断某物质在不同温度下的溶解度。
②比较不同物质在同一温度时的溶解度。
③比较不同物质的溶解度受温度变化影响的大小。
④判断物质的溶解度受温度影响的变化趋势。
⑤判断某物质的饱和溶液与不饱和溶液的转化方法。
⑥确定混合物的分离、提纯方法。
三、结晶
1.蒸发结晶(蒸发溶剂):适用于溶解度受温度变化不大的固体
2.降温结晶(冷却热饱和溶液):适用于溶解度随温度变化较大的固体
(1)对于所有固体溶质的溶液,都可用“蒸发溶剂法”;
(2)对于形如的溶质的溶液,还可用“降温结晶法”;
(3)对于形如的溶质的溶液,一般只采用“蒸发溶剂法”;
(4)对于形如的溶质的溶液,还可用“升温结晶法”。
3.
(a)t3℃时A的溶解度为 80g ;
(b)P点的的含义 在该温度时,A和C的溶解度相同;
(c)N点为 t3℃时A的不饱和溶液 ,可通过 加入A物质 、 降温、 蒸发溶剂 的方法使它变为饱和;
(d)t1℃时A、B、C、溶解度由大到小的顺序C>B>A;
(e)从A溶液中获取A晶体可用降温结晶 的方法获取晶体;
(f)从B的溶液中获取晶体,适宜采用蒸发结晶的方法获取晶体;
(g)t2℃ 时A、B、C的饱和溶液各W克,降温到t1℃会析出晶体的有A和B 无晶体析出的有 C ,所得溶液中溶质的质量分数由小到大依次为 A(h)除去A中的泥沙用 过滤法;分离A与B(含量少)的混合物,用结晶法。
四、气体溶解度
(1)定义:通常是指该气体的压强为101kPa和一定温度时,溶解在1体积水里达到饱和状态时的气体体积。
(2)影响因素
①内因:气体和溶剂本身的性质。
②外因:温度、压强。
一般来说,温度越高,气体的溶解度越小;压强越大,气体的溶解度越大。
题型一:固体溶解度
【例1】60℃时,硝酸钾的溶解度为110g,该温度下硝酸钾饱和溶液中有关质量关系正确的是
A.溶质质量:溶剂质量=10:11 B.溶剂质量:溶液质量=11:21
C.溶质质量:溶剂质量=11:10 D.溶液质量:溶质质量=21:10
【答案】C
【解析】
60℃时,硝酸钾的溶解度为110g,即100g水最多能溶解110g硝酸钾形成饱和溶液。
A、溶质质量:溶剂质量=110g:100g=11:10,错误。
B、溶剂质量:溶液质量=100g:(110g+100g)=10:21,错误。
C、溶质质量:溶剂质量=110g:100g=11:10,正确。
D、溶液质量:溶质质量=(110g+100g):110g=21:11,错误。
故选C。
【例2】下列对“50℃,氯化铵的溶解度是50g”理解错误的是( )
A. 50℃,100g水中最多溶解50g氯化铵
B. 氯化铵的溶解度何时都是50g
C. 50℃,氯化铵的饱和溶液中溶质溶剂之比是1:2
D. 50℃,氯化铵的溶液中溶质的质量分数最大是33.3%
【答案】 B
【解析】A、50℃时,氯化铵的溶解度是50g,说明该温度下,100g水中最多能溶解50g氯化铵,不符合题意;
B、50℃时,氯化铵的溶解度是50g,其它温度不是,符合题意;
C、50℃时,氯化铵的溶解度是50g,该温度下,饱和溶液中溶质、溶剂之比是:50g:100g=1:2,不符合题意;
D、50℃,氯化铵的饱和溶液中溶质的质量分数是: ,不符合题意。
题型二:溶解度曲线
【例3】(2022湖南邵阳中考)(6分)如图是甲、乙、丙三种固体物质的溶解度曲线图。
请回答下列问题:
(1) ℃时,甲、丙两种物质的溶解度相等;
(2)三种物质中, 物质的溶解度随温度的升高而减小;
(3)t3℃时,将甲、乙、丙三种物质的饱和溶液分别降温到t1℃,所得溶液的溶质质量分数由大到小的顺序是 。
【答案】(1)t2;(2)丙;(3)甲=乙>丙。
【解析】(1)由溶解度曲线图可知,t2℃时,甲、丙两种物质的溶解度相等;
(2)三种物质中,丙物质的溶解度随温度的升高而减小;
(3)甲、乙的溶解度随温度的升高而增大,丙的溶解度随温度的升高而减小,所以将t3℃时甲、乙、丙三种物质的饱和溶液降温到t1℃,甲、乙溶解度减小,析出晶体,溶质的质量分数减小,t1℃时,甲、乙溶解度相等,则t1℃时甲、乙的饱和溶液溶质的质量分数相等,丙溶解度变大,由饱和溶液变为不饱和溶液,t1℃饱和溶液中溶质质量分数与t3℃时相同,又t3℃时丙溶解度小于甲、乙在t1℃时溶解度,所以丙降温后所得溶液中溶质的质量分数最小,则将t3℃的甲、乙、丙三种物质的饱和溶液都降温至t1℃,所得三种溶液中溶质质量分数的由大到小关系是甲=乙>丙。
题型三:结晶
【例4】1.如图是A、B两物质(均不含结晶水)的溶解曲线,据此回答以下问题:
(1)t1℃时,A物质的溶解度为______g,A的饱和溶液中溶质的质量分数为______。
(2)a点的含义是________。
(3)从A、B的混合物中分离A物质,一般采用_________的方法。
【答案】
(1) 25 20%
(2)t2℃时A、B两种物质的溶解度相等
(3)降温结晶
【解析】
(1)从图示看:t1℃时,A物质的溶解度为25克;A的饱和溶液中溶质的质量分数为=20%;
(2)a点的含义是在t2℃时,A、B两物质的溶解度相同;
(3)从A、B的混合物中分离A物质,一般采用冷却热饱和溶液方法,因为A的溶解度随温度的变化很大。
题型四:气体溶解度
【例5】打开汽水瓶盖后,瓶内迅速出现大量气泡,对瓶盖打开后分析正确的是( )
A.瓶内压强增大
B.气体溶解度增大
C.溶液为饱和溶液
D.溶液中气体浓度变大
【答案】C
【解析】
气体的溶解度随着压强的增大而增大,随着压强的减小而减小,打开汽水瓶盖时,压强减小,二氧化碳的溶解度减小,一部分二氧化碳逸出,逸出后的二氧化碳溶液仍是饱和溶液,溶液中气体的浓度比未开盖前更小,因此ABD选项都不正确,故选C。
1.不同温度下KNO3的溶解度如下表所示。下列说法正确的是
温度/℃ 20 30 40
溶解度/g 31.6 45.8 63.9
A. 20℃时,100gKNO3饱和溶液中溶质质量为31.6g
B. 30℃时,100gKNO3饱和溶液的溶质质量分数为45.8%
C. 30℃时,将50gKNO3放入100g水中得到150g溶液
D 40℃时,100g水最多溶解63.9gKNO3
【答案】D
【解析】A、20℃时,硝酸钾的溶解度是31.6g,表示20℃时,100g水中溶解31.6gKNO3达到饱和状态,也就是131.6g的KNO3饱和溶液中的溶质质量为31.6g ,故选项A不正确;
B、30℃时,KNO3的溶解度是45.8g,要计算该温度下饱和溶液的溶质质量分数,根据一定温度下,饱和溶液中溶质质量分数与溶解度的关系:得,30℃时,100gKNO3饱和溶液的溶质质量分数=,故选项B不正确;
C、30℃时,KNO3的溶解度是45.8g,表示30℃时,100g水中溶解45.8g KNO3达到饱和状态,也就是30℃时,100g水中最多只能溶解45.8gKNO3,所得饱和溶液的质量是145.8g,故选项C不正确;
D、40℃时,KNO3的溶解度是63.9g,表示40℃时,100g水中溶解63,9g KNO3达到饱和状态,也就是40℃时,100g水中最多只能溶解63.9gKNO3,故选项D正确;
故选:D。
2.20℃时,把36克氯化钠放入64克水中,使其充分溶解(20℃时氯化钠的溶解度为36克)。对所得溶液的有关说法错误的是( )
A.该溶液是饱和溶液 B.溶液中Na+和Cl-个数一定相等
C.溶液的质量为100克 D.溶质与溶剂质量比为9:25
【答案】C
【解析】因为20℃时氯化钠的溶解度为36克,即在20℃时,100克水中溶解36克氯化钠达到饱和状态,则该温度下36克氯化钠不能完全溶解在64克水中,因此所得溶液为饱和溶液,故A选项正确;B. 氯化钠是由钠离子和氯离子构成的,且钠离子和氯离子的个数比为1:1,所以在氯化钠溶液中,钠离子和氯离子的个数一定相等,故B选项正确;C. 因为36克的氯化钠固体不能完全溶解在64克水中,因此所得溶液的质量小于36克+64克,即小于100克,故C选项号错误;D. 根据氯化钠在该温度下的溶解度为36克,则饱和溶液中的溶质和溶剂的质量比为36:100=9:25,故D选项正确。
3.(2022浙江杭州中考)40℃时恒温蒸发一杯不饱和食盐水至有晶体析出,此过程中不发生变化的是( )
A.溶剂的质量 B.溶质的质量
C.溶液中溶质的质量分数 D.食盐的溶解度
【答案】D
【解析】A、40℃时恒温蒸发一杯不饱和食盐水至有晶体析出,故选项说法错误。
B、40℃时恒温蒸发一杯不饱和食盐水至有晶体析出,故选项说法错误。
C、40℃时恒温蒸发一杯不饱和食盐水至有晶体析出,溶质的质量分数变大。
D、温度不变,故选项说法正确。
故选:D。
4.一定温度下,向一定量的水中,逐渐加入硝酸钾固体,下列图像符合溶液中溶质质量变化规律的是
A. B.
C. D.
【答案】A
【解析】
一定温度下,向一定量的水中,逐渐加入硝酸钾固体,溶质的质量会从零开始增加,直到溶液达到饱和状态,溶质的质量就不会在变。
故选:A
5.下列关于a、b数值的比较,其中a一定小于b的是
A.某物质的溶解度在低温时为ag,高温时为bg
B.同一饱和溶液中,溶质的质量分数为a%,溶解度为bg
C.某物质的饱和溶液中溶质的质量分数为a%,同一温度下,向其中加入少量该物质后,溶质的质量分数为b%
D.不饱和溶液中溶质的质量分数为a%,饱和溶液中溶质的质量分数为b%
【答案】B
【解析】
A、氢氧化钙的溶解度随温度升高反而减小,则氢氧化钙的溶解度在低温时为ag,高温时为bg,则a大于b,选项错误;
B、同一饱和溶液中,溶质的质量分数为a%,溶解度为bg,则a%=×100%,则a一定小于b,选项正确;
C、某物质的饱和溶液中溶质的质量分数为a%,同一温度下,向其中加入少量该物质后,该物质不再溶解,溶液的溶质质量分数不变,溶质的质量分数仍为a%,即a=b,选项错误;
D、同一温度下,某种物质的饱和溶液的溶质质量分数大于不饱和溶液的溶质质量分数,题文中两种溶液的温度与溶质的种类不确定,则无法比较溶液的溶质质量分数的大小,即不能确定a、b的关系,选项错误,故选B。
6.甲物质的溶解度曲线图如图所示,下列说法中正确的是
A.甲物质的溶解度随温度的升高而增大
B.甲物质的溶解度是102g
C.20℃时,50g水中加入15g甲物质充分溶解可得到65g溶液
D.70℃时,甲的饱和溶液升高温度或降低温度,都有晶体析出
【答案】D
【解析】
A、由图可知,甲物质的溶解度随温度的升高先增大后减小,不符合题意;
B、由图可知,70℃时,甲物质的溶解度为102g,应指明温度,不符合题意;
C、20℃时,甲物质的溶解度为28g,该温度下,50g水中加入15g甲物质,只能溶解14g,充分溶解后,可得到50g+14g=64g溶液,不符合题意;
D、由图可知,70℃时,甲的溶解度最大,甲的饱和溶液升高温度或降低温度,溶解度均减小,均有晶体析出,符合题意。
故选D。
7.室温时,不饱和的食盐水在空气中露置一段时间后,有少量晶体析出。对此下列说法不正确的是( )
A.溶液的质量减少 B.溶质的质量减少
C.溶质的质量分数减小 D.溶液变成饱和溶液
【答案】C
【解析】 .室温时,不饱和的食盐水在空气中露置一段时间后,有少量晶体析出,溶液的质量减小,溶质和溶剂的质量减小,溶液有不饱和变为饱和溶液,溶质的质量分数增大,故答案选择C
8.一定温度下,向图Ⅰ烧杯中加入一定量的水,如图Ⅱ所示,所得溶液与原溶液相比,下列判断一定正确的是( )
A.所得溶液是饱和溶液 B.溶质的质量分数变大
C.溶质的质量增加 D.溶质的溶解度变大
【答案】C
【解析】在一定温度下,向有氯化钾晶体存在的饱和氯化钾溶液中加水,固体会溶解,溶液中溶质的质量一定变大;图Ⅱ中烧杯内无剩余的氯化钾晶体,因此该溶液可能恰好饱和,也可能是不饱和溶液;在该实验中温度没有发生改变,因而当图Ⅱ中的溶液恰好饱和时,溶质质量分数不变,但是当溶液为不饱和溶液时,溶质质量分数会变小;由于温度没有发生改变,因而其溶解度一定不会发生改变。故选C。
9.物质X在40℃、80℃时的溶解度分别为60g/100g水、90g/100g水。甲、乙、丙、丁四个烧杯中均盛有100g水,对应温度下加入X的质量如图,充分溶解后,对所得溶液说法正确的是
A.甲、乙中的溶液含有相同质量的溶质
B.甲、丙中的溶液溶质的质量分数相等
C.乙中溶液升温至80℃,溶质质量分数增大
D.丁中溶液降温至40℃,析出X的质量为60g
【答案】AB
【解析】
A、在40℃时,X的溶解度为60g/100g水,甲中放入70g后固体只能溶解60g,所以甲、乙溶液中溶质质量都是60g,选项正确;
B、在40℃时,X的溶解度为60g/100g水,甲中放入70g后固体只能溶解60g,甲、丙中的溶液中溶质都是60g,溶剂都是100g,溶质的质量分数相等,选项正确;
C、乙中溶液升温至80℃,溶质、溶剂的质量不变,溶质质量分数不变,选项错误;
D、丁中溶液降温至40℃,析出X的质量为90g-60g=30g,选项错误。
故选AB。
10.KNO3的溶解度曲线如下图所示。下列说法错误的是
A.0~60 ℃,KNO3的溶解度随温度升高而增大
B.60 ℃时的KNO3饱和溶液降温至20 ℃,有晶体析出
C.20 ℃,100 g水中最多能溶解31.6 g KNO3
D.60 ℃时,可配制溶质质量分数为60%的KNO3溶液
【答案】D
【解析】A、由KNO3的溶解度曲线图可知,0~60 ℃,KNO3的溶解度随温度升高而增大,故A正确;B、KNO3的溶解度随温度升高而增大,60 ℃时的KNO3饱和溶液降温至20 ℃,有晶体析出,故B正确;C、20 ℃,KNO3的溶解度为31.6 g,则100 g水中最多能溶解31.6 g KNO3,故C正确;D、60 ℃时,KNO3的溶解度为110 g,饱和溶液的质量分数为×100%<60%,不能配制溶质质量分数为60%的KNO3溶液,故D不正确。故选D。
11.硝酸钾的溶解度曲线如图所示,将100g60℃的KNO3饱和溶液分别进行如下操作后,,所得溶液与原溶液相比,变化结果完全正确的是
选项 操作 溶质质量 溶液质量 溶质的质量分数 KNO3的溶解度
A 升温 变大 变大 不变 变大
B 降温 变小 变小 不变 变小
C 加入KNO3固体 不变 变大 变大 变大
D 恒温蒸发部分水 变小 变小 不变 不变
【答案】D
【解析】A、根据硝酸钾的溶解度曲线可知,升温后硝酸钾的溶解度变大,溶质质量、溶液质量、溶质的质量分数都不变,故错误;
B、根据硝酸钾的溶解度曲线可知,降温后硝酸钾的溶解度变小,硝酸钾会结晶析出,溶质质量、溶液质量、溶质的质量分数都变小,故错误;
C、加入KNO3固体后,不会继续溶解,溶质质量、溶液质量、溶质的质量分数、溶解度都不变,故错误;
D、恒温蒸发部分水,硝酸钾会结晶析出,溶质质量、溶液质量都变小,溶质的质量分数、解度都不变,故正确。故选D。
12.下列因素中不会影响气体物质溶解度的是( )
A. 溶剂的量 B. 温度 C. 溶质的种类 D. 压强
【答案】 A
【解析】A.溶剂的质量不会影响气体物质的溶解度;
B.温度影响气体物质的溶解度,温度越高,气体溶解度越小;
C.溶剂的种类影响气体物质的溶解度;
D.压强影响气体物质的溶解度,压强越大,气体溶解度越大;
13.如图所示,给饱和澄清石灰水加热。下列叙述错误的是( )。
A. 溶液由澄清变浑浊 B. 氢氧化钙的溶解度随温度的升高而增大
C. 溶液仍为饱和溶液 D. 溶液中溶质的质量分数减小
【答案】 B
【解析】A. 给饱和澄清石灰水加热,氢氧化钙的溶解度随温度升高而减小,所以溶液由澄清变浑浊,故叙述正确,不符合题意;
B. 氢氧化钙的溶解度随温度的升高而减小,故叙述错误,符合题意;
C. 溶液中溶质析出,仍为饱和溶液,故叙述正确,不符合题意;
D. 溶液中溶质析出,溶质的质量减少,溶液中溶质的质量分数减小,故叙述正确,不符合题意;
14.(2022广东中考)根据下图,判断下列说法正确的是( )
A. t1℃时,50g甲能完全溶于50g水 B. 乙的溶解度随温度升高而降低
C. t2℃时,丙和丁的溶解度相同 D. 加压或升温能增加戊的溶解度
【答案】C
【解析】A.t1℃时,甲物质的溶解度为80g,也就是100g水中最多能溶解80g物质甲,所以50g甲中只有40g能完全溶于50g水,选项错误。
B.随着温度的升高,溶解后剩余固体的质量在减小,说明溶解的物质变多,所以乙的溶解度随温度升高而升高,选项错误。
C.t2℃时,丙和丁的溶解度相同,正确。
D.压强增大或者温度降低戊的溶解度在升高,所以加压或降温能增加戊的溶解度,选项错误。
故选:C。
15.(2021陕西中考)如图,室温下,盛水的烧杯内放置两支分别盛有等质量KNO3溶液和饱和石灰水的试管甲和乙,向烧杯内的水中加入NH4NO3固体后,甲中未观察到明显现象。下列说法正确的是
A.乙中溶液一定变浑浊 B.甲中溶液一定变成饱和溶液
C.乙中溶液溶质的质量分数一定变小 D.甲、乙中溶液质量一定相等
【答案】D
【解析】A、加入硝酸铵,硝酸铵溶解吸热,溶液温度降低,氢氧化钙的溶解度增加,变为不饱和溶液,溶液不变浑浊,不符合题意;B、加入硝酸铵,硝酸铵溶解吸热,溶液温度降低,硝酸钾的溶解度减小,甲中无明显现象,硝酸钾可能恰好饱和,也可能是不饱和溶液,不符合题意;C、加入硝酸铵,硝酸铵溶解吸热,溶液温度降低,氢氧化钙的溶解度增加,变为不饱和溶液,乙中溶液溶质质量分数不变,不符合题意;D、由以上分析可知,甲、乙中溶液均无溶质析出,溶液质量不变,故溶液质量一定相等,符合题意。故选D。
16. (2022湖南荆州中考)以下是KNO3和NaCl在不同温度时的溶解度和对应的溶解度曲线。请回答:
温度/℃ 0 10 20 30 40 50 60
溶解度/g KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110
NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3
(1)代表KNO3溶解度曲线的是 _____(填“甲”或“乙”)。
(2)若KNO3中混有少量NaCl,可采用 _____的方法提纯KNO3。
(3)t1的范围为_________(填标号)。
A.10~20 B. 20~30 C. 30~40 D. 50~60
(4)t2℃时,将等质量的KNO3的饱和溶液和NaCl的饱和溶液分别降温到t1℃,所得溶液中溶质的质量m(KNO3) _____m(NaCl)(填“>”或“<”或“=”)。
【答案】(1)甲 (2)降温结晶或冷却热饱和溶液 (3)B (4)<
【解析】
(1)根据溶解度表可知硝酸钾的溶解度受温度影响大,如图甲的溶解度符合这一特点,故表KNO3溶解度曲线的是 :甲;
(2)由溶解度表和曲线图可知,硝酸钾和氯化钠溶解度均随温度的升高而升高,硝酸钾溶解度受温度影响大,氯化钠溶解度受温度影较小,则硝酸钾中混有少量氯化钠时应采用降温结晶或冷却热饱和溶液的方法提纯硝酸钾,故填:降温结晶(或冷却热饱和溶液);
(3)如图,t1℃时硝酸钾和氯化钠溶解度曲线交于一点说明该温度下,硝酸钾和氯化钠溶解度相等,小于t1℃时硝酸钾溶解度小于氯化钠,大于t1℃时硝酸钾溶解度大于氯化钠,根据表格数据,符合这一特点的温度是20℃硝酸钾溶解度小于氯化钠,30℃硝酸钾溶解度大于氯化钠,故t1的范围是20~30,故选:B;
(4)如图,t2℃时,等质量的硝酸钾的饱和溶液和氯化钠的饱和溶液分别降温到t1℃,两物质的溶解度减小析出溶质形成t1℃时的饱和溶液,此时两物质溶解度相等则溶质质量分数相等,由于原溶液质量相等且降温过程中硝酸钾溶解度变化较大,则析出的溶质大于氯化钠,使t1℃时硝酸钾饱和溶液的质量小于氯化钠饱和溶液,两溶液溶质质量分数相等故硝酸钾溶液中所含溶质质量小于氯化钠溶液中溶质,故填:<。
一、固体溶解度
(1)概念:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量。
(2)四要素:①一定温度下;②100g溶剂;③达到饱和状态;④所溶解溶质的质量,单位为g。
(3)影响因素
①内因:溶质和溶剂的性质。
②外因:温度。
a.多数固体物质的溶解度随温度的升高而增大,如KNO3;
b.少数固体物质的溶解度随温度变化的影响很小,如NaCl;
c.极少数固体物质的溶解度随温度的升高而减小,如Ca(OH)2。
(4)溶解度的相对大小(20℃)
溶解度/g <0.01 0.01~1 1~10 >10
一般称为 难溶 微溶 可溶 易溶
二、固体溶解度曲线
(1)意义
图1 图2
内容 意义
曲线(如图1曲线甲) 表示物质的溶解度受温度影响的变化趋势
曲线上方的点(如图1点C) 表示溶液饱和且有未溶解的固体
曲线下方的点(如图1点A) 表示溶液为不饱和溶液
曲线上的点(如图1点B) 表示物质在对应温度时的溶解度
曲线交点(如图2点d) 表示几种物质在某温度时的溶解度相等
(2)应用
①判断某物质在不同温度下的溶解度。
②比较不同物质在同一温度时的溶解度。
③比较不同物质的溶解度受温度变化影响的大小。
④判断物质的溶解度受温度影响的变化趋势。
⑤判断某物质的饱和溶液与不饱和溶液的转化方法。
⑥确定混合物的分离、提纯方法。
三、结晶
1.蒸发结晶(蒸发溶剂):适用于溶解度受温度变化不大的固体
2.降温结晶(冷却热饱和溶液):适用于溶解度随温度变化较大的固体
(1)对于所有固体溶质的溶液,都可用“蒸发溶剂法”;
(2)对于形如的溶质的溶液,还可用“降温结晶法”;
(3)对于形如的溶质的溶液,一般只采用“蒸发溶剂法”;
(4)对于形如的溶质的溶液,还可用“升温结晶法”。
3.
(a)t3℃时A的溶解度为 80g ;
(b)P点的的含义 在该温度时,A和C的溶解度相同;
(c)N点为 t3℃时A的不饱和溶液 ,可通过 加入A物质 、 降温、 蒸发溶剂 的方法使它变为饱和;
(d)t1℃时A、B、C、溶解度由大到小的顺序C>B>A;
(e)从A溶液中获取A晶体可用降温结晶 的方法获取晶体;
(f)从B的溶液中获取晶体,适宜采用蒸发结晶的方法获取晶体;
(g)t2℃ 时A、B、C的饱和溶液各W克,降温到t1℃会析出晶体的有A和B 无晶体析出的有 C ,所得溶液中溶质的质量分数由小到大依次为 A
四、气体溶解度
(1)定义:通常是指该气体的压强为101kPa和一定温度时,溶解在1体积水里达到饱和状态时的气体体积。
(2)影响因素
①内因:气体和溶剂本身的性质。
②外因:温度、压强。
一般来说,温度越高,气体的溶解度越小;压强越大,气体的溶解度越大。
题型一:固体溶解度
【例1】60℃时,硝酸钾的溶解度为110g,该温度下硝酸钾饱和溶液中有关质量关系正确的是
A.溶质质量:溶剂质量=10:11 B.溶剂质量:溶液质量=11:21
C.溶质质量:溶剂质量=11:10 D.溶液质量:溶质质量=21:10
【例2】下列对“50℃,氯化铵的溶解度是50g”理解错误的是( )
A. 50℃,100g水中最多溶解50g氯化铵
B. 氯化铵的溶解度何时都是50g
C. 50℃,氯化铵的饱和溶液中溶质溶剂之比是1:2
D. 50℃,氯化铵的溶液中溶质的质量分数最大是33.3%
题型二:溶解度曲线
【例3】(2022湖南邵阳中考)(6分)如图是甲、乙、丙三种固体物质的溶解度曲线图。
请回答下列问题:
(1) ℃时,甲、丙两种物质的溶解度相等;
(2)三种物质中, 物质的溶解度随温度的升高而减小;
(3)t3℃时,将甲、乙、丙三种物质的饱和溶液分别降温到t1℃,所得溶液的溶质质量分数由大到小的顺序是 。
题型三:结晶
【例4】1.如图是A、B两物质(均不含结晶水)的溶解曲线,据此回答以下问题:
(1)t1℃时,A物质的溶解度为______g,A的饱和溶液中溶质的质量分数为______。
(2)a点的含义是________。
(3)从A、B的混合物中分离A物质,一般采用_________的方法。
题型四:气体溶解度
【例5】打开汽水瓶盖后,瓶内迅速出现大量气泡,对瓶盖打开后分析正确的是( )A.瓶内压强增大B.气体溶解度增大C.溶液为饱和溶液D.溶液中气体浓度变大
1.不同温度下KNO3的溶解度如下表所示。下列说法正确的是
温度/℃ 20 30 40
溶解度/g 31.6 45.8 63.9
A. 20℃时,100gKNO3饱和溶液中溶质质量为31.6g
B. 30℃时,100gKNO3饱和溶液的溶质质量分数为45.8%
C. 30℃时,将50gKNO3放入100g水中得到150g溶液
D. 40℃时,100g水最多溶解63.9gKNO3
2.20℃时,把36克氯化钠放入64克水中,使其充分溶解(20℃时氯化钠的溶解度为36克)。对所得溶液的有关说法错误的是( )
A.该溶液是饱和溶液 B.溶液中Na+和Cl-个数一定相等
C.溶液的质量为100克 D.溶质与溶剂质量比为9:25
3.(2022浙江杭州中考)40℃时恒温蒸发一杯不饱和食盐水至有晶体析出,此过程中不发生变化的是( )
A.溶剂的质量 B.溶质的质量
C.溶液中溶质的质量分数 D.食盐的溶解度
4.一定温度下,向一定量的水中,逐渐加入硝酸钾固体,下列图像符合溶液中溶质质量变化规律的是
A B C D
5.下列关于a、b数值的比较,其中a一定小于b的是
A.某物质的溶解度在低温时为ag,高温时为bg
B.同一饱和溶液中,溶质的质量分数为a%,溶解度为bg
C.某物质的饱和溶液中溶质的质量分数为a%,同一温度下,向其中加入少量该物质后,溶质的质量分数为b%
D.不饱和溶液中溶质的质量分数为a%,饱和溶液中溶质的质量分数为b%
6.甲物质的溶解度曲线图如图所示,下列说法中正确的是
A.甲物质的溶解度随温度的升高而增大
B.甲物质的溶解度是102g
C.20℃时,50g水中加入15g甲物质充分溶解可得到65g溶液
D.70℃时,甲的饱和溶液升高温度或降低温度,都有晶体析出
7.室温时,不饱和的食盐水在空气中露置一段时间后,有少量晶体析出。对此下列说法不正确的是( )
A.溶液的质量减少 B.溶质的质量减少
C.溶质的质量分数减小 D.溶液变成饱和溶液
8.一定温度下,向图Ⅰ烧杯中加入一定量的水,如图Ⅱ所示,所得溶液与原溶液相比,下列判断一定正确的是( )
A.所得溶液是饱和溶液 B.溶质的质量分数变大
C.溶质的质量增加 D.溶质的溶解度变大
9.物质X在40℃、80℃时的溶解度分别为60g/100g水、90g/100g水。甲、乙、丙、丁四个烧杯中均盛有100g水,对应温度下加入X的质量如图,充分溶解后,对所得溶液说法正确的是
A.甲、乙中的溶液含有相同质量的溶质
B.甲、丙中的溶液溶质的质量分数相等
C.乙中溶液升温至80℃,溶质质量分数增大
D.丁中溶液降温至40℃,析出X的质量为60g
10.KNO3的溶解度曲线如下图所示。下列说法错误的是
A.0~60 ℃,KNO3的溶解度随温度升高而增大
B.60 ℃时的KNO3饱和溶液降温至20 ℃,有晶体析出
C.20 ℃,100 g水中最多能溶解31.6 g KNO3
D.60 ℃时,可配制溶质质量分数为60%的KNO3溶液
11.硝酸钾的溶解度曲线如图所示,将100g60℃的KNO3饱和溶液分别进行如下操作后,,所得溶液与原溶液相比,变化结果完全正确的是
选项 操作 溶质质量 溶液质量 溶质的质量分数 KNO3的溶解度
A 升温 变大 变大 不变 变大
B 降温 变小 变小 不变 变小
C 加入KNO3固体 不变 变大 变大 变大
D 恒温蒸发部分水 变小 变小 不变 不变
12.下列因素中不会影响气体物质溶解度的是( )
A. 溶剂的量 B. 温度 C. 溶质的种类 D. 压强
13.如图所示,给饱和澄清石灰水加热。下列叙述错误的是( )。
A. 溶液由澄清变浑浊 B. 氢氧化钙的溶解度随温度的升高而增大
C. 溶液仍为饱和溶液 D. 溶液中溶质的质量分数减小
14.(2022广东中考)根据下图,判断下列说法正确的是( )
A. t1℃时,50g甲能完全溶于50g水 B. 乙的溶解度随温度升高而降低
C. t2℃时,丙和丁的溶解度相同 D. 加压或升温能增加戊的溶解度
15.如图,室温下,盛水的烧杯内放置两支分别盛有等质量KNO3溶液和饱和石灰水的试管甲和乙,向烧杯内的水中加入NH4NO3固体后,甲中未观察到明显现象。下列说法正确的是
A.乙中溶液一定变浑浊 B.甲中溶液一定变成饱和溶液
C.乙中溶液溶质的质量分数一定变小 D.甲、乙中溶液质量一定相等
16. (2022湖南荆州中考)以下是KNO3和NaCl在不同温度时的溶解度和对应的溶解度曲线。请回答:
温度/℃ 0 10 20 30 40 50 60
溶解度/g KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110
NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3
(1)代表KNO3溶解度曲线的是 _____(填“甲”或“乙”)。
(2)若KNO3中混有少量NaCl,可采用 _____的方法提纯KNO3。
(3)t1的范围为_________(填标号)。
A.10~20 B. 20~30 C. 30~40 D. 50~60
(4)t2℃时,将等质量的KNO3的饱和溶液和NaCl的饱和溶液分别降温到t1℃,所得溶液中溶质的质量m(KNO3) _____m(NaCl)(填“>”或“<”或“=”)。
第04讲 溶解度和结晶
一、固体溶解度
(1)概念:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量。
(2)四要素:①一定温度下;②100g溶剂;③达到饱和状态;④所溶解溶质的质量,单位为g。
(3)影响因素
①内因:溶质和溶剂的性质。
②外因:温度。
a.多数固体物质的溶解度随温度的升高而增大,如KNO3;
b.少数固体物质的溶解度随温度变化的影响很小,如NaCl;
c.极少数固体物质的溶解度随温度的升高而减小,如Ca(OH)2。
(4)溶解度的相对大小(20℃)
溶解度/g <0.01 0.01~1 1~10 >10
一般称为 难溶 微溶 可溶 易溶
二、固体溶解度曲线
(1)意义
图1 图2
内容 意义
曲线(如图1曲线甲) 表示物质的溶解度受温度影响的变化趋势
曲线上方的点(如图1点C) 表示溶液饱和且有未溶解的固体
曲线下方的点(如图1点A) 表示溶液为不饱和溶液
曲线上的点(如图1点B) 表示物质在对应温度时的溶解度
曲线交点(如图2点d) 表示几种物质在某温度时的溶解度相等
(2)应用
①判断某物质在不同温度下的溶解度。
②比较不同物质在同一温度时的溶解度。
③比较不同物质的溶解度受温度变化影响的大小。
④判断物质的溶解度受温度影响的变化趋势。
⑤判断某物质的饱和溶液与不饱和溶液的转化方法。
⑥确定混合物的分离、提纯方法。
三、结晶
1.蒸发结晶(蒸发溶剂):适用于溶解度受温度变化不大的固体
2.降温结晶(冷却热饱和溶液):适用于溶解度随温度变化较大的固体
(1)对于所有固体溶质的溶液,都可用“蒸发溶剂法”;
(2)对于形如的溶质的溶液,还可用“降温结晶法”;
(3)对于形如的溶质的溶液,一般只采用“蒸发溶剂法”;
(4)对于形如的溶质的溶液,还可用“升温结晶法”。
3.
(a)t3℃时A的溶解度为 80g ;
(b)P点的的含义 在该温度时,A和C的溶解度相同;
(c)N点为 t3℃时A的不饱和溶液 ,可通过 加入A物质 、 降温、 蒸发溶剂 的方法使它变为饱和;
(d)t1℃时A、B、C、溶解度由大到小的顺序C>B>A;
(e)从A溶液中获取A晶体可用降温结晶 的方法获取晶体;
(f)从B的溶液中获取晶体,适宜采用蒸发结晶的方法获取晶体;
(g)t2℃ 时A、B、C的饱和溶液各W克,降温到t1℃会析出晶体的有A和B 无晶体析出的有 C ,所得溶液中溶质的质量分数由小到大依次为 A
四、气体溶解度
(1)定义:通常是指该气体的压强为101kPa和一定温度时,溶解在1体积水里达到饱和状态时的气体体积。
(2)影响因素
①内因:气体和溶剂本身的性质。
②外因:温度、压强。
一般来说,温度越高,气体的溶解度越小;压强越大,气体的溶解度越大。
题型一:固体溶解度
【例1】60℃时,硝酸钾的溶解度为110g,该温度下硝酸钾饱和溶液中有关质量关系正确的是
A.溶质质量:溶剂质量=10:11 B.溶剂质量:溶液质量=11:21
C.溶质质量:溶剂质量=11:10 D.溶液质量:溶质质量=21:10
【答案】C
【解析】
60℃时,硝酸钾的溶解度为110g,即100g水最多能溶解110g硝酸钾形成饱和溶液。
A、溶质质量:溶剂质量=110g:100g=11:10,错误。
B、溶剂质量:溶液质量=100g:(110g+100g)=10:21,错误。
C、溶质质量:溶剂质量=110g:100g=11:10,正确。
D、溶液质量:溶质质量=(110g+100g):110g=21:11,错误。
故选C。
【例2】下列对“50℃,氯化铵的溶解度是50g”理解错误的是( )
A. 50℃,100g水中最多溶解50g氯化铵
B. 氯化铵的溶解度何时都是50g
C. 50℃,氯化铵的饱和溶液中溶质溶剂之比是1:2
D. 50℃,氯化铵的溶液中溶质的质量分数最大是33.3%
【答案】 B
【解析】A、50℃时,氯化铵的溶解度是50g,说明该温度下,100g水中最多能溶解50g氯化铵,不符合题意;
B、50℃时,氯化铵的溶解度是50g,其它温度不是,符合题意;
C、50℃时,氯化铵的溶解度是50g,该温度下,饱和溶液中溶质、溶剂之比是:50g:100g=1:2,不符合题意;
D、50℃,氯化铵的饱和溶液中溶质的质量分数是: ,不符合题意。
题型二:溶解度曲线
【例3】(2022湖南邵阳中考)(6分)如图是甲、乙、丙三种固体物质的溶解度曲线图。
请回答下列问题:
(1) ℃时,甲、丙两种物质的溶解度相等;
(2)三种物质中, 物质的溶解度随温度的升高而减小;
(3)t3℃时,将甲、乙、丙三种物质的饱和溶液分别降温到t1℃,所得溶液的溶质质量分数由大到小的顺序是 。
【答案】(1)t2;(2)丙;(3)甲=乙>丙。
【解析】(1)由溶解度曲线图可知,t2℃时,甲、丙两种物质的溶解度相等;
(2)三种物质中,丙物质的溶解度随温度的升高而减小;
(3)甲、乙的溶解度随温度的升高而增大,丙的溶解度随温度的升高而减小,所以将t3℃时甲、乙、丙三种物质的饱和溶液降温到t1℃,甲、乙溶解度减小,析出晶体,溶质的质量分数减小,t1℃时,甲、乙溶解度相等,则t1℃时甲、乙的饱和溶液溶质的质量分数相等,丙溶解度变大,由饱和溶液变为不饱和溶液,t1℃饱和溶液中溶质质量分数与t3℃时相同,又t3℃时丙溶解度小于甲、乙在t1℃时溶解度,所以丙降温后所得溶液中溶质的质量分数最小,则将t3℃的甲、乙、丙三种物质的饱和溶液都降温至t1℃,所得三种溶液中溶质质量分数的由大到小关系是甲=乙>丙。
题型三:结晶
【例4】1.如图是A、B两物质(均不含结晶水)的溶解曲线,据此回答以下问题:
(1)t1℃时,A物质的溶解度为______g,A的饱和溶液中溶质的质量分数为______。
(2)a点的含义是________。
(3)从A、B的混合物中分离A物质,一般采用_________的方法。
【答案】
(1) 25 20%
(2)t2℃时A、B两种物质的溶解度相等
(3)降温结晶
【解析】
(1)从图示看:t1℃时,A物质的溶解度为25克;A的饱和溶液中溶质的质量分数为=20%;
(2)a点的含义是在t2℃时,A、B两物质的溶解度相同;
(3)从A、B的混合物中分离A物质,一般采用冷却热饱和溶液方法,因为A的溶解度随温度的变化很大。
题型四:气体溶解度
【例5】打开汽水瓶盖后,瓶内迅速出现大量气泡,对瓶盖打开后分析正确的是( )
A.瓶内压强增大
B.气体溶解度增大
C.溶液为饱和溶液
D.溶液中气体浓度变大
【答案】C
【解析】
气体的溶解度随着压强的增大而增大,随着压强的减小而减小,打开汽水瓶盖时,压强减小,二氧化碳的溶解度减小,一部分二氧化碳逸出,逸出后的二氧化碳溶液仍是饱和溶液,溶液中气体的浓度比未开盖前更小,因此ABD选项都不正确,故选C。
1.不同温度下KNO3的溶解度如下表所示。下列说法正确的是
温度/℃ 20 30 40
溶解度/g 31.6 45.8 63.9
A. 20℃时,100gKNO3饱和溶液中溶质质量为31.6g
B. 30℃时,100gKNO3饱和溶液的溶质质量分数为45.8%
C. 30℃时,将50gKNO3放入100g水中得到150g溶液
D 40℃时,100g水最多溶解63.9gKNO3
【答案】D
【解析】A、20℃时,硝酸钾的溶解度是31.6g,表示20℃时,100g水中溶解31.6gKNO3达到饱和状态,也就是131.6g的KNO3饱和溶液中的溶质质量为31.6g ,故选项A不正确;
B、30℃时,KNO3的溶解度是45.8g,要计算该温度下饱和溶液的溶质质量分数,根据一定温度下,饱和溶液中溶质质量分数与溶解度的关系:得,30℃时,100gKNO3饱和溶液的溶质质量分数=,故选项B不正确;
C、30℃时,KNO3的溶解度是45.8g,表示30℃时,100g水中溶解45.8g KNO3达到饱和状态,也就是30℃时,100g水中最多只能溶解45.8gKNO3,所得饱和溶液的质量是145.8g,故选项C不正确;
D、40℃时,KNO3的溶解度是63.9g,表示40℃时,100g水中溶解63,9g KNO3达到饱和状态,也就是40℃时,100g水中最多只能溶解63.9gKNO3,故选项D正确;
故选:D。
2.20℃时,把36克氯化钠放入64克水中,使其充分溶解(20℃时氯化钠的溶解度为36克)。对所得溶液的有关说法错误的是( )
A.该溶液是饱和溶液 B.溶液中Na+和Cl-个数一定相等
C.溶液的质量为100克 D.溶质与溶剂质量比为9:25
【答案】C
【解析】因为20℃时氯化钠的溶解度为36克,即在20℃时,100克水中溶解36克氯化钠达到饱和状态,则该温度下36克氯化钠不能完全溶解在64克水中,因此所得溶液为饱和溶液,故A选项正确;B. 氯化钠是由钠离子和氯离子构成的,且钠离子和氯离子的个数比为1:1,所以在氯化钠溶液中,钠离子和氯离子的个数一定相等,故B选项正确;C. 因为36克的氯化钠固体不能完全溶解在64克水中,因此所得溶液的质量小于36克+64克,即小于100克,故C选项号错误;D. 根据氯化钠在该温度下的溶解度为36克,则饱和溶液中的溶质和溶剂的质量比为36:100=9:25,故D选项正确。
3.(2022浙江杭州中考)40℃时恒温蒸发一杯不饱和食盐水至有晶体析出,此过程中不发生变化的是( )
A.溶剂的质量 B.溶质的质量
C.溶液中溶质的质量分数 D.食盐的溶解度
【答案】D
【解析】A、40℃时恒温蒸发一杯不饱和食盐水至有晶体析出,故选项说法错误。
B、40℃时恒温蒸发一杯不饱和食盐水至有晶体析出,故选项说法错误。
C、40℃时恒温蒸发一杯不饱和食盐水至有晶体析出,溶质的质量分数变大。
D、温度不变,故选项说法正确。
故选:D。
4.一定温度下,向一定量的水中,逐渐加入硝酸钾固体,下列图像符合溶液中溶质质量变化规律的是
A. B.
C. D.
【答案】A
【解析】
一定温度下,向一定量的水中,逐渐加入硝酸钾固体,溶质的质量会从零开始增加,直到溶液达到饱和状态,溶质的质量就不会在变。
故选:A
5.下列关于a、b数值的比较,其中a一定小于b的是
A.某物质的溶解度在低温时为ag,高温时为bg
B.同一饱和溶液中,溶质的质量分数为a%,溶解度为bg
C.某物质的饱和溶液中溶质的质量分数为a%,同一温度下,向其中加入少量该物质后,溶质的质量分数为b%
D.不饱和溶液中溶质的质量分数为a%,饱和溶液中溶质的质量分数为b%
【答案】B
【解析】
A、氢氧化钙的溶解度随温度升高反而减小,则氢氧化钙的溶解度在低温时为ag,高温时为bg,则a大于b,选项错误;
B、同一饱和溶液中,溶质的质量分数为a%,溶解度为bg,则a%=×100%,则a一定小于b,选项正确;
C、某物质的饱和溶液中溶质的质量分数为a%,同一温度下,向其中加入少量该物质后,该物质不再溶解,溶液的溶质质量分数不变,溶质的质量分数仍为a%,即a=b,选项错误;
D、同一温度下,某种物质的饱和溶液的溶质质量分数大于不饱和溶液的溶质质量分数,题文中两种溶液的温度与溶质的种类不确定,则无法比较溶液的溶质质量分数的大小,即不能确定a、b的关系,选项错误,故选B。
6.甲物质的溶解度曲线图如图所示,下列说法中正确的是
A.甲物质的溶解度随温度的升高而增大
B.甲物质的溶解度是102g
C.20℃时,50g水中加入15g甲物质充分溶解可得到65g溶液
D.70℃时,甲的饱和溶液升高温度或降低温度,都有晶体析出
【答案】D
【解析】
A、由图可知,甲物质的溶解度随温度的升高先增大后减小,不符合题意;
B、由图可知,70℃时,甲物质的溶解度为102g,应指明温度,不符合题意;
C、20℃时,甲物质的溶解度为28g,该温度下,50g水中加入15g甲物质,只能溶解14g,充分溶解后,可得到50g+14g=64g溶液,不符合题意;
D、由图可知,70℃时,甲的溶解度最大,甲的饱和溶液升高温度或降低温度,溶解度均减小,均有晶体析出,符合题意。
故选D。
7.室温时,不饱和的食盐水在空气中露置一段时间后,有少量晶体析出。对此下列说法不正确的是( )
A.溶液的质量减少 B.溶质的质量减少
C.溶质的质量分数减小 D.溶液变成饱和溶液
【答案】C
【解析】 .室温时,不饱和的食盐水在空气中露置一段时间后,有少量晶体析出,溶液的质量减小,溶质和溶剂的质量减小,溶液有不饱和变为饱和溶液,溶质的质量分数增大,故答案选择C
8.一定温度下,向图Ⅰ烧杯中加入一定量的水,如图Ⅱ所示,所得溶液与原溶液相比,下列判断一定正确的是( )
A.所得溶液是饱和溶液 B.溶质的质量分数变大
C.溶质的质量增加 D.溶质的溶解度变大
【答案】C
【解析】在一定温度下,向有氯化钾晶体存在的饱和氯化钾溶液中加水,固体会溶解,溶液中溶质的质量一定变大;图Ⅱ中烧杯内无剩余的氯化钾晶体,因此该溶液可能恰好饱和,也可能是不饱和溶液;在该实验中温度没有发生改变,因而当图Ⅱ中的溶液恰好饱和时,溶质质量分数不变,但是当溶液为不饱和溶液时,溶质质量分数会变小;由于温度没有发生改变,因而其溶解度一定不会发生改变。故选C。
9.物质X在40℃、80℃时的溶解度分别为60g/100g水、90g/100g水。甲、乙、丙、丁四个烧杯中均盛有100g水,对应温度下加入X的质量如图,充分溶解后,对所得溶液说法正确的是
A.甲、乙中的溶液含有相同质量的溶质
B.甲、丙中的溶液溶质的质量分数相等
C.乙中溶液升温至80℃,溶质质量分数增大
D.丁中溶液降温至40℃,析出X的质量为60g
【答案】AB
【解析】
A、在40℃时,X的溶解度为60g/100g水,甲中放入70g后固体只能溶解60g,所以甲、乙溶液中溶质质量都是60g,选项正确;
B、在40℃时,X的溶解度为60g/100g水,甲中放入70g后固体只能溶解60g,甲、丙中的溶液中溶质都是60g,溶剂都是100g,溶质的质量分数相等,选项正确;
C、乙中溶液升温至80℃,溶质、溶剂的质量不变,溶质质量分数不变,选项错误;
D、丁中溶液降温至40℃,析出X的质量为90g-60g=30g,选项错误。
故选AB。
10.KNO3的溶解度曲线如下图所示。下列说法错误的是
A.0~60 ℃,KNO3的溶解度随温度升高而增大
B.60 ℃时的KNO3饱和溶液降温至20 ℃,有晶体析出
C.20 ℃,100 g水中最多能溶解31.6 g KNO3
D.60 ℃时,可配制溶质质量分数为60%的KNO3溶液
【答案】D
【解析】A、由KNO3的溶解度曲线图可知,0~60 ℃,KNO3的溶解度随温度升高而增大,故A正确;B、KNO3的溶解度随温度升高而增大,60 ℃时的KNO3饱和溶液降温至20 ℃,有晶体析出,故B正确;C、20 ℃,KNO3的溶解度为31.6 g,则100 g水中最多能溶解31.6 g KNO3,故C正确;D、60 ℃时,KNO3的溶解度为110 g,饱和溶液的质量分数为×100%<60%,不能配制溶质质量分数为60%的KNO3溶液,故D不正确。故选D。
11.硝酸钾的溶解度曲线如图所示,将100g60℃的KNO3饱和溶液分别进行如下操作后,,所得溶液与原溶液相比,变化结果完全正确的是
选项 操作 溶质质量 溶液质量 溶质的质量分数 KNO3的溶解度
A 升温 变大 变大 不变 变大
B 降温 变小 变小 不变 变小
C 加入KNO3固体 不变 变大 变大 变大
D 恒温蒸发部分水 变小 变小 不变 不变
【答案】D
【解析】A、根据硝酸钾的溶解度曲线可知,升温后硝酸钾的溶解度变大,溶质质量、溶液质量、溶质的质量分数都不变,故错误;
B、根据硝酸钾的溶解度曲线可知,降温后硝酸钾的溶解度变小,硝酸钾会结晶析出,溶质质量、溶液质量、溶质的质量分数都变小,故错误;
C、加入KNO3固体后,不会继续溶解,溶质质量、溶液质量、溶质的质量分数、溶解度都不变,故错误;
D、恒温蒸发部分水,硝酸钾会结晶析出,溶质质量、溶液质量都变小,溶质的质量分数、解度都不变,故正确。故选D。
12.下列因素中不会影响气体物质溶解度的是( )
A. 溶剂的量 B. 温度 C. 溶质的种类 D. 压强
【答案】 A
【解析】A.溶剂的质量不会影响气体物质的溶解度;
B.温度影响气体物质的溶解度,温度越高,气体溶解度越小;
C.溶剂的种类影响气体物质的溶解度;
D.压强影响气体物质的溶解度,压强越大,气体溶解度越大;
13.如图所示,给饱和澄清石灰水加热。下列叙述错误的是( )。
A. 溶液由澄清变浑浊 B. 氢氧化钙的溶解度随温度的升高而增大
C. 溶液仍为饱和溶液 D. 溶液中溶质的质量分数减小
【答案】 B
【解析】A. 给饱和澄清石灰水加热,氢氧化钙的溶解度随温度升高而减小,所以溶液由澄清变浑浊,故叙述正确,不符合题意;
B. 氢氧化钙的溶解度随温度的升高而减小,故叙述错误,符合题意;
C. 溶液中溶质析出,仍为饱和溶液,故叙述正确,不符合题意;
D. 溶液中溶质析出,溶质的质量减少,溶液中溶质的质量分数减小,故叙述正确,不符合题意;
14.(2022广东中考)根据下图,判断下列说法正确的是( )
A. t1℃时,50g甲能完全溶于50g水 B. 乙的溶解度随温度升高而降低
C. t2℃时,丙和丁的溶解度相同 D. 加压或升温能增加戊的溶解度
【答案】C
【解析】A.t1℃时,甲物质的溶解度为80g,也就是100g水中最多能溶解80g物质甲,所以50g甲中只有40g能完全溶于50g水,选项错误。
B.随着温度的升高,溶解后剩余固体的质量在减小,说明溶解的物质变多,所以乙的溶解度随温度升高而升高,选项错误。
C.t2℃时,丙和丁的溶解度相同,正确。
D.压强增大或者温度降低戊的溶解度在升高,所以加压或降温能增加戊的溶解度,选项错误。
故选:C。
15.(2021陕西中考)如图,室温下,盛水的烧杯内放置两支分别盛有等质量KNO3溶液和饱和石灰水的试管甲和乙,向烧杯内的水中加入NH4NO3固体后,甲中未观察到明显现象。下列说法正确的是
A.乙中溶液一定变浑浊 B.甲中溶液一定变成饱和溶液
C.乙中溶液溶质的质量分数一定变小 D.甲、乙中溶液质量一定相等
【答案】D
【解析】A、加入硝酸铵,硝酸铵溶解吸热,溶液温度降低,氢氧化钙的溶解度增加,变为不饱和溶液,溶液不变浑浊,不符合题意;B、加入硝酸铵,硝酸铵溶解吸热,溶液温度降低,硝酸钾的溶解度减小,甲中无明显现象,硝酸钾可能恰好饱和,也可能是不饱和溶液,不符合题意;C、加入硝酸铵,硝酸铵溶解吸热,溶液温度降低,氢氧化钙的溶解度增加,变为不饱和溶液,乙中溶液溶质质量分数不变,不符合题意;D、由以上分析可知,甲、乙中溶液均无溶质析出,溶液质量不变,故溶液质量一定相等,符合题意。故选D。
16. (2022湖南荆州中考)以下是KNO3和NaCl在不同温度时的溶解度和对应的溶解度曲线。请回答:
温度/℃ 0 10 20 30 40 50 60
溶解度/g KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110
NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3
(1)代表KNO3溶解度曲线的是 _____(填“甲”或“乙”)。
(2)若KNO3中混有少量NaCl,可采用 _____的方法提纯KNO3。
(3)t1的范围为_________(填标号)。
A.10~20 B. 20~30 C. 30~40 D. 50~60
(4)t2℃时,将等质量的KNO3的饱和溶液和NaCl的饱和溶液分别降温到t1℃,所得溶液中溶质的质量m(KNO3) _____m(NaCl)(填“>”或“<”或“=”)。
【答案】(1)甲 (2)降温结晶或冷却热饱和溶液 (3)B (4)<
【解析】
(1)根据溶解度表可知硝酸钾的溶解度受温度影响大,如图甲的溶解度符合这一特点,故表KNO3溶解度曲线的是 :甲;
(2)由溶解度表和曲线图可知,硝酸钾和氯化钠溶解度均随温度的升高而升高,硝酸钾溶解度受温度影响大,氯化钠溶解度受温度影较小,则硝酸钾中混有少量氯化钠时应采用降温结晶或冷却热饱和溶液的方法提纯硝酸钾,故填:降温结晶(或冷却热饱和溶液);
(3)如图,t1℃时硝酸钾和氯化钠溶解度曲线交于一点说明该温度下,硝酸钾和氯化钠溶解度相等,小于t1℃时硝酸钾溶解度小于氯化钠,大于t1℃时硝酸钾溶解度大于氯化钠,根据表格数据,符合这一特点的温度是20℃硝酸钾溶解度小于氯化钠,30℃硝酸钾溶解度大于氯化钠,故t1的范围是20~30,故选:B;
(4)如图,t2℃时,等质量的硝酸钾的饱和溶液和氯化钠的饱和溶液分别降温到t1℃,两物质的溶解度减小析出溶质形成t1℃时的饱和溶液,此时两物质溶解度相等则溶质质量分数相等,由于原溶液质量相等且降温过程中硝酸钾溶解度变化较大,则析出的溶质大于氯化钠,使t1℃时硝酸钾饱和溶液的质量小于氯化钠饱和溶液,两溶液溶质质量分数相等故硝酸钾溶液中所含溶质质量小于氯化钠溶液中溶质,故填:<。
