2022—2023学年化学沪教版(全国)九年级下册第6章:溶解现象 分层练习题(含答案)
文档属性
| 名称 | 2022—2023学年化学沪教版(全国)九年级下册第6章:溶解现象 分层练习题(含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 434.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-01 19:45:01 | ||
图片预览



文档简介
2022—2023学年化学沪教版(全国)九年级下册第6章:溶解现象 分层练习题含答案
沪教版(全国)第6章:溶解现象
一、选择题。
1、把少量生活中的物质分别放入水中,充分搅拌,可以得到溶液的是( )
A.面粉 B.牛奶 C.蔗糖 D.植物油
2、常温下,在15 g氯化钠中加入60 g水,完全溶解后,溶液中氯化钠的质量分数为( )
A.15% B.20% C.25% D.33.3%
3、a、b、c三种不含结晶水的物质的溶解度曲线如图,下列说法正确的是( )
A.a的溶解度大于b的溶解度
B.将a的溶液由降温到,一定有晶体析出
C.时,50g的a溶于50g水,溶液的质量分数为
D.c的饱和溶液由降温到,溶液的质量分数不变
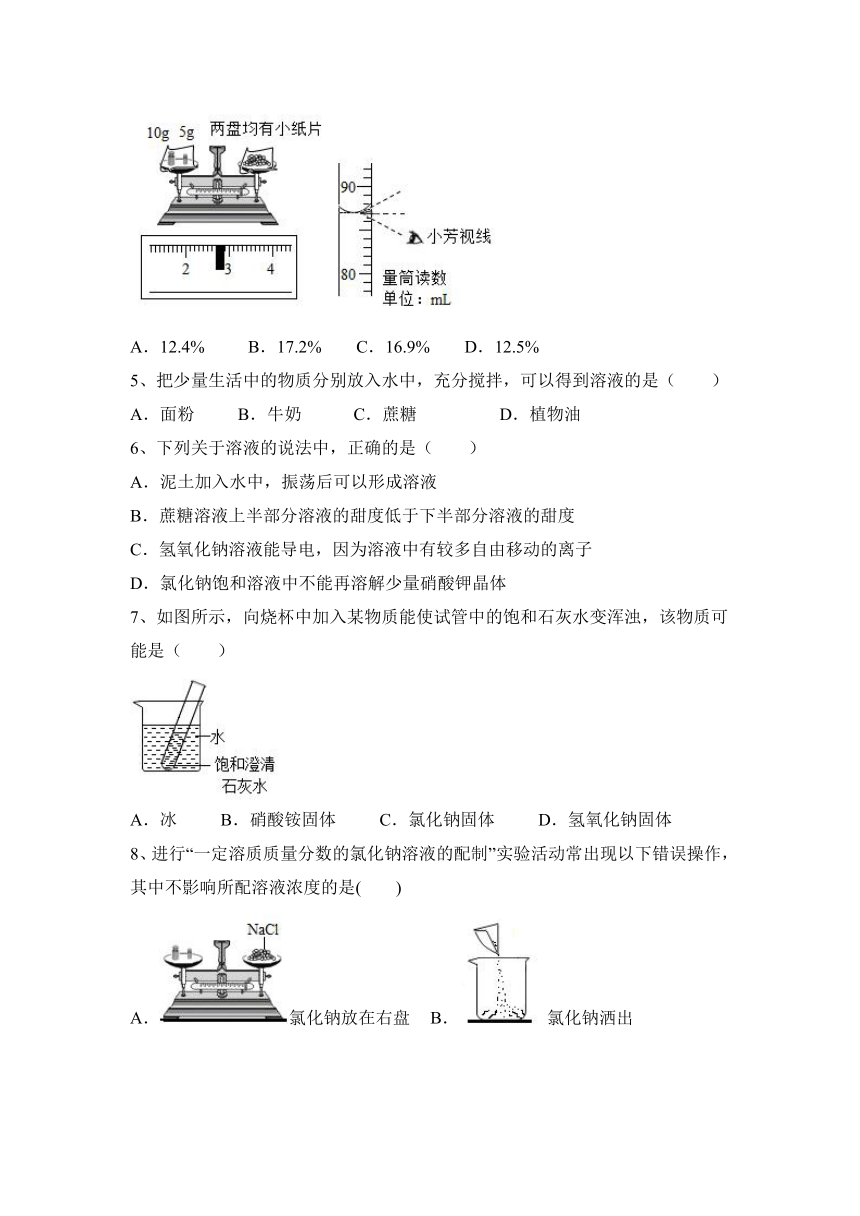
4、小芳在配制一定溶质质量分数的氯化钠溶液时,没有按照正确的称量氯化钠。量取水的操作规程进行操作(图示为小芳操作时的读数,其它操作都正确)。小芳实际配制的氯化钠溶液的溶质质量分数(水的密度为1g/cm3)约为
A.12.4% B.17.2% C.16.9% D.12.5%
5、把少量生活中的物质分别放入水中,充分搅拌,可以得到溶液的是( )
A.面粉 B.牛奶 C.蔗糖 D.植物油
6、下列关于溶液的说法中,正确的是( )
A.泥土加入水中,振荡后可以形成溶液
B.蔗糖溶液上半部分溶液的甜度低于下半部分溶液的甜度
C.氢氧化钠溶液能导电,因为溶液中有较多自由移动的离子
D.氯化钠饱和溶液中不能再溶解少量硝酸钾晶体
7、如图所示,向烧杯中加入某物质能使试管中的饱和石灰水变浑浊,该物质可能是( )
A.冰 B.硝酸铵固体 C.氯化钠固体 D.氢氧化钠固体
8、进行“一定溶质质量分数的氯化钠溶液的配制”实验活动常出现以下错误操作,其中不影响所配溶液浓度的是( )
A.氯化钠放在右盘 B.氯化钠洒出
C.俯视读数 D.配好的溶液装瓶时溅出
9、下列饮料中,不属于溶液的是( )
A.汽水 B.白酒 C.酸奶 D.苏打水
10、欲配制质量分数为6%的NaCl溶液,下列有关操作正确的是( )
A.取固体 B.称固体
C.量取水 D.溶解
11、下列有关饱和溶液与不饱和溶液的理解正确的是( )
A.饱和溶液就是浓溶液,不饱和溶液就是稀溶液
B.在一定条件下,饱和溶液和不饱和溶液之间不能实现转化
C.常温下,加热一杯饱和石灰水溶液会出现浑浊现象
D.饱和溶液就是在一定温度下,一定量的溶剂里不能溶解任何溶质的溶液
12、化学是一门以实验为基础的科学。下列仪器用途不正确的是( )
A.A. B.B C.C D.D
13、下列关于溶液特征的叙述中不正确的是( )
A.溶液都是澄清、透明、无色的
B.当外界条件不变时,溶液长期放置,溶质不会从溶液里分离出来
C.一种溶液中各部分的浓稀程度都是一样的
D.溶液是均一、稳定的混合物
14、分类是认识和研究物质及其变化的常用的科学方法,如物质可分为纯净物和混合物。下列物质属于化合物的是( )
A.盐酸 B.镁铝合金 C.氢氧化钠 D.氮气
15、生活中的下列现象不能说明气体溶解度随温度升高而减小的是( )
A.打开汽水瓶盖有大量泡沫逸出 B.烧水时水沸腾前有气泡逸出
C.喝下汽水打嗝 D.夏季黄昏,池塘里的鱼常浮出水面
二、填空题。
16、(1)小英同学从水库中取出浑浊水样进行实验。
①将水样静置,用如图装置进行过滤,其操作规范的是_____(填标号)。
a.用玻璃棒引流
b.滤纸边缘高出漏斗
c.漏斗末端颈尖未紧靠烧杯内壁
d.将滤纸湿润,使其紧贴漏斗内壁
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
②向过滤后所得水样中加入一定量活性炭,利用活性炭的___ 性除去杂质和臭味。
③在处理后的水样中加入一定量肥皂水,振荡,观察到泡沫较少,浮渣较多,说明该水样属于___ (填“硬水”或“软水”)。
④生活中常用___ (填“煮沸”“静置沉淀”或“过滤”)的方法降低水的硬度,并起到消毒杀菌的作用。
⑤为了人类的生存和发展,人类必须爱惜水。下列做法不利于保护水资源的是____(填标号)。
A 生活污水直接排放 B 提倡使用节水器具
C 工业上冷却水重复利用 D 园林浇灌用滴灌、喷灌
(2)①在盛有水的烧杯中加入一定量硝酸铵,形成溶液过程中,温度会____(填“升高”“降低”或“不变”)。
②用加了洗涤剂的水能洗掉餐具上的油污,这是利用了洗涤剂的____作用。
17、医疗上常用的生理盐水是质量分数为0.9%(密度近似为l g/cm3)的氯化钠溶液。500 mL这种生理盐水中含氯化钠_______g、水_____g。若以每分钟50滴(每20滴约为1 mL)的速率给病人静脉输液500 mL,约需_____分钟输完。
18、回答下列问题
(1)固体的溶解度指在一定______下,某固态物质在______溶剂里达到______状态所溶解的______。
(2)20℃时,氯化钠在水中的溶解度为36 g,意思是20℃时,______水中达到______状态时溶解氯化钠的质量为______;或者20℃时,______水中______可溶解氯化钠的质量为36 g。
(3)物质的溶解性是根据______℃时的溶解度规定的,当该温度下物质的溶解度______10 g时,为易溶物质。
a.固体的溶解度从几个要素进行规定?______
b.要比较两种物质的溶解度,需要注意什么问题?______
19、判断题:
(1)配制一定溶质质量分数溶液时,所得溶液的溶质质量分数偏小可能是烧杯用蒸馏水润洗过( )
(2)配制一定质量分数的氯化钠溶液,称量时天平右端忘垫称量纸会导致所配溶液的溶质质量分数偏小( )
(3)配制的100g16%的氯化钠溶液,装瓶时的标签为“NaCl溶液100g”( )
(4)实验室用6%的氯化钠溶液配制50g溶质质量分数为3%的氯化钠溶液,实验中玻璃棒的作用是防止液体飞溅( )
(5)配制一定质量分数的氯化钠溶液,量筒中本身有水会导致所配溶液的溶质质量分数偏小( )
20、城市中的生活用水是经自来水厂净化处理过的,但仍不建议直接饮用。因为中间经过管道、水箱等多个环节,容易被微生物、细菌、重金属污染,所以自来水一定要处理后才能饮用。
(1)我国生活饮用水卫生标准规定,饮用水(包括自来水)中含有铁、锰、铜、锌、钙等多种矿物质。这里的铁、锰、铜、锌、钙等是指____________(填“分子”、“原子”或“元素”)。
(2)检验自来水是硬水还是软水可以用___________。
(3)家庭中将自来水处理成能饮用的水的方法可以是_________。(任写一个)
(4)在自来水中加入洗涤剂可以除去衣物上的油污,这是利用了洗涤剂的________作用。
21、分别填写下列溶液中溶质和溶剂的名称:
(1)蔗糖溶液:溶质_______;溶剂________。
(2)碘酒(即碘的酒精溶液):溶质_______;溶剂________。
(3)乙醇的水溶液:溶质_______;溶剂________。
(4)0.9%的生理盐水:溶质_______;溶剂________。
22、交点的含义:
如图所示,P点表示______,此时两种物质的饱和溶液中一定相等的是______。
23、实验室配制100g6%的氯化钠溶液,需要称取氯化钠___________g;用调好的托盘天平称量所需的氯化钠时,发现天平的指针偏向左盘,此时应该进行的操作是___________;将配好的氯化钠溶液倒入细口瓶时,有少量溶液溅出瓶外,所配溶液的溶质质量分数___________(选填“变大”、“变小”或“不变”)。
三、综合应用题。
24、溶液与人们的生产、生活密切相关。
(1)向澄清石灰水中通入二氧化碳直至过量的全过程中,下列转变关系正确的是______(填字母)。
A.溶液、乳浊液、溶液 B.溶液、悬溶液、乳浊液
C.悬溶液、乳浊液、溶液 D.溶液、悬浊液、溶液
(2)在盛有水的烧杯中加入以下某种物质,在形成溶液的过程中,溶液温度明显升高的是______(填字母)。
A.烧碱 B.硝酸铵 C.氯化钠
(3)如图为甲、乙两种固体物质的溶解度曲线。
①溶解度随温度升高而增大的物质是______(填“甲”或“乙”)。
②将t1℃时的甲、乙两种物质的饱和溶液升温至t2℃,所得溶液中溶质的质量分数甲______乙(填“<”、“=”或“>”)
③在t2℃时,某同学向128.5g甲溶液中加入1.5g甲固体恰好得到t2℃时甲的饱和溶液,则原甲溶液溶质的质量分数为______(结果精确到0.1%)。
(4)t2℃时,同学们在实验室配制一定量10%的甲溶液(已知水的密度为1g/cm3)。
①用8.0g甲(不含结晶水)固体配制10%的甲溶液,需要水______mL。
②将配好的溶液倒入洁净的______中(填容器名称),盖好塞子贴上标签。
③下列操作会导致配制的甲溶液的溶质质量分数偏低的是______。
A.甲固体中含有杂质
B.烧杯未干燥直接用于配制溶液
C.用量筒量取水时采用俯视方法读数
四、实验题。
25、请你参与实验室配制一定溶质质量分数的硝酸钾溶液的实验,并进行实验过程的探究:
(1)计算:配制50g质量分数为10%的硝酸钾溶液,所需硝酸钾质量为______________ g,所需蒸馏水的体积为 _____________ mL(水的密度约为1g/mL).
(2)称量:分别在天平左右两盘放上纸片,调节平衡后,应_________ (填标号).
A 先在托盘上放置所需的砝码,再添加硝酸钾直至天平平衡.
B 先添加所需的硝酸钾,再添加砝码到所在的托盘直至天平平衡.
【探究一】:在称量过程中,某同学的称量操作如图所示,你认为该操作对本次实验的数据处理的正确性 ________ (填“有”或“没有”)影响,理由是___________ .
(3)量取:准确量取所需蒸馏水要用到的仪器是_________(选填图中的标号).
(4)溶解:将称量好的硝酸钾和蒸馏水混合溶解.
【探究二】:20℃时,将20mL质量分数为10%的硝酸钾溶液,稀释成质量分数为4%的硝酸钾溶液.从表中找出计算所需的数据为:_________ g/mL.
温度℃质量分数% 20 40 60
4 1.023 1.016 1.007
10 1.063 1.054 1.044
2022—2023学年化学沪教版(全国)九年级下册第6章:溶解现象 分层练习题含答案
沪教版(全国)第6章:溶解现象
一、选择题。
1、把少量生活中的物质分别放入水中,充分搅拌,可以得到溶液的是( )
A.面粉 B.牛奶 C.蔗糖 D.植物油
【答案】C
2、常温下,在15 g氯化钠中加入60 g水,完全溶解后,溶液中氯化钠的质量分数为( )
A.15% B.20% C.25% D.33.3%
【答案】B
3、a、b、c三种不含结晶水的物质的溶解度曲线如图,下列说法正确的是( )
A.a的溶解度大于b的溶解度
B.将a的溶液由降温到,一定有晶体析出
C.时,50g的a溶于50g水,溶液的质量分数为
D.c的饱和溶液由降温到,溶液的质量分数不变
【答案】D
4、小芳在配制一定溶质质量分数的氯化钠溶液时,没有按照正确的称量氯化钠。量取水的操作规程进行操作(图示为小芳操作时的读数,其它操作都正确)。小芳实际配制的氯化钠溶液的溶质质量分数(水的密度为1g/cm3)约为
A.12.4% B.17.2% C.16.9% D.12.5%
【答案】A
5、把少量生活中的物质分别放入水中,充分搅拌,可以得到溶液的是( )
A.面粉 B.牛奶 C.蔗糖 D.植物油
【答案】C
6、下列关于溶液的说法中,正确的是( )
A.泥土加入水中,振荡后可以形成溶液
B.蔗糖溶液上半部分溶液的甜度低于下半部分溶液的甜度
C.氢氧化钠溶液能导电,因为溶液中有较多自由移动的离子
D.氯化钠饱和溶液中不能再溶解少量硝酸钾晶体
【答案】C
7、如图所示,向烧杯中加入某物质能使试管中的饱和石灰水变浑浊,该物质可能是( )
A.冰 B.硝酸铵固体 C.氯化钠固体 D.氢氧化钠固体
【答案】D
8、进行“一定溶质质量分数的氯化钠溶液的配制”实验活动常出现以下错误操作,其中不影响所配溶液浓度的是( )
A.氯化钠放在右盘 B.氯化钠洒出
C.俯视读数 D.配好的溶液装瓶时溅出
【答案】D
9、下列饮料中,不属于溶液的是( )
A.汽水 B.白酒 C.酸奶 D.苏打水
【答案】C
10、欲配制质量分数为6%的NaCl溶液,下列有关操作正确的是( )
A.取固体 B.称固体
C.量取水 D.溶解
【答案】D
11、下列有关饱和溶液与不饱和溶液的理解正确的是( )
A.饱和溶液就是浓溶液,不饱和溶液就是稀溶液
B.在一定条件下,饱和溶液和不饱和溶液之间不能实现转化
C.常温下,加热一杯饱和石灰水溶液会出现浑浊现象
D.饱和溶液就是在一定温度下,一定量的溶剂里不能溶解任何溶质的溶液
【答案】C
12、化学是一门以实验为基础的科学。下列仪器用途不正确的是( )
A.A. B.B C.C D.D
【答案】A
13、下列关于溶液特征的叙述中不正确的是( )
A.溶液都是澄清、透明、无色的
B.当外界条件不变时,溶液长期放置,溶质不会从溶液里分离出来
C.一种溶液中各部分的浓稀程度都是一样的
D.溶液是均一、稳定的混合物
【答案】A
14、分类是认识和研究物质及其变化的常用的科学方法,如物质可分为纯净物和混合物。下列物质属于化合物的是( )
A.盐酸 B.镁铝合金 C.氢氧化钠 D.氮气
【答案】C
15、生活中的下列现象不能说明气体溶解度随温度升高而减小的是( )
A.打开汽水瓶盖有大量泡沫逸出 B.烧水时水沸腾前有气泡逸出
C.喝下汽水打嗝 D.夏季黄昏,池塘里的鱼常浮出水面
【答案】A
二、填空题。
16、(1)小英同学从水库中取出浑浊水样进行实验。
①将水样静置,用如图装置进行过滤,其操作规范的是_____(填标号)。
a.用玻璃棒引流
b.滤纸边缘高出漏斗
c.漏斗末端颈尖未紧靠烧杯内壁
d.将滤纸湿润,使其紧贴漏斗内壁
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
②向过滤后所得水样中加入一定量活性炭,利用活性炭的___ 性除去杂质和臭味。
③在处理后的水样中加入一定量肥皂水,振荡,观察到泡沫较少,浮渣较多,说明该水样属于___ (填“硬水”或“软水”)。
④生活中常用___ (填“煮沸”“静置沉淀”或“过滤”)的方法降低水的硬度,并起到消毒杀菌的作用。
⑤为了人类的生存和发展,人类必须爱惜水。下列做法不利于保护水资源的是____(填标号)。
A 生活污水直接排放 B 提倡使用节水器具
C 工业上冷却水重复利用 D 园林浇灌用滴灌、喷灌
(2)①在盛有水的烧杯中加入一定量硝酸铵,形成溶液过程中,温度会____(填“升高”“降低”或“不变”)。
②用加了洗涤剂的水能洗掉餐具上的油污,这是利用了洗涤剂的____作用。
【答案】(1)ad(多选、少选、错选不得分) 吸附 硬水 煮沸 A
(2)降低 乳化
17、医疗上常用的生理盐水是质量分数为0.9%(密度近似为l g/cm3)的氯化钠溶液。500 mL这种生理盐水中含氯化钠_______g、水_____g。若以每分钟50滴(每20滴约为1 mL)的速率给病人静脉输液500 mL,约需_____分钟输完。
【答案】4.5 495.5 200
18、回答下列问题
(1)固体的溶解度指在一定______下,某固态物质在______溶剂里达到______状态所溶解的______。
(2)20℃时,氯化钠在水中的溶解度为36 g,意思是20℃时,______水中达到______状态时溶解氯化钠的质量为______;或者20℃时,______水中______可溶解氯化钠的质量为36 g。
(3)物质的溶解性是根据______℃时的溶解度规定的,当该温度下物质的溶解度______10 g时,为易溶物质。
a.固体的溶解度从几个要素进行规定?______
b.要比较两种物质的溶解度,需要注意什么问题?______
【答案】(1) 温度 100g 饱和 质量
(2) 100g 饱和 36g 100g 最多
(3) 20 大于 一定温度、溶剂质量100g、饱和溶液、溶解质量 温度相同
19、判断题:
(1)配制一定溶质质量分数溶液时,所得溶液的溶质质量分数偏小可能是烧杯用蒸馏水润洗过( )
(2)配制一定质量分数的氯化钠溶液,称量时天平右端忘垫称量纸会导致所配溶液的溶质质量分数偏小( )
(3)配制的100g16%的氯化钠溶液,装瓶时的标签为“NaCl溶液100g”( )
(4)实验室用6%的氯化钠溶液配制50g溶质质量分数为3%的氯化钠溶液,实验中玻璃棒的作用是防止液体飞溅( )
(5)配制一定质量分数的氯化钠溶液,量筒中本身有水会导致所配溶液的溶质质量分数偏小( )
【答案】(1)正确 (2)正确 (3)错误
(4)错误 (5)错误
20、城市中的生活用水是经自来水厂净化处理过的,但仍不建议直接饮用。因为中间经过管道、水箱等多个环节,容易被微生物、细菌、重金属污染,所以自来水一定要处理后才能饮用。
(1)我国生活饮用水卫生标准规定,饮用水(包括自来水)中含有铁、锰、铜、锌、钙等多种矿物质。这里的铁、锰、铜、锌、钙等是指____________(填“分子”、“原子”或“元素”)。
(2)检验自来水是硬水还是软水可以用___________。
(3)家庭中将自来水处理成能饮用的水的方法可以是_________。(任写一个)
(4)在自来水中加入洗涤剂可以除去衣物上的油污,这是利用了洗涤剂的________作用。
【答案】元素 肥皂水 加热煮沸 乳化
21、分别填写下列溶液中溶质和溶剂的名称:
(1)蔗糖溶液:溶质_______;溶剂________。
(2)碘酒(即碘的酒精溶液):溶质_______;溶剂________。
(3)乙醇的水溶液:溶质_______;溶剂________。
(4)0.9%的生理盐水:溶质_______;溶剂________。
【答案】(1) 蔗糖 水 (2) 碘 酒精
(3) 乙醇 水 (4) 氯化钠 水
22、交点的含义:
如图所示,P点表示______,此时两种物质的饱和溶液中一定相等的是______。
【答案】t3℃时甲、乙的溶解度相等 溶解度、溶质质量分数
23、实验室配制100g6%的氯化钠溶液,需要称取氯化钠___________g;用调好的托盘天平称量所需的氯化钠时,发现天平的指针偏向左盘,此时应该进行的操作是___________;将配好的氯化钠溶液倒入细口瓶时,有少量溶液溅出瓶外,所配溶液的溶质质量分数___________(选填“变大”、“变小”或“不变”)。
【答案】6 减少适量氯化钠固体 不变
三、综合应用题。
24、溶液与人们的生产、生活密切相关。
(1)向澄清石灰水中通入二氧化碳直至过量的全过程中,下列转变关系正确的是______(填字母)。
A.溶液、乳浊液、溶液 B.溶液、悬溶液、乳浊液
C.悬溶液、乳浊液、溶液 D.溶液、悬浊液、溶液
(2)在盛有水的烧杯中加入以下某种物质,在形成溶液的过程中,溶液温度明显升高的是______(填字母)。
A.烧碱 B.硝酸铵 C.氯化钠
(3)如图为甲、乙两种固体物质的溶解度曲线。
①溶解度随温度升高而增大的物质是______(填“甲”或“乙”)。
②将t1℃时的甲、乙两种物质的饱和溶液升温至t2℃,所得溶液中溶质的质量分数甲______乙(填“<”、“=”或“>”)
③在t2℃时,某同学向128.5g甲溶液中加入1.5g甲固体恰好得到t2℃时甲的饱和溶液,则原甲溶液溶质的质量分数为______(结果精确到0.1%)。
(4)t2℃时,同学们在实验室配制一定量10%的甲溶液(已知水的密度为1g/cm3)。
①用8.0g甲(不含结晶水)固体配制10%的甲溶液,需要水______mL。
②将配好的溶液倒入洁净的______中(填容器名称),盖好塞子贴上标签。
③下列操作会导致配制的甲溶液的溶质质量分数偏低的是______。
A.甲固体中含有杂质
B.烧杯未干燥直接用于配制溶液
C.用量筒量取水时采用俯视方法读数
【答案】D A 甲 > 22.2% 72 细口瓶 AB
四、实验题。
25、请你参与实验室配制一定溶质质量分数的硝酸钾溶液的实验,并进行实验过程的探究:
(1)计算:配制50g质量分数为10%的硝酸钾溶液,所需硝酸钾质量为______________ g,所需蒸馏水的体积为 _____________ mL(水的密度约为1g/mL).
(2)称量:分别在天平左右两盘放上纸片,调节平衡后,应_________ (填标号).
A 先在托盘上放置所需的砝码,再添加硝酸钾直至天平平衡.
B 先添加所需的硝酸钾,再添加砝码到所在的托盘直至天平平衡.
【探究一】:在称量过程中,某同学的称量操作如图所示,你认为该操作对本次实验的数据处理的正确性 ________ (填“有”或“没有”)影响,理由是___________ .
(3)量取:准确量取所需蒸馏水要用到的仪器是_________(选填图中的标号).
(4)溶解:将称量好的硝酸钾和蒸馏水混合溶解.
【探究二】:20℃时,将20mL质量分数为10%的硝酸钾溶液,稀释成质量分数为4%的硝酸钾溶液.从表中找出计算所需的数据为:_________ g/mL.
温度℃质量分数% 20 40 60
4 1.023 1.016 1.007
10 1.063 1.054 1.044
【答案】5 45 A 没有 称量过程中没有使用游码 BC 1.063
沪教版(全国)第6章:溶解现象
一、选择题。
1、把少量生活中的物质分别放入水中,充分搅拌,可以得到溶液的是( )
A.面粉 B.牛奶 C.蔗糖 D.植物油
2、常温下,在15 g氯化钠中加入60 g水,完全溶解后,溶液中氯化钠的质量分数为( )
A.15% B.20% C.25% D.33.3%
3、a、b、c三种不含结晶水的物质的溶解度曲线如图,下列说法正确的是( )
A.a的溶解度大于b的溶解度
B.将a的溶液由降温到,一定有晶体析出
C.时,50g的a溶于50g水,溶液的质量分数为
D.c的饱和溶液由降温到,溶液的质量分数不变
4、小芳在配制一定溶质质量分数的氯化钠溶液时,没有按照正确的称量氯化钠。量取水的操作规程进行操作(图示为小芳操作时的读数,其它操作都正确)。小芳实际配制的氯化钠溶液的溶质质量分数(水的密度为1g/cm3)约为
A.12.4% B.17.2% C.16.9% D.12.5%
5、把少量生活中的物质分别放入水中,充分搅拌,可以得到溶液的是( )
A.面粉 B.牛奶 C.蔗糖 D.植物油
6、下列关于溶液的说法中,正确的是( )
A.泥土加入水中,振荡后可以形成溶液
B.蔗糖溶液上半部分溶液的甜度低于下半部分溶液的甜度
C.氢氧化钠溶液能导电,因为溶液中有较多自由移动的离子
D.氯化钠饱和溶液中不能再溶解少量硝酸钾晶体
7、如图所示,向烧杯中加入某物质能使试管中的饱和石灰水变浑浊,该物质可能是( )
A.冰 B.硝酸铵固体 C.氯化钠固体 D.氢氧化钠固体
8、进行“一定溶质质量分数的氯化钠溶液的配制”实验活动常出现以下错误操作,其中不影响所配溶液浓度的是( )
A.氯化钠放在右盘 B.氯化钠洒出
C.俯视读数 D.配好的溶液装瓶时溅出
9、下列饮料中,不属于溶液的是( )
A.汽水 B.白酒 C.酸奶 D.苏打水
10、欲配制质量分数为6%的NaCl溶液,下列有关操作正确的是( )
A.取固体 B.称固体
C.量取水 D.溶解
11、下列有关饱和溶液与不饱和溶液的理解正确的是( )
A.饱和溶液就是浓溶液,不饱和溶液就是稀溶液
B.在一定条件下,饱和溶液和不饱和溶液之间不能实现转化
C.常温下,加热一杯饱和石灰水溶液会出现浑浊现象
D.饱和溶液就是在一定温度下,一定量的溶剂里不能溶解任何溶质的溶液
12、化学是一门以实验为基础的科学。下列仪器用途不正确的是( )
A.A. B.B C.C D.D
13、下列关于溶液特征的叙述中不正确的是( )
A.溶液都是澄清、透明、无色的
B.当外界条件不变时,溶液长期放置,溶质不会从溶液里分离出来
C.一种溶液中各部分的浓稀程度都是一样的
D.溶液是均一、稳定的混合物
14、分类是认识和研究物质及其变化的常用的科学方法,如物质可分为纯净物和混合物。下列物质属于化合物的是( )
A.盐酸 B.镁铝合金 C.氢氧化钠 D.氮气
15、生活中的下列现象不能说明气体溶解度随温度升高而减小的是( )
A.打开汽水瓶盖有大量泡沫逸出 B.烧水时水沸腾前有气泡逸出
C.喝下汽水打嗝 D.夏季黄昏,池塘里的鱼常浮出水面
二、填空题。
16、(1)小英同学从水库中取出浑浊水样进行实验。
①将水样静置,用如图装置进行过滤,其操作规范的是_____(填标号)。
a.用玻璃棒引流
b.滤纸边缘高出漏斗
c.漏斗末端颈尖未紧靠烧杯内壁
d.将滤纸湿润,使其紧贴漏斗内壁
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
②向过滤后所得水样中加入一定量活性炭,利用活性炭的___ 性除去杂质和臭味。
③在处理后的水样中加入一定量肥皂水,振荡,观察到泡沫较少,浮渣较多,说明该水样属于___ (填“硬水”或“软水”)。
④生活中常用___ (填“煮沸”“静置沉淀”或“过滤”)的方法降低水的硬度,并起到消毒杀菌的作用。
⑤为了人类的生存和发展,人类必须爱惜水。下列做法不利于保护水资源的是____(填标号)。
A 生活污水直接排放 B 提倡使用节水器具
C 工业上冷却水重复利用 D 园林浇灌用滴灌、喷灌
(2)①在盛有水的烧杯中加入一定量硝酸铵,形成溶液过程中,温度会____(填“升高”“降低”或“不变”)。
②用加了洗涤剂的水能洗掉餐具上的油污,这是利用了洗涤剂的____作用。
17、医疗上常用的生理盐水是质量分数为0.9%(密度近似为l g/cm3)的氯化钠溶液。500 mL这种生理盐水中含氯化钠_______g、水_____g。若以每分钟50滴(每20滴约为1 mL)的速率给病人静脉输液500 mL,约需_____分钟输完。
18、回答下列问题
(1)固体的溶解度指在一定______下,某固态物质在______溶剂里达到______状态所溶解的______。
(2)20℃时,氯化钠在水中的溶解度为36 g,意思是20℃时,______水中达到______状态时溶解氯化钠的质量为______;或者20℃时,______水中______可溶解氯化钠的质量为36 g。
(3)物质的溶解性是根据______℃时的溶解度规定的,当该温度下物质的溶解度______10 g时,为易溶物质。
a.固体的溶解度从几个要素进行规定?______
b.要比较两种物质的溶解度,需要注意什么问题?______
19、判断题:
(1)配制一定溶质质量分数溶液时,所得溶液的溶质质量分数偏小可能是烧杯用蒸馏水润洗过( )
(2)配制一定质量分数的氯化钠溶液,称量时天平右端忘垫称量纸会导致所配溶液的溶质质量分数偏小( )
(3)配制的100g16%的氯化钠溶液,装瓶时的标签为“NaCl溶液100g”( )
(4)实验室用6%的氯化钠溶液配制50g溶质质量分数为3%的氯化钠溶液,实验中玻璃棒的作用是防止液体飞溅( )
(5)配制一定质量分数的氯化钠溶液,量筒中本身有水会导致所配溶液的溶质质量分数偏小( )
20、城市中的生活用水是经自来水厂净化处理过的,但仍不建议直接饮用。因为中间经过管道、水箱等多个环节,容易被微生物、细菌、重金属污染,所以自来水一定要处理后才能饮用。
(1)我国生活饮用水卫生标准规定,饮用水(包括自来水)中含有铁、锰、铜、锌、钙等多种矿物质。这里的铁、锰、铜、锌、钙等是指____________(填“分子”、“原子”或“元素”)。
(2)检验自来水是硬水还是软水可以用___________。
(3)家庭中将自来水处理成能饮用的水的方法可以是_________。(任写一个)
(4)在自来水中加入洗涤剂可以除去衣物上的油污,这是利用了洗涤剂的________作用。
21、分别填写下列溶液中溶质和溶剂的名称:
(1)蔗糖溶液:溶质_______;溶剂________。
(2)碘酒(即碘的酒精溶液):溶质_______;溶剂________。
(3)乙醇的水溶液:溶质_______;溶剂________。
(4)0.9%的生理盐水:溶质_______;溶剂________。
22、交点的含义:
如图所示,P点表示______,此时两种物质的饱和溶液中一定相等的是______。
23、实验室配制100g6%的氯化钠溶液,需要称取氯化钠___________g;用调好的托盘天平称量所需的氯化钠时,发现天平的指针偏向左盘,此时应该进行的操作是___________;将配好的氯化钠溶液倒入细口瓶时,有少量溶液溅出瓶外,所配溶液的溶质质量分数___________(选填“变大”、“变小”或“不变”)。
三、综合应用题。
24、溶液与人们的生产、生活密切相关。
(1)向澄清石灰水中通入二氧化碳直至过量的全过程中,下列转变关系正确的是______(填字母)。
A.溶液、乳浊液、溶液 B.溶液、悬溶液、乳浊液
C.悬溶液、乳浊液、溶液 D.溶液、悬浊液、溶液
(2)在盛有水的烧杯中加入以下某种物质,在形成溶液的过程中,溶液温度明显升高的是______(填字母)。
A.烧碱 B.硝酸铵 C.氯化钠
(3)如图为甲、乙两种固体物质的溶解度曲线。
①溶解度随温度升高而增大的物质是______(填“甲”或“乙”)。
②将t1℃时的甲、乙两种物质的饱和溶液升温至t2℃,所得溶液中溶质的质量分数甲______乙(填“<”、“=”或“>”)
③在t2℃时,某同学向128.5g甲溶液中加入1.5g甲固体恰好得到t2℃时甲的饱和溶液,则原甲溶液溶质的质量分数为______(结果精确到0.1%)。
(4)t2℃时,同学们在实验室配制一定量10%的甲溶液(已知水的密度为1g/cm3)。
①用8.0g甲(不含结晶水)固体配制10%的甲溶液,需要水______mL。
②将配好的溶液倒入洁净的______中(填容器名称),盖好塞子贴上标签。
③下列操作会导致配制的甲溶液的溶质质量分数偏低的是______。
A.甲固体中含有杂质
B.烧杯未干燥直接用于配制溶液
C.用量筒量取水时采用俯视方法读数
四、实验题。
25、请你参与实验室配制一定溶质质量分数的硝酸钾溶液的实验,并进行实验过程的探究:
(1)计算:配制50g质量分数为10%的硝酸钾溶液,所需硝酸钾质量为______________ g,所需蒸馏水的体积为 _____________ mL(水的密度约为1g/mL).
(2)称量:分别在天平左右两盘放上纸片,调节平衡后,应_________ (填标号).
A 先在托盘上放置所需的砝码,再添加硝酸钾直至天平平衡.
B 先添加所需的硝酸钾,再添加砝码到所在的托盘直至天平平衡.
【探究一】:在称量过程中,某同学的称量操作如图所示,你认为该操作对本次实验的数据处理的正确性 ________ (填“有”或“没有”)影响,理由是___________ .
(3)量取:准确量取所需蒸馏水要用到的仪器是_________(选填图中的标号).
(4)溶解:将称量好的硝酸钾和蒸馏水混合溶解.
【探究二】:20℃时,将20mL质量分数为10%的硝酸钾溶液,稀释成质量分数为4%的硝酸钾溶液.从表中找出计算所需的数据为:_________ g/mL.
温度℃质量分数% 20 40 60
4 1.023 1.016 1.007
10 1.063 1.054 1.044
2022—2023学年化学沪教版(全国)九年级下册第6章:溶解现象 分层练习题含答案
沪教版(全国)第6章:溶解现象
一、选择题。
1、把少量生活中的物质分别放入水中,充分搅拌,可以得到溶液的是( )
A.面粉 B.牛奶 C.蔗糖 D.植物油
【答案】C
2、常温下,在15 g氯化钠中加入60 g水,完全溶解后,溶液中氯化钠的质量分数为( )
A.15% B.20% C.25% D.33.3%
【答案】B
3、a、b、c三种不含结晶水的物质的溶解度曲线如图,下列说法正确的是( )
A.a的溶解度大于b的溶解度
B.将a的溶液由降温到,一定有晶体析出
C.时,50g的a溶于50g水,溶液的质量分数为
D.c的饱和溶液由降温到,溶液的质量分数不变
【答案】D
4、小芳在配制一定溶质质量分数的氯化钠溶液时,没有按照正确的称量氯化钠。量取水的操作规程进行操作(图示为小芳操作时的读数,其它操作都正确)。小芳实际配制的氯化钠溶液的溶质质量分数(水的密度为1g/cm3)约为
A.12.4% B.17.2% C.16.9% D.12.5%
【答案】A
5、把少量生活中的物质分别放入水中,充分搅拌,可以得到溶液的是( )
A.面粉 B.牛奶 C.蔗糖 D.植物油
【答案】C
6、下列关于溶液的说法中,正确的是( )
A.泥土加入水中,振荡后可以形成溶液
B.蔗糖溶液上半部分溶液的甜度低于下半部分溶液的甜度
C.氢氧化钠溶液能导电,因为溶液中有较多自由移动的离子
D.氯化钠饱和溶液中不能再溶解少量硝酸钾晶体
【答案】C
7、如图所示,向烧杯中加入某物质能使试管中的饱和石灰水变浑浊,该物质可能是( )
A.冰 B.硝酸铵固体 C.氯化钠固体 D.氢氧化钠固体
【答案】D
8、进行“一定溶质质量分数的氯化钠溶液的配制”实验活动常出现以下错误操作,其中不影响所配溶液浓度的是( )
A.氯化钠放在右盘 B.氯化钠洒出
C.俯视读数 D.配好的溶液装瓶时溅出
【答案】D
9、下列饮料中,不属于溶液的是( )
A.汽水 B.白酒 C.酸奶 D.苏打水
【答案】C
10、欲配制质量分数为6%的NaCl溶液,下列有关操作正确的是( )
A.取固体 B.称固体
C.量取水 D.溶解
【答案】D
11、下列有关饱和溶液与不饱和溶液的理解正确的是( )
A.饱和溶液就是浓溶液,不饱和溶液就是稀溶液
B.在一定条件下,饱和溶液和不饱和溶液之间不能实现转化
C.常温下,加热一杯饱和石灰水溶液会出现浑浊现象
D.饱和溶液就是在一定温度下,一定量的溶剂里不能溶解任何溶质的溶液
【答案】C
12、化学是一门以实验为基础的科学。下列仪器用途不正确的是( )
A.A. B.B C.C D.D
【答案】A
13、下列关于溶液特征的叙述中不正确的是( )
A.溶液都是澄清、透明、无色的
B.当外界条件不变时,溶液长期放置,溶质不会从溶液里分离出来
C.一种溶液中各部分的浓稀程度都是一样的
D.溶液是均一、稳定的混合物
【答案】A
14、分类是认识和研究物质及其变化的常用的科学方法,如物质可分为纯净物和混合物。下列物质属于化合物的是( )
A.盐酸 B.镁铝合金 C.氢氧化钠 D.氮气
【答案】C
15、生活中的下列现象不能说明气体溶解度随温度升高而减小的是( )
A.打开汽水瓶盖有大量泡沫逸出 B.烧水时水沸腾前有气泡逸出
C.喝下汽水打嗝 D.夏季黄昏,池塘里的鱼常浮出水面
【答案】A
二、填空题。
16、(1)小英同学从水库中取出浑浊水样进行实验。
①将水样静置,用如图装置进行过滤,其操作规范的是_____(填标号)。
a.用玻璃棒引流
b.滤纸边缘高出漏斗
c.漏斗末端颈尖未紧靠烧杯内壁
d.将滤纸湿润,使其紧贴漏斗内壁
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
②向过滤后所得水样中加入一定量活性炭,利用活性炭的___ 性除去杂质和臭味。
③在处理后的水样中加入一定量肥皂水,振荡,观察到泡沫较少,浮渣较多,说明该水样属于___ (填“硬水”或“软水”)。
④生活中常用___ (填“煮沸”“静置沉淀”或“过滤”)的方法降低水的硬度,并起到消毒杀菌的作用。
⑤为了人类的生存和发展,人类必须爱惜水。下列做法不利于保护水资源的是____(填标号)。
A 生活污水直接排放 B 提倡使用节水器具
C 工业上冷却水重复利用 D 园林浇灌用滴灌、喷灌
(2)①在盛有水的烧杯中加入一定量硝酸铵,形成溶液过程中,温度会____(填“升高”“降低”或“不变”)。
②用加了洗涤剂的水能洗掉餐具上的油污,这是利用了洗涤剂的____作用。
【答案】(1)ad(多选、少选、错选不得分) 吸附 硬水 煮沸 A
(2)降低 乳化
17、医疗上常用的生理盐水是质量分数为0.9%(密度近似为l g/cm3)的氯化钠溶液。500 mL这种生理盐水中含氯化钠_______g、水_____g。若以每分钟50滴(每20滴约为1 mL)的速率给病人静脉输液500 mL,约需_____分钟输完。
【答案】4.5 495.5 200
18、回答下列问题
(1)固体的溶解度指在一定______下,某固态物质在______溶剂里达到______状态所溶解的______。
(2)20℃时,氯化钠在水中的溶解度为36 g,意思是20℃时,______水中达到______状态时溶解氯化钠的质量为______;或者20℃时,______水中______可溶解氯化钠的质量为36 g。
(3)物质的溶解性是根据______℃时的溶解度规定的,当该温度下物质的溶解度______10 g时,为易溶物质。
a.固体的溶解度从几个要素进行规定?______
b.要比较两种物质的溶解度,需要注意什么问题?______
【答案】(1) 温度 100g 饱和 质量
(2) 100g 饱和 36g 100g 最多
(3) 20 大于 一定温度、溶剂质量100g、饱和溶液、溶解质量 温度相同
19、判断题:
(1)配制一定溶质质量分数溶液时,所得溶液的溶质质量分数偏小可能是烧杯用蒸馏水润洗过( )
(2)配制一定质量分数的氯化钠溶液,称量时天平右端忘垫称量纸会导致所配溶液的溶质质量分数偏小( )
(3)配制的100g16%的氯化钠溶液,装瓶时的标签为“NaCl溶液100g”( )
(4)实验室用6%的氯化钠溶液配制50g溶质质量分数为3%的氯化钠溶液,实验中玻璃棒的作用是防止液体飞溅( )
(5)配制一定质量分数的氯化钠溶液,量筒中本身有水会导致所配溶液的溶质质量分数偏小( )
【答案】(1)正确 (2)正确 (3)错误
(4)错误 (5)错误
20、城市中的生活用水是经自来水厂净化处理过的,但仍不建议直接饮用。因为中间经过管道、水箱等多个环节,容易被微生物、细菌、重金属污染,所以自来水一定要处理后才能饮用。
(1)我国生活饮用水卫生标准规定,饮用水(包括自来水)中含有铁、锰、铜、锌、钙等多种矿物质。这里的铁、锰、铜、锌、钙等是指____________(填“分子”、“原子”或“元素”)。
(2)检验自来水是硬水还是软水可以用___________。
(3)家庭中将自来水处理成能饮用的水的方法可以是_________。(任写一个)
(4)在自来水中加入洗涤剂可以除去衣物上的油污,这是利用了洗涤剂的________作用。
【答案】元素 肥皂水 加热煮沸 乳化
21、分别填写下列溶液中溶质和溶剂的名称:
(1)蔗糖溶液:溶质_______;溶剂________。
(2)碘酒(即碘的酒精溶液):溶质_______;溶剂________。
(3)乙醇的水溶液:溶质_______;溶剂________。
(4)0.9%的生理盐水:溶质_______;溶剂________。
【答案】(1) 蔗糖 水 (2) 碘 酒精
(3) 乙醇 水 (4) 氯化钠 水
22、交点的含义:
如图所示,P点表示______,此时两种物质的饱和溶液中一定相等的是______。
【答案】t3℃时甲、乙的溶解度相等 溶解度、溶质质量分数
23、实验室配制100g6%的氯化钠溶液,需要称取氯化钠___________g;用调好的托盘天平称量所需的氯化钠时,发现天平的指针偏向左盘,此时应该进行的操作是___________;将配好的氯化钠溶液倒入细口瓶时,有少量溶液溅出瓶外,所配溶液的溶质质量分数___________(选填“变大”、“变小”或“不变”)。
【答案】6 减少适量氯化钠固体 不变
三、综合应用题。
24、溶液与人们的生产、生活密切相关。
(1)向澄清石灰水中通入二氧化碳直至过量的全过程中,下列转变关系正确的是______(填字母)。
A.溶液、乳浊液、溶液 B.溶液、悬溶液、乳浊液
C.悬溶液、乳浊液、溶液 D.溶液、悬浊液、溶液
(2)在盛有水的烧杯中加入以下某种物质,在形成溶液的过程中,溶液温度明显升高的是______(填字母)。
A.烧碱 B.硝酸铵 C.氯化钠
(3)如图为甲、乙两种固体物质的溶解度曲线。
①溶解度随温度升高而增大的物质是______(填“甲”或“乙”)。
②将t1℃时的甲、乙两种物质的饱和溶液升温至t2℃,所得溶液中溶质的质量分数甲______乙(填“<”、“=”或“>”)
③在t2℃时,某同学向128.5g甲溶液中加入1.5g甲固体恰好得到t2℃时甲的饱和溶液,则原甲溶液溶质的质量分数为______(结果精确到0.1%)。
(4)t2℃时,同学们在实验室配制一定量10%的甲溶液(已知水的密度为1g/cm3)。
①用8.0g甲(不含结晶水)固体配制10%的甲溶液,需要水______mL。
②将配好的溶液倒入洁净的______中(填容器名称),盖好塞子贴上标签。
③下列操作会导致配制的甲溶液的溶质质量分数偏低的是______。
A.甲固体中含有杂质
B.烧杯未干燥直接用于配制溶液
C.用量筒量取水时采用俯视方法读数
【答案】D A 甲 > 22.2% 72 细口瓶 AB
四、实验题。
25、请你参与实验室配制一定溶质质量分数的硝酸钾溶液的实验,并进行实验过程的探究:
(1)计算:配制50g质量分数为10%的硝酸钾溶液,所需硝酸钾质量为______________ g,所需蒸馏水的体积为 _____________ mL(水的密度约为1g/mL).
(2)称量:分别在天平左右两盘放上纸片,调节平衡后,应_________ (填标号).
A 先在托盘上放置所需的砝码,再添加硝酸钾直至天平平衡.
B 先添加所需的硝酸钾,再添加砝码到所在的托盘直至天平平衡.
【探究一】:在称量过程中,某同学的称量操作如图所示,你认为该操作对本次实验的数据处理的正确性 ________ (填“有”或“没有”)影响,理由是___________ .
(3)量取:准确量取所需蒸馏水要用到的仪器是_________(选填图中的标号).
(4)溶解:将称量好的硝酸钾和蒸馏水混合溶解.
【探究二】:20℃时,将20mL质量分数为10%的硝酸钾溶液,稀释成质量分数为4%的硝酸钾溶液.从表中找出计算所需的数据为:_________ g/mL.
温度℃质量分数% 20 40 60
4 1.023 1.016 1.007
10 1.063 1.054 1.044
【答案】5 45 A 没有 称量过程中没有使用游码 BC 1.063
