2022—2023学年化学沪教版(全国)九年级下册第7章 应用广泛的酸、碱、盐 培优练习(含答案)
文档属性
| 名称 | 2022—2023学年化学沪教版(全国)九年级下册第7章 应用广泛的酸、碱、盐 培优练习(含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 454.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-18 14:53:23 | ||
图片预览


文档简介
2022—2023学年化学沪教版(全国)九年级下册第7章 应用广泛的酸、碱、盐 培优练习含答案
沪教版(全国)第7章 应用广泛的酸、碱、盐
一、选择题。
1、生活中一些物质的pH如下:
物质 白醋 橘子汁 料酒 炉具清洁剂
pH 2~3 3~4 6~7 12~13
其中能使无色酚酞溶液变红的是( )
A.白醋 B.橘子汁 C.料酒 D.炉具清洁剂
2、把一枚无锈铁钉放在硫酸铜溶液中,一段时间后,可出现的是( )
A.溶液蓝色变浅直至无色 B.铁钉表面析出红色物质
C.产生大量气泡 D.溶液质量增加
3、下列物质名称与化学式对应关系错误的是( )
A.烧碱—NaOH B.纯碱—Na2CO3
C.小苏打—NaHCO3 D.熟石灰—CaO
4、下列有关实验的叙述错误的是( )
A.用pH试纸测定未知溶液的酸碱度时,应将pH试纸预先用水湿润
B.实验室用高锰酸钾制取O2,在实验结束时应先将导管移出水面,再停止加热
C.稀释浓硫酸时,要把浓硫酸缓缓注入盛有水的烧杯中,用玻璃棒引流并不断搅拌
D.在粗盐提纯实验中,待蒸发皿中出现较多固体时,停止加热,利用余热将滤液蒸干
5、饮食过量,胃酸会大量分泌,以致消化不良。为缓减该症状,下列药剂不适宜的是( )
A.氢氧化铝 B.氯化钠 C.碳酸镁 D.碳酸氢钠
6、下列溶液显碱性的是( )
A.酸雨 B.食醋 C.NaOH溶液 D.盐酸
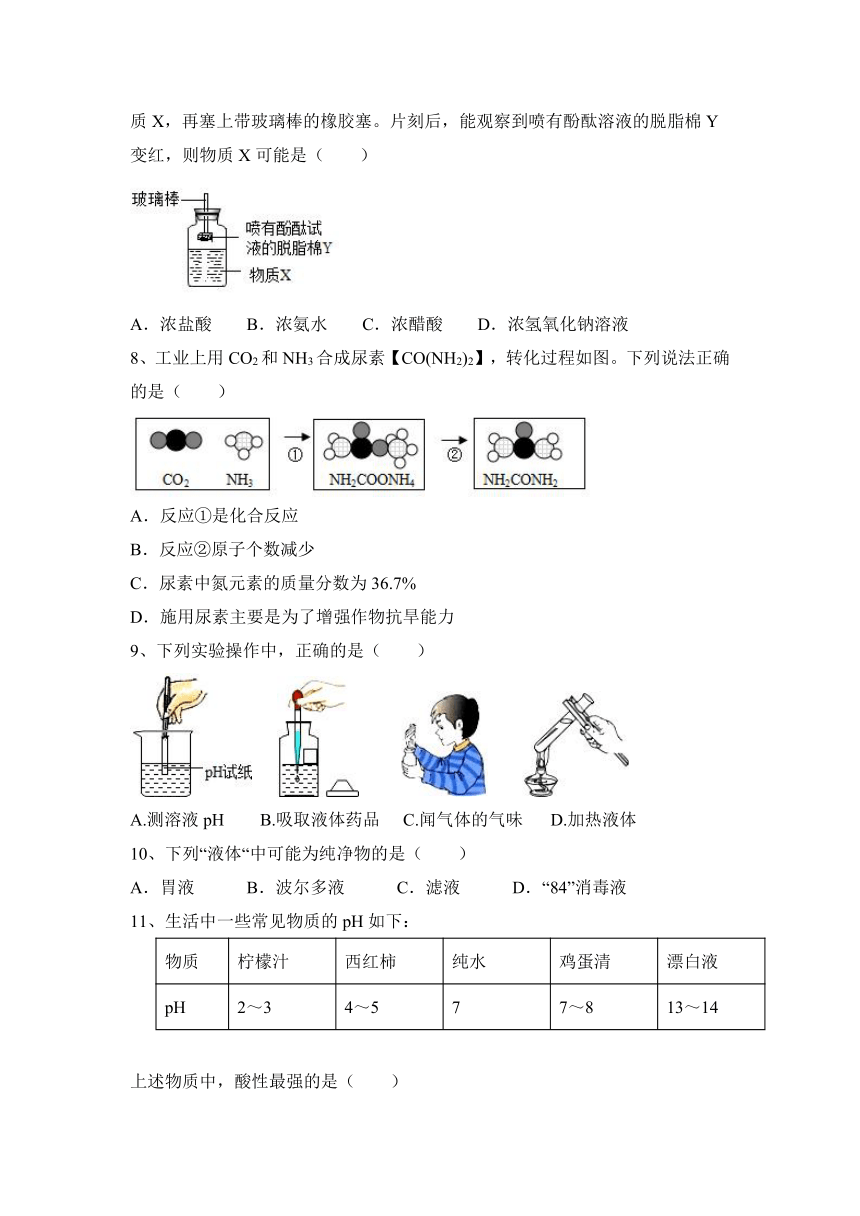
7、按如图所示装置,玻璃棒末端固定一团喷有酚酞溶液的脱脂棉Y。先加入物质X,再塞上带玻璃棒的橡胶塞。片刻后,能观察到喷有酚酞溶液的脱脂棉Y变红,则物质X可能是( )
A.浓盐酸 B.浓氨水 C.浓醋酸 D.浓氢氧化钠溶液
8、工业上用CO2和NH3合成尿素【CO(NH2)2】,转化过程如图。下列说法正确的是( )
A.反应①是化合反应
B.反应②原子个数减少
C.尿素中氮元素的质量分数为36.7%
D.施用尿素主要是为了增强作物抗旱能力
9、下列实验操作中,正确的是( )
A.测溶液pH B.吸取液体药品 C.闻气体的气味 D.加热液体
10、下列“液体“中可能为纯净物的是( )
A.胃液 B.波尔多液 C.滤液 D.“84”消毒液
11、生活中一些常见物质的pH如下:
物质 柠檬汁 西红柿 纯水 鸡蛋清 漂白液
pH 2~3 4~5 7 7~8 13~14
上述物质中,酸性最强的是( )
A.柠檬汁 B.西红柿 C.鸡蛋清 D.漂白液
12、下图是常见的几个实验操作,其中正确的是( )
A.加热液体药品 B.放置盛氢气的集气瓶
C.稀释浓硫酸 D.试管的洗涤
13、下列各组物质的溶液,不用其他试剂,仅通过观察和用组内溶液相互混合的方法,不能将其逐一鉴别出来的是( )
A. NaOH Ca(OH)2 HCl Na2CO3
B. KCl Ba(NO3)2 CuSO4 NaOH
C. AgNO3 HCl Na2CO3 CaCl2
D. Ba(OH)2 KCl Na2SO4 Na2CO3
14、某同学在化学晚会上用毛笔蘸取一种无色液体在一张白纸上书写了“化学魔术”四个字,然后再喷上另一种无色液体,白纸上立即出现了红色的“化学魔术”四个字。该同学所用的两种无色液体可能是( )
A.NaOH溶液、酚酞溶液 B.白醋、紫色石蕊试液
C.食盐水、酚酞溶液 D.“雪碧”饮料、酚酞溶液
15、某工厂排出的废水pH小于7,并含有较多的Cu2+,对环境污染严重。从环保及回收利用考虑,较切合实际的治理方案是应适量加入( )
A.烧碱和纯碱 B.盐酸和铁粉
C.生石灰和铁粉 D.熟石灰和金属银
二、填空题。
16、用pH试纸测定某溶液的pH时,应先将pH试纸放在_______上。用_______蘸取1滴待测液置于pH试纸上,然后将pH试纸的颜色与__________对照可以测得pH。
17、专家提示在日常防控新型冠状病毒中“84”消毒液可以使病毒灭活。
(1)“84"消毒液有效成分【NaClO】中氯元素的化合价为________。
(2)“84"消毒液的消毒原理为,生成的HClO(次氯酸)具有较强的杀菌作用。化学方程式中X的化学式为_________。
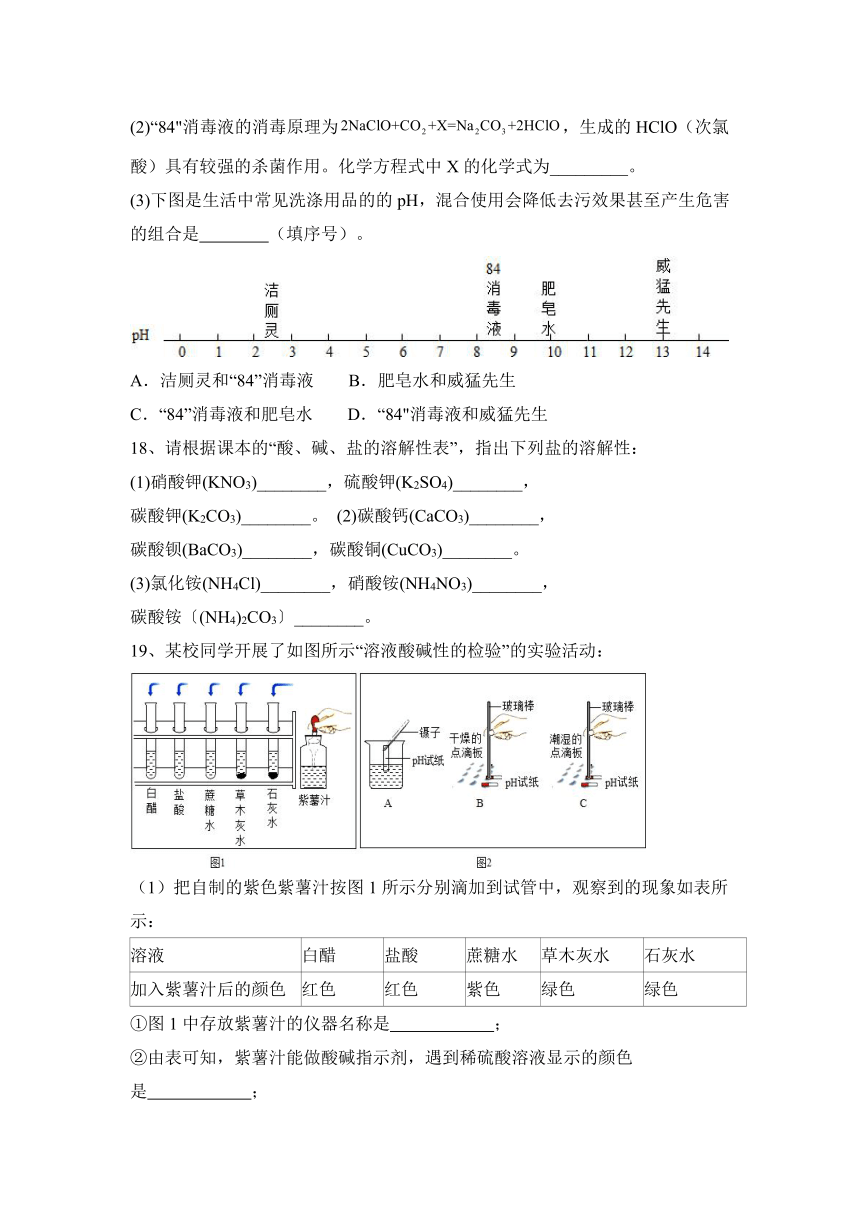
(3)下图是生活中常见洗涤用品的的pH,混合使用会降低去污效果甚至产生危害的组合是 (填序号)。
A.洁厕灵和“84”消毒液 B.肥皂水和威猛先生
C.“84”消毒液和肥皂水 D.“84"消毒液和威猛先生
18、请根据课本的“酸、碱、盐的溶解性表”,指出下列盐的溶解性:
(1)硝酸钾(KNO3)________,硫酸钾(K2SO4)________,
碳酸钾(K2CO3)________。 (2)碳酸钙(CaCO3)________,
碳酸钡(BaCO3)________,碳酸铜(CuCO3)________。
(3)氯化铵(NH4Cl)________,硝酸铵(NH4NO3)________,
碳酸铵〔(NH4)2CO3〕________。
19、某校同学开展了如图所示“溶液酸碱性的检验”的实验活动:
(1)把自制的紫色紫薯汁按图1所示分别滴加到试管中,观察到的现象如表所示:
溶液 白醋 盐酸 蔗糖水 草木灰水 石灰水
加入紫薯汁后的颜色 红色 红色 紫色 绿色 绿色
①图1中存放紫薯汁的仪器名称是 ;
②由表可知,紫薯汁能做酸碱指示剂,遇到稀硫酸溶液显示的颜色是 ;
(2)用pH试纸测定图1中部分溶液的酸碱度:草木灰水pH>7,属于 (填“酸性”、“中性”或“碱性”)溶液,白醋pH (填“>”、“<”或“=”)7;
(3)图2是三位同学分别测定某溶液酸碱度的操作示意图,其中正确的是
(填“A”、“B”或“C”,下同),可能导致被测溶液的pH数值发生改变的错误操作是 。
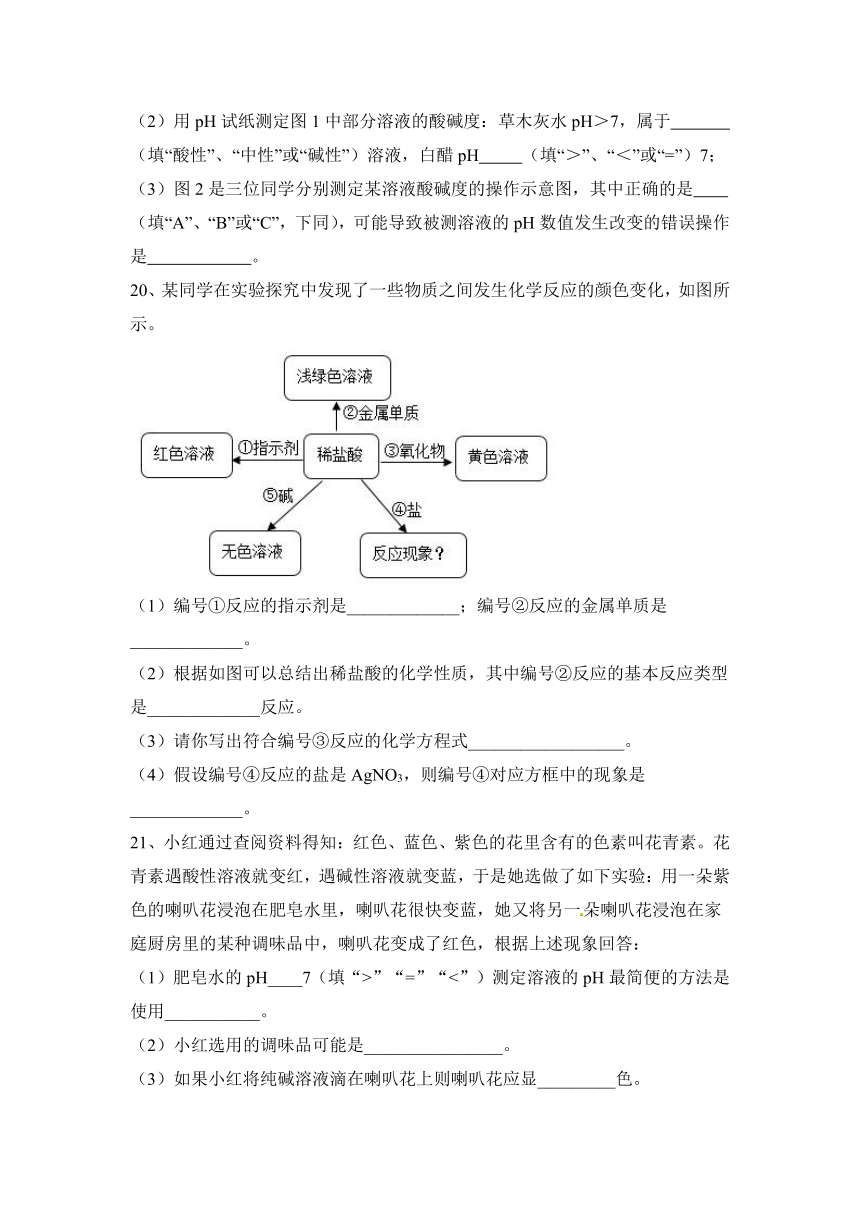
20、某同学在实验探究中发现了一些物质之间发生化学反应的颜色变化,如图所示。
(1)编号①反应的指示剂是_____________;编号②反应的金属单质是_____________。
(2)根据如图可以总结出稀盐酸的化学性质,其中编号②反应的基本反应类型是_____________反应。
(3)请你写出符合编号③反应的化学方程式__________________。
(4)假设编号④反应的盐是AgNO3,则编号④对应方框中的现象是_____________。
21、小红通过查阅资料得知:红色、蓝色、紫色的花里含有的色素叫花青素。花青素遇酸性溶液就变红,遇碱性溶液就变蓝,于是她选做了如下实验:用一朵紫色的喇叭花浸泡在肥皂水里,喇叭花很快变蓝,她又将另一朵喇叭花浸泡在家庭厨房里的某种调味品中,喇叭花变成了红色,根据上述现象回答:
(1)肥皂水的pH____7(填“>”“=”“<”)测定溶液的pH最简便的方法是使用___________。
(2)小红选用的调味品可能是________________。
(3)如果小红将纯碱溶液滴在喇叭花上则喇叭花应显_________色。
(4)喇叭花汁液的性质与化学实验室中常用的___________性质相似。
22、在高温条件下,甲、乙两种物质可以发生化学反应生成丙和丁。反应前后分子种类变化的微观示意图如下所示。
(1)一个甲分子由___________构成
(2)四种物质中,属于氧化物的是___________(填化学式)
(3)丙分子中两种原子的质量比是___________
(4)写出该反应的化学方程式___________,该反应___________(填“是”或“不是”)置换反应。
23、化肥对提高农作物的产量具有重要作用,但不合理使用会带来很多环境问题。
(1)化肥对环境造成______等不良影响。
(2)对合理使用化肥提出两点合理化建议分别是______、______。
三、实验题。
24、通过一年的化学学习,我们已经了解了常见金属在溶液中的活动性顺序.铬(Cr)是重要的金属材料,越来越受到人们的关注.某化学兴趣小组对Cr,Al,Cu的金属活动性顺序进行了探究,过程如下:
【提出假设】(1)对三种金属的活动性顺序提出的三种可能的假设:
a.Al>Cr>Cu b.Cr>Al>Cu c.___________
【设计实验】同温下,取大小相同的打磨过的金属薄片,分别投入到体积等浓度的足量稀盐酸中,观察现象,记录如下:
金属 Cr Al Cu
与盐酸反应发生现象 气泡产生缓慢,金属逐渐溶解 气泡产生激烈,金属迅速溶解 无气泡产生,金属无变化
【控制实验条件】(2)打磨三种金属发生的是___ 变化;上述实验使用等浓度的盐酸溶液的理由是___________________________________。
【得出结论】(3)原假设中正确的是______(填假设中a,b或c).写出铬(铬与盐酸反应后显+2价)与盐酸反应的化学方程式____________ 。
【结论应用】(4)根据探究结果,在CuCl2和AlCl3的混合液中加入一定量的金属铬,充分反应后过滤,向滤出的固体中加入盐酸,无明显现象,则滤液中一定含有的溶质是__________.
25、某小组同学设计的简易灭火器装置及原理示意图如下:
(1)图Ⅰ:将矿泉水瓶的瓶盖上用钉子扎几个小孔,“棒棒冰”瓶口剪成锯齿状。
图Ⅱ:向矿泉水瓶里加入一些碳酸氢钠固体,再向“棒棒冰”瓶里倒入一些盐酸,并将其放入矿泉水瓶中,拧紧瓶盖。装置正立时,“棒棒冰”瓶中的盐酸与放在矿泉水瓶中的碳酸氢钠固体不能接触,因而不能引发反应。
图Ⅲ:装置倾斜倒置时,①盐酸会与碳酸氢钠接触,反应产生大量的二氧化碳气体。②强大的气压使二氧化碳气体夹带液体一并从瓶盖上的小孔溢出,喷射在可燃物表面将火扑灭。
①中发生反应的化学方程式为________ 。
②将火扑灭依据的灭火原理是________ 。
(2)小组同学对反应后残留废液进行了如下探究。
【提出问题】残留废液中的溶质是什么?
【猜想假设】
猜想一: NaCl; 猜想二: NaCl、HCl; 猜想三:______ 。
【实验验证】
实验步骤 实验现象 实验结论
向盛有氢氧化铝固体的试管中,滴加残留废液 _______ 猜想二正确
该实验发生反应的化学方程式为_______ 。
【拓展应用】
若猜想二成立,残留废液直接倒入下水道会造成铸铁管道腐蚀,所以需将残留废液处理后再排放。请就如何处理残留废液提一条具体建议_____ 。
四、计算题。
26、钢是铁的合金。为测定某钢样中铁的质量分数,取11.4g钢样,向其中加入稀硫酸,产生氢气的质量与加入稀硫酸的质量关系如图所示(不考虑钢样中其它成分与稀硫酸的反应)。
(1)钢_____(填“是”或“不是”)金属材料。
(2)计算此钢样中铁的质量分数。
2022—2023学年化学沪教版(全国)九年级下册第7章 应用广泛的酸、碱、盐 培优练习含答案
沪教版(全国)第7章 应用广泛的酸、碱、盐
一、选择题。
1、生活中一些物质的pH如下:
物质 白醋 橘子汁 料酒 炉具清洁剂
pH 2~3 3~4 6~7 12~13
其中能使无色酚酞溶液变红的是( )
A.白醋 B.橘子汁 C.料酒 D.炉具清洁剂
【答案】D
2、把一枚无锈铁钉放在硫酸铜溶液中,一段时间后,可出现的是( )
A.溶液蓝色变浅直至无色 B.铁钉表面析出红色物质
C.产生大量气泡 D.溶液质量增加
【答案】B
3、下列物质名称与化学式对应关系错误的是( )
A.烧碱—NaOH B.纯碱—Na2CO3
C.小苏打—NaHCO3 D.熟石灰—CaO
【答案】D
4、下列有关实验的叙述错误的是( )
A.用pH试纸测定未知溶液的酸碱度时,应将pH试纸预先用水湿润
B.实验室用高锰酸钾制取O2,在实验结束时应先将导管移出水面,再停止加热
C.稀释浓硫酸时,要把浓硫酸缓缓注入盛有水的烧杯中,用玻璃棒引流并不断搅拌
D.在粗盐提纯实验中,待蒸发皿中出现较多固体时,停止加热,利用余热将滤液蒸干
【答案】A
5、饮食过量,胃酸会大量分泌,以致消化不良。为缓减该症状,下列药剂不适宜的是( )
A.氢氧化铝 B.氯化钠 C.碳酸镁 D.碳酸氢钠
【答案】B
6、下列溶液显碱性的是( )
A.酸雨 B.食醋 C.NaOH溶液 D.盐酸
【答案】C
7、按如图所示装置,玻璃棒末端固定一团喷有酚酞溶液的脱脂棉Y。先加入物质X,再塞上带玻璃棒的橡胶塞。片刻后,能观察到喷有酚酞溶液的脱脂棉Y变红,则物质X可能是( )
A.浓盐酸 B.浓氨水 C.浓醋酸 D.浓氢氧化钠溶液
【答案】B
8、工业上用CO2和NH3合成尿素【CO(NH2)2】,转化过程如图。下列说法正确的是( )
A.反应①是化合反应
B.反应②原子个数减少
C.尿素中氮元素的质量分数为36.7%
D.施用尿素主要是为了增强作物抗旱能力
【答案】A
9、下列实验操作中,正确的是( )
A.测溶液pH B.吸取液体药品 C.闻气体的气味 D.加热液体
【答案】C
10、下列“液体“中可能为纯净物的是( )
A.胃液 B.波尔多液 C.滤液 D.“84”消毒液
【答案】C
11、生活中一些常见物质的pH如下:
物质 柠檬汁 西红柿 纯水 鸡蛋清 漂白液
pH 2~3 4~5 7 7~8 13~14
上述物质中,酸性最强的是( )
A.柠檬汁 B.西红柿 C.鸡蛋清 D.漂白液
【答案】A
12、下图是常见的几个实验操作,其中正确的是( )
A.加热液体药品 B.放置盛氢气的集气瓶
C.稀释浓硫酸 D.试管的洗涤
【答案】D
13、下列各组物质的溶液,不用其他试剂,仅通过观察和用组内溶液相互混合的方法,不能将其逐一鉴别出来的是( )
A. NaOH Ca(OH)2 HCl Na2CO3
B. KCl Ba(NO3)2 CuSO4 NaOH
C. AgNO3 HCl Na2CO3 CaCl2
D. Ba(OH)2 KCl Na2SO4 Na2CO3
【答案】D
14、某同学在化学晚会上用毛笔蘸取一种无色液体在一张白纸上书写了“化学魔术”四个字,然后再喷上另一种无色液体,白纸上立即出现了红色的“化学魔术”四个字。该同学所用的两种无色液体可能是( )
A.NaOH溶液、酚酞溶液 B.白醋、紫色石蕊试液
C.食盐水、酚酞溶液 D.“雪碧”饮料、酚酞溶液
【答案】A
15、某工厂排出的废水pH小于7,并含有较多的Cu2+,对环境污染严重。从环保及回收利用考虑,较切合实际的治理方案是应适量加入( )
A.烧碱和纯碱 B.盐酸和铁粉
C.生石灰和铁粉 D.熟石灰和金属银
【答案】C
二、填空题。
16、用pH试纸测定某溶液的pH时,应先将pH试纸放在_______上。用_______蘸取1滴待测液置于pH试纸上,然后将pH试纸的颜色与__________对照可以测得pH。
【答案】表面皿 玻璃棒 比色卡
17、专家提示在日常防控新型冠状病毒中“84”消毒液可以使病毒灭活。
(1)“84"消毒液有效成分【NaClO】中氯元素的化合价为________。
(2)“84"消毒液的消毒原理为,生成的HClO(次氯酸)具有较强的杀菌作用。化学方程式中X的化学式为_________。
(3)下图是生活中常见洗涤用品的的pH,混合使用会降低去污效果甚至产生危害的组合是 (填序号)。
A.洁厕灵和“84”消毒液 B.肥皂水和威猛先生
C.“84”消毒液和肥皂水 D.“84"消毒液和威猛先生
【答案】(1)+1 (2)H2O (3)A
18、请根据课本的“酸、碱、盐的溶解性表”,指出下列盐的溶解性:
(1)硝酸钾(KNO3)________,硫酸钾(K2SO4)________,
碳酸钾(K2CO3)________。 (2)碳酸钙(CaCO3)________,
碳酸钡(BaCO3)________,碳酸铜(CuCO3)________。
(3)氯化铵(NH4Cl)________,硝酸铵(NH4NO3)________,
碳酸铵〔(NH4)2CO3〕________。
【答案】溶 溶 溶 不溶 不溶 不溶 溶 溶 溶
19、某校同学开展了如图所示“溶液酸碱性的检验”的实验活动:
(1)把自制的紫色紫薯汁按图1所示分别滴加到试管中,观察到的现象如表所示:
溶液 白醋 盐酸 蔗糖水 草木灰水 石灰水
加入紫薯汁后的颜色 红色 红色 紫色 绿色 绿色
①图1中存放紫薯汁的仪器名称是 ;
②由表可知,紫薯汁能做酸碱指示剂,遇到稀硫酸溶液显示的颜色是 ;
(2)用pH试纸测定图1中部分溶液的酸碱度:草木灰水pH>7,属于 (填“酸性”、“中性”或“碱性”)溶液,白醋pH (填“>”、“<”或“=”)7;
(3)图2是三位同学分别测定某溶液酸碱度的操作示意图,其中正确的是
(填“A”、“B”或“C”,下同),可能导致被测溶液的pH数值发生改变的错误操作是 。
【答案】(1)①滴瓶 ②红色 (2)碱性 < (3)B C
20、某同学在实验探究中发现了一些物质之间发生化学反应的颜色变化,如图所示。
(1)编号①反应的指示剂是_____________;编号②反应的金属单质是_____________。
(2)根据如图可以总结出稀盐酸的化学性质,其中编号②反应的基本反应类型是_____________反应。
(3)请你写出符合编号③反应的化学方程式__________________。
(4)假设编号④反应的盐是AgNO3,则编号④对应方框中的现象是_____________。
【答案】石蕊试剂 Fe 置换反应
产生白色沉淀
21、小红通过查阅资料得知:红色、蓝色、紫色的花里含有的色素叫花青素。花青素遇酸性溶液就变红,遇碱性溶液就变蓝,于是她选做了如下实验:用一朵紫色的喇叭花浸泡在肥皂水里,喇叭花很快变蓝,她又将另一朵喇叭花浸泡在家庭厨房里的某种调味品中,喇叭花变成了红色,根据上述现象回答:
(1)肥皂水的pH____7(填“>”“=”“<”)测定溶液的pH最简便的方法是使用___________。
(2)小红选用的调味品可能是________________。
(3)如果小红将纯碱溶液滴在喇叭花上则喇叭花应显_________色。
(4)喇叭花汁液的性质与化学实验室中常用的___________性质相似。
【答案】(1)> pH试纸测定 (2)食醋 (3)蓝 (4)紫色石蕊试液
22、在高温条件下,甲、乙两种物质可以发生化学反应生成丙和丁。反应前后分子种类变化的微观示意图如下所示。
(1)一个甲分子由___________构成
(2)四种物质中,属于氧化物的是___________(填化学式)
(3)丙分子中两种原子的质量比是___________
(4)写出该反应的化学方程式___________,该反应___________(填“是”或“不是”)置换反应。
【答案】(1)2个氢原子、1个氧原子 (2)H2O、CO (3)3:4
(4) H2O+CCO+H2 是
23、化肥对提高农作物的产量具有重要作用,但不合理使用会带来很多环境问题。
(1)化肥对环境造成______等不良影响。
(2)对合理使用化肥提出两点合理化建议分别是______、______。
【答案】土壤污染、水体污染(合理即可) 测土配方施肥 增加有机肥料的使用改善土壤结构
三、实验题。
24、通过一年的化学学习,我们已经了解了常见金属在溶液中的活动性顺序.铬(Cr)是重要的金属材料,越来越受到人们的关注.某化学兴趣小组对Cr,Al,Cu的金属活动性顺序进行了探究,过程如下:
【提出假设】(1)对三种金属的活动性顺序提出的三种可能的假设:
a.Al>Cr>Cu b.Cr>Al>Cu c.___________
【设计实验】同温下,取大小相同的打磨过的金属薄片,分别投入到体积等浓度的足量稀盐酸中,观察现象,记录如下:
金属 Cr Al Cu
与盐酸反应发生现象 气泡产生缓慢,金属逐渐溶解 气泡产生激烈,金属迅速溶解 无气泡产生,金属无变化
【控制实验条件】(2)打磨三种金属发生的是___ 变化;上述实验使用等浓度的盐酸溶液的理由是___________________________________。
【得出结论】(3)原假设中正确的是______(填假设中a,b或c).写出铬(铬与盐酸反应后显+2价)与盐酸反应的化学方程式____________ 。
【结论应用】(4)根据探究结果,在CuCl2和AlCl3的混合液中加入一定量的金属铬,充分反应后过滤,向滤出的固体中加入盐酸,无明显现象,则滤液中一定含有的溶质是__________.
【答案】 (1) Al>Cu>Cr
(2)物理 盐酸的浓度不同,会影响反应产生的气体的速率 a
(3)Cr+2HCl═CrCl2+H2↑ AlCl3、CrCl2
25、某小组同学设计的简易灭火器装置及原理示意图如下:
(1)图Ⅰ:将矿泉水瓶的瓶盖上用钉子扎几个小孔,“棒棒冰”瓶口剪成锯齿状。
图Ⅱ:向矿泉水瓶里加入一些碳酸氢钠固体,再向“棒棒冰”瓶里倒入一些盐酸,并将其放入矿泉水瓶中,拧紧瓶盖。装置正立时,“棒棒冰”瓶中的盐酸与放在矿泉水瓶中的碳酸氢钠固体不能接触,因而不能引发反应。
图Ⅲ:装置倾斜倒置时,①盐酸会与碳酸氢钠接触,反应产生大量的二氧化碳气体。②强大的气压使二氧化碳气体夹带液体一并从瓶盖上的小孔溢出,喷射在可燃物表面将火扑灭。
①中发生反应的化学方程式为________ 。
②将火扑灭依据的灭火原理是________ 。
(2)小组同学对反应后残留废液进行了如下探究。
【提出问题】残留废液中的溶质是什么?
【猜想假设】
猜想一: NaCl; 猜想二: NaCl、HCl; 猜想三:______ 。
【实验验证】
实验步骤 实验现象 实验结论
向盛有氢氧化铝固体的试管中,滴加残留废液 _______ 猜想二正确
该实验发生反应的化学方程式为_______ 。
【拓展应用】
若猜想二成立,残留废液直接倒入下水道会造成铸铁管道腐蚀,所以需将残留废液处理后再排放。请就如何处理残留废液提一条具体建议_____ 。
【答案】(1)
隔绝氧气和降低温度至可燃物的着火点以下
(2)NaCl、NaHCO3 白色固体逐渐溶解
蒸发结晶回收氯化钠(合理即可)
四、计算题。
26、钢是铁的合金。为测定某钢样中铁的质量分数,取11.4g钢样,向其中加入稀硫酸,产生氢气的质量与加入稀硫酸的质量关系如图所示(不考虑钢样中其它成分与稀硫酸的反应)。
(1)钢_____(填“是”或“不是”)金属材料。
(2)计算此钢样中铁的质量分数。
【答案】(1)是 (2)98%
沪教版(全国)第7章 应用广泛的酸、碱、盐
一、选择题。
1、生活中一些物质的pH如下:
物质 白醋 橘子汁 料酒 炉具清洁剂
pH 2~3 3~4 6~7 12~13
其中能使无色酚酞溶液变红的是( )
A.白醋 B.橘子汁 C.料酒 D.炉具清洁剂
2、把一枚无锈铁钉放在硫酸铜溶液中,一段时间后,可出现的是( )
A.溶液蓝色变浅直至无色 B.铁钉表面析出红色物质
C.产生大量气泡 D.溶液质量增加
3、下列物质名称与化学式对应关系错误的是( )
A.烧碱—NaOH B.纯碱—Na2CO3
C.小苏打—NaHCO3 D.熟石灰—CaO
4、下列有关实验的叙述错误的是( )
A.用pH试纸测定未知溶液的酸碱度时,应将pH试纸预先用水湿润
B.实验室用高锰酸钾制取O2,在实验结束时应先将导管移出水面,再停止加热
C.稀释浓硫酸时,要把浓硫酸缓缓注入盛有水的烧杯中,用玻璃棒引流并不断搅拌
D.在粗盐提纯实验中,待蒸发皿中出现较多固体时,停止加热,利用余热将滤液蒸干
5、饮食过量,胃酸会大量分泌,以致消化不良。为缓减该症状,下列药剂不适宜的是( )
A.氢氧化铝 B.氯化钠 C.碳酸镁 D.碳酸氢钠
6、下列溶液显碱性的是( )
A.酸雨 B.食醋 C.NaOH溶液 D.盐酸
7、按如图所示装置,玻璃棒末端固定一团喷有酚酞溶液的脱脂棉Y。先加入物质X,再塞上带玻璃棒的橡胶塞。片刻后,能观察到喷有酚酞溶液的脱脂棉Y变红,则物质X可能是( )
A.浓盐酸 B.浓氨水 C.浓醋酸 D.浓氢氧化钠溶液
8、工业上用CO2和NH3合成尿素【CO(NH2)2】,转化过程如图。下列说法正确的是( )
A.反应①是化合反应
B.反应②原子个数减少
C.尿素中氮元素的质量分数为36.7%
D.施用尿素主要是为了增强作物抗旱能力
9、下列实验操作中,正确的是( )
A.测溶液pH B.吸取液体药品 C.闻气体的气味 D.加热液体
10、下列“液体“中可能为纯净物的是( )
A.胃液 B.波尔多液 C.滤液 D.“84”消毒液
11、生活中一些常见物质的pH如下:
物质 柠檬汁 西红柿 纯水 鸡蛋清 漂白液
pH 2~3 4~5 7 7~8 13~14
上述物质中,酸性最强的是( )
A.柠檬汁 B.西红柿 C.鸡蛋清 D.漂白液
12、下图是常见的几个实验操作,其中正确的是( )
A.加热液体药品 B.放置盛氢气的集气瓶
C.稀释浓硫酸 D.试管的洗涤
13、下列各组物质的溶液,不用其他试剂,仅通过观察和用组内溶液相互混合的方法,不能将其逐一鉴别出来的是( )
A. NaOH Ca(OH)2 HCl Na2CO3
B. KCl Ba(NO3)2 CuSO4 NaOH
C. AgNO3 HCl Na2CO3 CaCl2
D. Ba(OH)2 KCl Na2SO4 Na2CO3
14、某同学在化学晚会上用毛笔蘸取一种无色液体在一张白纸上书写了“化学魔术”四个字,然后再喷上另一种无色液体,白纸上立即出现了红色的“化学魔术”四个字。该同学所用的两种无色液体可能是( )
A.NaOH溶液、酚酞溶液 B.白醋、紫色石蕊试液
C.食盐水、酚酞溶液 D.“雪碧”饮料、酚酞溶液
15、某工厂排出的废水pH小于7,并含有较多的Cu2+,对环境污染严重。从环保及回收利用考虑,较切合实际的治理方案是应适量加入( )
A.烧碱和纯碱 B.盐酸和铁粉
C.生石灰和铁粉 D.熟石灰和金属银
二、填空题。
16、用pH试纸测定某溶液的pH时,应先将pH试纸放在_______上。用_______蘸取1滴待测液置于pH试纸上,然后将pH试纸的颜色与__________对照可以测得pH。
17、专家提示在日常防控新型冠状病毒中“84”消毒液可以使病毒灭活。
(1)“84"消毒液有效成分【NaClO】中氯元素的化合价为________。
(2)“84"消毒液的消毒原理为,生成的HClO(次氯酸)具有较强的杀菌作用。化学方程式中X的化学式为_________。
(3)下图是生活中常见洗涤用品的的pH,混合使用会降低去污效果甚至产生危害的组合是 (填序号)。
A.洁厕灵和“84”消毒液 B.肥皂水和威猛先生
C.“84”消毒液和肥皂水 D.“84"消毒液和威猛先生
18、请根据课本的“酸、碱、盐的溶解性表”,指出下列盐的溶解性:
(1)硝酸钾(KNO3)________,硫酸钾(K2SO4)________,
碳酸钾(K2CO3)________。 (2)碳酸钙(CaCO3)________,
碳酸钡(BaCO3)________,碳酸铜(CuCO3)________。
(3)氯化铵(NH4Cl)________,硝酸铵(NH4NO3)________,
碳酸铵〔(NH4)2CO3〕________。
19、某校同学开展了如图所示“溶液酸碱性的检验”的实验活动:
(1)把自制的紫色紫薯汁按图1所示分别滴加到试管中,观察到的现象如表所示:
溶液 白醋 盐酸 蔗糖水 草木灰水 石灰水
加入紫薯汁后的颜色 红色 红色 紫色 绿色 绿色
①图1中存放紫薯汁的仪器名称是 ;
②由表可知,紫薯汁能做酸碱指示剂,遇到稀硫酸溶液显示的颜色是 ;
(2)用pH试纸测定图1中部分溶液的酸碱度:草木灰水pH>7,属于 (填“酸性”、“中性”或“碱性”)溶液,白醋pH (填“>”、“<”或“=”)7;
(3)图2是三位同学分别测定某溶液酸碱度的操作示意图,其中正确的是
(填“A”、“B”或“C”,下同),可能导致被测溶液的pH数值发生改变的错误操作是 。
20、某同学在实验探究中发现了一些物质之间发生化学反应的颜色变化,如图所示。
(1)编号①反应的指示剂是_____________;编号②反应的金属单质是_____________。
(2)根据如图可以总结出稀盐酸的化学性质,其中编号②反应的基本反应类型是_____________反应。
(3)请你写出符合编号③反应的化学方程式__________________。
(4)假设编号④反应的盐是AgNO3,则编号④对应方框中的现象是_____________。
21、小红通过查阅资料得知:红色、蓝色、紫色的花里含有的色素叫花青素。花青素遇酸性溶液就变红,遇碱性溶液就变蓝,于是她选做了如下实验:用一朵紫色的喇叭花浸泡在肥皂水里,喇叭花很快变蓝,她又将另一朵喇叭花浸泡在家庭厨房里的某种调味品中,喇叭花变成了红色,根据上述现象回答:
(1)肥皂水的pH____7(填“>”“=”“<”)测定溶液的pH最简便的方法是使用___________。
(2)小红选用的调味品可能是________________。
(3)如果小红将纯碱溶液滴在喇叭花上则喇叭花应显_________色。
(4)喇叭花汁液的性质与化学实验室中常用的___________性质相似。
22、在高温条件下,甲、乙两种物质可以发生化学反应生成丙和丁。反应前后分子种类变化的微观示意图如下所示。
(1)一个甲分子由___________构成
(2)四种物质中,属于氧化物的是___________(填化学式)
(3)丙分子中两种原子的质量比是___________
(4)写出该反应的化学方程式___________,该反应___________(填“是”或“不是”)置换反应。
23、化肥对提高农作物的产量具有重要作用,但不合理使用会带来很多环境问题。
(1)化肥对环境造成______等不良影响。
(2)对合理使用化肥提出两点合理化建议分别是______、______。
三、实验题。
24、通过一年的化学学习,我们已经了解了常见金属在溶液中的活动性顺序.铬(Cr)是重要的金属材料,越来越受到人们的关注.某化学兴趣小组对Cr,Al,Cu的金属活动性顺序进行了探究,过程如下:
【提出假设】(1)对三种金属的活动性顺序提出的三种可能的假设:
a.Al>Cr>Cu b.Cr>Al>Cu c.___________
【设计实验】同温下,取大小相同的打磨过的金属薄片,分别投入到体积等浓度的足量稀盐酸中,观察现象,记录如下:
金属 Cr Al Cu
与盐酸反应发生现象 气泡产生缓慢,金属逐渐溶解 气泡产生激烈,金属迅速溶解 无气泡产生,金属无变化
【控制实验条件】(2)打磨三种金属发生的是___ 变化;上述实验使用等浓度的盐酸溶液的理由是___________________________________。
【得出结论】(3)原假设中正确的是______(填假设中a,b或c).写出铬(铬与盐酸反应后显+2价)与盐酸反应的化学方程式____________ 。
【结论应用】(4)根据探究结果,在CuCl2和AlCl3的混合液中加入一定量的金属铬,充分反应后过滤,向滤出的固体中加入盐酸,无明显现象,则滤液中一定含有的溶质是__________.
25、某小组同学设计的简易灭火器装置及原理示意图如下:
(1)图Ⅰ:将矿泉水瓶的瓶盖上用钉子扎几个小孔,“棒棒冰”瓶口剪成锯齿状。
图Ⅱ:向矿泉水瓶里加入一些碳酸氢钠固体,再向“棒棒冰”瓶里倒入一些盐酸,并将其放入矿泉水瓶中,拧紧瓶盖。装置正立时,“棒棒冰”瓶中的盐酸与放在矿泉水瓶中的碳酸氢钠固体不能接触,因而不能引发反应。
图Ⅲ:装置倾斜倒置时,①盐酸会与碳酸氢钠接触,反应产生大量的二氧化碳气体。②强大的气压使二氧化碳气体夹带液体一并从瓶盖上的小孔溢出,喷射在可燃物表面将火扑灭。
①中发生反应的化学方程式为________ 。
②将火扑灭依据的灭火原理是________ 。
(2)小组同学对反应后残留废液进行了如下探究。
【提出问题】残留废液中的溶质是什么?
【猜想假设】
猜想一: NaCl; 猜想二: NaCl、HCl; 猜想三:______ 。
【实验验证】
实验步骤 实验现象 实验结论
向盛有氢氧化铝固体的试管中,滴加残留废液 _______ 猜想二正确
该实验发生反应的化学方程式为_______ 。
【拓展应用】
若猜想二成立,残留废液直接倒入下水道会造成铸铁管道腐蚀,所以需将残留废液处理后再排放。请就如何处理残留废液提一条具体建议_____ 。
四、计算题。
26、钢是铁的合金。为测定某钢样中铁的质量分数,取11.4g钢样,向其中加入稀硫酸,产生氢气的质量与加入稀硫酸的质量关系如图所示(不考虑钢样中其它成分与稀硫酸的反应)。
(1)钢_____(填“是”或“不是”)金属材料。
(2)计算此钢样中铁的质量分数。
2022—2023学年化学沪教版(全国)九年级下册第7章 应用广泛的酸、碱、盐 培优练习含答案
沪教版(全国)第7章 应用广泛的酸、碱、盐
一、选择题。
1、生活中一些物质的pH如下:
物质 白醋 橘子汁 料酒 炉具清洁剂
pH 2~3 3~4 6~7 12~13
其中能使无色酚酞溶液变红的是( )
A.白醋 B.橘子汁 C.料酒 D.炉具清洁剂
【答案】D
2、把一枚无锈铁钉放在硫酸铜溶液中,一段时间后,可出现的是( )
A.溶液蓝色变浅直至无色 B.铁钉表面析出红色物质
C.产生大量气泡 D.溶液质量增加
【答案】B
3、下列物质名称与化学式对应关系错误的是( )
A.烧碱—NaOH B.纯碱—Na2CO3
C.小苏打—NaHCO3 D.熟石灰—CaO
【答案】D
4、下列有关实验的叙述错误的是( )
A.用pH试纸测定未知溶液的酸碱度时,应将pH试纸预先用水湿润
B.实验室用高锰酸钾制取O2,在实验结束时应先将导管移出水面,再停止加热
C.稀释浓硫酸时,要把浓硫酸缓缓注入盛有水的烧杯中,用玻璃棒引流并不断搅拌
D.在粗盐提纯实验中,待蒸发皿中出现较多固体时,停止加热,利用余热将滤液蒸干
【答案】A
5、饮食过量,胃酸会大量分泌,以致消化不良。为缓减该症状,下列药剂不适宜的是( )
A.氢氧化铝 B.氯化钠 C.碳酸镁 D.碳酸氢钠
【答案】B
6、下列溶液显碱性的是( )
A.酸雨 B.食醋 C.NaOH溶液 D.盐酸
【答案】C
7、按如图所示装置,玻璃棒末端固定一团喷有酚酞溶液的脱脂棉Y。先加入物质X,再塞上带玻璃棒的橡胶塞。片刻后,能观察到喷有酚酞溶液的脱脂棉Y变红,则物质X可能是( )
A.浓盐酸 B.浓氨水 C.浓醋酸 D.浓氢氧化钠溶液
【答案】B
8、工业上用CO2和NH3合成尿素【CO(NH2)2】,转化过程如图。下列说法正确的是( )
A.反应①是化合反应
B.反应②原子个数减少
C.尿素中氮元素的质量分数为36.7%
D.施用尿素主要是为了增强作物抗旱能力
【答案】A
9、下列实验操作中,正确的是( )
A.测溶液pH B.吸取液体药品 C.闻气体的气味 D.加热液体
【答案】C
10、下列“液体“中可能为纯净物的是( )
A.胃液 B.波尔多液 C.滤液 D.“84”消毒液
【答案】C
11、生活中一些常见物质的pH如下:
物质 柠檬汁 西红柿 纯水 鸡蛋清 漂白液
pH 2~3 4~5 7 7~8 13~14
上述物质中,酸性最强的是( )
A.柠檬汁 B.西红柿 C.鸡蛋清 D.漂白液
【答案】A
12、下图是常见的几个实验操作,其中正确的是( )
A.加热液体药品 B.放置盛氢气的集气瓶
C.稀释浓硫酸 D.试管的洗涤
【答案】D
13、下列各组物质的溶液,不用其他试剂,仅通过观察和用组内溶液相互混合的方法,不能将其逐一鉴别出来的是( )
A. NaOH Ca(OH)2 HCl Na2CO3
B. KCl Ba(NO3)2 CuSO4 NaOH
C. AgNO3 HCl Na2CO3 CaCl2
D. Ba(OH)2 KCl Na2SO4 Na2CO3
【答案】D
14、某同学在化学晚会上用毛笔蘸取一种无色液体在一张白纸上书写了“化学魔术”四个字,然后再喷上另一种无色液体,白纸上立即出现了红色的“化学魔术”四个字。该同学所用的两种无色液体可能是( )
A.NaOH溶液、酚酞溶液 B.白醋、紫色石蕊试液
C.食盐水、酚酞溶液 D.“雪碧”饮料、酚酞溶液
【答案】A
15、某工厂排出的废水pH小于7,并含有较多的Cu2+,对环境污染严重。从环保及回收利用考虑,较切合实际的治理方案是应适量加入( )
A.烧碱和纯碱 B.盐酸和铁粉
C.生石灰和铁粉 D.熟石灰和金属银
【答案】C
二、填空题。
16、用pH试纸测定某溶液的pH时,应先将pH试纸放在_______上。用_______蘸取1滴待测液置于pH试纸上,然后将pH试纸的颜色与__________对照可以测得pH。
【答案】表面皿 玻璃棒 比色卡
17、专家提示在日常防控新型冠状病毒中“84”消毒液可以使病毒灭活。
(1)“84"消毒液有效成分【NaClO】中氯元素的化合价为________。
(2)“84"消毒液的消毒原理为,生成的HClO(次氯酸)具有较强的杀菌作用。化学方程式中X的化学式为_________。
(3)下图是生活中常见洗涤用品的的pH,混合使用会降低去污效果甚至产生危害的组合是 (填序号)。
A.洁厕灵和“84”消毒液 B.肥皂水和威猛先生
C.“84”消毒液和肥皂水 D.“84"消毒液和威猛先生
【答案】(1)+1 (2)H2O (3)A
18、请根据课本的“酸、碱、盐的溶解性表”,指出下列盐的溶解性:
(1)硝酸钾(KNO3)________,硫酸钾(K2SO4)________,
碳酸钾(K2CO3)________。 (2)碳酸钙(CaCO3)________,
碳酸钡(BaCO3)________,碳酸铜(CuCO3)________。
(3)氯化铵(NH4Cl)________,硝酸铵(NH4NO3)________,
碳酸铵〔(NH4)2CO3〕________。
【答案】溶 溶 溶 不溶 不溶 不溶 溶 溶 溶
19、某校同学开展了如图所示“溶液酸碱性的检验”的实验活动:
(1)把自制的紫色紫薯汁按图1所示分别滴加到试管中,观察到的现象如表所示:
溶液 白醋 盐酸 蔗糖水 草木灰水 石灰水
加入紫薯汁后的颜色 红色 红色 紫色 绿色 绿色
①图1中存放紫薯汁的仪器名称是 ;
②由表可知,紫薯汁能做酸碱指示剂,遇到稀硫酸溶液显示的颜色是 ;
(2)用pH试纸测定图1中部分溶液的酸碱度:草木灰水pH>7,属于 (填“酸性”、“中性”或“碱性”)溶液,白醋pH (填“>”、“<”或“=”)7;
(3)图2是三位同学分别测定某溶液酸碱度的操作示意图,其中正确的是
(填“A”、“B”或“C”,下同),可能导致被测溶液的pH数值发生改变的错误操作是 。
【答案】(1)①滴瓶 ②红色 (2)碱性 < (3)B C
20、某同学在实验探究中发现了一些物质之间发生化学反应的颜色变化,如图所示。
(1)编号①反应的指示剂是_____________;编号②反应的金属单质是_____________。
(2)根据如图可以总结出稀盐酸的化学性质,其中编号②反应的基本反应类型是_____________反应。
(3)请你写出符合编号③反应的化学方程式__________________。
(4)假设编号④反应的盐是AgNO3,则编号④对应方框中的现象是_____________。
【答案】石蕊试剂 Fe 置换反应
产生白色沉淀
21、小红通过查阅资料得知:红色、蓝色、紫色的花里含有的色素叫花青素。花青素遇酸性溶液就变红,遇碱性溶液就变蓝,于是她选做了如下实验:用一朵紫色的喇叭花浸泡在肥皂水里,喇叭花很快变蓝,她又将另一朵喇叭花浸泡在家庭厨房里的某种调味品中,喇叭花变成了红色,根据上述现象回答:
(1)肥皂水的pH____7(填“>”“=”“<”)测定溶液的pH最简便的方法是使用___________。
(2)小红选用的调味品可能是________________。
(3)如果小红将纯碱溶液滴在喇叭花上则喇叭花应显_________色。
(4)喇叭花汁液的性质与化学实验室中常用的___________性质相似。
【答案】(1)> pH试纸测定 (2)食醋 (3)蓝 (4)紫色石蕊试液
22、在高温条件下,甲、乙两种物质可以发生化学反应生成丙和丁。反应前后分子种类变化的微观示意图如下所示。
(1)一个甲分子由___________构成
(2)四种物质中,属于氧化物的是___________(填化学式)
(3)丙分子中两种原子的质量比是___________
(4)写出该反应的化学方程式___________,该反应___________(填“是”或“不是”)置换反应。
【答案】(1)2个氢原子、1个氧原子 (2)H2O、CO (3)3:4
(4) H2O+CCO+H2 是
23、化肥对提高农作物的产量具有重要作用,但不合理使用会带来很多环境问题。
(1)化肥对环境造成______等不良影响。
(2)对合理使用化肥提出两点合理化建议分别是______、______。
【答案】土壤污染、水体污染(合理即可) 测土配方施肥 增加有机肥料的使用改善土壤结构
三、实验题。
24、通过一年的化学学习,我们已经了解了常见金属在溶液中的活动性顺序.铬(Cr)是重要的金属材料,越来越受到人们的关注.某化学兴趣小组对Cr,Al,Cu的金属活动性顺序进行了探究,过程如下:
【提出假设】(1)对三种金属的活动性顺序提出的三种可能的假设:
a.Al>Cr>Cu b.Cr>Al>Cu c.___________
【设计实验】同温下,取大小相同的打磨过的金属薄片,分别投入到体积等浓度的足量稀盐酸中,观察现象,记录如下:
金属 Cr Al Cu
与盐酸反应发生现象 气泡产生缓慢,金属逐渐溶解 气泡产生激烈,金属迅速溶解 无气泡产生,金属无变化
【控制实验条件】(2)打磨三种金属发生的是___ 变化;上述实验使用等浓度的盐酸溶液的理由是___________________________________。
【得出结论】(3)原假设中正确的是______(填假设中a,b或c).写出铬(铬与盐酸反应后显+2价)与盐酸反应的化学方程式____________ 。
【结论应用】(4)根据探究结果,在CuCl2和AlCl3的混合液中加入一定量的金属铬,充分反应后过滤,向滤出的固体中加入盐酸,无明显现象,则滤液中一定含有的溶质是__________.
【答案】 (1) Al>Cu>Cr
(2)物理 盐酸的浓度不同,会影响反应产生的气体的速率 a
(3)Cr+2HCl═CrCl2+H2↑ AlCl3、CrCl2
25、某小组同学设计的简易灭火器装置及原理示意图如下:
(1)图Ⅰ:将矿泉水瓶的瓶盖上用钉子扎几个小孔,“棒棒冰”瓶口剪成锯齿状。
图Ⅱ:向矿泉水瓶里加入一些碳酸氢钠固体,再向“棒棒冰”瓶里倒入一些盐酸,并将其放入矿泉水瓶中,拧紧瓶盖。装置正立时,“棒棒冰”瓶中的盐酸与放在矿泉水瓶中的碳酸氢钠固体不能接触,因而不能引发反应。
图Ⅲ:装置倾斜倒置时,①盐酸会与碳酸氢钠接触,反应产生大量的二氧化碳气体。②强大的气压使二氧化碳气体夹带液体一并从瓶盖上的小孔溢出,喷射在可燃物表面将火扑灭。
①中发生反应的化学方程式为________ 。
②将火扑灭依据的灭火原理是________ 。
(2)小组同学对反应后残留废液进行了如下探究。
【提出问题】残留废液中的溶质是什么?
【猜想假设】
猜想一: NaCl; 猜想二: NaCl、HCl; 猜想三:______ 。
【实验验证】
实验步骤 实验现象 实验结论
向盛有氢氧化铝固体的试管中,滴加残留废液 _______ 猜想二正确
该实验发生反应的化学方程式为_______ 。
【拓展应用】
若猜想二成立,残留废液直接倒入下水道会造成铸铁管道腐蚀,所以需将残留废液处理后再排放。请就如何处理残留废液提一条具体建议_____ 。
【答案】(1)
隔绝氧气和降低温度至可燃物的着火点以下
(2)NaCl、NaHCO3 白色固体逐渐溶解
蒸发结晶回收氯化钠(合理即可)
四、计算题。
26、钢是铁的合金。为测定某钢样中铁的质量分数,取11.4g钢样,向其中加入稀硫酸,产生氢气的质量与加入稀硫酸的质量关系如图所示(不考虑钢样中其它成分与稀硫酸的反应)。
(1)钢_____(填“是”或“不是”)金属材料。
(2)计算此钢样中铁的质量分数。
【答案】(1)是 (2)98%
