2.3 原子结构的模型 基础训练(含答案)
文档属性
| 名称 | 2.3 原子结构的模型 基础训练(含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 376.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-01-23 22:44:22 | ||
图片预览

文档简介
2.3 原子结构的模型
1.有三种原子,甲原子核内有8个质子和8个中子,乙原子核内有8个质子和9个中子,丙原子核内有6个质子和6个中子,则下列说法正确的是( )
A.甲和乙是同种原子 B.甲和乙是同种元素
C.乙和丙核电荷数相等 D.乙和丙核外电子数相等
2.科学研究中,人们通过一定的科学方法,建立一个适当的模型来代替和反映客观对象,并通过研究这个模型来揭示客观对象的形态、特征和本质。下列分析正确的是( )
A.①揭示单侧光对生长素分布的影响,向光侧生长素多,生长快
B.②用磁感线描述条形磁体周围的磁场分布,越密表示磁场越弱
C.③是原子结构模型,中央是原子核,核外是绕核高速运动的电子
D.④描述地球绕日公转,地轴始终呈倾斜状态,箭头表示公转方向
3.俄国科学家门捷列夫对元素周期表的编制做出了巨大贡献,人们将101号元素命名为“钔”来纪念他。钔原子的核电荷数为101,相对原子质量为258,则钔原子的核外电子数为( )
A.101 B.157 C.258 D.359
4.金属是由原子构成的,1kg下列金属中所含原子个数最多的是( )
A.铁 B.铜 C.铝 D.锌
5.同位素的应用非常广泛,比如用于考古。三星堆遗址出土的文物经C-14同位素检测,已有5000年左右的历史,这表明我国上下五千年的历史是真实存在的。碳有多种同位素,互为同位素的两种碳原子不可能具有相同的( )
A.化学性质 B.质子数 C.电子数 D.中子数
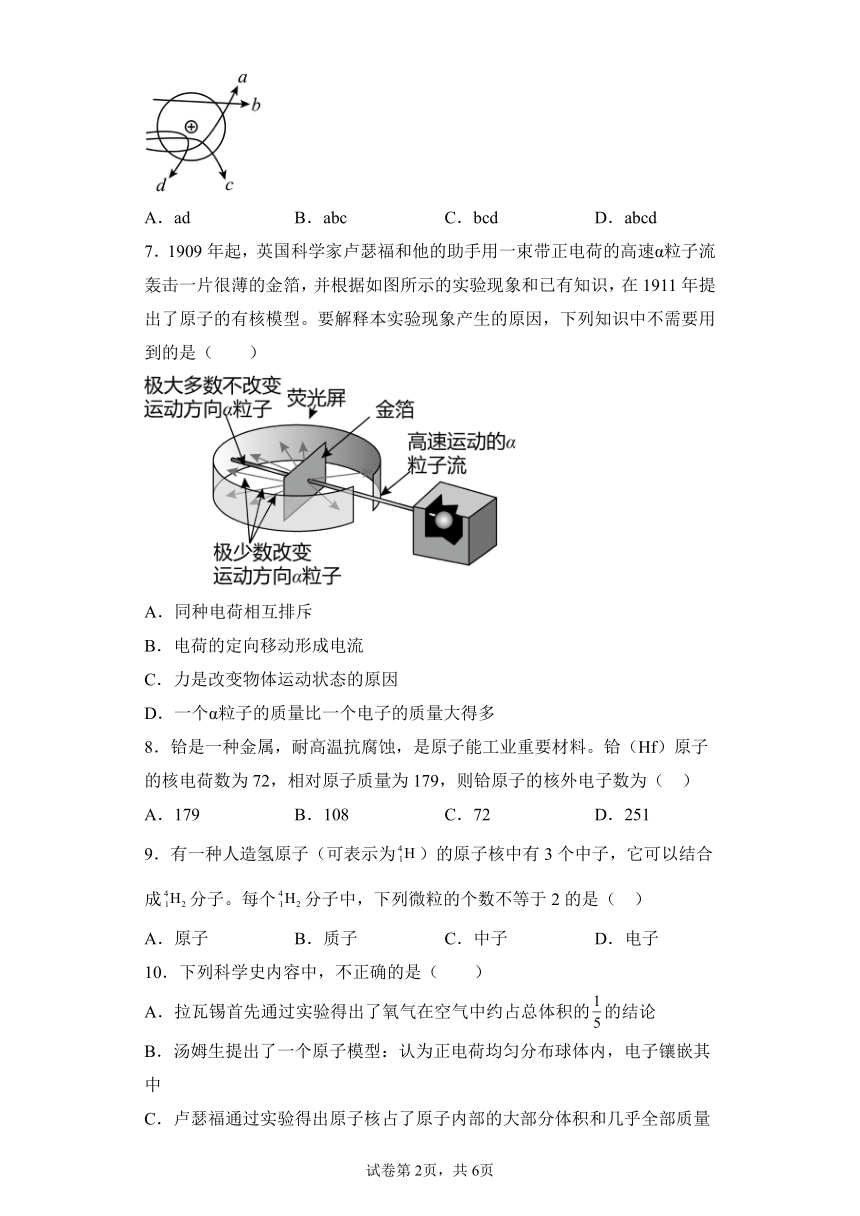
6.卢瑟福的α粒子轰击金箔实验为建立现代原子理论打下了基础。如图线条中,可能是α粒子(带正电)在该实验中的运动轨迹的是( )
A.ad B.abc C.bcd D.abcd
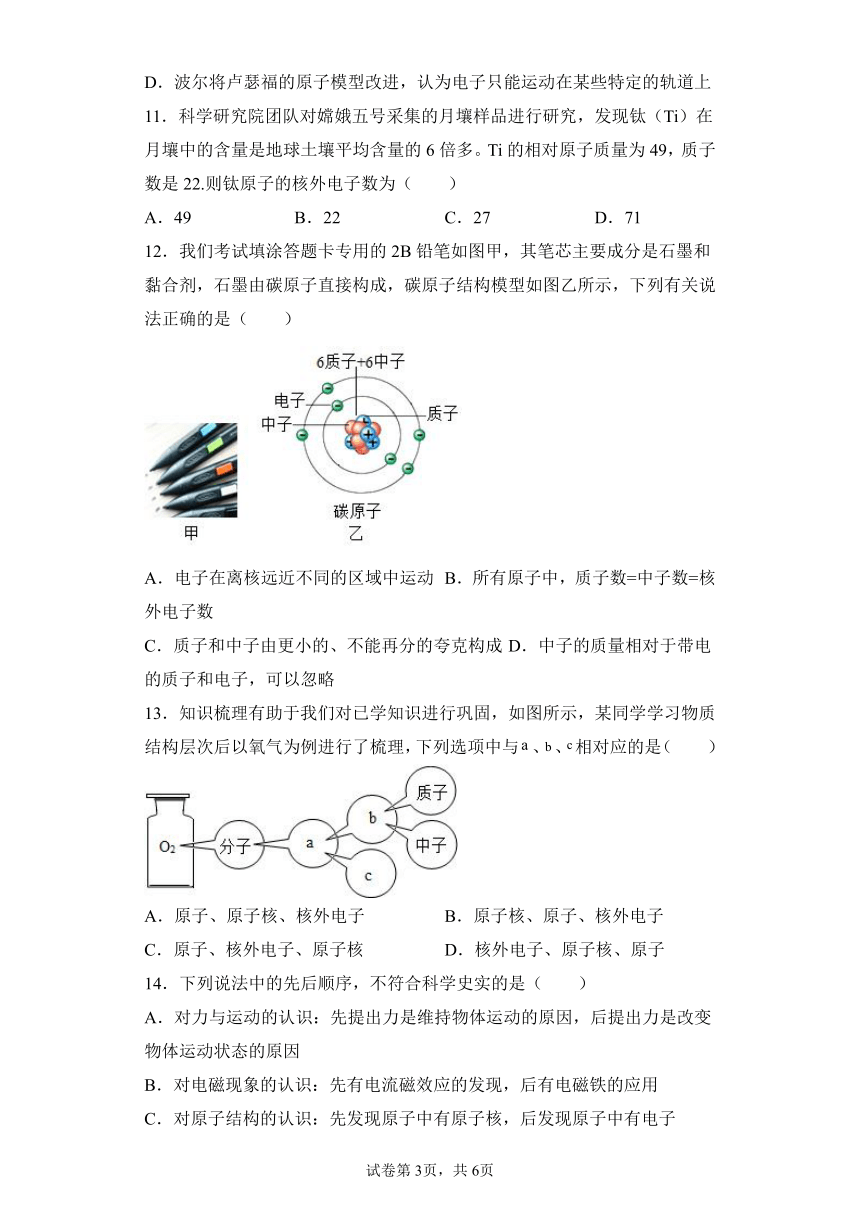
7.1909年起,英国科学家卢瑟福和他的助手用一束带正电荷的高速α粒子流轰击一片很薄的金箔,并根据如图所示的实验现象和已有知识,在1911年提出了原子的有核模型。要解释本实验现象产生的原因,下列知识中不需要用到的是( )
A.同种电荷相互排斥
B.电荷的定向移动形成电流
C.力是改变物体运动状态的原因
D.一个α粒子的质量比一个电子的质量大得多
8.铪是一种金属,耐高温抗腐蚀,是原子能工业重要材料。铪(Hf)原子的核电荷数为72,相对原子质量为179,则铪原子的核外电子数为( )
A.179 B.108 C.72 D.251
9.有一种人造氢原子(可表示为)的原子核中有3个中子,它可以结合成分子。每个分子中,下列微粒的个数不等于2的是( )
A.原子 B.质子 C.中子 D.电子
10.下列科学史内容中,不正确的是( )
A.拉瓦锡首先通过实验得出了氧气在空气中约占总体积的的结论
B.汤姆生提出了一个原子模型:认为正电荷均匀分布球体内,电子镶嵌其中
C.卢瑟福通过实验得出原子核占了原子内部的大部分体积和几乎全部质量
D.波尔将卢瑟福的原子模型改进,认为电子只能运动在某些特定的轨道上
11.科学研究院团队对嫦娥五号采集的月壤样品进行研究,发现钛(Ti)在月壤中的含量是地球土壤平均含量的6倍多。Ti的相对原子质量为49,质子数是22.则钛原子的核外电子数为( )
A.49 B.22 C.27 D.71
12.我们考试填涂答题卡专用的2B铅笔如图甲,其笔芯主要成分是石墨和黏合剂,石墨由碳原子直接构成,碳原子结构模型如图乙所示,下列有关说法正确的是( )
A.电子在离核远近不同的区域中运动 B.所有原子中,质子数=中子数=核外电子数
C.质子和中子由更小的、不能再分的夸克构成 D.中子的质量相对于带电的质子和电子,可以忽略
13.知识梳理有助于我们对已学知识进行巩固,如图所示,某同学学习物质结构层次后以氧气为例进行了梳理,下列选项中与、、相对应的是( )
A.原子、原子核、核外电子 B.原子核、原子、核外电子
C.原子、核外电子、原子核 D.核外电子、原子核、原子
14.下列说法中的先后顺序,不符合科学史实的是( )
A.对力与运动的认识:先提出力是维持物体运动的原因,后提出力是改变物体运动状态的原因
B.对电磁现象的认识:先有电流磁效应的发现,后有电磁铁的应用
C.对原子结构的认识:先发现原子中有原子核,后发现原子中有电子
D.对海陆变迁的认识:先提出大陆漂移学说,后建立板块构造学说
15.下列所描述的粒子与氧原子一致的是( )
A.该粒子有8个质子,9个中子,10个电子
B.该粒子有9个质子,8个中子,10个电子
C.该粒子有8个质子,10个中子,8个电子
D.该粒子有9个质子,10个中子,8个电子
16.用高能粒子轰击原子核是研究微观粒子的一种方法。
1934年,意大利科学家费米用中子轰击铀原子(质子数为92,元素符号为U),得到了一种质量增加的原子,他公开宣布发现了93号元素,被科学界认可,从而获得了诺贝尔物理学奖。
1938年,德国科学家哈恩在重复费米的实验后,发现费米实验中得到的是56号钡元素,并用图示模型来定义这一变化。费米知道后,立即重复哈恩的实验,结果证实自己错了,费米坦率地检讨并纠正了错误。
(1)费米用中子轰击铀原子,不可能增加铀原子的________数,所以得不到93号元素。
(2)结合材料分析,以下观点正确的是________。
A.面对前人的观点要敢于质疑
B.科学结论的得出要依据客观事实
C.对科学的认识是一个不断修正、完善的过程
17.当一颗大质量恒星耗尽其自身内部燃料时,它将迎来死亡的时刻,在一次巨大的爆炸后形成每立方厘米的质量为一亿吨的黑洞或中子星。大恒星归结为中子星时,在巨大的压力下,电子会被压缩到原子核内与___________(选填“质子”或“中子”)中和,使原子变得仅由中子组成,核内原来的原子结构将不复存在。那么发生的这个变化是否属于化学变化___________(选填“属于”或“不属于”)。
18.碘是一种由碘分子构成的物质。小明同学利用碘进行如下实验:①把少量的固体碘放在湿润的馒头上,发现馒头会变成蓝色;②再取少量的碘溶解再酒精中,取少量碘酒滴在馒头上,发现馒头也会变成蓝色。请回答以下问题。
(1)如果取少量的碘放入烧杯中,用酒精灯加热,碘升华成碘蒸气,把湿润的馒头放在碘蒸气中,馒头会有什么变化,请预测实验现象为___________,并阐述理由___________。
(2)现在市场上买来的食盐大多是加碘盐,将少量食盐水滴在馒头上,馒头不变蓝。那么加碘盐中的“碘”是指___________。
A.碘单质 B.碘元素 C.碘原子 D.碘分子
19.2020年10月,关于日本政府欲将核废水排入太平洋的事曾在全球闹得沸沸扬扬。核废水中131I(碘-131)的相关报道成为热门话题。请回答下列问题:
(1)131I原子中含有53个质子,78个中子。131I原子的核外电子数是_________。
(2)自然界中普遍存在的另一种碘原子127I,它和131I同属于碘元素。127I原子的质子数为_________。
20.人们为揭示原子结构的奥秘,经历了漫长的探究过程.1897年汤姆生发现电子并提出类似“西瓜”的原子模型;1911年卢瑟福等人为探索原子的内部结构又进行了下面的实验:用一束带正电的、质量比电子大得多的高速运动的a粒子轰击金箔,发现:①大多数a粒子能穿透金箔而不改变原来的运动方向;②一小部分a粒子改变了原来的运动方向;③有极少数a粒子被弹了回来。请你根据对原子结构的认识,分析出现上述现象的原因:
(1)现象①:___;
(2)现象②:___;
(3)现象③:___.
21.探究原子结构的奥秘。1910年英国科学家卢瑟福进行了著名的α粒子(带正电)轰击金箔实验,卢瑟福和他的团队发现:绝大多数α粒子穿过金箔后仍沿原方向前进,但是有少数α粒子却发生了较大的偏转,并且有极少数α粒子的偏转超过90°,有的甚至几乎达到180°,像是被金箔弹了回来。
(1)根据实验现象,卢瑟福提出“原子的大部分质量集中到了一个很小的结构上”中的“很小的结构”指的是______。
(2)lum金箔包含了3000层金原子,绝大多数α粒子穿过后方向不变,说明______。
A.原子的质量是均匀分布的 B.原子内部绝大部分空间是空的
(3)卢瑟福核式结构模型是利用α粒子袭击金箔实验的基础上提出的。下列能正确反映他的实验结果的示意图是______(选填序号)。
(4)从原子结构模型建立的过程中,我们发现______(选填序号)
A.模型在科学研究中起着很重要的作用
B.人类借助模型的建立,对原子的认识逐渐接近本质
C.科学模型的建立是一个不断完善、不断修正的过程
D.玻尔的原子模型建立,使人们对原子结构的认识达到了完美的境界
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
2.C
3.A
4.C
5.D
6.C
7.B
8.C
9.C
10.C
11.B
12.A
13.A
14.C
15.C
16. 质子 ABC
17. 质子 不属于
18. 馒头会变蓝色 碘升华,其分子种类不变,其化学性质不变,因此还能使馒头变蓝 B
19. 53 53
20.
21. 原子核 B 乙 ABC
答案第1页,共2页
答案第1页,共2页
1.有三种原子,甲原子核内有8个质子和8个中子,乙原子核内有8个质子和9个中子,丙原子核内有6个质子和6个中子,则下列说法正确的是( )
A.甲和乙是同种原子 B.甲和乙是同种元素
C.乙和丙核电荷数相等 D.乙和丙核外电子数相等
2.科学研究中,人们通过一定的科学方法,建立一个适当的模型来代替和反映客观对象,并通过研究这个模型来揭示客观对象的形态、特征和本质。下列分析正确的是( )
A.①揭示单侧光对生长素分布的影响,向光侧生长素多,生长快
B.②用磁感线描述条形磁体周围的磁场分布,越密表示磁场越弱
C.③是原子结构模型,中央是原子核,核外是绕核高速运动的电子
D.④描述地球绕日公转,地轴始终呈倾斜状态,箭头表示公转方向
3.俄国科学家门捷列夫对元素周期表的编制做出了巨大贡献,人们将101号元素命名为“钔”来纪念他。钔原子的核电荷数为101,相对原子质量为258,则钔原子的核外电子数为( )
A.101 B.157 C.258 D.359
4.金属是由原子构成的,1kg下列金属中所含原子个数最多的是( )
A.铁 B.铜 C.铝 D.锌
5.同位素的应用非常广泛,比如用于考古。三星堆遗址出土的文物经C-14同位素检测,已有5000年左右的历史,这表明我国上下五千年的历史是真实存在的。碳有多种同位素,互为同位素的两种碳原子不可能具有相同的( )
A.化学性质 B.质子数 C.电子数 D.中子数
6.卢瑟福的α粒子轰击金箔实验为建立现代原子理论打下了基础。如图线条中,可能是α粒子(带正电)在该实验中的运动轨迹的是( )
A.ad B.abc C.bcd D.abcd
7.1909年起,英国科学家卢瑟福和他的助手用一束带正电荷的高速α粒子流轰击一片很薄的金箔,并根据如图所示的实验现象和已有知识,在1911年提出了原子的有核模型。要解释本实验现象产生的原因,下列知识中不需要用到的是( )
A.同种电荷相互排斥
B.电荷的定向移动形成电流
C.力是改变物体运动状态的原因
D.一个α粒子的质量比一个电子的质量大得多
8.铪是一种金属,耐高温抗腐蚀,是原子能工业重要材料。铪(Hf)原子的核电荷数为72,相对原子质量为179,则铪原子的核外电子数为( )
A.179 B.108 C.72 D.251
9.有一种人造氢原子(可表示为)的原子核中有3个中子,它可以结合成分子。每个分子中,下列微粒的个数不等于2的是( )
A.原子 B.质子 C.中子 D.电子
10.下列科学史内容中,不正确的是( )
A.拉瓦锡首先通过实验得出了氧气在空气中约占总体积的的结论
B.汤姆生提出了一个原子模型:认为正电荷均匀分布球体内,电子镶嵌其中
C.卢瑟福通过实验得出原子核占了原子内部的大部分体积和几乎全部质量
D.波尔将卢瑟福的原子模型改进,认为电子只能运动在某些特定的轨道上
11.科学研究院团队对嫦娥五号采集的月壤样品进行研究,发现钛(Ti)在月壤中的含量是地球土壤平均含量的6倍多。Ti的相对原子质量为49,质子数是22.则钛原子的核外电子数为( )
A.49 B.22 C.27 D.71
12.我们考试填涂答题卡专用的2B铅笔如图甲,其笔芯主要成分是石墨和黏合剂,石墨由碳原子直接构成,碳原子结构模型如图乙所示,下列有关说法正确的是( )
A.电子在离核远近不同的区域中运动 B.所有原子中,质子数=中子数=核外电子数
C.质子和中子由更小的、不能再分的夸克构成 D.中子的质量相对于带电的质子和电子,可以忽略
13.知识梳理有助于我们对已学知识进行巩固,如图所示,某同学学习物质结构层次后以氧气为例进行了梳理,下列选项中与、、相对应的是( )
A.原子、原子核、核外电子 B.原子核、原子、核外电子
C.原子、核外电子、原子核 D.核外电子、原子核、原子
14.下列说法中的先后顺序,不符合科学史实的是( )
A.对力与运动的认识:先提出力是维持物体运动的原因,后提出力是改变物体运动状态的原因
B.对电磁现象的认识:先有电流磁效应的发现,后有电磁铁的应用
C.对原子结构的认识:先发现原子中有原子核,后发现原子中有电子
D.对海陆变迁的认识:先提出大陆漂移学说,后建立板块构造学说
15.下列所描述的粒子与氧原子一致的是( )
A.该粒子有8个质子,9个中子,10个电子
B.该粒子有9个质子,8个中子,10个电子
C.该粒子有8个质子,10个中子,8个电子
D.该粒子有9个质子,10个中子,8个电子
16.用高能粒子轰击原子核是研究微观粒子的一种方法。
1934年,意大利科学家费米用中子轰击铀原子(质子数为92,元素符号为U),得到了一种质量增加的原子,他公开宣布发现了93号元素,被科学界认可,从而获得了诺贝尔物理学奖。
1938年,德国科学家哈恩在重复费米的实验后,发现费米实验中得到的是56号钡元素,并用图示模型来定义这一变化。费米知道后,立即重复哈恩的实验,结果证实自己错了,费米坦率地检讨并纠正了错误。
(1)费米用中子轰击铀原子,不可能增加铀原子的________数,所以得不到93号元素。
(2)结合材料分析,以下观点正确的是________。
A.面对前人的观点要敢于质疑
B.科学结论的得出要依据客观事实
C.对科学的认识是一个不断修正、完善的过程
17.当一颗大质量恒星耗尽其自身内部燃料时,它将迎来死亡的时刻,在一次巨大的爆炸后形成每立方厘米的质量为一亿吨的黑洞或中子星。大恒星归结为中子星时,在巨大的压力下,电子会被压缩到原子核内与___________(选填“质子”或“中子”)中和,使原子变得仅由中子组成,核内原来的原子结构将不复存在。那么发生的这个变化是否属于化学变化___________(选填“属于”或“不属于”)。
18.碘是一种由碘分子构成的物质。小明同学利用碘进行如下实验:①把少量的固体碘放在湿润的馒头上,发现馒头会变成蓝色;②再取少量的碘溶解再酒精中,取少量碘酒滴在馒头上,发现馒头也会变成蓝色。请回答以下问题。
(1)如果取少量的碘放入烧杯中,用酒精灯加热,碘升华成碘蒸气,把湿润的馒头放在碘蒸气中,馒头会有什么变化,请预测实验现象为___________,并阐述理由___________。
(2)现在市场上买来的食盐大多是加碘盐,将少量食盐水滴在馒头上,馒头不变蓝。那么加碘盐中的“碘”是指___________。
A.碘单质 B.碘元素 C.碘原子 D.碘分子
19.2020年10月,关于日本政府欲将核废水排入太平洋的事曾在全球闹得沸沸扬扬。核废水中131I(碘-131)的相关报道成为热门话题。请回答下列问题:
(1)131I原子中含有53个质子,78个中子。131I原子的核外电子数是_________。
(2)自然界中普遍存在的另一种碘原子127I,它和131I同属于碘元素。127I原子的质子数为_________。
20.人们为揭示原子结构的奥秘,经历了漫长的探究过程.1897年汤姆生发现电子并提出类似“西瓜”的原子模型;1911年卢瑟福等人为探索原子的内部结构又进行了下面的实验:用一束带正电的、质量比电子大得多的高速运动的a粒子轰击金箔,发现:①大多数a粒子能穿透金箔而不改变原来的运动方向;②一小部分a粒子改变了原来的运动方向;③有极少数a粒子被弹了回来。请你根据对原子结构的认识,分析出现上述现象的原因:
(1)现象①:___;
(2)现象②:___;
(3)现象③:___.
21.探究原子结构的奥秘。1910年英国科学家卢瑟福进行了著名的α粒子(带正电)轰击金箔实验,卢瑟福和他的团队发现:绝大多数α粒子穿过金箔后仍沿原方向前进,但是有少数α粒子却发生了较大的偏转,并且有极少数α粒子的偏转超过90°,有的甚至几乎达到180°,像是被金箔弹了回来。
(1)根据实验现象,卢瑟福提出“原子的大部分质量集中到了一个很小的结构上”中的“很小的结构”指的是______。
(2)lum金箔包含了3000层金原子,绝大多数α粒子穿过后方向不变,说明______。
A.原子的质量是均匀分布的 B.原子内部绝大部分空间是空的
(3)卢瑟福核式结构模型是利用α粒子袭击金箔实验的基础上提出的。下列能正确反映他的实验结果的示意图是______(选填序号)。
(4)从原子结构模型建立的过程中,我们发现______(选填序号)
A.模型在科学研究中起着很重要的作用
B.人类借助模型的建立,对原子的认识逐渐接近本质
C.科学模型的建立是一个不断完善、不断修正的过程
D.玻尔的原子模型建立,使人们对原子结构的认识达到了完美的境界
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
2.C
3.A
4.C
5.D
6.C
7.B
8.C
9.C
10.C
11.B
12.A
13.A
14.C
15.C
16. 质子 ABC
17. 质子 不属于
18. 馒头会变蓝色 碘升华,其分子种类不变,其化学性质不变,因此还能使馒头变蓝 B
19. 53 53
20.
21. 原子核 B 乙 ABC
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
