基础实验8酸与碱的化学性质(课件15页)-2022-2023学年九年级化学下册同步精品课堂(沪教版)
文档属性
| 名称 | 基础实验8酸与碱的化学性质(课件15页)-2022-2023学年九年级化学下册同步精品课堂(沪教版) |

|
|
| 格式 | pptx | ||
| 文件大小 | 141.2KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-30 12:21:41 | ||
图片预览






文档简介
(共15张PPT)
JICHU HUAXUE SHIYAN
基础实验8
酸与碱的化学性质
1. 比较常见酸的化学性质,认识其特征;
2. 认识常见碱的一些化学性质;
3. 通过探究,认识酸碱中和反应。
【实验目的】
药品:稀盐酸、稀硫酸、稀氢氧化钠溶液、石灰水、镁条、锌粒、铜片、碳酸钠粉末、石灰石
(或大理石)、生锈铁钉、硫酸铜溶液、蒸馏水等。
仪器:试管、烧杯、胶头滴管、玻璃棒等。
【实验用品】
1. 常见酸的化学性质
实验过程 实验现象 实验结论
(1)取三支试管,分别放入适量镁条、锌粒和铜片,再各加入适量稀硫酸(稀盐酸),观察实验现象
(2)取一支试管,放入一枚生锈铁钉,再加入适量稀硫酸(稀盐酸),观察实验现象
(3)取两支试管,分别加入适量碳酸钠粉末、石灰石(或大理石),再各加入适量稀硫酸(稀盐酸),观察实验现象
镁条、锌粒表面有气泡产生,且镁条表面产生气泡的速率较快,铜片表面无明显变化
铁钉表面的铁锈逐渐消失,铁钉变光亮,溶液由无色变为黄色
若加入稀H2SO4,盛有Na2CO3粉末的试管中会产生大量气泡,盛有石灰石(或大理石)的试管中刚开始时有气泡产生,之后产生气泡的速率减慢并逐渐停止;若加入稀HCl,两支试管中均有大量气泡产生
在金属活动性顺序表中,排在氢前面的金属可以与稀硫酸(稀盐酸)反应产生氢气,且金属活动性越强,产生气泡速率越快
酸能与某些金属氧化物反应
酸能与碳酸盐反应产生气体
【实验过程】
2. 常见碱的化学性质
实验过程 实验现象 实验结论
取一支试管,加入2ml硫酸铜溶液,再逐滴加入石灰水(稀氢氧化钠溶液),观察实验现象
碱能与某些盐溶液发生反应
产生蓝色沉淀
【实验过程】
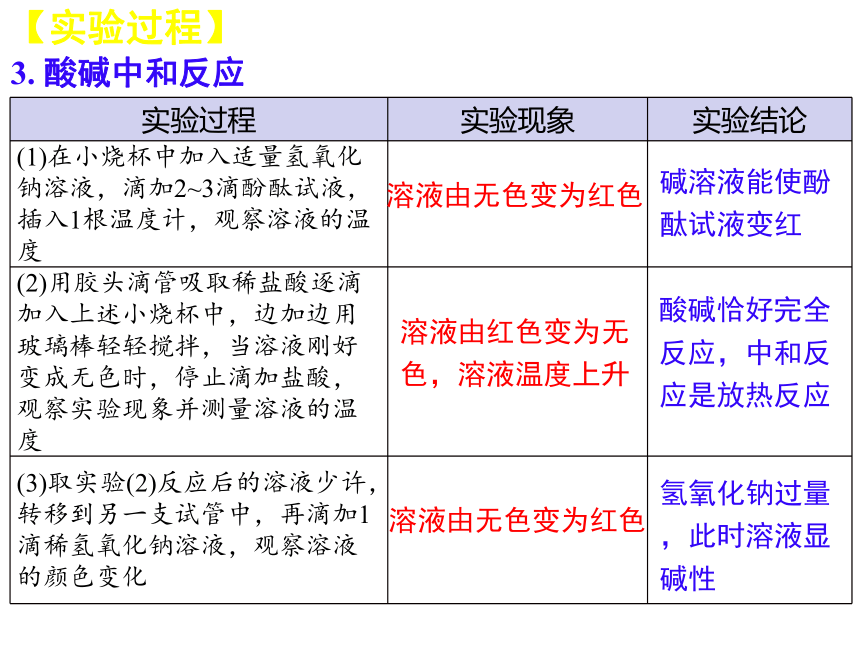
3. 酸碱中和反应
实验过程 实验现象 实验结论
(1)在小烧杯中加入适量氢氧化钠溶液,滴加2~3滴酚酞试液,插入1根温度计,观察溶液的温度
(2)用胶头滴管吸取稀盐酸逐滴加入上述小烧杯中,边加边用玻璃棒轻轻搅拌,当溶液刚好变成无色时,停止滴加盐酸,观察实验现象并测量溶液的温度
(3)取实验(2)反应后的溶液少许,转移到另一支试管中,再滴加1滴稀氢氧化钠溶液,观察溶液的颜色变化
溶液由无色变为红色
碱溶液能使酚酞试液变红
溶液由红色变为无色,溶液温度上升
酸碱恰好完全反应,中和反应是放热反应
溶液由无色变为红色
氢氧化钠过量,此时溶液显碱性
【实验过程】
1. 用稀酸除去铁制品表面的铁锈,是否能将铁制品长期浸泡在酸溶液中?为什么?写出相关的化学方程式。
不能。若将铁制品长期浸泡在酸溶液中,铁锈与酸反应后,铁会继续与酸反应,损坏铁制品。
Fe2O3 + 6HCl == 2FeCl3 + 3H2O
稀酸以稀盐酸为例:
Fe + 2HCl == FeCl2 + H2↑
【问题讨论】
2. 根据实验现象说明,在实验室为什么常用稀盐酸和大理石反应来制取CO2气体?
大理石价格低廉,稀盐酸和大理石反应能持续地产生CO2气体,且速率适中便于收集;而碳酸钠与酸溶液反应速率过快,不便于气体的收集;大理石与稀硫酸反应不能持续地产生CO2气体。
【问题讨论】
3. 酸碱中和反应实验中,步骤(3)的目的是什么?
目的是验证酸、碱是否恰好完全反应。
【问题讨论】
1.(2022·湖南株洲)下列物质中,不能与稀硫酸反应的是( )
A.BaCl2溶液
B.Cu丝
C.CuO粉末
D.Cu(OH)2固体
【中考链接】
B
2.(2022·内蒙古通辽)初中化学几种常见物质之间的反应关系如图所示,“一”两端的物质均能发生反应,图中各物质(除石蕊溶液外)的类别均不相同。下列说法不正确的是( )
A.X可能是碳酸钠
B.Z与硫酸反应,可能得到黄色溶液
C.X和Y可能是NaOH和Ba(NO3)2
D.Mg与H2SO4发生置换反应
【中考链接】
C
3.(2022·浙江杭州)如图所示,分别向四支试管中加入饱和石灰水,使其与试管内溶液充分反应。无论饱和石灰水加入量的多少,反应后试管内溶液一定呈碱性的是
( )
A.① B.② C.③ D.④
【中考链接】
C
4.(2022·山西晋中)老师布置了以下四个实验,让同学们分组完成。当把胶头滴管内的液体全部加入试管中时,片刻后,通过观察反应物的变化,可判断出反应发生的是( )
A. B. C. D.
【中考链接】
A
5.(2022·浙江绍兴)在做酸碱反应的实验时,向盛有氢氧化钠溶液的烧杯中,逐渐加入稀盐酸。烧杯内相关物质的质量与加入稀盐酸质量的变化关系不正确的是
( )
A. B. C. D.
【中考链接】
D
6.(2022·四川成都)实验小组用图1装置探究稀氢氧化钠溶液与稀盐酸能否反应,测得数据如图2。下列说法正确的是( )
A.烧杯中只能盛放稀氢氧化钠溶液
B.图2不能证明反应是放热反应
C.60s时溶液中溶质只有氯化钠
D.实验证明氢氧化钠与盐酸能反应
【中考链接】
D
JICHU HUAXUE SHIYAN
基础实验8
酸与碱的化学性质
1. 比较常见酸的化学性质,认识其特征;
2. 认识常见碱的一些化学性质;
3. 通过探究,认识酸碱中和反应。
【实验目的】
药品:稀盐酸、稀硫酸、稀氢氧化钠溶液、石灰水、镁条、锌粒、铜片、碳酸钠粉末、石灰石
(或大理石)、生锈铁钉、硫酸铜溶液、蒸馏水等。
仪器:试管、烧杯、胶头滴管、玻璃棒等。
【实验用品】
1. 常见酸的化学性质
实验过程 实验现象 实验结论
(1)取三支试管,分别放入适量镁条、锌粒和铜片,再各加入适量稀硫酸(稀盐酸),观察实验现象
(2)取一支试管,放入一枚生锈铁钉,再加入适量稀硫酸(稀盐酸),观察实验现象
(3)取两支试管,分别加入适量碳酸钠粉末、石灰石(或大理石),再各加入适量稀硫酸(稀盐酸),观察实验现象
镁条、锌粒表面有气泡产生,且镁条表面产生气泡的速率较快,铜片表面无明显变化
铁钉表面的铁锈逐渐消失,铁钉变光亮,溶液由无色变为黄色
若加入稀H2SO4,盛有Na2CO3粉末的试管中会产生大量气泡,盛有石灰石(或大理石)的试管中刚开始时有气泡产生,之后产生气泡的速率减慢并逐渐停止;若加入稀HCl,两支试管中均有大量气泡产生
在金属活动性顺序表中,排在氢前面的金属可以与稀硫酸(稀盐酸)反应产生氢气,且金属活动性越强,产生气泡速率越快
酸能与某些金属氧化物反应
酸能与碳酸盐反应产生气体
【实验过程】
2. 常见碱的化学性质
实验过程 实验现象 实验结论
取一支试管,加入2ml硫酸铜溶液,再逐滴加入石灰水(稀氢氧化钠溶液),观察实验现象
碱能与某些盐溶液发生反应
产生蓝色沉淀
【实验过程】
3. 酸碱中和反应
实验过程 实验现象 实验结论
(1)在小烧杯中加入适量氢氧化钠溶液,滴加2~3滴酚酞试液,插入1根温度计,观察溶液的温度
(2)用胶头滴管吸取稀盐酸逐滴加入上述小烧杯中,边加边用玻璃棒轻轻搅拌,当溶液刚好变成无色时,停止滴加盐酸,观察实验现象并测量溶液的温度
(3)取实验(2)反应后的溶液少许,转移到另一支试管中,再滴加1滴稀氢氧化钠溶液,观察溶液的颜色变化
溶液由无色变为红色
碱溶液能使酚酞试液变红
溶液由红色变为无色,溶液温度上升
酸碱恰好完全反应,中和反应是放热反应
溶液由无色变为红色
氢氧化钠过量,此时溶液显碱性
【实验过程】
1. 用稀酸除去铁制品表面的铁锈,是否能将铁制品长期浸泡在酸溶液中?为什么?写出相关的化学方程式。
不能。若将铁制品长期浸泡在酸溶液中,铁锈与酸反应后,铁会继续与酸反应,损坏铁制品。
Fe2O3 + 6HCl == 2FeCl3 + 3H2O
稀酸以稀盐酸为例:
Fe + 2HCl == FeCl2 + H2↑
【问题讨论】
2. 根据实验现象说明,在实验室为什么常用稀盐酸和大理石反应来制取CO2气体?
大理石价格低廉,稀盐酸和大理石反应能持续地产生CO2气体,且速率适中便于收集;而碳酸钠与酸溶液反应速率过快,不便于气体的收集;大理石与稀硫酸反应不能持续地产生CO2气体。
【问题讨论】
3. 酸碱中和反应实验中,步骤(3)的目的是什么?
目的是验证酸、碱是否恰好完全反应。
【问题讨论】
1.(2022·湖南株洲)下列物质中,不能与稀硫酸反应的是( )
A.BaCl2溶液
B.Cu丝
C.CuO粉末
D.Cu(OH)2固体
【中考链接】
B
2.(2022·内蒙古通辽)初中化学几种常见物质之间的反应关系如图所示,“一”两端的物质均能发生反应,图中各物质(除石蕊溶液外)的类别均不相同。下列说法不正确的是( )
A.X可能是碳酸钠
B.Z与硫酸反应,可能得到黄色溶液
C.X和Y可能是NaOH和Ba(NO3)2
D.Mg与H2SO4发生置换反应
【中考链接】
C
3.(2022·浙江杭州)如图所示,分别向四支试管中加入饱和石灰水,使其与试管内溶液充分反应。无论饱和石灰水加入量的多少,反应后试管内溶液一定呈碱性的是
( )
A.① B.② C.③ D.④
【中考链接】
C
4.(2022·山西晋中)老师布置了以下四个实验,让同学们分组完成。当把胶头滴管内的液体全部加入试管中时,片刻后,通过观察反应物的变化,可判断出反应发生的是( )
A. B. C. D.
【中考链接】
A
5.(2022·浙江绍兴)在做酸碱反应的实验时,向盛有氢氧化钠溶液的烧杯中,逐渐加入稀盐酸。烧杯内相关物质的质量与加入稀盐酸质量的变化关系不正确的是
( )
A. B. C. D.
【中考链接】
D
6.(2022·四川成都)实验小组用图1装置探究稀氢氧化钠溶液与稀盐酸能否反应,测得数据如图2。下列说法正确的是( )
A.烧杯中只能盛放稀氢氧化钠溶液
B.图2不能证明反应是放热反应
C.60s时溶液中溶质只有氯化钠
D.实验证明氢氧化钠与盐酸能反应
【中考链接】
D
