第2章 微粒的模型与符号 单元测试(含答案)
文档属性
| 名称 | 第2章 微粒的模型与符号 单元测试(含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 263.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-01-29 11:18:31 | ||
图片预览


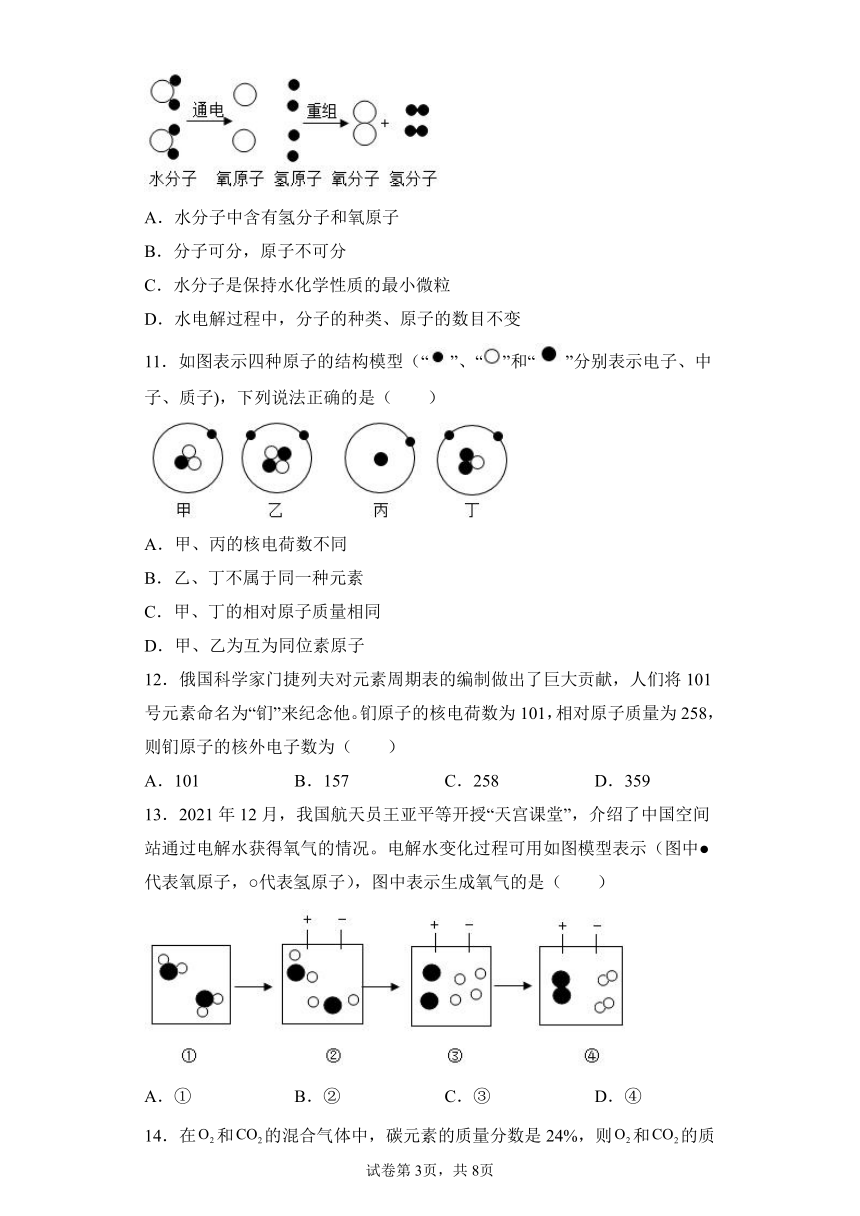
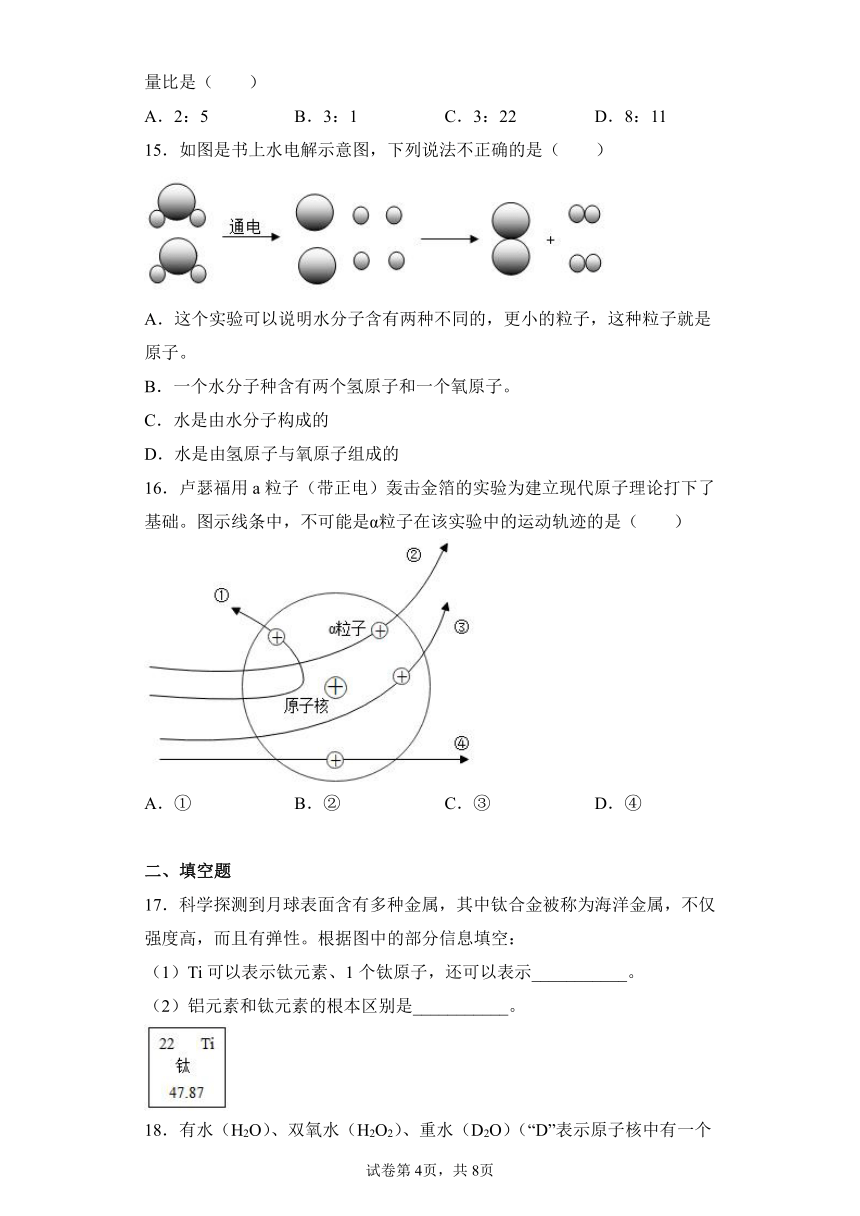
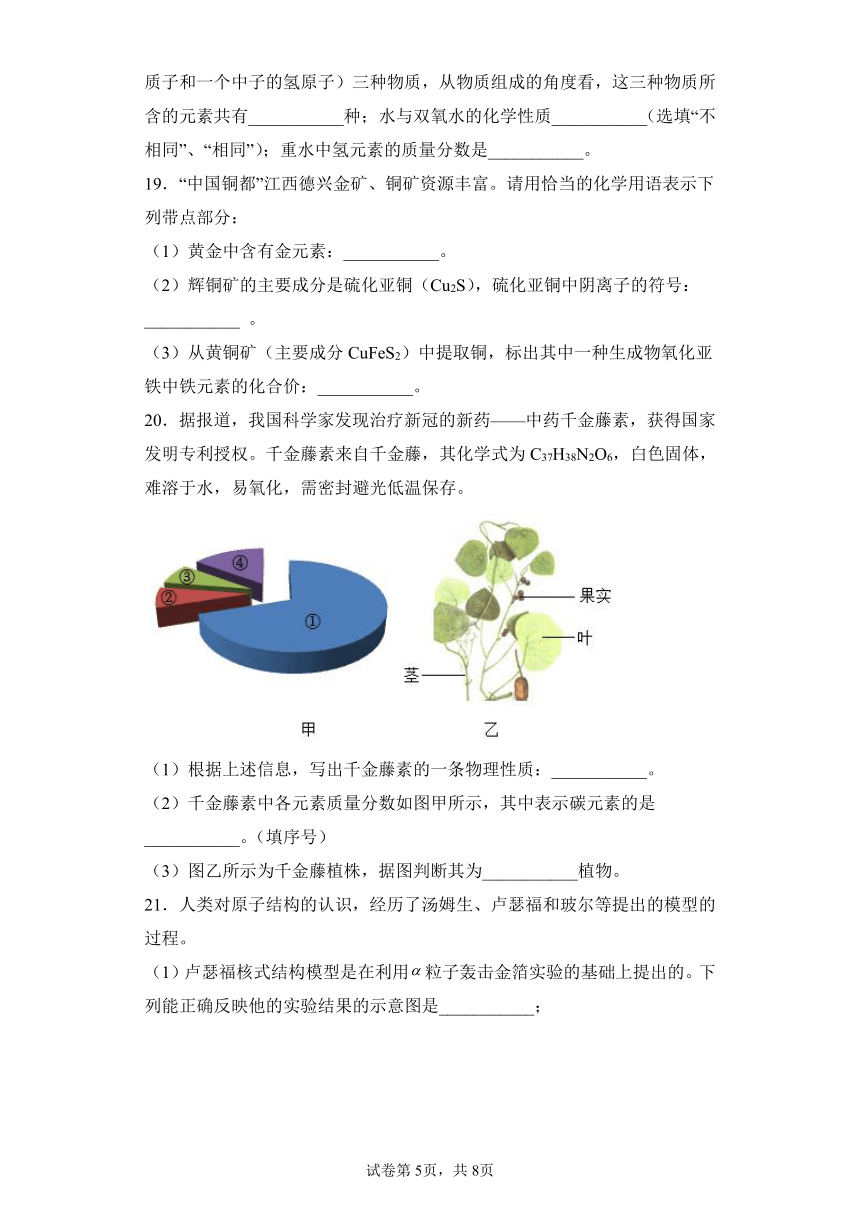
文档简介
微粒的模型与符号
姓名:___________班级:___________考号:___________
一、选择题
1,氢元素有()种同位素。
A,1种 B 2种 C 3种 D 4种
2.下列所描述的粒子与氧原子一致的是( )
A.该粒子有8个质子,9个中子,10个电子
B.该粒子有9个质子,8个中子,10个电子
C.该粒子有8个质子,10个中子,8个电子
D.该粒子有9个质子,10个中子,8个电子
3.借助模型有利于学科概念的学习与理解,下列属于模型的是( )
A. B.
C. D.
4.科学家用滤纸和二氧化钛(TiO2)制出一种“纳米纸”,在纳米纸上“铺”一层“萘胺(C10H9N)染料制成试纸,用于检测食品中亚硝酸盐浓度的高低,下列说法正确的是( )
A.二氧化钛中Ti的化合价为+4 B.这种试纸是一种新型化合物
C.二氧化钛和萘胺都属于氧化物 D.萘胺中含有20个原子
5.厨师烹饪时常往食物中加入少量的酒和食醋,是因为酒和食醋在一定条件下能反应生成具有香味的乙酸乙酯(化学式为C4H8O2)。关于乙酸乙酯的说法错误的是( )
A.乙酸乙酯的相对分子质量为88
B.乙酸乙酯中氢元素的质量分数为9.1%
C.乙酸乙酯中碳、氢、氧元素的质量比为4∶8∶2
D.1个乙酸乙酯分子由4个碳原子、8个氢原子和2个氧原子构成
6.对下列化学用语中数字“2”含义的说法正确的是( )
① ② ③ ④ ⑤ ⑥ ⑦H2O
A.表示离子个数的是⑤⑥ B.表示分子中原子个数的是③⑦
C.表示离子所带电荷数的是④⑤ D.表示分子个数的是①②
7.高温下焦炭和硫酸钠制备硫化钠,Na2SO4+4CNa2S+4X,说法正确的是( )
A.该反应属于置换反应 B.在该反应中,C体现了还原性
C.反应前后硫元素化合价不变 D.X的化学式为CO2
8.2020年新型冠状病毒肺炎在全世界蔓延,距今为止全球确诊人数已达上千万,在治疗新型冠状病毒肺炎的过程中,一种名叫利巴韦林的药物已经成为了必用药,发挥了巨大作用。利巴韦林别名三氮唑核苷,化学式为 C8H12N4O5,为白色结晶性粉末,无臭,在乙醇中微溶。下列关于此药物的说法正确的是( )
A.三氮唑核苷分子是由 8 个碳原子、12 个氢原子、4 个氮原子和 5 个氧原子构成的
B.三氮唑核苷的相对分子质量为 244 g
C.三氮唑核苷为白色结晶性粉末,无臭,是物理性质,在乙醇中微溶是化学性质
D.三氮唑核苷中的氮含量约为 23.0%
9.由于波音飞机的两起重大事故,我国的C919大型客机迎来了发展的机遇。C919部分机身采用了新型的铝锂合金,铝锂合金中的铝(Al)元素和锂(Li)元素的本质区别是( )
A.元素符号不同
B.相对原子质量不同
C.原子的质子数不同
D.原子的电子数不同
10.下图是电解水时,水分子分解过程示意图,关于对该图理解的叙述中,正确的是( )
A.水分子中含有氢分子和氧原子
B.分子可分,原子不可分
C.水分子是保持水化学性质的最小微粒
D.水电解过程中,分子的种类、原子的数目不变
11.如图表示四种原子的结构模型(“”、“”和“”分别表示电子、中子、质子),下列说法正确的是( )
A.甲、丙的核电荷数不同
B.乙、丁不属于同一种元素
C.甲、丁的相对原子质量相同
D.甲、乙为互为同位素原子
12.俄国科学家门捷列夫对元素周期表的编制做出了巨大贡献,人们将101号元素命名为“钔”来纪念他。钔原子的核电荷数为101,相对原子质量为258,则钔原子的核外电子数为( )
A.101 B.157 C.258 D.359
13.2021年12月,我国航天员王亚平等开授“天宫课堂”,介绍了中国空间站通过电解水获得氧气的情况。电解水变化过程可用如图模型表示(图中●代表氧原子,○代表氢原子),图中表示生成氧气的是( )
A.① B.② C.③ D.④
14.在和的混合气体中,碳元素的质量分数是24%,则和的质量比是( )
A.2:5 B.3:1 C.3:22 D.8:11
15.如图是书上水电解示意图,下列说法不正确的是( )
A.这个实验可以说明水分子含有两种不同的,更小的粒子,这种粒子就是原子。
B.一个水分子种含有两个氢原子和一个氧原子。
C.水是由水分子构成的
D.水是由氢原子与氧原子组成的
16.卢瑟福用a粒子(带正电)轰击金箔的实验为建立现代原子理论打下了基础。图示线条中,不可能是α粒子在该实验中的运动轨迹的是( )
A.① B.② C.③ D.④
二、填空题
17.科学探测到月球表面含有多种金属,其中钛合金被称为海洋金属,不仅强度高,而且有弹性。根据图中的部分信息填空:
(1)Ti可以表示钛元素、1个钛原子,还可以表示___________。
(2)铝元素和钛元素的根本区别是___________。
18.有水(H2O)、双氧水(H2O2)、重水(D2O)(“D”表示原子核中有一个质子和一个中子的氢原子)三种物质,从物质组成的角度看,这三种物质所含的元素共有___________种; 水与双氧水的化学性质___________(选填“不相同”、“相同”);重水中氢元素的质量分数是___________。
19.“中国铜都”江西德兴金矿、铜矿资源丰富。请用恰当的化学用语表示下列带点部分:
(1)黄金中含有金元素:___________。
(2)辉铜矿的主要成分是硫化亚铜(Cu2S),硫化亚铜中阴离子的符号:___________ 。
(3)从黄铜矿(主要成分CuFeS2)中提取铜,标出其中一种生成物氧化亚铁中铁元素的化合价:___________。
20.据报道,我国科学家发现治疗新冠的新药——中药千金藤素,获得国家发明专利授权。千金藤素来自千金藤,其化学式为C37H38N2O6,白色固体,难溶于水,易氧化,需密封避光低温保存。
(1)根据上述信息,写出千金藤素的一条物理性质:___________。
(2)千金藤素中各元素质量分数如图甲所示,其中表示碳元素的是___________。(填序号)
(3)图乙所示为千金藤植株,据图判断其为___________植物。
21.人类对原子结构的认识,经历了汤姆生、卢瑟福和玻尔等提出的模型的过程。
(1)卢瑟福核式结构模型是在利用粒子轰击金箔实验的基础上提出的。下列能正确反映他的实验结果的示意图是___________;
(2)从原子结构模型建立的过程中,我们发现___________(选填序号)。
A.科学模型的建立是一个不断完善、不断修正的过程
B.模型在科学研究中起着很重要的作用
C.玻尔的原子模型建立,使人们对原子结构的认识达到了完美的境界
D.人类借助模型的建立,对原子的认识逐渐接近本质
22.山梨酸钾(化学式为C5H7COOK)是国际粮农组织和卫生组织推荐的高效安全的防腐保鲜剂,在某市海产品深加工过程中广泛使用。
(1)该物质中碳、氧元素的原子个数比是_______________。
(2)该物质中碳元素的质量分数为_______________。
三、探究题
23.探究原子结构的奥秘。
[情景提供] 19世纪以前,人们一直以为原子是不可分的,直到1887年,汤姆生发现了带负电的电子后,才引起人们对原子结构模型的探索。
[提出问题]电子带负电,原子不带电,说明原子内存在着带正电荷的部分,它们是均匀分布还是集中分布的呢?
[进行实验] 1910年英国科学家卢瑟福进行了著名的a粒子轰击金箔实验。
实验做法如图∶
(1)放射源-放射性物质放出a粒子(带正电荷),质量是电子质量的7000倍∶
(2)金箔-作为靶子,厚度1um, 重叠了3000层左右的原子∶
(3) 荧光屏-a粒子打在上面发出闪光∶
(4)显微镜--通过显微镜观察闪光,且通过360度转动可观察不同角度a粒子的到达情况。
[收集证据]绝大多数a粒子穿过金箔后仍沿原来的方向前进,但是有少数a粒子却发生了较大的偏转,并且有极少数口粒子的偏转超过90°,有的甚至几乎达到180°,像是被金箔弹了回来
[猜想与假设] a粒子遇到电子后,就像飞行的子弹碰到灰尘一样运动方向不会发生明显的改变,而结果却出乎意料,除非原子的大部分质量集中到了一个很小的结构上,否则大角度的散射是不可能的
[解释与结论]
(1)若原子质量,正电荷在原子内均匀分布,则极少数粒子就___________ (填 “会”或“不会”)发生大角度散射,卢瑟福所说的“除非原子的大部分质量集中到了一个很小的结构上”中的“很小的结构”指的是___________。
(2)1un金箔包含了5000层金原子,绝大多数a粒子穿过后方向不变,说明___________
A.原子的质量是均匀分布的 B.原子内部绝大部分空间是空的
(3)科学家对原子结构的探究经历了三个过程,通过a粒子散射实验,你认为原子结构为以下的___________。
24.“原子-分子”学说的建立经历了曲折的过程。
材料一:1803年,道尔顿在原子论中提出元素由微小的不可分的原子组成;不同元素的原子以简单数目比例形成不可再分的原子——“复杂原子”。
材料二:1809年,盖·吕萨克认同道尔顿的原子论,并提出自己的假说:在同温同压下,相同体积的不同气体中含有相同数目的原子(包括“复杂原子”)。道尔顿反对盖·吕萨克的假说,他认为若该假说成立,解释化学反应时,有些反应会推导出“半个原子”,与原于论矛盾。
材料三:1811年,阿伏加德罗提出分子学说,解决了道尔顿和盖·吕萨克的矛盾。随后科学家们确立并逐步完善了“原子—分子”学说。
(1)1897年,汤姆生发现原子内有带负电的___________,否定了“原子不可再分”的观点。
(2)道尔顿原子论中“复杂原子”构成的物质,按现在物质的组成分类,属于纯净物中的___________。
(3)依据道尔顿的原子论和盖·吕萨克的假说,下列反应能推导出“半个原子”的是___________。(可多选)
A.1升氢气和1升氯气化合成2升氯化氢气体
B.2升氢气和1升氧气化合成2升水蒸气
C.木炭与1升氧气化合成1升二氧化碳
D.木炭与1升二氧化碳化合成2升一氧化碳
E.硫与1升氢气化合成1升硫化氢气体
四、简答题
25.碳酸钙和氧化钙的混合物32g,其中钙元素的质量分数为50%,将其充分煅烧至完全分解,向剩余固体中加入足量的水,固体全部溶解,则生成氢氧化钙的质量为______。
26.莽草酸(C7H10O5)是制取抗“H7N9流感”的药物“达菲“的原料。试计算:
(1)莽草酸的相对分子质量;
(2)莽草酸(C7H10O5)中碳元素与氧元素的质量比;
(3)多少克莽草酸含碳元素的质量为168g;
(4)对1岁以上的儿童推荐按照下列“体重一剂量表”服用“达菲”:假如患病儿童的体重是20kg,在治疗过程中,需每天服用“达菲”胶囊(每颗胶囊含“达菲”75mg)2次,一个疗程5天,那么该患儿一个疗程共服用多少颗?
体重 小于等于l5kg 15~23kg 23~40kg 大于40kg
每次用量 30mg 45mg 60mg 75mg
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.C
3.B
4.A
5.C
6.B
7.B
8.D
9.C
10.C
11.C
12.A
13.D
14.C
15.D
16.C
17. 钛单质 质子数不同
18. 2种 不相同 20%
19. Au S2-
20. 白色固体##难溶于水 ① 被子
21. 乙 ABD
22. 3:1 48%
23. 不会 原子核 B C
24. 电子 化合物 ABD
25.解:混合物中钙元素的质量=32g×50%=16g
钙元素最终转化为氢氧化钙中的钙元素,则生成氢氧化钙的质量=16g÷×100%=29.6g
答:生成氢氧化钙的质量为29.6g。
26.(1)莽草酸的相对分子质量为12×7+1×10+16×5=174。
(2)莽草酸(C7H10O5)中碳元素与氧元素的质量比为(12×7):(16×5)=21:20。
(3)含碳元素的质量为168g需莽草酸的质量为:。
(4)由题意体重是20千克,由“体重-剂量表”每次用量45mg,每天服用“达菲”胶囊(每颗胶囊含“达菲”75mg)2次,一个疗程5天,该患儿需服用“达菲”的颗数为:45mg×2×5÷75mg/颗=6颗。
答案第1页,共2页
答案第1页,共2页
姓名:___________班级:___________考号:___________
一、选择题
1,氢元素有()种同位素。
A,1种 B 2种 C 3种 D 4种
2.下列所描述的粒子与氧原子一致的是( )
A.该粒子有8个质子,9个中子,10个电子
B.该粒子有9个质子,8个中子,10个电子
C.该粒子有8个质子,10个中子,8个电子
D.该粒子有9个质子,10个中子,8个电子
3.借助模型有利于学科概念的学习与理解,下列属于模型的是( )
A. B.
C. D.
4.科学家用滤纸和二氧化钛(TiO2)制出一种“纳米纸”,在纳米纸上“铺”一层“萘胺(C10H9N)染料制成试纸,用于检测食品中亚硝酸盐浓度的高低,下列说法正确的是( )
A.二氧化钛中Ti的化合价为+4 B.这种试纸是一种新型化合物
C.二氧化钛和萘胺都属于氧化物 D.萘胺中含有20个原子
5.厨师烹饪时常往食物中加入少量的酒和食醋,是因为酒和食醋在一定条件下能反应生成具有香味的乙酸乙酯(化学式为C4H8O2)。关于乙酸乙酯的说法错误的是( )
A.乙酸乙酯的相对分子质量为88
B.乙酸乙酯中氢元素的质量分数为9.1%
C.乙酸乙酯中碳、氢、氧元素的质量比为4∶8∶2
D.1个乙酸乙酯分子由4个碳原子、8个氢原子和2个氧原子构成
6.对下列化学用语中数字“2”含义的说法正确的是( )
① ② ③ ④ ⑤ ⑥ ⑦H2O
A.表示离子个数的是⑤⑥ B.表示分子中原子个数的是③⑦
C.表示离子所带电荷数的是④⑤ D.表示分子个数的是①②
7.高温下焦炭和硫酸钠制备硫化钠,Na2SO4+4CNa2S+4X,说法正确的是( )
A.该反应属于置换反应 B.在该反应中,C体现了还原性
C.反应前后硫元素化合价不变 D.X的化学式为CO2
8.2020年新型冠状病毒肺炎在全世界蔓延,距今为止全球确诊人数已达上千万,在治疗新型冠状病毒肺炎的过程中,一种名叫利巴韦林的药物已经成为了必用药,发挥了巨大作用。利巴韦林别名三氮唑核苷,化学式为 C8H12N4O5,为白色结晶性粉末,无臭,在乙醇中微溶。下列关于此药物的说法正确的是( )
A.三氮唑核苷分子是由 8 个碳原子、12 个氢原子、4 个氮原子和 5 个氧原子构成的
B.三氮唑核苷的相对分子质量为 244 g
C.三氮唑核苷为白色结晶性粉末,无臭,是物理性质,在乙醇中微溶是化学性质
D.三氮唑核苷中的氮含量约为 23.0%
9.由于波音飞机的两起重大事故,我国的C919大型客机迎来了发展的机遇。C919部分机身采用了新型的铝锂合金,铝锂合金中的铝(Al)元素和锂(Li)元素的本质区别是( )
A.元素符号不同
B.相对原子质量不同
C.原子的质子数不同
D.原子的电子数不同
10.下图是电解水时,水分子分解过程示意图,关于对该图理解的叙述中,正确的是( )
A.水分子中含有氢分子和氧原子
B.分子可分,原子不可分
C.水分子是保持水化学性质的最小微粒
D.水电解过程中,分子的种类、原子的数目不变
11.如图表示四种原子的结构模型(“”、“”和“”分别表示电子、中子、质子),下列说法正确的是( )
A.甲、丙的核电荷数不同
B.乙、丁不属于同一种元素
C.甲、丁的相对原子质量相同
D.甲、乙为互为同位素原子
12.俄国科学家门捷列夫对元素周期表的编制做出了巨大贡献,人们将101号元素命名为“钔”来纪念他。钔原子的核电荷数为101,相对原子质量为258,则钔原子的核外电子数为( )
A.101 B.157 C.258 D.359
13.2021年12月,我国航天员王亚平等开授“天宫课堂”,介绍了中国空间站通过电解水获得氧气的情况。电解水变化过程可用如图模型表示(图中●代表氧原子,○代表氢原子),图中表示生成氧气的是( )
A.① B.② C.③ D.④
14.在和的混合气体中,碳元素的质量分数是24%,则和的质量比是( )
A.2:5 B.3:1 C.3:22 D.8:11
15.如图是书上水电解示意图,下列说法不正确的是( )
A.这个实验可以说明水分子含有两种不同的,更小的粒子,这种粒子就是原子。
B.一个水分子种含有两个氢原子和一个氧原子。
C.水是由水分子构成的
D.水是由氢原子与氧原子组成的
16.卢瑟福用a粒子(带正电)轰击金箔的实验为建立现代原子理论打下了基础。图示线条中,不可能是α粒子在该实验中的运动轨迹的是( )
A.① B.② C.③ D.④
二、填空题
17.科学探测到月球表面含有多种金属,其中钛合金被称为海洋金属,不仅强度高,而且有弹性。根据图中的部分信息填空:
(1)Ti可以表示钛元素、1个钛原子,还可以表示___________。
(2)铝元素和钛元素的根本区别是___________。
18.有水(H2O)、双氧水(H2O2)、重水(D2O)(“D”表示原子核中有一个质子和一个中子的氢原子)三种物质,从物质组成的角度看,这三种物质所含的元素共有___________种; 水与双氧水的化学性质___________(选填“不相同”、“相同”);重水中氢元素的质量分数是___________。
19.“中国铜都”江西德兴金矿、铜矿资源丰富。请用恰当的化学用语表示下列带点部分:
(1)黄金中含有金元素:___________。
(2)辉铜矿的主要成分是硫化亚铜(Cu2S),硫化亚铜中阴离子的符号:___________ 。
(3)从黄铜矿(主要成分CuFeS2)中提取铜,标出其中一种生成物氧化亚铁中铁元素的化合价:___________。
20.据报道,我国科学家发现治疗新冠的新药——中药千金藤素,获得国家发明专利授权。千金藤素来自千金藤,其化学式为C37H38N2O6,白色固体,难溶于水,易氧化,需密封避光低温保存。
(1)根据上述信息,写出千金藤素的一条物理性质:___________。
(2)千金藤素中各元素质量分数如图甲所示,其中表示碳元素的是___________。(填序号)
(3)图乙所示为千金藤植株,据图判断其为___________植物。
21.人类对原子结构的认识,经历了汤姆生、卢瑟福和玻尔等提出的模型的过程。
(1)卢瑟福核式结构模型是在利用粒子轰击金箔实验的基础上提出的。下列能正确反映他的实验结果的示意图是___________;
(2)从原子结构模型建立的过程中,我们发现___________(选填序号)。
A.科学模型的建立是一个不断完善、不断修正的过程
B.模型在科学研究中起着很重要的作用
C.玻尔的原子模型建立,使人们对原子结构的认识达到了完美的境界
D.人类借助模型的建立,对原子的认识逐渐接近本质
22.山梨酸钾(化学式为C5H7COOK)是国际粮农组织和卫生组织推荐的高效安全的防腐保鲜剂,在某市海产品深加工过程中广泛使用。
(1)该物质中碳、氧元素的原子个数比是_______________。
(2)该物质中碳元素的质量分数为_______________。
三、探究题
23.探究原子结构的奥秘。
[情景提供] 19世纪以前,人们一直以为原子是不可分的,直到1887年,汤姆生发现了带负电的电子后,才引起人们对原子结构模型的探索。
[提出问题]电子带负电,原子不带电,说明原子内存在着带正电荷的部分,它们是均匀分布还是集中分布的呢?
[进行实验] 1910年英国科学家卢瑟福进行了著名的a粒子轰击金箔实验。
实验做法如图∶
(1)放射源-放射性物质放出a粒子(带正电荷),质量是电子质量的7000倍∶
(2)金箔-作为靶子,厚度1um, 重叠了3000层左右的原子∶
(3) 荧光屏-a粒子打在上面发出闪光∶
(4)显微镜--通过显微镜观察闪光,且通过360度转动可观察不同角度a粒子的到达情况。
[收集证据]绝大多数a粒子穿过金箔后仍沿原来的方向前进,但是有少数a粒子却发生了较大的偏转,并且有极少数口粒子的偏转超过90°,有的甚至几乎达到180°,像是被金箔弹了回来
[猜想与假设] a粒子遇到电子后,就像飞行的子弹碰到灰尘一样运动方向不会发生明显的改变,而结果却出乎意料,除非原子的大部分质量集中到了一个很小的结构上,否则大角度的散射是不可能的
[解释与结论]
(1)若原子质量,正电荷在原子内均匀分布,则极少数粒子就___________ (填 “会”或“不会”)发生大角度散射,卢瑟福所说的“除非原子的大部分质量集中到了一个很小的结构上”中的“很小的结构”指的是___________。
(2)1un金箔包含了5000层金原子,绝大多数a粒子穿过后方向不变,说明___________
A.原子的质量是均匀分布的 B.原子内部绝大部分空间是空的
(3)科学家对原子结构的探究经历了三个过程,通过a粒子散射实验,你认为原子结构为以下的___________。
24.“原子-分子”学说的建立经历了曲折的过程。
材料一:1803年,道尔顿在原子论中提出元素由微小的不可分的原子组成;不同元素的原子以简单数目比例形成不可再分的原子——“复杂原子”。
材料二:1809年,盖·吕萨克认同道尔顿的原子论,并提出自己的假说:在同温同压下,相同体积的不同气体中含有相同数目的原子(包括“复杂原子”)。道尔顿反对盖·吕萨克的假说,他认为若该假说成立,解释化学反应时,有些反应会推导出“半个原子”,与原于论矛盾。
材料三:1811年,阿伏加德罗提出分子学说,解决了道尔顿和盖·吕萨克的矛盾。随后科学家们确立并逐步完善了“原子—分子”学说。
(1)1897年,汤姆生发现原子内有带负电的___________,否定了“原子不可再分”的观点。
(2)道尔顿原子论中“复杂原子”构成的物质,按现在物质的组成分类,属于纯净物中的___________。
(3)依据道尔顿的原子论和盖·吕萨克的假说,下列反应能推导出“半个原子”的是___________。(可多选)
A.1升氢气和1升氯气化合成2升氯化氢气体
B.2升氢气和1升氧气化合成2升水蒸气
C.木炭与1升氧气化合成1升二氧化碳
D.木炭与1升二氧化碳化合成2升一氧化碳
E.硫与1升氢气化合成1升硫化氢气体
四、简答题
25.碳酸钙和氧化钙的混合物32g,其中钙元素的质量分数为50%,将其充分煅烧至完全分解,向剩余固体中加入足量的水,固体全部溶解,则生成氢氧化钙的质量为______。
26.莽草酸(C7H10O5)是制取抗“H7N9流感”的药物“达菲“的原料。试计算:
(1)莽草酸的相对分子质量;
(2)莽草酸(C7H10O5)中碳元素与氧元素的质量比;
(3)多少克莽草酸含碳元素的质量为168g;
(4)对1岁以上的儿童推荐按照下列“体重一剂量表”服用“达菲”:假如患病儿童的体重是20kg,在治疗过程中,需每天服用“达菲”胶囊(每颗胶囊含“达菲”75mg)2次,一个疗程5天,那么该患儿一个疗程共服用多少颗?
体重 小于等于l5kg 15~23kg 23~40kg 大于40kg
每次用量 30mg 45mg 60mg 75mg
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.C
3.B
4.A
5.C
6.B
7.B
8.D
9.C
10.C
11.C
12.A
13.D
14.C
15.D
16.C
17. 钛单质 质子数不同
18. 2种 不相同 20%
19. Au S2-
20. 白色固体##难溶于水 ① 被子
21. 乙 ABD
22. 3:1 48%
23. 不会 原子核 B C
24. 电子 化合物 ABD
25.解:混合物中钙元素的质量=32g×50%=16g
钙元素最终转化为氢氧化钙中的钙元素,则生成氢氧化钙的质量=16g÷×100%=29.6g
答:生成氢氧化钙的质量为29.6g。
26.(1)莽草酸的相对分子质量为12×7+1×10+16×5=174。
(2)莽草酸(C7H10O5)中碳元素与氧元素的质量比为(12×7):(16×5)=21:20。
(3)含碳元素的质量为168g需莽草酸的质量为:。
(4)由题意体重是20千克,由“体重-剂量表”每次用量45mg,每天服用“达菲”胶囊(每颗胶囊含“达菲”75mg)2次,一个疗程5天,该患儿需服用“达菲”的颗数为:45mg×2×5÷75mg/颗=6颗。
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
