2022—2023学年化学沪教版(全国)九年级下册第7章 应用广泛的酸、碱、盐 分层选练题(含答案)
文档属性
| 名称 | 2022—2023学年化学沪教版(全国)九年级下册第7章 应用广泛的酸、碱、盐 分层选练题(含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 357.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-30 20:21:01 | ||
图片预览



文档简介
2022—2023学年化学沪教版(全国)九年级下册第7章 应用广泛的酸、碱、盐 分层选练题附答案
沪教版(全国)第7章 应用广泛的酸、碱、盐
一、选择题。
1、某地农业科技工作者在进行“酸雨对农业产量影响及对策的研究”中,得出酸雨的pH大小与小麦减产幅度关系的一组数据如下表所示。根据数据判断,下列说法正确的是( )
酸雨pH[来 3.58 4.59 4.86
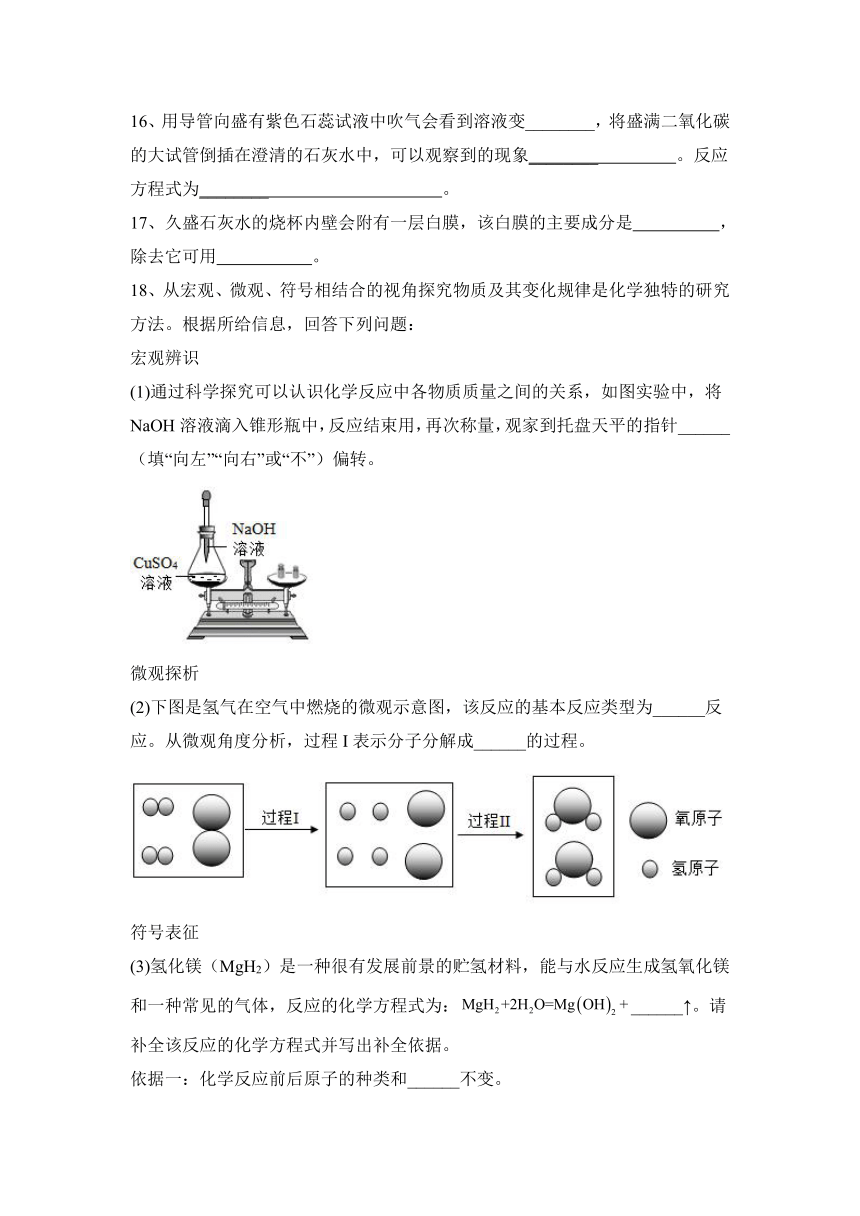
小麦减产(%) 10 5 3
A.酸雨的pH越大,小麦减产幅度越大
B.酸雨的pH越小,小麦减产幅度越大
C.酸雨的酸性越强,小麦的减产越小
D.酸雨的酸性越强,小麦的减产越大
2、不可能由两种元素组成的化合物是( )
A.氧化物 B.酸 C.碱 D.盐
3、现有甲、乙、丙三种金属,先将三者分别加入到硫酸亚铁溶液中,只有甲可使溶液中析出铁单质。再将三者加入到硝酸银溶液中,只有乙不能使溶液中析出银单质,则三者的金属活动性从强到弱的顺序是( )
A.甲>乙>丙 B.乙>甲>丙 C.甲>丙>乙 D.无法判断
4、一包固体粉末可能含有NaNO3、CaCO3、NaOH、CuCl2、NaCl和Ca(NO3)2中的一种或几种,为确定其组成,某同学设计了如下实验方案:
下列判断正确的是( )
A.蓝色溶液B中阳离子只有Cu2+
B.无色溶液A中一定有NaOH
C.原固体粉末一定有NaCl
D.原固体粉末一定有CaCO3、NaOH、NaNO3、CuCl2和Ca(NO3)2
5、下列实验操作符合规范的是( )
A.测溶液的pH B.稀释浓硫酸 C.加热液体 D.取用液体试剂
6、下列化学方程式与客观事实相符,且书写完全正确的是( )
A.用过氧化氢溶液制氧气:
B.铁丝在氧气中燃烧:
C.用稀硫酸除铁锈:
D.用澄清石灰水检验二氧化碳:
7、下列能正确表示加水稀释pH=10的溶液的是( )
A. B. C. D.
8、下列关于氢氧化钠的描述中不正确的是( )
A.曝露在空气中易潮解 B.能与酸发生中和反应
C.其水溶液能使石蕊溶液变红 D.对皮肤有强烈的腐蚀作用
9、若利用碱的性质进行下列实验,不能达到相应目的的是( )
A.分别加入少量Mg(OH)2固体,根据是否溶解,可鉴别稀盐酸和Na2CO3溶液
B.分别加入适量水溶解,根据温度是否明显升高,可鉴别NaOH固体和NaCl固体
C.分别加入Ba(OH)2溶液,根据是否产生沉淀,可鉴别MgCl2溶液和Na2SO4溶液
D.分别加入熟石灰粉末研磨,根据是否产生氨味,可鉴别(NH4)2SO4固体和K2SO4固体
10、下列实验操作及现象合理的是( )
A.用pH试纸测得某溶液的pH=1.4
B.用托盘天平称取5.6 g硝酸钾固体
C.铁丝在O2中燃烧,生成白色固体
D.鸡蛋清遇碘水变蓝色
11、饮食过量,胃酸会大量分泌,以致消化不良。为缓减该症状,下列药剂不适宜的是( )
A.氢氧化铝 B.氯化钠 C.碳酸镁 D.碳酸氢钠
12、“雪碧”等碳酸型饮料饮用前晃动后打开,其pH将( )
A.变大 B.变小 C.不变 D.无法确定
13、将适量的铜粉和镁粉的混合物放入一定量的硝酸银溶液中,充分反应后过滤,得到固体物质和无色滤液,则关于滤出的固体和无色滤液的下列判断正确的是( )
A.滤出的固体中一定含有银和铜,一定不含镁
B.滤出的固体中一定含有银,可能含有铜和镁
C.滤液中一定含有硝酸银和硝酸镁,一定没有硝酸铜
D.滤液中一定含有硝酸镁,一定没有硝酸银和硝酸铜
*14、钯(Pd)是一种稀有的贵金属,钯镍合金在电子工业等有广泛应用。已知钯、镍、铜三种金属的活动性强弱顺序是Ni>Cu>Pd,下列实验可以验证三者金属活动性强弱的实验组合是( )
①Cu+硝酸镍溶液 ②Pd+稀盐酸 ③Pd+硫酸铜溶液 ④Ni+稀盐酸
A.①② B.①③ C.②③ D.②④
15、小东同学家的西红柿植株生长不茂盛,叶色淡绿需要施加的肥料是( )
A.尿素 B.磷矿粉 C.碳酸钾 D.磷酸二氢钾
二、填空题。
16、用导管向盛有紫色石蕊试液中吹气会看到溶液变________,将盛满二氧化碳的大试管倒插在澄清的石灰水中,可以观察到的现象________ 。反应方程式为________ 。
17、久盛石灰水的烧杯内壁会附有一层白膜,该白膜的主要成分是 ,除去它可用 。
18、从宏观、微观、符号相结合的视角探究物质及其变化规律是化学独特的研究方法。根据所给信息,回答下列问题:
宏观辨识
(1)通过科学探究可以认识化学反应中各物质质量之间的关系,如图实验中,将NaOH溶液滴入锥形瓶中,反应结束用,再次称量,观家到托盘天平的指针______(填“向左”“向右”或“不”)偏转。
微观探析
(2)下图是氢气在空气中燃烧的微观示意图,该反应的基本反应类型为______反应。从微观角度分析,过程I表示分子分解成______的过程。
符号表征
(3)氢化镁(MgH2)是一种很有发展前景的贮氢材料,能与水反应生成氢氧化镁和一种常见的气体,反应的化学方程式为:______↑。请补全该反应的化学方程式并写出补全依据。
依据一:化学反应前后原子的种类和______不变。
依据二:______ 。
19、如果实验室没有pH试纸,又要测定未知溶液的酸碱性,可选用 试液来进行实验,该试液从 色变成 色,能确定其呈碱性。
20、判断题:
(1)氢氧化铝可治疗胃酸过多,故氢氧化钠也可治疗胃酸过多( )
(2)生锈的铁钉加入适量的稀盐酸后溶液也会变成浅绿色( )
(3)用稀盐酸除去水垢( )
(4)铁能与氢氧化钠溶液反应放出氢气( )
(5)“要留清白在人间”实现了从Ca(OH)2到CaCO3的转化( )
21、在一张洁白干燥的滤纸上依次喷洒 A、B、C三种无色液体,当喷洒A时滤纸无明显变化,再喷洒B时滤纸上显出一间红色小屋,最后喷洒C时红色小屋又消失了,回答下列问题:滤纸上的小屋事先是用_______试剂画出的.无色液体A是___________;B是___________;C是_________.
22、玻璃中含有二氧化硅,请用化学方程式表示盛放NaOH溶液的试剂瓶塞不能用玻璃塞的原因 。
23、利用海水提取粗盐的过程如下图所示,回答有关问题
(1)一定质量的海水,通过贮水池引入到蒸发池中,在没有引入结晶池之前的蒸发过程中,蒸发池中氯化 钠的质量会__________(填“增大”、“不变”或“减小”)。
(2)粗盐中含有的难溶性杂质,在实验室里可以通过溶解、过滤、蒸发等操作将其去除,这些操作中都会用到玻璃棒,其中在过滤操作中玻璃棒的作用是________(填“引流”或“加快溶解”)。
(3)用氯化钠固体配制100g质量分数为6%的氯化钠溶液。
①配制时,涉及以下实验步骤:
A.称量及量取 B.计算 C.溶解 D.装瓶贴标签。
其正确的实验步骤顺序是______________(填字母)
②将已配好的100g质量分数为6%的氯化钠溶液变成质量分数为16%的氯化钠溶液,需要再加NaCl的质量是______________g(计算结果精确到0.1)
三、综合应用题。
24、某同学称取10g碳酸钙粉末,如图所示进行实验。
(1)计算10g碳酸钙完全分解生成二氧化碳的物质的量。(根据化学方程式列式计算)_____
(2)加热一段时间后欲停止实验,应先_____。
(3)对加热后的剩余固体A进行实验,过程如右图所示。滤液B的溶质是_____;步骤Ⅲ中生成气体的化学方程式是_____ ;剩余固体A的成分是_____ 。
(4)不使用酚酞试液和稀盐酸也可以确定剩余固体A的成分,写出方法、结论及依据:_____
_____ 。
四、实验题。
25、某校同学开展了如图所示“溶液酸碱性的检验”的实验活动:
(1)把自制的紫薯汁按图1所示分别滴加到试管中,观察到的现象如下表所示
溶液 白醋 盐酸 蔗糖水 草木灰水 石灰水
加入紫薯汁之后的颜色 红色 红色 紫色 绿色 绿色
①图1中存放紫薯汁的仪器名称是 。
②据上表推测,紫薯汁遇到稀硫酸溶液可能显示的颜色是 ,该汁液
(填“能”或“不能”)作酸碱指示剂。
(2)用pH试纸测定图1中部分溶液的酸碱度:草木灰水pH>7,属于 (填“酸性”、“中性”或“碱性”)溶液,白醋pH (填“>”“<”或“=”)7。
(3)图2是三位同学分别测定土壤酸碱度的操作示意图,其中正确的是 (填“A”、“B”或“C”,下同),可能导致被测溶液的pH数值发生改变的错误操作是 。
五、计算类题。
26、某化工厂排放的废水中含有一定量的氢氧化钾为了回收利用,欲用2%的稀盐酸测定废水中的氢氧化钾含量(废水中其他杂质不与盐酸反应)。取20g该废水于锥形瓶中,逐滴加入2%的稀盐酸,至恰好完全反应时,消耗稀盐酸7.3g,求废水中氢氧化钾的质量分数。
2022—2023学年化学沪教版(全国)九年级下册第7章 应用广泛的酸、碱、盐 分层选练题附答案
沪教版(全国)第7章 应用广泛的酸、碱、盐
一、选择题。
1、某地农业科技工作者在进行“酸雨对农业产量影响及对策的研究”中,得出酸雨的pH大小与小麦减产幅度关系的一组数据如下表所示。根据数据判断,下列说法正确的是( )
酸雨pH[来 3.58 4.59 4.86
小麦减产(%) 10 5 3
A.酸雨的pH越大,小麦减产幅度越大
B.酸雨的pH越小,小麦减产幅度越大
C.酸雨的酸性越强,小麦的减产越小
D.酸雨的酸性越强,小麦的减产越大
【答案】B D
2、不可能由两种元素组成的化合物是( )
A.氧化物 B.酸 C.碱 D.盐
【答案】C
3、现有甲、乙、丙三种金属,先将三者分别加入到硫酸亚铁溶液中,只有甲可使溶液中析出铁单质。再将三者加入到硝酸银溶液中,只有乙不能使溶液中析出银单质,则三者的金属活动性从强到弱的顺序是( )
A.甲>乙>丙 B.乙>甲>丙 C.甲>丙>乙 D.无法判断
【答案】C
4、一包固体粉末可能含有NaNO3、CaCO3、NaOH、CuCl2、NaCl和Ca(NO3)2中的一种或几种,为确定其组成,某同学设计了如下实验方案:
下列判断正确的是( )
A.蓝色溶液B中阳离子只有Cu2+
B.无色溶液A中一定有NaOH
C.原固体粉末一定有NaCl
D.原固体粉末一定有CaCO3、NaOH、NaNO3、CuCl2和Ca(NO3)2
【答案】B
5、下列实验操作符合规范的是( )
A.测溶液的pH B.稀释浓硫酸 C.加热液体 D.取用液体试剂
【答案】B
6、下列化学方程式与客观事实相符,且书写完全正确的是( )
A.用过氧化氢溶液制氧气:
B.铁丝在氧气中燃烧:
C.用稀硫酸除铁锈:
D.用澄清石灰水检验二氧化碳:
【答案】D
7、下列能正确表示加水稀释pH=10的溶液的是( )
A. B. C. D.
【答案】D
8、下列关于氢氧化钠的描述中不正确的是( )
A.曝露在空气中易潮解 B.能与酸发生中和反应
C.其水溶液能使石蕊溶液变红 D.对皮肤有强烈的腐蚀作用
【答案】C
9、若利用碱的性质进行下列实验,不能达到相应目的的是( )
A.分别加入少量Mg(OH)2固体,根据是否溶解,可鉴别稀盐酸和Na2CO3溶液
B.分别加入适量水溶解,根据温度是否明显升高,可鉴别NaOH固体和NaCl固体
C.分别加入Ba(OH)2溶液,根据是否产生沉淀,可鉴别MgCl2溶液和Na2SO4溶液
D.分别加入熟石灰粉末研磨,根据是否产生氨味,可鉴别(NH4)2SO4固体和K2SO4固体
【答案】C
10、下列实验操作及现象合理的是( )
A.用pH试纸测得某溶液的pH=1.4
B.用托盘天平称取5.6 g硝酸钾固体
C.铁丝在O2中燃烧,生成白色固体
D.鸡蛋清遇碘水变蓝色
【答案】B
11、饮食过量,胃酸会大量分泌,以致消化不良。为缓减该症状,下列药剂不适宜的是( )
A.氢氧化铝 B.氯化钠 C.碳酸镁 D.碳酸氢钠
【答案】B
12、“雪碧”等碳酸型饮料饮用前晃动后打开,其pH将( )
A.变大 B.变小 C.不变 D.无法确定
【答案】A
13、将适量的铜粉和镁粉的混合物放入一定量的硝酸银溶液中,充分反应后过滤,得到固体物质和无色滤液,则关于滤出的固体和无色滤液的下列判断正确的是( )
A.滤出的固体中一定含有银和铜,一定不含镁
B.滤出的固体中一定含有银,可能含有铜和镁
C.滤液中一定含有硝酸银和硝酸镁,一定没有硝酸铜
D.滤液中一定含有硝酸镁,一定没有硝酸银和硝酸铜
【答案】B
*14、钯(Pd)是一种稀有的贵金属,钯镍合金在电子工业等有广泛应用。已知钯、镍、铜三种金属的活动性强弱顺序是Ni>Cu>Pd,下列实验可以验证三者金属活动性强弱的实验组合是( )
①Cu+硝酸镍溶液 ②Pd+稀盐酸 ③Pd+硫酸铜溶液 ④Ni+稀盐酸
A.①② B.①③ C.②③ D.②④
【答案】B
15、小东同学家的西红柿植株生长不茂盛,叶色淡绿需要施加的肥料是( )
A.尿素 B.磷矿粉 C.碳酸钾 D.磷酸二氢钾
【答案】A
二、填空题。
16、用导管向盛有紫色石蕊试液中吹气会看到溶液变________,将盛满二氧化碳的大试管倒插在澄清的石灰水中,可以观察到的现象________ 。反应方程式为________ 。
【答案】红; 澄清石灰水变浑浊; CO2+Ca(OH)2=CaCO3↓+H2O
17、久盛石灰水的烧杯内壁会附有一层白膜,该白膜的主要成分是 ,除去它可用 。
【答案】Ca(OH)2 稀盐酸
18、从宏观、微观、符号相结合的视角探究物质及其变化规律是化学独特的研究方法。根据所给信息,回答下列问题:
宏观辨识
(1)通过科学探究可以认识化学反应中各物质质量之间的关系,如图实验中,将NaOH溶液滴入锥形瓶中,反应结束用,再次称量,观家到托盘天平的指针______(填“向左”“向右”或“不”)偏转。
微观探析
(2)下图是氢气在空气中燃烧的微观示意图,该反应的基本反应类型为______反应。从微观角度分析,过程I表示分子分解成______的过程。
符号表征
(3)氢化镁(MgH2)是一种很有发展前景的贮氢材料,能与水反应生成氢氧化镁和一种常见的气体,反应的化学方程式为:______↑。请补全该反应的化学方程式并写出补全依据。
依据一:化学反应前后原子的种类和______不变。
依据二:______ 。
【答案】(1)不 (2) 化合 原子
(3) 2H2 数目 每个氢分子由2个氢原子构成
19、如果实验室没有pH试纸,又要测定未知溶液的酸碱性,可选用 试液来进行实验,该试液从 色变成 色,能确定其呈碱性。
【答案】无色酚酞 无 红
20、判断题:
(1)氢氧化铝可治疗胃酸过多,故氢氧化钠也可治疗胃酸过多( )
(2)生锈的铁钉加入适量的稀盐酸后溶液也会变成浅绿色( )
(3)用稀盐酸除去水垢( )
(4)铁能与氢氧化钠溶液反应放出氢气( )
(5)“要留清白在人间”实现了从Ca(OH)2到CaCO3的转化( )
【答案】(1)错误 (2)错误 (3)正确 (4)错误 (5)正确
21、在一张洁白干燥的滤纸上依次喷洒 A、B、C三种无色液体,当喷洒A时滤纸无明显变化,再喷洒B时滤纸上显出一间红色小屋,最后喷洒C时红色小屋又消失了,回答下列问题:滤纸上的小屋事先是用_______试剂画出的.无色液体A是___________;B是___________;C是_________.
【答案】酚酞 水 氢氧化钠 稀盐酸
22、玻璃中含有二氧化硅,请用化学方程式表示盛放NaOH溶液的试剂瓶塞不能用玻璃塞的原因 。
【答案】2NaOH + SiO2 = Na2SiO3 + H2O
23、利用海水提取粗盐的过程如下图所示,回答有关问题
(1)一定质量的海水,通过贮水池引入到蒸发池中,在没有引入结晶池之前的蒸发过程中,蒸发池中氯化 钠的质量会__________(填“增大”、“不变”或“减小”)。
(2)粗盐中含有的难溶性杂质,在实验室里可以通过溶解、过滤、蒸发等操作将其去除,这些操作中都会用到玻璃棒,其中在过滤操作中玻璃棒的作用是________(填“引流”或“加快溶解”)。
(3)用氯化钠固体配制100g质量分数为6%的氯化钠溶液。
①配制时,涉及以下实验步骤:
A.称量及量取 B.计算 C.溶解 D.装瓶贴标签。
其正确的实验步骤顺序是______________(填字母)
②将已配好的100g质量分数为6%的氯化钠溶液变成质量分数为16%的氯化钠溶液,需要再加NaCl的质量是______________g(计算结果精确到0.1)
【答案】不变 引流 BACD 11.9
三、综合应用题。
24、某同学称取10g碳酸钙粉末,如图所示进行实验。
(1)计算10g碳酸钙完全分解生成二氧化碳的物质的量。(根据化学方程式列式计算)_____
(2)加热一段时间后欲停止实验,应先_____。
(3)对加热后的剩余固体A进行实验,过程如右图所示。滤液B的溶质是_____;步骤Ⅲ中生成气体的化学方程式是_____ ;剩余固体A的成分是_____ 。
(4)不使用酚酞试液和稀盐酸也可以确定剩余固体A的成分,写出方法、结论及依据:_____
_____ 。
【答案】(1)0.1mol (2)将导管从石灰水中取出
(3)Ca(OH)2 CaCO3+2HCl=CaCl2+H2O+CO2↑ CaO、CaCO3
(4)称量剩余固体A的质量m,根据质量守恒定律:若m为10g,剩余固体A成分为CaCO3;若5.6g四、实验题。
25、某校同学开展了如图所示“溶液酸碱性的检验”的实验活动:
(1)把自制的紫薯汁按图1所示分别滴加到试管中,观察到的现象如下表所示
溶液 白醋 盐酸 蔗糖水 草木灰水 石灰水
加入紫薯汁之后的颜色 红色 红色 紫色 绿色 绿色
①图1中存放紫薯汁的仪器名称是 。
②据上表推测,紫薯汁遇到稀硫酸溶液可能显示的颜色是 ,该汁液
(填“能”或“不能”)作酸碱指示剂。
(2)用pH试纸测定图1中部分溶液的酸碱度:草木灰水pH>7,属于 (填“酸性”、“中性”或“碱性”)溶液,白醋pH (填“>”“<”或“=”)7。
(3)图2是三位同学分别测定土壤酸碱度的操作示意图,其中正确的是 (填“A”、“B”或“C”,下同),可能导致被测溶液的pH数值发生改变的错误操作是 。
【答案】(1)①滴瓶 ②红色 能 (2)碱性 < (3)B C
五、计算类题。
26、某化工厂排放的废水中含有一定量的氢氧化钾为了回收利用,欲用2%的稀盐酸测定废水中的氢氧化钾含量(废水中其他杂质不与盐酸反应)。取20g该废水于锥形瓶中,逐滴加入2%的稀盐酸,至恰好完全反应时,消耗稀盐酸7.3g,求废水中氢氧化钾的质量分数。
【答案】设参加反应的氢氧化钾的质量为x。
x=0.224g
废水中氢氧化钾的质量分数为。
答:废水中氢氧化钾的质量分数为1.12%。
pH
7
pH
7
pH
7
pH
7
pH
7
pH
7
pH
7
pH
7
沪教版(全国)第7章 应用广泛的酸、碱、盐
一、选择题。
1、某地农业科技工作者在进行“酸雨对农业产量影响及对策的研究”中,得出酸雨的pH大小与小麦减产幅度关系的一组数据如下表所示。根据数据判断,下列说法正确的是( )
酸雨pH[来 3.58 4.59 4.86
小麦减产(%) 10 5 3
A.酸雨的pH越大,小麦减产幅度越大
B.酸雨的pH越小,小麦减产幅度越大
C.酸雨的酸性越强,小麦的减产越小
D.酸雨的酸性越强,小麦的减产越大
2、不可能由两种元素组成的化合物是( )
A.氧化物 B.酸 C.碱 D.盐
3、现有甲、乙、丙三种金属,先将三者分别加入到硫酸亚铁溶液中,只有甲可使溶液中析出铁单质。再将三者加入到硝酸银溶液中,只有乙不能使溶液中析出银单质,则三者的金属活动性从强到弱的顺序是( )
A.甲>乙>丙 B.乙>甲>丙 C.甲>丙>乙 D.无法判断
4、一包固体粉末可能含有NaNO3、CaCO3、NaOH、CuCl2、NaCl和Ca(NO3)2中的一种或几种,为确定其组成,某同学设计了如下实验方案:
下列判断正确的是( )
A.蓝色溶液B中阳离子只有Cu2+
B.无色溶液A中一定有NaOH
C.原固体粉末一定有NaCl
D.原固体粉末一定有CaCO3、NaOH、NaNO3、CuCl2和Ca(NO3)2
5、下列实验操作符合规范的是( )
A.测溶液的pH B.稀释浓硫酸 C.加热液体 D.取用液体试剂
6、下列化学方程式与客观事实相符,且书写完全正确的是( )
A.用过氧化氢溶液制氧气:
B.铁丝在氧气中燃烧:
C.用稀硫酸除铁锈:
D.用澄清石灰水检验二氧化碳:
7、下列能正确表示加水稀释pH=10的溶液的是( )
A. B. C. D.
8、下列关于氢氧化钠的描述中不正确的是( )
A.曝露在空气中易潮解 B.能与酸发生中和反应
C.其水溶液能使石蕊溶液变红 D.对皮肤有强烈的腐蚀作用
9、若利用碱的性质进行下列实验,不能达到相应目的的是( )
A.分别加入少量Mg(OH)2固体,根据是否溶解,可鉴别稀盐酸和Na2CO3溶液
B.分别加入适量水溶解,根据温度是否明显升高,可鉴别NaOH固体和NaCl固体
C.分别加入Ba(OH)2溶液,根据是否产生沉淀,可鉴别MgCl2溶液和Na2SO4溶液
D.分别加入熟石灰粉末研磨,根据是否产生氨味,可鉴别(NH4)2SO4固体和K2SO4固体
10、下列实验操作及现象合理的是( )
A.用pH试纸测得某溶液的pH=1.4
B.用托盘天平称取5.6 g硝酸钾固体
C.铁丝在O2中燃烧,生成白色固体
D.鸡蛋清遇碘水变蓝色
11、饮食过量,胃酸会大量分泌,以致消化不良。为缓减该症状,下列药剂不适宜的是( )
A.氢氧化铝 B.氯化钠 C.碳酸镁 D.碳酸氢钠
12、“雪碧”等碳酸型饮料饮用前晃动后打开,其pH将( )
A.变大 B.变小 C.不变 D.无法确定
13、将适量的铜粉和镁粉的混合物放入一定量的硝酸银溶液中,充分反应后过滤,得到固体物质和无色滤液,则关于滤出的固体和无色滤液的下列判断正确的是( )
A.滤出的固体中一定含有银和铜,一定不含镁
B.滤出的固体中一定含有银,可能含有铜和镁
C.滤液中一定含有硝酸银和硝酸镁,一定没有硝酸铜
D.滤液中一定含有硝酸镁,一定没有硝酸银和硝酸铜
*14、钯(Pd)是一种稀有的贵金属,钯镍合金在电子工业等有广泛应用。已知钯、镍、铜三种金属的活动性强弱顺序是Ni>Cu>Pd,下列实验可以验证三者金属活动性强弱的实验组合是( )
①Cu+硝酸镍溶液 ②Pd+稀盐酸 ③Pd+硫酸铜溶液 ④Ni+稀盐酸
A.①② B.①③ C.②③ D.②④
15、小东同学家的西红柿植株生长不茂盛,叶色淡绿需要施加的肥料是( )
A.尿素 B.磷矿粉 C.碳酸钾 D.磷酸二氢钾
二、填空题。
16、用导管向盛有紫色石蕊试液中吹气会看到溶液变________,将盛满二氧化碳的大试管倒插在澄清的石灰水中,可以观察到的现象________ 。反应方程式为________ 。
17、久盛石灰水的烧杯内壁会附有一层白膜,该白膜的主要成分是 ,除去它可用 。
18、从宏观、微观、符号相结合的视角探究物质及其变化规律是化学独特的研究方法。根据所给信息,回答下列问题:
宏观辨识
(1)通过科学探究可以认识化学反应中各物质质量之间的关系,如图实验中,将NaOH溶液滴入锥形瓶中,反应结束用,再次称量,观家到托盘天平的指针______(填“向左”“向右”或“不”)偏转。
微观探析
(2)下图是氢气在空气中燃烧的微观示意图,该反应的基本反应类型为______反应。从微观角度分析,过程I表示分子分解成______的过程。
符号表征
(3)氢化镁(MgH2)是一种很有发展前景的贮氢材料,能与水反应生成氢氧化镁和一种常见的气体,反应的化学方程式为:______↑。请补全该反应的化学方程式并写出补全依据。
依据一:化学反应前后原子的种类和______不变。
依据二:______ 。
19、如果实验室没有pH试纸,又要测定未知溶液的酸碱性,可选用 试液来进行实验,该试液从 色变成 色,能确定其呈碱性。
20、判断题:
(1)氢氧化铝可治疗胃酸过多,故氢氧化钠也可治疗胃酸过多( )
(2)生锈的铁钉加入适量的稀盐酸后溶液也会变成浅绿色( )
(3)用稀盐酸除去水垢( )
(4)铁能与氢氧化钠溶液反应放出氢气( )
(5)“要留清白在人间”实现了从Ca(OH)2到CaCO3的转化( )
21、在一张洁白干燥的滤纸上依次喷洒 A、B、C三种无色液体,当喷洒A时滤纸无明显变化,再喷洒B时滤纸上显出一间红色小屋,最后喷洒C时红色小屋又消失了,回答下列问题:滤纸上的小屋事先是用_______试剂画出的.无色液体A是___________;B是___________;C是_________.
22、玻璃中含有二氧化硅,请用化学方程式表示盛放NaOH溶液的试剂瓶塞不能用玻璃塞的原因 。
23、利用海水提取粗盐的过程如下图所示,回答有关问题
(1)一定质量的海水,通过贮水池引入到蒸发池中,在没有引入结晶池之前的蒸发过程中,蒸发池中氯化 钠的质量会__________(填“增大”、“不变”或“减小”)。
(2)粗盐中含有的难溶性杂质,在实验室里可以通过溶解、过滤、蒸发等操作将其去除,这些操作中都会用到玻璃棒,其中在过滤操作中玻璃棒的作用是________(填“引流”或“加快溶解”)。
(3)用氯化钠固体配制100g质量分数为6%的氯化钠溶液。
①配制时,涉及以下实验步骤:
A.称量及量取 B.计算 C.溶解 D.装瓶贴标签。
其正确的实验步骤顺序是______________(填字母)
②将已配好的100g质量分数为6%的氯化钠溶液变成质量分数为16%的氯化钠溶液,需要再加NaCl的质量是______________g(计算结果精确到0.1)
三、综合应用题。
24、某同学称取10g碳酸钙粉末,如图所示进行实验。
(1)计算10g碳酸钙完全分解生成二氧化碳的物质的量。(根据化学方程式列式计算)_____
(2)加热一段时间后欲停止实验,应先_____。
(3)对加热后的剩余固体A进行实验,过程如右图所示。滤液B的溶质是_____;步骤Ⅲ中生成气体的化学方程式是_____ ;剩余固体A的成分是_____ 。
(4)不使用酚酞试液和稀盐酸也可以确定剩余固体A的成分,写出方法、结论及依据:_____
_____ 。
四、实验题。
25、某校同学开展了如图所示“溶液酸碱性的检验”的实验活动:
(1)把自制的紫薯汁按图1所示分别滴加到试管中,观察到的现象如下表所示
溶液 白醋 盐酸 蔗糖水 草木灰水 石灰水
加入紫薯汁之后的颜色 红色 红色 紫色 绿色 绿色
①图1中存放紫薯汁的仪器名称是 。
②据上表推测,紫薯汁遇到稀硫酸溶液可能显示的颜色是 ,该汁液
(填“能”或“不能”)作酸碱指示剂。
(2)用pH试纸测定图1中部分溶液的酸碱度:草木灰水pH>7,属于 (填“酸性”、“中性”或“碱性”)溶液,白醋pH (填“>”“<”或“=”)7。
(3)图2是三位同学分别测定土壤酸碱度的操作示意图,其中正确的是 (填“A”、“B”或“C”,下同),可能导致被测溶液的pH数值发生改变的错误操作是 。
五、计算类题。
26、某化工厂排放的废水中含有一定量的氢氧化钾为了回收利用,欲用2%的稀盐酸测定废水中的氢氧化钾含量(废水中其他杂质不与盐酸反应)。取20g该废水于锥形瓶中,逐滴加入2%的稀盐酸,至恰好完全反应时,消耗稀盐酸7.3g,求废水中氢氧化钾的质量分数。
2022—2023学年化学沪教版(全国)九年级下册第7章 应用广泛的酸、碱、盐 分层选练题附答案
沪教版(全国)第7章 应用广泛的酸、碱、盐
一、选择题。
1、某地农业科技工作者在进行“酸雨对农业产量影响及对策的研究”中,得出酸雨的pH大小与小麦减产幅度关系的一组数据如下表所示。根据数据判断,下列说法正确的是( )
酸雨pH[来 3.58 4.59 4.86
小麦减产(%) 10 5 3
A.酸雨的pH越大,小麦减产幅度越大
B.酸雨的pH越小,小麦减产幅度越大
C.酸雨的酸性越强,小麦的减产越小
D.酸雨的酸性越强,小麦的减产越大
【答案】B D
2、不可能由两种元素组成的化合物是( )
A.氧化物 B.酸 C.碱 D.盐
【答案】C
3、现有甲、乙、丙三种金属,先将三者分别加入到硫酸亚铁溶液中,只有甲可使溶液中析出铁单质。再将三者加入到硝酸银溶液中,只有乙不能使溶液中析出银单质,则三者的金属活动性从强到弱的顺序是( )
A.甲>乙>丙 B.乙>甲>丙 C.甲>丙>乙 D.无法判断
【答案】C
4、一包固体粉末可能含有NaNO3、CaCO3、NaOH、CuCl2、NaCl和Ca(NO3)2中的一种或几种,为确定其组成,某同学设计了如下实验方案:
下列判断正确的是( )
A.蓝色溶液B中阳离子只有Cu2+
B.无色溶液A中一定有NaOH
C.原固体粉末一定有NaCl
D.原固体粉末一定有CaCO3、NaOH、NaNO3、CuCl2和Ca(NO3)2
【答案】B
5、下列实验操作符合规范的是( )
A.测溶液的pH B.稀释浓硫酸 C.加热液体 D.取用液体试剂
【答案】B
6、下列化学方程式与客观事实相符,且书写完全正确的是( )
A.用过氧化氢溶液制氧气:
B.铁丝在氧气中燃烧:
C.用稀硫酸除铁锈:
D.用澄清石灰水检验二氧化碳:
【答案】D
7、下列能正确表示加水稀释pH=10的溶液的是( )
A. B. C. D.
【答案】D
8、下列关于氢氧化钠的描述中不正确的是( )
A.曝露在空气中易潮解 B.能与酸发生中和反应
C.其水溶液能使石蕊溶液变红 D.对皮肤有强烈的腐蚀作用
【答案】C
9、若利用碱的性质进行下列实验,不能达到相应目的的是( )
A.分别加入少量Mg(OH)2固体,根据是否溶解,可鉴别稀盐酸和Na2CO3溶液
B.分别加入适量水溶解,根据温度是否明显升高,可鉴别NaOH固体和NaCl固体
C.分别加入Ba(OH)2溶液,根据是否产生沉淀,可鉴别MgCl2溶液和Na2SO4溶液
D.分别加入熟石灰粉末研磨,根据是否产生氨味,可鉴别(NH4)2SO4固体和K2SO4固体
【答案】C
10、下列实验操作及现象合理的是( )
A.用pH试纸测得某溶液的pH=1.4
B.用托盘天平称取5.6 g硝酸钾固体
C.铁丝在O2中燃烧,生成白色固体
D.鸡蛋清遇碘水变蓝色
【答案】B
11、饮食过量,胃酸会大量分泌,以致消化不良。为缓减该症状,下列药剂不适宜的是( )
A.氢氧化铝 B.氯化钠 C.碳酸镁 D.碳酸氢钠
【答案】B
12、“雪碧”等碳酸型饮料饮用前晃动后打开,其pH将( )
A.变大 B.变小 C.不变 D.无法确定
【答案】A
13、将适量的铜粉和镁粉的混合物放入一定量的硝酸银溶液中,充分反应后过滤,得到固体物质和无色滤液,则关于滤出的固体和无色滤液的下列判断正确的是( )
A.滤出的固体中一定含有银和铜,一定不含镁
B.滤出的固体中一定含有银,可能含有铜和镁
C.滤液中一定含有硝酸银和硝酸镁,一定没有硝酸铜
D.滤液中一定含有硝酸镁,一定没有硝酸银和硝酸铜
【答案】B
*14、钯(Pd)是一种稀有的贵金属,钯镍合金在电子工业等有广泛应用。已知钯、镍、铜三种金属的活动性强弱顺序是Ni>Cu>Pd,下列实验可以验证三者金属活动性强弱的实验组合是( )
①Cu+硝酸镍溶液 ②Pd+稀盐酸 ③Pd+硫酸铜溶液 ④Ni+稀盐酸
A.①② B.①③ C.②③ D.②④
【答案】B
15、小东同学家的西红柿植株生长不茂盛,叶色淡绿需要施加的肥料是( )
A.尿素 B.磷矿粉 C.碳酸钾 D.磷酸二氢钾
【答案】A
二、填空题。
16、用导管向盛有紫色石蕊试液中吹气会看到溶液变________,将盛满二氧化碳的大试管倒插在澄清的石灰水中,可以观察到的现象________ 。反应方程式为________ 。
【答案】红; 澄清石灰水变浑浊; CO2+Ca(OH)2=CaCO3↓+H2O
17、久盛石灰水的烧杯内壁会附有一层白膜,该白膜的主要成分是 ,除去它可用 。
【答案】Ca(OH)2 稀盐酸
18、从宏观、微观、符号相结合的视角探究物质及其变化规律是化学独特的研究方法。根据所给信息,回答下列问题:
宏观辨识
(1)通过科学探究可以认识化学反应中各物质质量之间的关系,如图实验中,将NaOH溶液滴入锥形瓶中,反应结束用,再次称量,观家到托盘天平的指针______(填“向左”“向右”或“不”)偏转。
微观探析
(2)下图是氢气在空气中燃烧的微观示意图,该反应的基本反应类型为______反应。从微观角度分析,过程I表示分子分解成______的过程。
符号表征
(3)氢化镁(MgH2)是一种很有发展前景的贮氢材料,能与水反应生成氢氧化镁和一种常见的气体,反应的化学方程式为:______↑。请补全该反应的化学方程式并写出补全依据。
依据一:化学反应前后原子的种类和______不变。
依据二:______ 。
【答案】(1)不 (2) 化合 原子
(3) 2H2 数目 每个氢分子由2个氢原子构成
19、如果实验室没有pH试纸,又要测定未知溶液的酸碱性,可选用 试液来进行实验,该试液从 色变成 色,能确定其呈碱性。
【答案】无色酚酞 无 红
20、判断题:
(1)氢氧化铝可治疗胃酸过多,故氢氧化钠也可治疗胃酸过多( )
(2)生锈的铁钉加入适量的稀盐酸后溶液也会变成浅绿色( )
(3)用稀盐酸除去水垢( )
(4)铁能与氢氧化钠溶液反应放出氢气( )
(5)“要留清白在人间”实现了从Ca(OH)2到CaCO3的转化( )
【答案】(1)错误 (2)错误 (3)正确 (4)错误 (5)正确
21、在一张洁白干燥的滤纸上依次喷洒 A、B、C三种无色液体,当喷洒A时滤纸无明显变化,再喷洒B时滤纸上显出一间红色小屋,最后喷洒C时红色小屋又消失了,回答下列问题:滤纸上的小屋事先是用_______试剂画出的.无色液体A是___________;B是___________;C是_________.
【答案】酚酞 水 氢氧化钠 稀盐酸
22、玻璃中含有二氧化硅,请用化学方程式表示盛放NaOH溶液的试剂瓶塞不能用玻璃塞的原因 。
【答案】2NaOH + SiO2 = Na2SiO3 + H2O
23、利用海水提取粗盐的过程如下图所示,回答有关问题
(1)一定质量的海水,通过贮水池引入到蒸发池中,在没有引入结晶池之前的蒸发过程中,蒸发池中氯化 钠的质量会__________(填“增大”、“不变”或“减小”)。
(2)粗盐中含有的难溶性杂质,在实验室里可以通过溶解、过滤、蒸发等操作将其去除,这些操作中都会用到玻璃棒,其中在过滤操作中玻璃棒的作用是________(填“引流”或“加快溶解”)。
(3)用氯化钠固体配制100g质量分数为6%的氯化钠溶液。
①配制时,涉及以下实验步骤:
A.称量及量取 B.计算 C.溶解 D.装瓶贴标签。
其正确的实验步骤顺序是______________(填字母)
②将已配好的100g质量分数为6%的氯化钠溶液变成质量分数为16%的氯化钠溶液,需要再加NaCl的质量是______________g(计算结果精确到0.1)
【答案】不变 引流 BACD 11.9
三、综合应用题。
24、某同学称取10g碳酸钙粉末,如图所示进行实验。
(1)计算10g碳酸钙完全分解生成二氧化碳的物质的量。(根据化学方程式列式计算)_____
(2)加热一段时间后欲停止实验,应先_____。
(3)对加热后的剩余固体A进行实验,过程如右图所示。滤液B的溶质是_____;步骤Ⅲ中生成气体的化学方程式是_____ ;剩余固体A的成分是_____ 。
(4)不使用酚酞试液和稀盐酸也可以确定剩余固体A的成分,写出方法、结论及依据:_____
_____ 。
【答案】(1)0.1mol (2)将导管从石灰水中取出
(3)Ca(OH)2 CaCO3+2HCl=CaCl2+H2O+CO2↑ CaO、CaCO3
(4)称量剩余固体A的质量m,根据质量守恒定律:若m为10g,剩余固体A成分为CaCO3;若5.6g
25、某校同学开展了如图所示“溶液酸碱性的检验”的实验活动:
(1)把自制的紫薯汁按图1所示分别滴加到试管中,观察到的现象如下表所示
溶液 白醋 盐酸 蔗糖水 草木灰水 石灰水
加入紫薯汁之后的颜色 红色 红色 紫色 绿色 绿色
①图1中存放紫薯汁的仪器名称是 。
②据上表推测,紫薯汁遇到稀硫酸溶液可能显示的颜色是 ,该汁液
(填“能”或“不能”)作酸碱指示剂。
(2)用pH试纸测定图1中部分溶液的酸碱度:草木灰水pH>7,属于 (填“酸性”、“中性”或“碱性”)溶液,白醋pH (填“>”“<”或“=”)7。
(3)图2是三位同学分别测定土壤酸碱度的操作示意图,其中正确的是 (填“A”、“B”或“C”,下同),可能导致被测溶液的pH数值发生改变的错误操作是 。
【答案】(1)①滴瓶 ②红色 能 (2)碱性 < (3)B C
五、计算类题。
26、某化工厂排放的废水中含有一定量的氢氧化钾为了回收利用,欲用2%的稀盐酸测定废水中的氢氧化钾含量(废水中其他杂质不与盐酸反应)。取20g该废水于锥形瓶中,逐滴加入2%的稀盐酸,至恰好完全反应时,消耗稀盐酸7.3g,求废水中氢氧化钾的质量分数。
【答案】设参加反应的氢氧化钾的质量为x。
x=0.224g
废水中氢氧化钾的质量分数为。
答:废水中氢氧化钾的质量分数为1.12%。
pH
7
pH
7
pH
7
pH
7
pH
7
pH
7
pH
7
pH
7
