沪教版初三化学下册 第7章《应用广泛的酸、碱、盐》 基础实验8 酸与碱的化学性质(练习)(含解析)
文档属性
| 名称 | 沪教版初三化学下册 第7章《应用广泛的酸、碱、盐》 基础实验8 酸与碱的化学性质(练习)(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 359.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-01 08:33:42 | ||
图片预览


文档简介
第7章 应用广泛的酸碱盐
基础实验8 酸与碱的化学性质
一、选择题
1.(2022·湖南株洲·中考真题)下列物质中,不能与稀硫酸反应的是
A.BaCl2溶液 B.Cu丝
C.CuO粉末 D.Cu(OH)2固体
2.(2022秋·河北邢台·九年级金华中学校考期末)航天员舱外服内含有与氢氧化钠性质相似的氢氧化锂(LiOH),它不可能具有的化学性质是
A.与二氧化碳反应 B.与盐酸反应
C.与氧化铁反应 D.与氯化铜溶液反应
3.(2022秋·山东威海·九年级校联考期中)氢氧化铯是一种可溶性碱,其化学式为CsOH,则下列叙述中不正确的是
A.CsOH溶液的pH大于7 B.CsOH在水中可以电离出Cs+和OH-
C.CsOH溶液能使酚酞试溶变红 D.CsOH与硫酸反应生成的盐的化学式为CsSO4
4.(2022秋·山东泰安·九年级统考期中)日常生活中遇到的下列污垢,不宜用盐酸清洗的是
A.保温瓶内的水垢(主要成分氢氧化镁)
B.盛石灰水的试剂瓶内壁的白色固体(主要成分是碳酸钙)
C.不锈钢茶杯内的茶垢(主要成分是茶多酚)
D.玻璃水槽内的黄色铁锈斑(主要成分是铁锈)
5.(2022秋·山东泰安·九年级东平县实验中学校考阶段练习)下列关于酸的说法错误的是
A.浓硫酸具有吸水性,浓盐酸具有挥发性
B.稀盐酸能够使紫色石蕊溶液和无色酚酞溶液都变红色
C.稀盐酸和稀硫酸都可用于金属除锈
D.稀硫酸能够与活泼金属反应制取氢气
6.(2022·内蒙古通辽·统考中考真题)初中化学几种常见物质之间的反应关系如图所示,“一”两端的物质均能发生反应,图中各物质(除石蕊溶液外)的类别均不相同。下列说法不正确的是
A.X可能是碳酸钠 B.Z与硫酸反应,可能得到黄色溶液
C.X和Y可能是NaOH和Ba(NO3)2 D.Mg与H2SO4发生置换反应
7.(2022春·全国·九年级专题练习)关于酸和碱的性质说法正确的是
A.用盐酸不能洗掉盛石灰水后留下的白色固体
B.酸溶液有相似的化学性质是因为有共同的阳离子H+
C.酸有一些相似的化学性质,原因是它们与金属反应有氢气产生
D.碱有一些相似的化学性质,原因是它们都能与空气中的二氧化碳反应
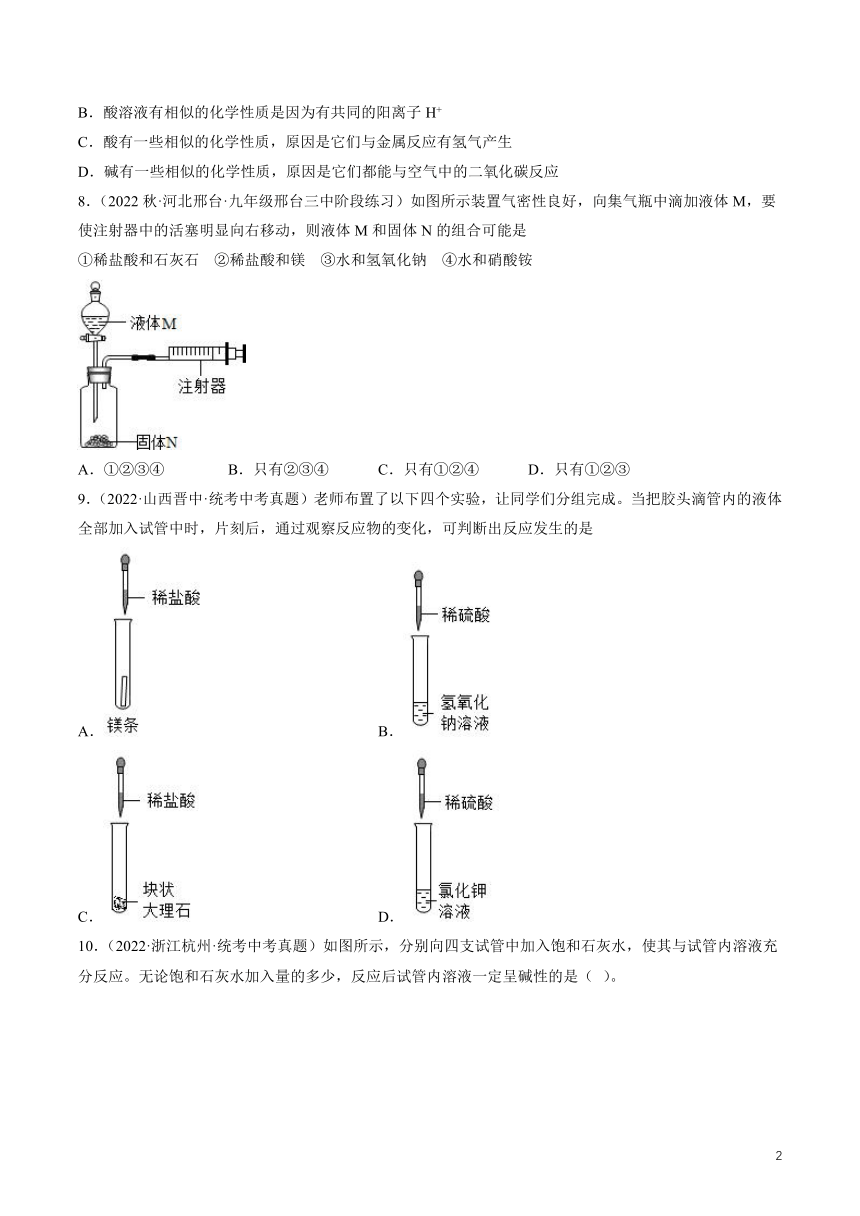
8.(2022秋·河北邢台·九年级邢台三中阶段练习)如图所示装置气密性良好,向集气瓶中滴加液体M,要使注射器中的活塞明显向右移动,则液体M和固体N的组合可能是
①稀盐酸和石灰石 ②稀盐酸和镁 ③水和氢氧化钠 ④水和硝酸铵
A.①②③④ B.只有②③④ C.只有①②④ D.只有①②③
9.(2022·山西晋中·统考中考真题)老师布置了以下四个实验,让同学们分组完成。当把胶头滴管内的液体全部加入试管中时,片刻后,通过观察反应物的变化,可判断出反应发生的是
A. B.
C. D.
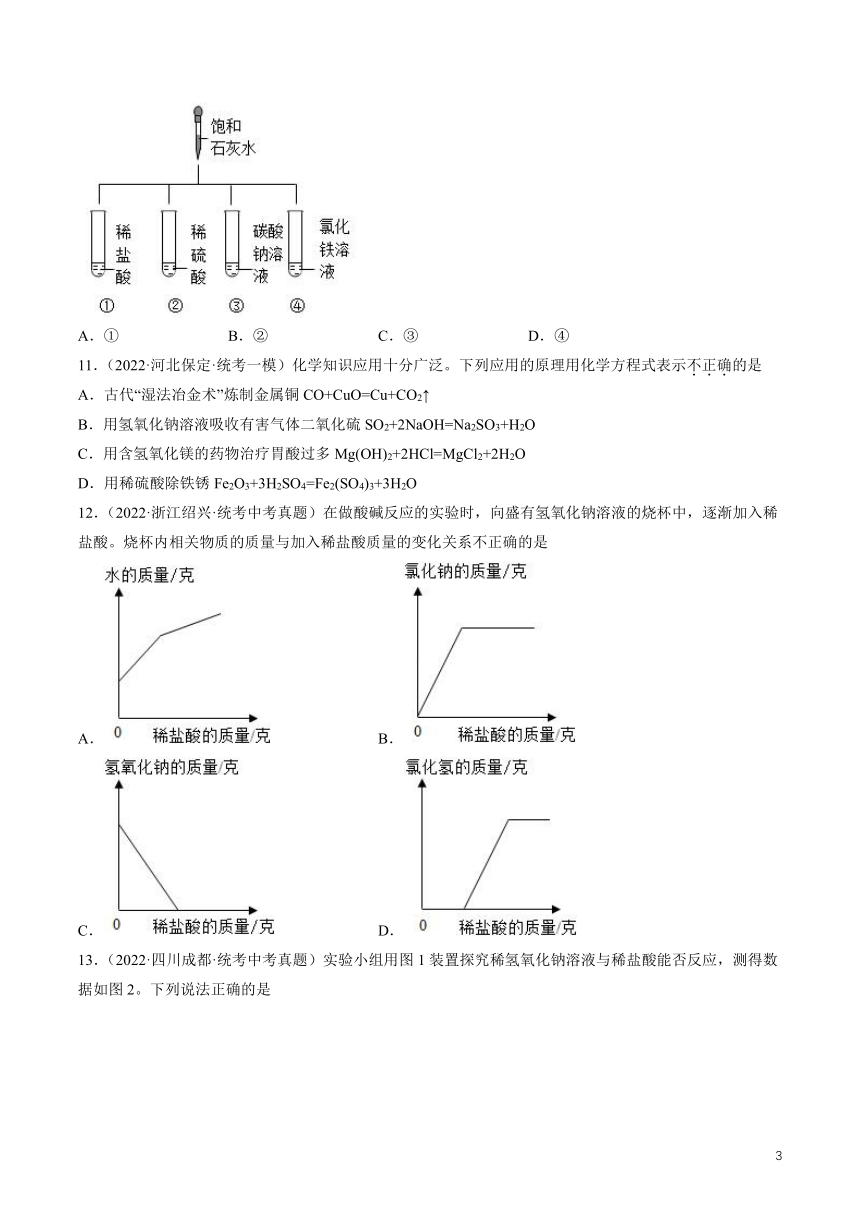
10.(2022·浙江杭州·统考中考真题)如图所示,分别向四支试管中加入饱和石灰水,使其与试管内溶液充分反应。无论饱和石灰水加入量的多少,反应后试管内溶液一定呈碱性的是( )。
A.① B.② C.③ D.④
11.(2022·河北保定·统考一模)化学知识应用十分广泛。下列应用的原理用化学方程式表示不正确的是
A.古代“湿法冶金术”炼制金属铜CO+CuO=Cu+CO2↑
B.用氢氧化钠溶液吸收有害气体二氧化硫SO2+2NaOH=Na2SO3+H2O
C.用含氢氧化镁的药物治疗胃酸过多Mg(OH)2+2HCl=MgCl2+2H2O
D.用稀硫酸除铁锈Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
12.(2022·浙江绍兴·统考中考真题)在做酸碱反应的实验时,向盛有氢氧化钠溶液的烧杯中,逐渐加入稀盐酸。烧杯内相关物质的质量与加入稀盐酸质量的变化关系不正确的是
A. B.
C. D.
13.(2022·四川成都·统考中考真题)实验小组用图1装置探究稀氢氧化钠溶液与稀盐酸能否反应,测得数据如图2。下列说法正确的是
A.烧杯中只能盛放稀氢氧化钠溶液
B.图2不能证明反应是放热反应
C.60s时溶液中溶质只有氯化钠
D.实验证明氢氧化钠与盐酸能反应
14.(2022春·九年级课时练习)在日常生活中,中和反应被广泛地运用,下列不属于中和反应的是
A.在酸性土壤中加入熟石灰,可以调节土壤的酸碱性
B.胃酸过多的病人可以服用含氢氧化铝的药物,以中和过多的胃酸
C.被蜜蜂蜇后,涂一些含有氨水的药水,可减轻痛痒
D.在做消化道检查时,用硫酸钡作为造影剂,在X线照射下显示消化道有无病变的一种检查方法
15.(2022秋·湖北孝感·九年级期末)在铁粉和氧化铜粉末组成的混合物中,加入一定量的稀硫酸,充分反应后,过滤,向滤液中放入一枚铁钉,一段时间后,发现铁钉无变化。根据上述现象,确定下列结论正确的是
A.滤渣中一定含铜、铁
B.滤渣中一定含铜,一定不含铁
C.滤渣中一定含铜,但不一定含铁
D.滤液中一定含硫酸亚铁,但不一定含硫酸铜和硫酸
二、实验题
16.(2022秋·山东烟台·九年级统考期中)某化学兴趣小组为探究硫酸的化学性质,进行了如下的实验(所加稀硫酸均过量)。
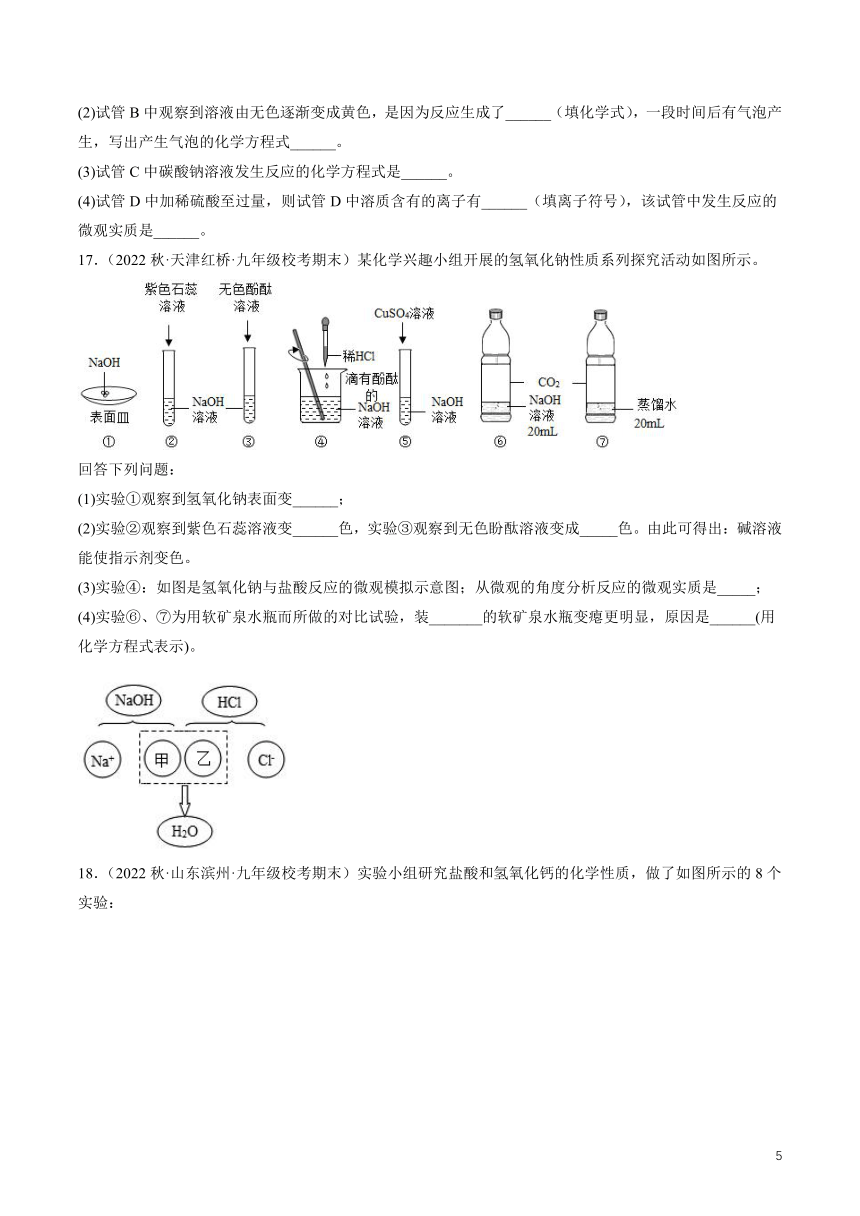
(1)试管A中观察到紫色石蕊试液变______色。
(2)试管B中观察到溶液由无色逐渐变成黄色,是因为反应生成了______(填化学式),一段时间后有气泡产生,写出产生气泡的化学方程式______。
(3)试管C中碳酸钠溶液发生反应的化学方程式是______。
(4)试管D中加稀硫酸至过量,则试管D中溶质含有的离子有______(填离子符号),该试管中发生反应的微观实质是______。
17.(2022秋·天津红桥·九年级校考期末)某化学兴趣小组开展的氢氧化钠性质系列探究活动如图所示。
回答下列问题:
(1)实验①观察到氢氧化钠表面变______;
(2)实验②观察到紫色石蕊溶液变______色,实验③观察到无色盼酞溶液变成_____色。由此可得出:碱溶液能使指示剂变色。
(3)实验④:如图是氢氧化钠与盐酸反应的微观模拟示意图;从微观的角度分析反应的微观实质是_____;
(4)实验⑥、⑦为用软矿泉水瓶而所做的对比试验,装_______的软矿泉水瓶变瘪更明显,原因是______(用化学方程式表示)。
18.(2022秋·山东滨州·九年级校考期末)实验小组研究盐酸和氢氧化钙的化学性质,做了如图所示的8个实验:
(1)溶液颜色变为红色的试管编号是___________。
(2)②中最后会形成___________色的溶液,该试管中发生的化学方程式为___________。③④中都有___________的现象。
(3)试管⑥发生的化学方程式为___________,要证明试管⑥反应后盐酸有剩余,下列所给的药品中可以选择的有___________种。
所给药品:酚酞试液、石蕊试液、稀硫酸、铁粉、氧化铁、大理石。
(4)试管⑧中的现象是___________;利用该反应可以检验二氧化碳气体。
19.(2022秋·山东烟台·九年级统考期末)为认识酸和碱的性质,某化学学习小组进行了如下实验。
(1)20℃时,配制80g溶质质量分数为10%的NaOH溶液。
①用图1中仪器完成实验,还缺少的玻璃仪器是___________(填名称),玻璃棒在实验中的作用是___________。
②配制该溶液需要___________g水。用量筒量取水时,俯视读数会导致所配溶液的溶质质量分数___________10%。(填“大于”或“小于”)
(2)向1-5号小试管中分别滴加少量稀盐酸(见图2)。
①___________中溶液变为红色(填“试管1”或“试管2”)。
②试管3中产生现象是___________,试管4中无明显现象,由此推断金属活动性Cu比Zn___________(填“强”或“弱”)。试管3中发生反应的化学方程式为___________。
③试管5中生成一种盐和两种氧化物,该反应的化学方程式为___________。
20.(2022·广东·九年级专题练习)某兴趣小组用实验室常用药品对“NaOH溶液与稀盐酸的反应”进行探究。
【实验探究一】某同学利用图1装置研究稀盐酸与氢氧化钠溶液反应的过程,并用PH和温度传感器测量反应过程中相关物理量的变化情况,得到图2和图3。
(1)烧杯中发生反应的化学方程式是_______。
(2)图1中A中溶液的溶质是______(填化学式)。
(3)图3中V的数值最接近______(填“6”、“12”或“16”)。
【实验探究二】实验目的:
(4)氢氧化钠溶液与稀盐酸是否恰好完全反应设计并进行实验。
实验步骤 实验现象 结论
取2mL氢氧化钠溶液于试管中,滴入一定量的稀盐酸,振荡后加入镁条 若_____。 稀盐酸过量
若_____。 氢氧化钠与稀盐酸恰好完全反应
(5)另有同学提出上述实验探究二设计的方案不能证明NaOH溶液与稀盐酸恰好完全反应,其原因是______。
(6)从微观角度分析,氢氧化钠溶液和稀硫酸反应的实质是:______微粒(符号表示)参与反应,而______(同上)微粒没有参加反应,只是“旁观者”。
(7)向一定量的NaOH溶液中滴加少量盐酸后,为了证明盐酸已完全反应,可以加入_______(填字母)
A.Fe2O3 B.NaCl溶液 C.Fe D.氢氧化钾溶液
答案与解析
二、选择题
1.(2022·湖南株洲·中考真题)下列物质中,不能与稀硫酸反应的是
A.BaCl2溶液 B.Cu丝
C.CuO粉末 D.Cu(OH)2固体
【答案】B
【解析】A、氯化钡能与硫酸反应生成硫酸钡和盐酸,不符合题意;
B、在金属活动性顺序里,铜排在氢后,铜和硫酸不反应,符合题意;
C、氧化铜和硫酸反应生成硫酸铜和水,不符合题意;
D、氢氧化铜和硫酸反应生成硫酸铜和水,不符合题意。
故选B。
2.(2022秋·河北邢台·九年级金华中学校考期末)航天员舱外服内含有与氢氧化钠性质相似的氢氧化锂(LiOH),它不可能具有的化学性质是
A.与二氧化碳反应 B.与盐酸反应
C.与氧化铁反应 D.与氯化铜溶液反应
【答案】C
【解析】A、氢氧化锂与二氧化碳反应生成碳酸锂和水,故选项不符合题意;
B、氢氧化锂与盐酸反应生成氯化锂和水,故选项不符合题意;
C、氢氧化锂与氧化铁不反应,故选项符合题意;
D、氢氧化锂与氯化铜反应生成氯化锂和氢氧化铜沉淀,故选项不符合题意;
故选C。
3.(2022秋·山东威海·九年级校联考期中)氢氧化铯是一种可溶性碱,其化学式为CsOH,则下列叙述中不正确的是
A.CsOH溶液的pH大于7 B.CsOH在水中可以电离出Cs+和OH-
C.CsOH溶液能使酚酞试溶变红 D.CsOH与硫酸反应生成的盐的化学式为CsSO4
【答案】D
【解析】A、CsOH是可溶碱,碱的水溶液pH均大于7,叙述正确;
B、氢氧化铯是一种可溶性碱,所以CsOH在水中可以电离出Cs+和OH-,叙述正确;
C、CsOH是可溶碱,碱的水溶液能使酚酞试溶变红,叙述正确;
D、氢氧化铯的化学式为CsOH,说明铯离子的化学价为+1,硫酸根的化合价为-2,则CsOH与硫酸反应生成的盐的化学式为Cs2SO4,叙述错误。
故选D。
4.(2022秋·山东泰安·九年级统考期中)日常生活中遇到的下列污垢,不宜用盐酸清洗的是
A.保温瓶内的水垢(主要成分氢氧化镁)
B.盛石灰水的试剂瓶内壁的白色固体(主要成分是碳酸钙)
C.不锈钢茶杯内的茶垢(主要成分是茶多酚)
D.玻璃水槽内的黄色铁锈斑(主要成分是铁锈)
【答案】C
【解析】A、保温瓶内的水垢主要成分是氢氧化镁,而氢氧化镁与盐酸会反应,,所以宜用盐酸清洗,故选项错误;
B、盛石灰水的瓶内壁上的白色固体主要为碳酸钙,碳酸钙能和盐酸反应,即,所以宜用盐酸清洗,故选项错误;
C、不锈钢茶杯的主要成分是铁,能和盐酸反应损坏茶杯,所以不能用盐酸除茶杯内的水垢,故选项正确;
D、铁锈的主要成分是三氧化二铁,与盐酸时会发生如下反应,所以宜用盐酸清洗,故选项正确;
故选C。
5.(2022秋·山东泰安·九年级东平县实验中学校考阶段练习)下列关于酸的说法错误的是
A.浓硫酸具有吸水性,浓盐酸具有挥发性
B.稀盐酸能够使紫色石蕊溶液和无色酚酞溶液都变红色
C.稀盐酸和稀硫酸都可用于金属除锈
D.稀硫酸能够与活泼金属反应制取氢气
【答案】B
【解析】A、浓硫酸具有吸水性,浓盐酸具有挥发性,此选项正确;
B、稀盐酸能够使紫色石蕊溶液变红,不能使无色酚酞溶液变色,此选项错误;
C、稀盐酸和稀硫酸都能与金属氧化物反应,可用于金属除锈,此选项正确;
D、稀硫酸能够与活泼金属反应制取氢气,此选项正确。
故选B。
6.(2022·内蒙古通辽·统考中考真题)初中化学几种常见物质之间的反应关系如图所示,“一”两端的物质均能发生反应,图中各物质(除石蕊溶液外)的类别均不相同。下列说法不正确的是
A.X可能是碳酸钠 B.Z与硫酸反应,可能得到黄色溶液
C.X和Y可能是NaOH和Ba(NO3)2 D.Mg与H2SO4发生置换反应
【答案】C
【解析】A、若X为Na2CO3,则Y可以为Ca(OH)2,氢氧化钙能与碳酸钠反应生成碳酸钙沉淀与氢氧化钠,氢氧化钙能与硫酸反应生成硫酸钙与水;Z可以为Fe2O3,氧化铁能与硫酸反应生成硫酸铁与水,碳酸钠属于盐,氢氧化钙属于碱,硫酸属于酸,镁属于金属,氧化铁属于氧化物,物质类别也不同,故选项说法正确;
B、根据上述分析可知Z可以为氧化铁,氧化铁能与稀硫酸反应生成硫酸铁与水,硫酸铁的溶液呈黄色,带入验证合理,故选项说法正确;
C、根据题干信息可知,“一”两端的物质均能发生反应,X与Y相连,若X和Y是NaOH和Ba(NO3)2,两者不发生反应,则推断不合理,故选项说法错误;
D、镁与稀硫酸反应生成硫酸镁与氢气,该反应为单质与化合物反应生成另一种单质与另一种化合物,反应属于置换反应,故选项说法正确;
故选C。
7.(2022春·全国·九年级专题练习)关于酸和碱的性质说法正确的是
A.用盐酸不能洗掉盛石灰水后留下的白色固体
B.酸溶液有相似的化学性质是因为有共同的阳离子H+
C.酸有一些相似的化学性质,原因是它们与金属反应有氢气产生
D.碱有一些相似的化学性质,原因是它们都能与空气中的二氧化碳反应
【答案】B
【解析】A、根据石灰水在空气中会与二氧化碳反应生成碳酸钙沉淀和水,因此留下的白色固体是碳酸钙,碳酸钙能与稀盐酸反应生成氯化钙、水和二氧化碳,故稀盐酸能洗掉盛石灰水后留下的白色固体,选项说法错误;
B、酸是电离时产生的阳离子全部是氢离子的化合物,酸溶液有相似的化学性质是因为有共同的阳离子氢离子,选项正确;
C、酸具有相似的化学性质是因为在水溶液中都能电离出氢离子,而不是它们与金属反应有氢气产生,故选项说法错误;
D、碱有一些相似的化学性质,是因为在水溶液中都能电离出氢氧根离子,而不是都能与空气中的二氧化碳反应,故选项说法错误;
故选B。
8.(2022秋·河北邢台·九年级邢台三中阶段练习)如图所示装置气密性良好,向集气瓶中滴加液体M,要使注射器中的活塞明显向右移动,则液体M和固体N的组合可能是
①稀盐酸和石灰石 ②稀盐酸和镁 ③水和氢氧化钠 ④水和硝酸铵
A.①②③④ B.只有②③④ C.只有①②④ D.只有①②③
【答案】D
【解析】,向集气瓶中滴加液体M,要使注射器中的活塞明显向右移动,说明装置内的气压变大,则①稀盐酸和石灰石反应生成氯化钙、水和二氧化碳,有气体生成使气压变大,符合题意;
②稀盐酸和镁会反应生成氯化镁和氢气,有气体生成使气压变大,符合题意;
③水和氢氧化钠混合物,由于氢氧化钠溶于水会使水温升高则气体受热膨胀,气压变大,符合题意;
④水和硝酸铵混合后,硝酸铵溶于水会使水温降低,气压变小,不符合题意;
则①②③正确。
故选D。
9.(2022·山西晋中·统考中考真题)老师布置了以下四个实验,让同学们分组完成。当把胶头滴管内的液体全部加入试管中时,片刻后,通过观察反应物的变化,可判断出反应发生的是
A. B.
C. D.
【答案】A
【解析】A、稀盐酸与镁带发生反应,Mg+2HCl=MgCl2+H2↑,可观察到固体溶解且有气泡产生,可判断反应是否发生,此选项符合题意;
B、稀硫酸与氢氧化钠发生反应:2NaOH+H2SO4=Na2SO4+2H2O,反应无明显现象,无法判断反应是否反应,此选项不符合题意;
C、稀盐酸与大理石发生反应:CaCO3+2HCl=CaCl2+H2O+CO2↑,该反应现象为大理石表面有气泡产生,片刻以后,现象不明显,无法判断反应是否反应,此选项不符合题意;
D、稀硫酸与氯化钾混合,无明显现象,无法判断反应是否反应,此选项不符合题意。
故选A。
10.(2022·浙江杭州·统考中考真题)如图所示,分别向四支试管中加入饱和石灰水,使其与试管内溶液充分反应。无论饱和石灰水加入量的多少,反应后试管内溶液一定呈碱性的是( )。
A.① B.② C.③ D.④
【答案】C
【解析】A、①中稀盐酸和饱和石灰水中的氢氧化钙反应生成氯化钙和水,氯化钙溶液呈中性,若饱和石灰水的量不足,反应后试管内溶液呈酸性;若饱和石灰水和稀盐酸恰好完全反应,反应后试管内溶液呈中性;若饱和石灰水过量,反应后试管内溶液呈碱性,故A不符合题意;
B、②中稀硫酸和饱和石灰水中的氢氧化钙反应生成硫酸钙和水,硫酸钙溶液呈中性,若饱和石灰水的量不足,反应后试管内溶液呈酸性;若饱和石灰水和稀硫酸恰好完全反应,反应后试管内溶液呈中性;若饱和石灰水过量,反应后试管内溶液呈碱性,故B不符合题意;
C、③中试管内的碳酸钠溶液呈碱性,向其中加入饱和石灰水,碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,生成的氢氧化钠溶液呈碱性,无论饱和石灰水加入量的多少,反应后试管内溶液一定呈碱性,故C符合题意;
D、④中试管内的氯化铁溶液呈酸性,加入石灰水,氢氧化钙和氯化铁反应生成氢氧化铁沉淀和氯化钙,氯化钙溶液呈中性,若饱和石灰水的量不足,反应后试管内溶液呈酸性;若饱和石灰水和氯化铁恰好完全反应,反应后试管内溶液呈中性;若饱和石灰水过量,反应后试管内溶液呈碱性,故D不符合题意。
故选C。
11.(2022·河北保定·统考一模)化学知识应用十分广泛。下列应用的原理用化学方程式表示不正确的是
A.古代“湿法冶金术”炼制金属铜CO+CuO=Cu+CO2↑
B.用氢氧化钠溶液吸收有害气体二氧化硫SO2+2NaOH=Na2SO3+H2O
C.用含氢氧化镁的药物治疗胃酸过多Mg(OH)2+2HCl=MgCl2+2H2O
D.用稀硫酸除铁锈Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
【答案】A
【解析】A、古代“湿法冶金术”炼制金属铜是铁和硫酸铜反应生成硫酸亚铁和铜,该反应的化学方程式为:,符合题意;
B、用氢氧化钠溶液吸收有害气体二氧化硫,二氧化硫和氢氧化钠反应生成亚硫酸钠和水,该反应的化学方程式为:,不符合题意;
C、用含氢氧化镁的药物治疗胃酸过多,氢氧化镁和盐酸反应生成氯化镁和水,该反应的化学方程式为:,不符合题意;
D、铁锈的主要成分是氧化铁,氧化铁和稀硫酸反应生成硫酸铁和水,该反应的化学方程式为:,不符合题意。
故选A。
12.(2022·浙江绍兴·统考中考真题)在做酸碱反应的实验时,向盛有氢氧化钠溶液的烧杯中,逐渐加入稀盐酸。烧杯内相关物质的质量与加入稀盐酸质量的变化关系不正确的是
A. B.
C. D.
【答案】D
【分析】氢氧化钠和稀盐酸反应生成氯化钠和水,随着稀盐酸的不断加入,氢氧化钠越来越少,氯化钠越来越多。
【解析】A、随着反应进行,当恰好完全反应后,水的质量由于一直加入加入稀盐酸,所以水的质量不断增大,正确;
B、随着反应进行,当恰好完全反应后,氯化钠质量不变,正确;
C、随着反应进行,当恰好完全反应后氢氧化钠质量是0,正确;
D、随着稀盐酸的加入,一段时间内溶液中氯化氢质量是0,恰好完全反应后一直在加入稀盐酸,所以溶液中的氯化氢质量不断增大,选项错误;
故选D。
13.(2022·四川成都·统考中考真题)实验小组用图1装置探究稀氢氧化钠溶液与稀盐酸能否反应,测得数据如图2。下列说法正确的是
A.烧杯中只能盛放稀氢氧化钠溶液
B.图2不能证明反应是放热反应
C.60s时溶液中溶质只有氯化钠
D.实验证明氢氧化钠与盐酸能反应
【答案】D
【分析】从图中可以看出,随着反应时间的增加,温度先上升后下降,说明氢氧化钠溶液和稀盐酸反应放热。
【解析】A、烧杯中放稀氢氧化钠溶液还是稀盐酸,不影响对反应温度的升高,A错误,不符合题意;
B、图2温度升高,能证明反应放热,B错误,不符合题意;
C、60s是反应温度达到最高点以后的时间,不确定反应是加到恰好完全反应就停止滴加,还是一直滴加注射器中溶液;
若恰好完全反应就停止滴加,溶液中溶质只有氯化钠;
若是一直滴加注射器中溶液,60s时溶液中除了氯化钠,还有注射器中溶液的溶质;
C错误,不符合题意;
D、实验反应放热是化学能转化为热能的过程,能证明氢氧化钠与盐酸反应,D正确,符合题意。
故选D。
14.(2022春·九年级课时练习)在日常生活中,中和反应被广泛地运用,下列不属于中和反应的是
A.在酸性土壤中加入熟石灰,可以调节土壤的酸碱性
B.胃酸过多的病人可以服用含氢氧化铝的药物,以中和过多的胃酸
C.被蜜蜂蜇后,涂一些含有氨水的药水,可减轻痛痒
D.在做消化道检查时,用硫酸钡作为造影剂,在X线照射下显示消化道有无病变的一种检查方法
【答案】D
【解析】A、熟石灰是氢氧化钙的俗称,能和酸反应生成盐和水,属于中和反应,故A错误;
B、胃酸中的稀盐酸和氢氧化铝反应生成氯化铝和水,属于中和反应,故B错误;
C、含碱性物质的药水和蚊子叮咬分泌的蚁酸反应生成盐和水,属于中和反应,故C错误;
D、在做消化道检查时,用硫酸钡作为造影剂,是利用了硫酸钡不与胃酸反应,与中和反应无关,故D正确。
故选D。
15.(2022秋·湖北孝感·九年级期末)在铁粉和氧化铜粉末组成的混合物中,加入一定量的稀硫酸,充分反应后,过滤,向滤液中放入一枚铁钉,一段时间后,发现铁钉无变化。根据上述现象,确定下列结论正确的是
A.滤渣中一定含铜、铁
B.滤渣中一定含铜,一定不含铁
C.滤渣中一定含铜,但不一定含铁
D.滤液中一定含硫酸亚铁,但不一定含硫酸铜和硫酸
【答案】C
【分析】在铁粉和氧化铜粉末组成的混合物中,加入一定量的稀硫酸,铁与硫酸反应生成硫酸亚铁和氢气,氧化铜与硫酸反应生成硫酸铜和水,铁与硫酸铜反应生成硫酸亚铁和铜,充分反应后,过滤,滤渣中一定含铜,滤液中一定含有硫酸亚铁;向滤液中放入一枚铁钉,一段时间后,发现铁钉无变化,说明滤液中一定没有硫酸铜和硫酸。
【解析】A、由分析知,滤渣中一定含铜,不能确定是否含有铁,故A不符合题意;
B、由分析知,滤渣中一定含铜,但不能确定是否含有铁,故B不符合题意;
C、由分析知,滤渣中一定含铜,但不一定含铁,故C符合题意;
D、由分析知,滤液中一定含有硫酸亚铁,一定没有硫酸铜和硫酸,故D不符合题意。
故选C。
二、实验题
16.(2022秋·山东烟台·九年级统考期中)某化学兴趣小组为探究硫酸的化学性质,进行了如下的实验(所加稀硫酸均过量)。
(1)试管A中观察到紫色石蕊试液变______色。
(2)试管B中观察到溶液由无色逐渐变成黄色,是因为反应生成了______(填化学式),一段时间后有气泡产生,写出产生气泡的化学方程式______。
(3)试管C中碳酸钠溶液发生反应的化学方程式是______。
(4)试管D中加稀硫酸至过量,则试管D中溶质含有的离子有______(填离子符号),该试管中发生反应的微观实质是______。
【答案】(1)红
(2)
(3)
(4) Na+、H+、 H+和结合生成H2O
【解析】(1)试管A中稀硫酸显酸性能使石蕊试液变红,故填:红;
(2)试管B中的铁锈中含有氧化铁能与稀硫酸反应生成黄色的硫酸铁和水,故填:;
有气泡产生是因为铁锈反应后,里面的铁和稀硫酸反应生成硫酸亚铁和氢气,化学方程式为:;
(3)试管C中碳酸钠和稀硫酸反应生成硫酸钠、水和二氧化碳,化学方程式为:;
(4)试管D中加稀硫酸至过量,根据氢氧化钠和稀硫酸反应生成硫酸钠和水,因此溶液中的溶质是生成的硫酸钠和剩余的硫酸,则试管D中溶质含有的离子有硫酸根离子,钠离子和氢离子,故填:;
酸碱中和的实质是:H+和结合生成H2O。
17.(2022秋·天津红桥·九年级校考期末)某化学兴趣小组开展的氢氧化钠性质系列探究活动如图所示。
回答下列问题:
(1)实验①观察到氢氧化钠表面变______;
(2)实验②观察到紫色石蕊溶液变______色,实验③观察到无色盼酞溶液变成_____色。由此可得出:碱溶液能使指示剂变色。
(3)实验④:如图是氢氧化钠与盐酸反应的微观模拟示意图;从微观的角度分析反应的微观实质是_____;
(4)实验⑥、⑦为用软矿泉水瓶而所做的对比试验,装_______的软矿泉水瓶变瘪更明显,原因是______(用化学方程式表示)。
【答案】(1)潮湿
(2) 蓝 红
(3)氢离子和氢氧根离子结合生成水
(4) 氢氧化钠溶液或NaOH溶液
【解析】(1)氢氧化钠固体在空气中易吸收水分而潮解,所以实验①观察到氢氧化钠表面变潮湿,故填:潮湿。
(2)氢氧化钠溶液呈碱性,能使紫色的石蕊溶液变蓝色,无色的酚酞变红色,所以实验②观察到紫色石蕊溶液变成蓝色,实验③观察到无色酚酞溶液变成红色。由此得出:碱溶液能使指示剂变色,故①填:蓝,②填:红。
(3)氢氧化钠与盐酸反应的微观实质是盐酸中的氢离子和氢氧化钠中氢氧根离子结合生成水,故填:氢离子和氢氧根离子结合生成水。
(4)①实验⑥⑦为用软矿泉水瓶所做的对比实验,二氧化碳能溶于水,也能与氢氧化钠发生反应,所以装氢氧化钠溶液的软矿泉水瓶变瘪更明显,故填:氢氧化钠溶液或NaOH溶液。
②二氧化碳和氢氧化钠反应生成碳酸钠和水,反应的化学方程式为: ,故填: 。
18.(2022秋·山东滨州·九年级校考期末)实验小组研究盐酸和氢氧化钙的化学性质,做了如图所示的8个实验:
(1)溶液颜色变为红色的试管编号是___________。
(2)②中最后会形成___________色的溶液,该试管中发生的化学方程式为___________。③④中都有___________的现象。
(3)试管⑥发生的化学方程式为___________,要证明试管⑥反应后盐酸有剩余,下列所给的药品中可以选择的有___________种。
所给药品:酚酞试液、石蕊试液、稀硫酸、铁粉、氧化铁、大理石。
(4)试管⑧中的现象是___________;利用该反应可以检验二氧化碳气体。
【答案】(1)①⑤##⑤①
(2) 黄 气泡产生
(3) 四##4
(4)澄清石灰水变浑浊
【解析】(1)根据紫色石蕊试液遇酸变红色,遇中性溶液不变色,遇碱性溶液变蓝色,无色酚酞溶液遇酸性和中性溶液不变色,遇碱性溶液变红色,故上述溶液颜色变为红色的有①⑤;
(2)②中稀盐酸与氧化铁反应生成氯化铁和水,故②中最后会形成黄色的溶液,该反应方程式为;③中碳酸钙与稀盐酸反应生成氯化钙、二氧化碳和水,④中碳酸钠与稀盐酸反应生成氯化钠、二氧化碳和水,故都有产生气泡的现象;
(3)⑥中稀盐酸与澄清石灰水的溶质氢氧化钙反应生成氯化钙和水,该反应方程式为;
要证明试管⑥反应后盐酸有剩余,
盐酸与酚酞试液无现象、使石蕊试液变成红色、与稀硫酸不反应、与铁粉反应会产生气泡、与氧化铁反应会生成氯化铁和水,氯化铁溶液为黄色的、与大理石反应会产生气泡,因此可以选择与盐酸混合有明显现象的试剂石蕊试液、铁粉、氧化铁、大理石这四种物质进行证明;
(4)⑧中二氧化碳与澄清石灰水的溶质氢氧化钙反应生成碳酸钙沉淀和水,故可观察到澄清石灰水变浑浊,利用该反应可以检验二氧化碳气体。
19.(2022秋·山东烟台·九年级统考期末)为认识酸和碱的性质,某化学学习小组进行了如下实验。
(1)20℃时,配制80g溶质质量分数为10%的NaOH溶液。
①用图1中仪器完成实验,还缺少的玻璃仪器是___________(填名称),玻璃棒在实验中的作用是___________。
②配制该溶液需要___________g水。用量筒量取水时,俯视读数会导致所配溶液的溶质质量分数___________10%。(填“大于”或“小于”)
(2)向1-5号小试管中分别滴加少量稀盐酸(见图2)。
①___________中溶液变为红色(填“试管1”或“试管2”)。
②试管3中产生现象是___________,试管4中无明显现象,由此推断金属活动性Cu比Zn___________(填“强”或“弱”)。试管3中发生反应的化学方程式为___________。
③试管5中生成一种盐和两种氧化物,该反应的化学方程式为___________。
【答案】(1) 烧杯 搅拌,加速溶解 72 大于
(2) 试管1 锌粒逐渐减少,产生大量气泡 弱
【解析】(1)①用固体配制一定溶质质量分数的溶液时,需要使用烧杯、玻璃棒、胶头滴管、量筒、托盘天平、药匙,图中缺少烧杯,故填烧杯;
配制溶液时,需要用玻璃棒进行搅拌,以加速溶质溶解,故填搅拌,加速溶解;
②配制80g溶质质量分数为10%的NaOH溶液,则其中溶质质量为 ,则溶剂水的质量为 ,故填72;
使用量筒量取液体时俯视读数,会使得量取的液体实际体积偏小,最终配制的溶液浓度偏大,故填大于;
(2)①盐酸呈酸性,能使紫色石蕊试液变红色,但不能使无色酚酞试液变色,故填试管1;
②锌和稀盐酸反应生成氯化锌和氢气,则在试管3中加入稀盐酸可观察到锌粒逐渐减小,且有气泡产生,故填锌粒逐渐减少,产生大量气泡;
试管4中无明显现象,说明铜的金属活泼性排在氢之后;而锌能和盐酸反应生成氢气,说明锌的金属活泼性排在氢之前,则金属活动性Cu比Zn弱,故填弱;
锌和稀盐酸反应生成氯化锌和氢气,其化学方程式为 ,故填;
③碱式碳酸铜和稀盐酸反应生成氯化铜、二氧化碳和水,其化学方程式为 ,故填。
20.(2022·广东·九年级专题练习)某兴趣小组用实验室常用药品对“NaOH溶液与稀盐酸的反应”进行探究。
【实验探究一】某同学利用图1装置研究稀盐酸与氢氧化钠溶液反应的过程,并用PH和温度传感器测量反应过程中相关物理量的变化情况,得到图2和图3。
(1)烧杯中发生反应的化学方程式是_______。
(2)图1中A中溶液的溶质是______(填化学式)。
(3)图3中V的数值最接近______(填“6”、“12”或“16”)。
【实验探究二】实验目的:
(4)氢氧化钠溶液与稀盐酸是否恰好完全反应设计并进行实验。
实验步骤 实验现象 结论
取2mL氢氧化钠溶液于试管中,滴入一定量的稀盐酸,振荡后加入镁条 若_____。 稀盐酸过量
若_____。 氢氧化钠与稀盐酸恰好完全反应
(5)另有同学提出上述实验探究二设计的方案不能证明NaOH溶液与稀盐酸恰好完全反应,其原因是______。
(6)从微观角度分析,氢氧化钠溶液和稀硫酸反应的实质是:______微粒(符号表示)参与反应,而______(同上)微粒没有参加反应,只是“旁观者”。
(7)向一定量的NaOH溶液中滴加少量盐酸后,为了证明盐酸已完全反应,可以加入_______(填字母)
A.Fe2O3 B.NaCl溶液 C.Fe D.氢氧化钾溶液
【答案】(1)HCl+NaOH=NaCl+H2O
(2)HCl
(3)12
(4) 大量气泡 无明显现象
(5)氢氧化钠与稀盐酸恰好完全反应或氢氧化钠过量加入镁条均无明显现象
(6) OH-、H+ 、Na+
(7)AC
【解析】(1)氢氧化钠与稀盐酸反应生成氯化钠和水,反应的化学方程式为:HCl+NaOH=NaCl+H2O。
(2)根据图二中pH变化,反应之前pH>7,随着仪器A中溶液的不断滴入,pH逐渐降低,可知烧杯中溶液溶质是氢氧化钠,仪器A中溶液的溶质是HCl。
(3)中和反应放热,二者恰好完全反应时pH=7,放出的热量最多,结合图二和图三可知,图三中V的数值最接近12。
(4)取2mL氢氧化钠溶液于试管中,滴入一定量的稀盐酸,振荡后加入镁条,由于镁条能与稀盐酸反应生成氯化镁和氢气,即有气泡产生,因此若出现大量气泡,则稀盐酸过量,若无明显现象,则氢氧化钠与稀盐酸恰好完全反应或氢氧化钠过量。
(5)由小问4的解析可知,氢氧化钠与稀盐酸恰好完全反应或氢氧化钠过量加入镁条均无明显现象。
(6)从微观角度分析,氢氧化钠溶液和稀硫酸反应的实质是氢氧根离子(OH-)与氢离子(H+)结合生成水的过程,而钠离子(Na+)和硫酸根离子()没有参加反应。
(7)Fe2O3与稀盐酸反应生成氯化铁和水,溶液由无色变为黄色,Fe与稀盐酸反应生成氯化亚铁和氢气,出现大量气泡,稀盐酸与氯化钠不反应,稀盐酸与氢氧化钾溶液反应生成氯化钾和水,无明显想象。
故选AC。
1
基础实验8 酸与碱的化学性质
一、选择题
1.(2022·湖南株洲·中考真题)下列物质中,不能与稀硫酸反应的是
A.BaCl2溶液 B.Cu丝
C.CuO粉末 D.Cu(OH)2固体
2.(2022秋·河北邢台·九年级金华中学校考期末)航天员舱外服内含有与氢氧化钠性质相似的氢氧化锂(LiOH),它不可能具有的化学性质是
A.与二氧化碳反应 B.与盐酸反应
C.与氧化铁反应 D.与氯化铜溶液反应
3.(2022秋·山东威海·九年级校联考期中)氢氧化铯是一种可溶性碱,其化学式为CsOH,则下列叙述中不正确的是
A.CsOH溶液的pH大于7 B.CsOH在水中可以电离出Cs+和OH-
C.CsOH溶液能使酚酞试溶变红 D.CsOH与硫酸反应生成的盐的化学式为CsSO4
4.(2022秋·山东泰安·九年级统考期中)日常生活中遇到的下列污垢,不宜用盐酸清洗的是
A.保温瓶内的水垢(主要成分氢氧化镁)
B.盛石灰水的试剂瓶内壁的白色固体(主要成分是碳酸钙)
C.不锈钢茶杯内的茶垢(主要成分是茶多酚)
D.玻璃水槽内的黄色铁锈斑(主要成分是铁锈)
5.(2022秋·山东泰安·九年级东平县实验中学校考阶段练习)下列关于酸的说法错误的是
A.浓硫酸具有吸水性,浓盐酸具有挥发性
B.稀盐酸能够使紫色石蕊溶液和无色酚酞溶液都变红色
C.稀盐酸和稀硫酸都可用于金属除锈
D.稀硫酸能够与活泼金属反应制取氢气
6.(2022·内蒙古通辽·统考中考真题)初中化学几种常见物质之间的反应关系如图所示,“一”两端的物质均能发生反应,图中各物质(除石蕊溶液外)的类别均不相同。下列说法不正确的是
A.X可能是碳酸钠 B.Z与硫酸反应,可能得到黄色溶液
C.X和Y可能是NaOH和Ba(NO3)2 D.Mg与H2SO4发生置换反应
7.(2022春·全国·九年级专题练习)关于酸和碱的性质说法正确的是
A.用盐酸不能洗掉盛石灰水后留下的白色固体
B.酸溶液有相似的化学性质是因为有共同的阳离子H+
C.酸有一些相似的化学性质,原因是它们与金属反应有氢气产生
D.碱有一些相似的化学性质,原因是它们都能与空气中的二氧化碳反应
8.(2022秋·河北邢台·九年级邢台三中阶段练习)如图所示装置气密性良好,向集气瓶中滴加液体M,要使注射器中的活塞明显向右移动,则液体M和固体N的组合可能是
①稀盐酸和石灰石 ②稀盐酸和镁 ③水和氢氧化钠 ④水和硝酸铵
A.①②③④ B.只有②③④ C.只有①②④ D.只有①②③
9.(2022·山西晋中·统考中考真题)老师布置了以下四个实验,让同学们分组完成。当把胶头滴管内的液体全部加入试管中时,片刻后,通过观察反应物的变化,可判断出反应发生的是
A. B.
C. D.
10.(2022·浙江杭州·统考中考真题)如图所示,分别向四支试管中加入饱和石灰水,使其与试管内溶液充分反应。无论饱和石灰水加入量的多少,反应后试管内溶液一定呈碱性的是( )。
A.① B.② C.③ D.④
11.(2022·河北保定·统考一模)化学知识应用十分广泛。下列应用的原理用化学方程式表示不正确的是
A.古代“湿法冶金术”炼制金属铜CO+CuO=Cu+CO2↑
B.用氢氧化钠溶液吸收有害气体二氧化硫SO2+2NaOH=Na2SO3+H2O
C.用含氢氧化镁的药物治疗胃酸过多Mg(OH)2+2HCl=MgCl2+2H2O
D.用稀硫酸除铁锈Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
12.(2022·浙江绍兴·统考中考真题)在做酸碱反应的实验时,向盛有氢氧化钠溶液的烧杯中,逐渐加入稀盐酸。烧杯内相关物质的质量与加入稀盐酸质量的变化关系不正确的是
A. B.
C. D.
13.(2022·四川成都·统考中考真题)实验小组用图1装置探究稀氢氧化钠溶液与稀盐酸能否反应,测得数据如图2。下列说法正确的是
A.烧杯中只能盛放稀氢氧化钠溶液
B.图2不能证明反应是放热反应
C.60s时溶液中溶质只有氯化钠
D.实验证明氢氧化钠与盐酸能反应
14.(2022春·九年级课时练习)在日常生活中,中和反应被广泛地运用,下列不属于中和反应的是
A.在酸性土壤中加入熟石灰,可以调节土壤的酸碱性
B.胃酸过多的病人可以服用含氢氧化铝的药物,以中和过多的胃酸
C.被蜜蜂蜇后,涂一些含有氨水的药水,可减轻痛痒
D.在做消化道检查时,用硫酸钡作为造影剂,在X线照射下显示消化道有无病变的一种检查方法
15.(2022秋·湖北孝感·九年级期末)在铁粉和氧化铜粉末组成的混合物中,加入一定量的稀硫酸,充分反应后,过滤,向滤液中放入一枚铁钉,一段时间后,发现铁钉无变化。根据上述现象,确定下列结论正确的是
A.滤渣中一定含铜、铁
B.滤渣中一定含铜,一定不含铁
C.滤渣中一定含铜,但不一定含铁
D.滤液中一定含硫酸亚铁,但不一定含硫酸铜和硫酸
二、实验题
16.(2022秋·山东烟台·九年级统考期中)某化学兴趣小组为探究硫酸的化学性质,进行了如下的实验(所加稀硫酸均过量)。
(1)试管A中观察到紫色石蕊试液变______色。
(2)试管B中观察到溶液由无色逐渐变成黄色,是因为反应生成了______(填化学式),一段时间后有气泡产生,写出产生气泡的化学方程式______。
(3)试管C中碳酸钠溶液发生反应的化学方程式是______。
(4)试管D中加稀硫酸至过量,则试管D中溶质含有的离子有______(填离子符号),该试管中发生反应的微观实质是______。
17.(2022秋·天津红桥·九年级校考期末)某化学兴趣小组开展的氢氧化钠性质系列探究活动如图所示。
回答下列问题:
(1)实验①观察到氢氧化钠表面变______;
(2)实验②观察到紫色石蕊溶液变______色,实验③观察到无色盼酞溶液变成_____色。由此可得出:碱溶液能使指示剂变色。
(3)实验④:如图是氢氧化钠与盐酸反应的微观模拟示意图;从微观的角度分析反应的微观实质是_____;
(4)实验⑥、⑦为用软矿泉水瓶而所做的对比试验,装_______的软矿泉水瓶变瘪更明显,原因是______(用化学方程式表示)。
18.(2022秋·山东滨州·九年级校考期末)实验小组研究盐酸和氢氧化钙的化学性质,做了如图所示的8个实验:
(1)溶液颜色变为红色的试管编号是___________。
(2)②中最后会形成___________色的溶液,该试管中发生的化学方程式为___________。③④中都有___________的现象。
(3)试管⑥发生的化学方程式为___________,要证明试管⑥反应后盐酸有剩余,下列所给的药品中可以选择的有___________种。
所给药品:酚酞试液、石蕊试液、稀硫酸、铁粉、氧化铁、大理石。
(4)试管⑧中的现象是___________;利用该反应可以检验二氧化碳气体。
19.(2022秋·山东烟台·九年级统考期末)为认识酸和碱的性质,某化学学习小组进行了如下实验。
(1)20℃时,配制80g溶质质量分数为10%的NaOH溶液。
①用图1中仪器完成实验,还缺少的玻璃仪器是___________(填名称),玻璃棒在实验中的作用是___________。
②配制该溶液需要___________g水。用量筒量取水时,俯视读数会导致所配溶液的溶质质量分数___________10%。(填“大于”或“小于”)
(2)向1-5号小试管中分别滴加少量稀盐酸(见图2)。
①___________中溶液变为红色(填“试管1”或“试管2”)。
②试管3中产生现象是___________,试管4中无明显现象,由此推断金属活动性Cu比Zn___________(填“强”或“弱”)。试管3中发生反应的化学方程式为___________。
③试管5中生成一种盐和两种氧化物,该反应的化学方程式为___________。
20.(2022·广东·九年级专题练习)某兴趣小组用实验室常用药品对“NaOH溶液与稀盐酸的反应”进行探究。
【实验探究一】某同学利用图1装置研究稀盐酸与氢氧化钠溶液反应的过程,并用PH和温度传感器测量反应过程中相关物理量的变化情况,得到图2和图3。
(1)烧杯中发生反应的化学方程式是_______。
(2)图1中A中溶液的溶质是______(填化学式)。
(3)图3中V的数值最接近______(填“6”、“12”或“16”)。
【实验探究二】实验目的:
(4)氢氧化钠溶液与稀盐酸是否恰好完全反应设计并进行实验。
实验步骤 实验现象 结论
取2mL氢氧化钠溶液于试管中,滴入一定量的稀盐酸,振荡后加入镁条 若_____。 稀盐酸过量
若_____。 氢氧化钠与稀盐酸恰好完全反应
(5)另有同学提出上述实验探究二设计的方案不能证明NaOH溶液与稀盐酸恰好完全反应,其原因是______。
(6)从微观角度分析,氢氧化钠溶液和稀硫酸反应的实质是:______微粒(符号表示)参与反应,而______(同上)微粒没有参加反应,只是“旁观者”。
(7)向一定量的NaOH溶液中滴加少量盐酸后,为了证明盐酸已完全反应,可以加入_______(填字母)
A.Fe2O3 B.NaCl溶液 C.Fe D.氢氧化钾溶液
答案与解析
二、选择题
1.(2022·湖南株洲·中考真题)下列物质中,不能与稀硫酸反应的是
A.BaCl2溶液 B.Cu丝
C.CuO粉末 D.Cu(OH)2固体
【答案】B
【解析】A、氯化钡能与硫酸反应生成硫酸钡和盐酸,不符合题意;
B、在金属活动性顺序里,铜排在氢后,铜和硫酸不反应,符合题意;
C、氧化铜和硫酸反应生成硫酸铜和水,不符合题意;
D、氢氧化铜和硫酸反应生成硫酸铜和水,不符合题意。
故选B。
2.(2022秋·河北邢台·九年级金华中学校考期末)航天员舱外服内含有与氢氧化钠性质相似的氢氧化锂(LiOH),它不可能具有的化学性质是
A.与二氧化碳反应 B.与盐酸反应
C.与氧化铁反应 D.与氯化铜溶液反应
【答案】C
【解析】A、氢氧化锂与二氧化碳反应生成碳酸锂和水,故选项不符合题意;
B、氢氧化锂与盐酸反应生成氯化锂和水,故选项不符合题意;
C、氢氧化锂与氧化铁不反应,故选项符合题意;
D、氢氧化锂与氯化铜反应生成氯化锂和氢氧化铜沉淀,故选项不符合题意;
故选C。
3.(2022秋·山东威海·九年级校联考期中)氢氧化铯是一种可溶性碱,其化学式为CsOH,则下列叙述中不正确的是
A.CsOH溶液的pH大于7 B.CsOH在水中可以电离出Cs+和OH-
C.CsOH溶液能使酚酞试溶变红 D.CsOH与硫酸反应生成的盐的化学式为CsSO4
【答案】D
【解析】A、CsOH是可溶碱,碱的水溶液pH均大于7,叙述正确;
B、氢氧化铯是一种可溶性碱,所以CsOH在水中可以电离出Cs+和OH-,叙述正确;
C、CsOH是可溶碱,碱的水溶液能使酚酞试溶变红,叙述正确;
D、氢氧化铯的化学式为CsOH,说明铯离子的化学价为+1,硫酸根的化合价为-2,则CsOH与硫酸反应生成的盐的化学式为Cs2SO4,叙述错误。
故选D。
4.(2022秋·山东泰安·九年级统考期中)日常生活中遇到的下列污垢,不宜用盐酸清洗的是
A.保温瓶内的水垢(主要成分氢氧化镁)
B.盛石灰水的试剂瓶内壁的白色固体(主要成分是碳酸钙)
C.不锈钢茶杯内的茶垢(主要成分是茶多酚)
D.玻璃水槽内的黄色铁锈斑(主要成分是铁锈)
【答案】C
【解析】A、保温瓶内的水垢主要成分是氢氧化镁,而氢氧化镁与盐酸会反应,,所以宜用盐酸清洗,故选项错误;
B、盛石灰水的瓶内壁上的白色固体主要为碳酸钙,碳酸钙能和盐酸反应,即,所以宜用盐酸清洗,故选项错误;
C、不锈钢茶杯的主要成分是铁,能和盐酸反应损坏茶杯,所以不能用盐酸除茶杯内的水垢,故选项正确;
D、铁锈的主要成分是三氧化二铁,与盐酸时会发生如下反应,所以宜用盐酸清洗,故选项正确;
故选C。
5.(2022秋·山东泰安·九年级东平县实验中学校考阶段练习)下列关于酸的说法错误的是
A.浓硫酸具有吸水性,浓盐酸具有挥发性
B.稀盐酸能够使紫色石蕊溶液和无色酚酞溶液都变红色
C.稀盐酸和稀硫酸都可用于金属除锈
D.稀硫酸能够与活泼金属反应制取氢气
【答案】B
【解析】A、浓硫酸具有吸水性,浓盐酸具有挥发性,此选项正确;
B、稀盐酸能够使紫色石蕊溶液变红,不能使无色酚酞溶液变色,此选项错误;
C、稀盐酸和稀硫酸都能与金属氧化物反应,可用于金属除锈,此选项正确;
D、稀硫酸能够与活泼金属反应制取氢气,此选项正确。
故选B。
6.(2022·内蒙古通辽·统考中考真题)初中化学几种常见物质之间的反应关系如图所示,“一”两端的物质均能发生反应,图中各物质(除石蕊溶液外)的类别均不相同。下列说法不正确的是
A.X可能是碳酸钠 B.Z与硫酸反应,可能得到黄色溶液
C.X和Y可能是NaOH和Ba(NO3)2 D.Mg与H2SO4发生置换反应
【答案】C
【解析】A、若X为Na2CO3,则Y可以为Ca(OH)2,氢氧化钙能与碳酸钠反应生成碳酸钙沉淀与氢氧化钠,氢氧化钙能与硫酸反应生成硫酸钙与水;Z可以为Fe2O3,氧化铁能与硫酸反应生成硫酸铁与水,碳酸钠属于盐,氢氧化钙属于碱,硫酸属于酸,镁属于金属,氧化铁属于氧化物,物质类别也不同,故选项说法正确;
B、根据上述分析可知Z可以为氧化铁,氧化铁能与稀硫酸反应生成硫酸铁与水,硫酸铁的溶液呈黄色,带入验证合理,故选项说法正确;
C、根据题干信息可知,“一”两端的物质均能发生反应,X与Y相连,若X和Y是NaOH和Ba(NO3)2,两者不发生反应,则推断不合理,故选项说法错误;
D、镁与稀硫酸反应生成硫酸镁与氢气,该反应为单质与化合物反应生成另一种单质与另一种化合物,反应属于置换反应,故选项说法正确;
故选C。
7.(2022春·全国·九年级专题练习)关于酸和碱的性质说法正确的是
A.用盐酸不能洗掉盛石灰水后留下的白色固体
B.酸溶液有相似的化学性质是因为有共同的阳离子H+
C.酸有一些相似的化学性质,原因是它们与金属反应有氢气产生
D.碱有一些相似的化学性质,原因是它们都能与空气中的二氧化碳反应
【答案】B
【解析】A、根据石灰水在空气中会与二氧化碳反应生成碳酸钙沉淀和水,因此留下的白色固体是碳酸钙,碳酸钙能与稀盐酸反应生成氯化钙、水和二氧化碳,故稀盐酸能洗掉盛石灰水后留下的白色固体,选项说法错误;
B、酸是电离时产生的阳离子全部是氢离子的化合物,酸溶液有相似的化学性质是因为有共同的阳离子氢离子,选项正确;
C、酸具有相似的化学性质是因为在水溶液中都能电离出氢离子,而不是它们与金属反应有氢气产生,故选项说法错误;
D、碱有一些相似的化学性质,是因为在水溶液中都能电离出氢氧根离子,而不是都能与空气中的二氧化碳反应,故选项说法错误;
故选B。
8.(2022秋·河北邢台·九年级邢台三中阶段练习)如图所示装置气密性良好,向集气瓶中滴加液体M,要使注射器中的活塞明显向右移动,则液体M和固体N的组合可能是
①稀盐酸和石灰石 ②稀盐酸和镁 ③水和氢氧化钠 ④水和硝酸铵
A.①②③④ B.只有②③④ C.只有①②④ D.只有①②③
【答案】D
【解析】,向集气瓶中滴加液体M,要使注射器中的活塞明显向右移动,说明装置内的气压变大,则①稀盐酸和石灰石反应生成氯化钙、水和二氧化碳,有气体生成使气压变大,符合题意;
②稀盐酸和镁会反应生成氯化镁和氢气,有气体生成使气压变大,符合题意;
③水和氢氧化钠混合物,由于氢氧化钠溶于水会使水温升高则气体受热膨胀,气压变大,符合题意;
④水和硝酸铵混合后,硝酸铵溶于水会使水温降低,气压变小,不符合题意;
则①②③正确。
故选D。
9.(2022·山西晋中·统考中考真题)老师布置了以下四个实验,让同学们分组完成。当把胶头滴管内的液体全部加入试管中时,片刻后,通过观察反应物的变化,可判断出反应发生的是
A. B.
C. D.
【答案】A
【解析】A、稀盐酸与镁带发生反应,Mg+2HCl=MgCl2+H2↑,可观察到固体溶解且有气泡产生,可判断反应是否发生,此选项符合题意;
B、稀硫酸与氢氧化钠发生反应:2NaOH+H2SO4=Na2SO4+2H2O,反应无明显现象,无法判断反应是否反应,此选项不符合题意;
C、稀盐酸与大理石发生反应:CaCO3+2HCl=CaCl2+H2O+CO2↑,该反应现象为大理石表面有气泡产生,片刻以后,现象不明显,无法判断反应是否反应,此选项不符合题意;
D、稀硫酸与氯化钾混合,无明显现象,无法判断反应是否反应,此选项不符合题意。
故选A。
10.(2022·浙江杭州·统考中考真题)如图所示,分别向四支试管中加入饱和石灰水,使其与试管内溶液充分反应。无论饱和石灰水加入量的多少,反应后试管内溶液一定呈碱性的是( )。
A.① B.② C.③ D.④
【答案】C
【解析】A、①中稀盐酸和饱和石灰水中的氢氧化钙反应生成氯化钙和水,氯化钙溶液呈中性,若饱和石灰水的量不足,反应后试管内溶液呈酸性;若饱和石灰水和稀盐酸恰好完全反应,反应后试管内溶液呈中性;若饱和石灰水过量,反应后试管内溶液呈碱性,故A不符合题意;
B、②中稀硫酸和饱和石灰水中的氢氧化钙反应生成硫酸钙和水,硫酸钙溶液呈中性,若饱和石灰水的量不足,反应后试管内溶液呈酸性;若饱和石灰水和稀硫酸恰好完全反应,反应后试管内溶液呈中性;若饱和石灰水过量,反应后试管内溶液呈碱性,故B不符合题意;
C、③中试管内的碳酸钠溶液呈碱性,向其中加入饱和石灰水,碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,生成的氢氧化钠溶液呈碱性,无论饱和石灰水加入量的多少,反应后试管内溶液一定呈碱性,故C符合题意;
D、④中试管内的氯化铁溶液呈酸性,加入石灰水,氢氧化钙和氯化铁反应生成氢氧化铁沉淀和氯化钙,氯化钙溶液呈中性,若饱和石灰水的量不足,反应后试管内溶液呈酸性;若饱和石灰水和氯化铁恰好完全反应,反应后试管内溶液呈中性;若饱和石灰水过量,反应后试管内溶液呈碱性,故D不符合题意。
故选C。
11.(2022·河北保定·统考一模)化学知识应用十分广泛。下列应用的原理用化学方程式表示不正确的是
A.古代“湿法冶金术”炼制金属铜CO+CuO=Cu+CO2↑
B.用氢氧化钠溶液吸收有害气体二氧化硫SO2+2NaOH=Na2SO3+H2O
C.用含氢氧化镁的药物治疗胃酸过多Mg(OH)2+2HCl=MgCl2+2H2O
D.用稀硫酸除铁锈Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
【答案】A
【解析】A、古代“湿法冶金术”炼制金属铜是铁和硫酸铜反应生成硫酸亚铁和铜,该反应的化学方程式为:,符合题意;
B、用氢氧化钠溶液吸收有害气体二氧化硫,二氧化硫和氢氧化钠反应生成亚硫酸钠和水,该反应的化学方程式为:,不符合题意;
C、用含氢氧化镁的药物治疗胃酸过多,氢氧化镁和盐酸反应生成氯化镁和水,该反应的化学方程式为:,不符合题意;
D、铁锈的主要成分是氧化铁,氧化铁和稀硫酸反应生成硫酸铁和水,该反应的化学方程式为:,不符合题意。
故选A。
12.(2022·浙江绍兴·统考中考真题)在做酸碱反应的实验时,向盛有氢氧化钠溶液的烧杯中,逐渐加入稀盐酸。烧杯内相关物质的质量与加入稀盐酸质量的变化关系不正确的是
A. B.
C. D.
【答案】D
【分析】氢氧化钠和稀盐酸反应生成氯化钠和水,随着稀盐酸的不断加入,氢氧化钠越来越少,氯化钠越来越多。
【解析】A、随着反应进行,当恰好完全反应后,水的质量由于一直加入加入稀盐酸,所以水的质量不断增大,正确;
B、随着反应进行,当恰好完全反应后,氯化钠质量不变,正确;
C、随着反应进行,当恰好完全反应后氢氧化钠质量是0,正确;
D、随着稀盐酸的加入,一段时间内溶液中氯化氢质量是0,恰好完全反应后一直在加入稀盐酸,所以溶液中的氯化氢质量不断增大,选项错误;
故选D。
13.(2022·四川成都·统考中考真题)实验小组用图1装置探究稀氢氧化钠溶液与稀盐酸能否反应,测得数据如图2。下列说法正确的是
A.烧杯中只能盛放稀氢氧化钠溶液
B.图2不能证明反应是放热反应
C.60s时溶液中溶质只有氯化钠
D.实验证明氢氧化钠与盐酸能反应
【答案】D
【分析】从图中可以看出,随着反应时间的增加,温度先上升后下降,说明氢氧化钠溶液和稀盐酸反应放热。
【解析】A、烧杯中放稀氢氧化钠溶液还是稀盐酸,不影响对反应温度的升高,A错误,不符合题意;
B、图2温度升高,能证明反应放热,B错误,不符合题意;
C、60s是反应温度达到最高点以后的时间,不确定反应是加到恰好完全反应就停止滴加,还是一直滴加注射器中溶液;
若恰好完全反应就停止滴加,溶液中溶质只有氯化钠;
若是一直滴加注射器中溶液,60s时溶液中除了氯化钠,还有注射器中溶液的溶质;
C错误,不符合题意;
D、实验反应放热是化学能转化为热能的过程,能证明氢氧化钠与盐酸反应,D正确,符合题意。
故选D。
14.(2022春·九年级课时练习)在日常生活中,中和反应被广泛地运用,下列不属于中和反应的是
A.在酸性土壤中加入熟石灰,可以调节土壤的酸碱性
B.胃酸过多的病人可以服用含氢氧化铝的药物,以中和过多的胃酸
C.被蜜蜂蜇后,涂一些含有氨水的药水,可减轻痛痒
D.在做消化道检查时,用硫酸钡作为造影剂,在X线照射下显示消化道有无病变的一种检查方法
【答案】D
【解析】A、熟石灰是氢氧化钙的俗称,能和酸反应生成盐和水,属于中和反应,故A错误;
B、胃酸中的稀盐酸和氢氧化铝反应生成氯化铝和水,属于中和反应,故B错误;
C、含碱性物质的药水和蚊子叮咬分泌的蚁酸反应生成盐和水,属于中和反应,故C错误;
D、在做消化道检查时,用硫酸钡作为造影剂,是利用了硫酸钡不与胃酸反应,与中和反应无关,故D正确。
故选D。
15.(2022秋·湖北孝感·九年级期末)在铁粉和氧化铜粉末组成的混合物中,加入一定量的稀硫酸,充分反应后,过滤,向滤液中放入一枚铁钉,一段时间后,发现铁钉无变化。根据上述现象,确定下列结论正确的是
A.滤渣中一定含铜、铁
B.滤渣中一定含铜,一定不含铁
C.滤渣中一定含铜,但不一定含铁
D.滤液中一定含硫酸亚铁,但不一定含硫酸铜和硫酸
【答案】C
【分析】在铁粉和氧化铜粉末组成的混合物中,加入一定量的稀硫酸,铁与硫酸反应生成硫酸亚铁和氢气,氧化铜与硫酸反应生成硫酸铜和水,铁与硫酸铜反应生成硫酸亚铁和铜,充分反应后,过滤,滤渣中一定含铜,滤液中一定含有硫酸亚铁;向滤液中放入一枚铁钉,一段时间后,发现铁钉无变化,说明滤液中一定没有硫酸铜和硫酸。
【解析】A、由分析知,滤渣中一定含铜,不能确定是否含有铁,故A不符合题意;
B、由分析知,滤渣中一定含铜,但不能确定是否含有铁,故B不符合题意;
C、由分析知,滤渣中一定含铜,但不一定含铁,故C符合题意;
D、由分析知,滤液中一定含有硫酸亚铁,一定没有硫酸铜和硫酸,故D不符合题意。
故选C。
二、实验题
16.(2022秋·山东烟台·九年级统考期中)某化学兴趣小组为探究硫酸的化学性质,进行了如下的实验(所加稀硫酸均过量)。
(1)试管A中观察到紫色石蕊试液变______色。
(2)试管B中观察到溶液由无色逐渐变成黄色,是因为反应生成了______(填化学式),一段时间后有气泡产生,写出产生气泡的化学方程式______。
(3)试管C中碳酸钠溶液发生反应的化学方程式是______。
(4)试管D中加稀硫酸至过量,则试管D中溶质含有的离子有______(填离子符号),该试管中发生反应的微观实质是______。
【答案】(1)红
(2)
(3)
(4) Na+、H+、 H+和结合生成H2O
【解析】(1)试管A中稀硫酸显酸性能使石蕊试液变红,故填:红;
(2)试管B中的铁锈中含有氧化铁能与稀硫酸反应生成黄色的硫酸铁和水,故填:;
有气泡产生是因为铁锈反应后,里面的铁和稀硫酸反应生成硫酸亚铁和氢气,化学方程式为:;
(3)试管C中碳酸钠和稀硫酸反应生成硫酸钠、水和二氧化碳,化学方程式为:;
(4)试管D中加稀硫酸至过量,根据氢氧化钠和稀硫酸反应生成硫酸钠和水,因此溶液中的溶质是生成的硫酸钠和剩余的硫酸,则试管D中溶质含有的离子有硫酸根离子,钠离子和氢离子,故填:;
酸碱中和的实质是:H+和结合生成H2O。
17.(2022秋·天津红桥·九年级校考期末)某化学兴趣小组开展的氢氧化钠性质系列探究活动如图所示。
回答下列问题:
(1)实验①观察到氢氧化钠表面变______;
(2)实验②观察到紫色石蕊溶液变______色,实验③观察到无色盼酞溶液变成_____色。由此可得出:碱溶液能使指示剂变色。
(3)实验④:如图是氢氧化钠与盐酸反应的微观模拟示意图;从微观的角度分析反应的微观实质是_____;
(4)实验⑥、⑦为用软矿泉水瓶而所做的对比试验,装_______的软矿泉水瓶变瘪更明显,原因是______(用化学方程式表示)。
【答案】(1)潮湿
(2) 蓝 红
(3)氢离子和氢氧根离子结合生成水
(4) 氢氧化钠溶液或NaOH溶液
【解析】(1)氢氧化钠固体在空气中易吸收水分而潮解,所以实验①观察到氢氧化钠表面变潮湿,故填:潮湿。
(2)氢氧化钠溶液呈碱性,能使紫色的石蕊溶液变蓝色,无色的酚酞变红色,所以实验②观察到紫色石蕊溶液变成蓝色,实验③观察到无色酚酞溶液变成红色。由此得出:碱溶液能使指示剂变色,故①填:蓝,②填:红。
(3)氢氧化钠与盐酸反应的微观实质是盐酸中的氢离子和氢氧化钠中氢氧根离子结合生成水,故填:氢离子和氢氧根离子结合生成水。
(4)①实验⑥⑦为用软矿泉水瓶所做的对比实验,二氧化碳能溶于水,也能与氢氧化钠发生反应,所以装氢氧化钠溶液的软矿泉水瓶变瘪更明显,故填:氢氧化钠溶液或NaOH溶液。
②二氧化碳和氢氧化钠反应生成碳酸钠和水,反应的化学方程式为: ,故填: 。
18.(2022秋·山东滨州·九年级校考期末)实验小组研究盐酸和氢氧化钙的化学性质,做了如图所示的8个实验:
(1)溶液颜色变为红色的试管编号是___________。
(2)②中最后会形成___________色的溶液,该试管中发生的化学方程式为___________。③④中都有___________的现象。
(3)试管⑥发生的化学方程式为___________,要证明试管⑥反应后盐酸有剩余,下列所给的药品中可以选择的有___________种。
所给药品:酚酞试液、石蕊试液、稀硫酸、铁粉、氧化铁、大理石。
(4)试管⑧中的现象是___________;利用该反应可以检验二氧化碳气体。
【答案】(1)①⑤##⑤①
(2) 黄 气泡产生
(3) 四##4
(4)澄清石灰水变浑浊
【解析】(1)根据紫色石蕊试液遇酸变红色,遇中性溶液不变色,遇碱性溶液变蓝色,无色酚酞溶液遇酸性和中性溶液不变色,遇碱性溶液变红色,故上述溶液颜色变为红色的有①⑤;
(2)②中稀盐酸与氧化铁反应生成氯化铁和水,故②中最后会形成黄色的溶液,该反应方程式为;③中碳酸钙与稀盐酸反应生成氯化钙、二氧化碳和水,④中碳酸钠与稀盐酸反应生成氯化钠、二氧化碳和水,故都有产生气泡的现象;
(3)⑥中稀盐酸与澄清石灰水的溶质氢氧化钙反应生成氯化钙和水,该反应方程式为;
要证明试管⑥反应后盐酸有剩余,
盐酸与酚酞试液无现象、使石蕊试液变成红色、与稀硫酸不反应、与铁粉反应会产生气泡、与氧化铁反应会生成氯化铁和水,氯化铁溶液为黄色的、与大理石反应会产生气泡,因此可以选择与盐酸混合有明显现象的试剂石蕊试液、铁粉、氧化铁、大理石这四种物质进行证明;
(4)⑧中二氧化碳与澄清石灰水的溶质氢氧化钙反应生成碳酸钙沉淀和水,故可观察到澄清石灰水变浑浊,利用该反应可以检验二氧化碳气体。
19.(2022秋·山东烟台·九年级统考期末)为认识酸和碱的性质,某化学学习小组进行了如下实验。
(1)20℃时,配制80g溶质质量分数为10%的NaOH溶液。
①用图1中仪器完成实验,还缺少的玻璃仪器是___________(填名称),玻璃棒在实验中的作用是___________。
②配制该溶液需要___________g水。用量筒量取水时,俯视读数会导致所配溶液的溶质质量分数___________10%。(填“大于”或“小于”)
(2)向1-5号小试管中分别滴加少量稀盐酸(见图2)。
①___________中溶液变为红色(填“试管1”或“试管2”)。
②试管3中产生现象是___________,试管4中无明显现象,由此推断金属活动性Cu比Zn___________(填“强”或“弱”)。试管3中发生反应的化学方程式为___________。
③试管5中生成一种盐和两种氧化物,该反应的化学方程式为___________。
【答案】(1) 烧杯 搅拌,加速溶解 72 大于
(2) 试管1 锌粒逐渐减少,产生大量气泡 弱
【解析】(1)①用固体配制一定溶质质量分数的溶液时,需要使用烧杯、玻璃棒、胶头滴管、量筒、托盘天平、药匙,图中缺少烧杯,故填烧杯;
配制溶液时,需要用玻璃棒进行搅拌,以加速溶质溶解,故填搅拌,加速溶解;
②配制80g溶质质量分数为10%的NaOH溶液,则其中溶质质量为 ,则溶剂水的质量为 ,故填72;
使用量筒量取液体时俯视读数,会使得量取的液体实际体积偏小,最终配制的溶液浓度偏大,故填大于;
(2)①盐酸呈酸性,能使紫色石蕊试液变红色,但不能使无色酚酞试液变色,故填试管1;
②锌和稀盐酸反应生成氯化锌和氢气,则在试管3中加入稀盐酸可观察到锌粒逐渐减小,且有气泡产生,故填锌粒逐渐减少,产生大量气泡;
试管4中无明显现象,说明铜的金属活泼性排在氢之后;而锌能和盐酸反应生成氢气,说明锌的金属活泼性排在氢之前,则金属活动性Cu比Zn弱,故填弱;
锌和稀盐酸反应生成氯化锌和氢气,其化学方程式为 ,故填;
③碱式碳酸铜和稀盐酸反应生成氯化铜、二氧化碳和水,其化学方程式为 ,故填。
20.(2022·广东·九年级专题练习)某兴趣小组用实验室常用药品对“NaOH溶液与稀盐酸的反应”进行探究。
【实验探究一】某同学利用图1装置研究稀盐酸与氢氧化钠溶液反应的过程,并用PH和温度传感器测量反应过程中相关物理量的变化情况,得到图2和图3。
(1)烧杯中发生反应的化学方程式是_______。
(2)图1中A中溶液的溶质是______(填化学式)。
(3)图3中V的数值最接近______(填“6”、“12”或“16”)。
【实验探究二】实验目的:
(4)氢氧化钠溶液与稀盐酸是否恰好完全反应设计并进行实验。
实验步骤 实验现象 结论
取2mL氢氧化钠溶液于试管中,滴入一定量的稀盐酸,振荡后加入镁条 若_____。 稀盐酸过量
若_____。 氢氧化钠与稀盐酸恰好完全反应
(5)另有同学提出上述实验探究二设计的方案不能证明NaOH溶液与稀盐酸恰好完全反应,其原因是______。
(6)从微观角度分析,氢氧化钠溶液和稀硫酸反应的实质是:______微粒(符号表示)参与反应,而______(同上)微粒没有参加反应,只是“旁观者”。
(7)向一定量的NaOH溶液中滴加少量盐酸后,为了证明盐酸已完全反应,可以加入_______(填字母)
A.Fe2O3 B.NaCl溶液 C.Fe D.氢氧化钾溶液
【答案】(1)HCl+NaOH=NaCl+H2O
(2)HCl
(3)12
(4) 大量气泡 无明显现象
(5)氢氧化钠与稀盐酸恰好完全反应或氢氧化钠过量加入镁条均无明显现象
(6) OH-、H+ 、Na+
(7)AC
【解析】(1)氢氧化钠与稀盐酸反应生成氯化钠和水,反应的化学方程式为:HCl+NaOH=NaCl+H2O。
(2)根据图二中pH变化,反应之前pH>7,随着仪器A中溶液的不断滴入,pH逐渐降低,可知烧杯中溶液溶质是氢氧化钠,仪器A中溶液的溶质是HCl。
(3)中和反应放热,二者恰好完全反应时pH=7,放出的热量最多,结合图二和图三可知,图三中V的数值最接近12。
(4)取2mL氢氧化钠溶液于试管中,滴入一定量的稀盐酸,振荡后加入镁条,由于镁条能与稀盐酸反应生成氯化镁和氢气,即有气泡产生,因此若出现大量气泡,则稀盐酸过量,若无明显现象,则氢氧化钠与稀盐酸恰好完全反应或氢氧化钠过量。
(5)由小问4的解析可知,氢氧化钠与稀盐酸恰好完全反应或氢氧化钠过量加入镁条均无明显现象。
(6)从微观角度分析,氢氧化钠溶液和稀硫酸反应的实质是氢氧根离子(OH-)与氢离子(H+)结合生成水的过程,而钠离子(Na+)和硫酸根离子()没有参加反应。
(7)Fe2O3与稀盐酸反应生成氯化铁和水,溶液由无色变为黄色,Fe与稀盐酸反应生成氯化亚铁和氢气,出现大量气泡,稀盐酸与氯化钠不反应,稀盐酸与氢氧化钾溶液反应生成氯化钾和水,无明显想象。
故选AC。
1
