2022—2023学年化学沪教版(全国)九年级下册第6章 溶解现象 章末夯练题(含答案)
文档属性
| 名称 | 2022—2023学年化学沪教版(全国)九年级下册第6章 溶解现象 章末夯练题(含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 226.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-01 08:32:28 | ||
图片预览



文档简介
2022—2023学年化学沪教版(全国)九年级下册第6章 溶解现象 章末夯练题含答案
沪教版(全国)第6章 溶解现象
一、选择题。
1、下列各种生活实例中,不属于溶液应用的是( )。
A.医院里使用消毒酒精对皮肤、体温计等消毒
B.用熟石灰粉等物质配制粉刷内墙的涂料
C.长跑运动员赛跑途中服用葡萄糖口服液来补充能量
D.实验室里将物质配成溶液进行化学反应
2、实验室配制50g溶质质量分数为15%的氯化钠溶液。下列说法中错误的是( )
A.实验的步骤为计算、称量、量取、溶解、转移
B.溶解过程中玻璃棒的作用是搅拌,加快氯化钠的溶解速率
C.把配制好的氯化钠溶液倒入刚用蒸馏水润洗过的试剂瓶中,并贴上标签
D.量取水时,用规格为50mL的量筒量取42.5mL蒸馏水
3、(双选)NH4Cl和Na2SO4的溶解度表及溶解度曲线如下。下列说法正确的是 ( )
温度/℃ 10 20 30 40 50 60
溶解度S/g NH4Cl 33.3 37.2 41.4 45.8 50.4 60.2
Na2SO4 9.6 20.2 40.8 48.4 47.5 47.0
A.甲为NH4Cl
B.t3℃应介于40℃~50℃
C.乙物质的饱和溶液从t2升温到t3,溶液的溶质质量分数不变
D.甲、乙饱和溶液从t3降温到t1,析出晶体(均不带结晶水)的质量一定相等
4、用15%的葡萄糖溶液配制150g 5%葡萄糖溶液,下列做法不正确的是( )
A.取用15%的葡萄糖溶液50g
B.使用量筒、烧杯和漏斗等仪器
C.加水100g
D.量水时选用规格100mL的量筒
5、在“粗盐中难溶性杂质的去除”实验中,玻璃棒的用途不正确的是( )
A.称取粗盐后,把粗盐研磨细
B.溶解时搅拌,加速粗盐溶解
C.称量精盐前,把精盐固体转移到纸上
D.蒸发时搅拌,防止局部温度过高,造成液体飞溅
6、某化学实验小组用如图所示的实验装置进行相关实验,向集气瓶中先装入Y试剂,然后从胶头滴管中滴加X(X的体积忽略不计),下列判断不正确的是( )。
A.若X为水,Y为硝酸铵,则乙瓶中右端导管内液面下降
B.若X为稀盐酸,Y为镁,则乙瓶中右端导管内液面上升
C.若乙瓶中右端导管内液面上升,X为水,则Y可能为氯化钠
D.若乙瓶中右端导管内液面上升,Y为生石灰,则X可能为水
7、实验室欲配制0.9%的生理水100g,下列操作步骤合理的是( )
A.用托盘天平称量9g NaCl B.用烧杯量取99.1mL水
C.在量筒中配制溶液 D.配好后转移到试剂瓶中,贴上标签
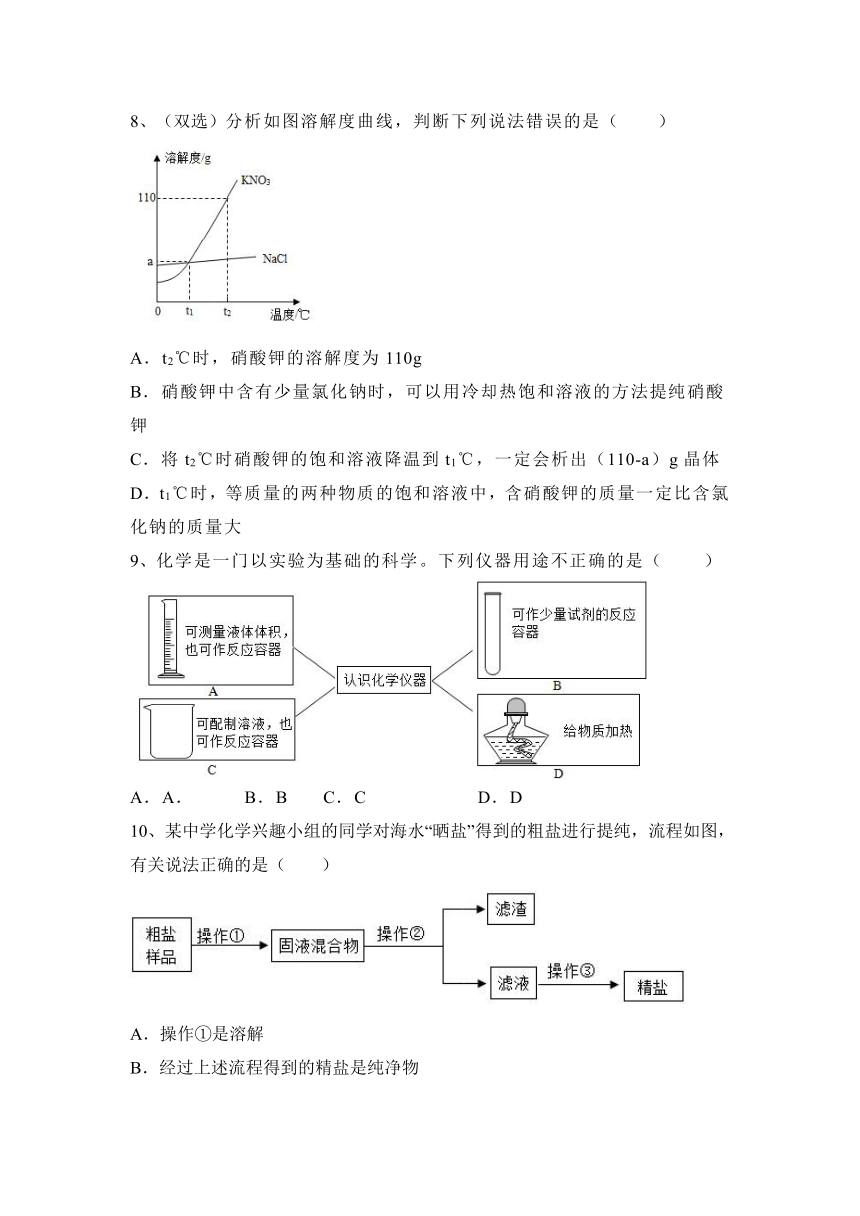
8、(双选)分析如图溶解度曲线,判断下列说法错误的是( )
A.t2℃时,硝酸钾的溶解度为110g
B.硝酸钾中含有少量氯化钠时,可以用冷却热饱和溶液的方法提纯硝酸钾
C.将t2℃时硝酸钾的饱和溶液降温到t1℃,一定会析出(110-a)g晶体
D.t1℃时,等质量的两种物质的饱和溶液中,含硝酸钾的质量一定比含氯化钠的质量大
9、化学是一门以实验为基础的科学。下列仪器用途不正确的是( )
A.A. B.B C.C D.D
10、某中学化学兴趣小组的同学对海水“晒盐”得到的粗盐进行提纯,流程如图,有关说法正确的是( )
A.操作①是溶解
B.经过上述流程得到的精盐是纯净物
C.蒸发后,取下蒸发皿直接放在实验台上
D.操作①②③均用到玻璃棒,且玻璃棒的作用相同
11、鱼类腥味产生的原因是鱼身上有甲胺,甲胺易溶于乙醇,因此,煮鱼时加些酒,能使甲胺溶于乙醇并随加热挥发逸出,这样烹饪的鱼就不再有腥味。下列过程与上述原理相似的是( )。
A.用洗涤剂洗碗 B.用酒精将试管壁上的碘洗掉
C.用烧碱除油污 D.用盐酸除去铁锈
12、常温下,在15 g氯化钠中加入60 g水,完全溶解后,溶液中氯化钠的质量分数为( )
A.15% B.20% C.25% D.33.3%
13、(双选)如图所示为甲、乙、丙三种固体物质的溶解度曲线,下列说法错误的是( )
A.甲中混有少量乙,若要提纯甲,可采取冷却热饱和溶液法
B.t2℃时,丙的饱和溶液中溶质和溶剂的质量比为1:4
C.将t3℃的甲、乙饱和溶液降温到t1℃,析出固体甲的质量一定大于乙
D.在t3℃时,等质量的甲、乙、丙的饱和溶液降温至t1℃时,所得溶液中溶质的质量分数由大到小的顺序为乙﹥甲﹥丙
14、将家庭中常用的四种调味品分别放入水中,不能形成溶液的是( )
A.醋 B.蔗糖 C.花生油 D.食盐
15、除质量分数以外,人们有时也用体积分数来表示溶液的浓度.例如,52%的饮用白酒就是指每100体积的饮用白酒中含有52体积的乙醇.下列溶液的浓度属于用体积分数来表示的是( )
A.0.9%的生理盐水 B.5%的葡萄糖注射液
C.10%的氢氧化钠溶液 D.75%的医用酒精
二、填空题。
16、下列物质属于溶液的是 ,属于悬浊液的是 ,属于乳浊液的是 。
A蒸馏水 B石灰浆 C牛奶 D矿泉水
17、t1 ℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100 g水的两个烧杯中,充分搅拌后现象如图1所示,硝酸钾和氯化钾的溶解度曲线如图2所示。
(1)烧杯②种的上层清液是否达到饱和状态?____(填“是”“否”或“无法判断”);
(2)烧杯①中溶解的溶质是____(写名称或化学式);
(3)将t1 ℃时50 g硝酸钾的饱和溶液稀释成10%的溶液,需加水____g;
(4)关于图1中烧杯内的物质,下列说法正确的是____。
A.烧杯①内溶液中溶质的质量分数>烧杯②内上层清液中溶质的质量分数
B.蒸发一定量的水,两烧杯中都一定有固体析出
C.将两个烧杯中的溶液混合,充分搅拌后,烧杯中一定还有剩余固体
D.将温度升高到t2 ℃,两烧杯内溶液中溶质的质量分数相等(不考虑水的蒸发)
18、t1 ℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100 g水的两个烧杯中,充分搅拌后现象如图1所示,硝酸钾和氯化钾的溶解度曲线如图2所示。
(1)烧杯②种的上层清液是否达到饱和状态? (填“是”“否”或“无法判断”);
(2)烧杯①中溶解的溶质是 (写名称或化学式);
(3)将t1 ℃时50 g硝酸钾的饱和溶液稀释成10%的溶液,需加水 g;
(4)关于图1中烧杯内的物质,下列说法正确的是 。
A.烧杯①内溶液中溶质的质量分数>烧杯②内上层清液中溶质的质量分数
B.蒸发一定量的水,两烧杯中都一定有固体析出
C.将两个烧杯中的溶液混合,充分搅拌后,烧杯中一定还有剩余固体
D.将温度升高到t2 ℃,两烧杯内溶液中溶质的质量分数相等(不考虑水的蒸发)
19、化学就在我们身边,生活中蕴藏着丰富的化学知识。
(1)净化水的操作有①过滤②蒸馏③静置沉淀等多种,其中净化程度最高的操作是 (填序号)。净水器中经常使用活性炭,主要利用活性炭的 性。
(2)农业上选种需配制一定溶质质量分数的氯化钠溶液,在其他操作无错误的前提下,用量筒取水时俯视读数,则配制的溶液中溶质质量分数会
(选填“偏大”、“偏小”或“不变”)。
(3)实验时要处处注意安全。用完酒精灯后,必须用灯帽盖灭,熄灭火焰的主要原理是 (填序号)。
A降温到着火点以下 B隔绝氧气 C清除可燃物
20、粗盐的初步提纯:
①使用蒸发皿蒸发溶液时,液体不超过其容积的_______ ;②蒸发过程中要用_______不断搅拌,防止局部过热,造成液滴飞溅;③蒸发皿中出现________时,停止加热,用余热蒸干。
21、下列物质属于溶液的是_________,属于悬浊液的是__________,属于乳浊液的是_________。
A蒸馏水 B石灰浆 C牛奶 D矿泉水
22、在抗击“新型冠状病毒”的疫情当中给病人治疗过程中需要输液,除了治疗,更重要的是预防,我们需要如酒精等进行消毒,而这些药品大多都属于溶液,写出下列医用药品中溶质的化学式:
编号 溶液 溶质化学式
① 医用碘酒 ________
② 医疗消毒用高锰酸钾溶液(俗称紫药水) ________
③ 0.9%的氯化钠注射液(俗称生理盐水) ________
④ 75%的医用酒精 _________
⑤ 医疗上消毒用3%的过氧化氢溶液 __________
23、控制变量法是科学探究中常用的方法之一。
(1)在探究固体物质的溶解度时,需要考虑的因素有:①溶质的种类; ②溶剂的种类;③溶质最多被溶解的质量; ④溶剂的质量; ⑤温度。
如测定“某物质在不同温度下的溶解度”,研究的是 (填序号)受温度的影响,这就需要控制其他因素保持不变。
(2)右表是利用控制变量法测得的氯化钠、硝酸钾在不同温度时的溶解度,请根据表格内容及实验现象回答下列问题。
温度(℃) 20 40 50
溶解度/g NaCl 36.0 36.6 37.0
KNO3 31.6 63.9 85.5
①从上表可知,两种物质的溶解度受温度变化影响较大的是 ;
②20℃时,将等质量的NaCl、KNO3分别放入盛有100 g水的两个烧杯中,充分溶解后如图1所示,升温到50℃时如图2所示。试判断:50℃时甲烧杯中的溶液一定是 (填“饱和溶液”、“不饱和溶液”或“不能确定”)。
三、填空题。
24、粗盐的初步提纯实验中采用的方法利用了氯化钠的哪些性质?考虑到粗盐的来源,你判断这样提纯的盐是否为纯净物?怎样设计实验证明你的判断。
四、实验题。
25、某化学兴趣小组探究NH4Cl、CaCl2、NaCl三种物质溶于水过程中的热量变化。
【药品和器材】水、NH4Cl、CaCl2、NaCl;烧杯、药匙、玻璃棒、量筒、温度计等。
【实验探究】各取1药匙三种物质于烧杯中并分别溶于水,另取一个烧杯只加水,用温度计测量液体温度,并记录有关数据,如表所示。
实验 水的体积/mL 所加物质 测量液体温度/℃
实验1 50 NH4Cl 15
实验2 50 CaCl2 28
实验3 x NaCl 22
实验4 50 无 22
(1)表中x为 。
(2)比较实验2与实验4,可得出的结论是 。
(3)如果要生产一种“冰袋”用于冷敷,上述三种物质中最合适的是 (填化学式)。
【反思提升】
(4)经讨论认为本实验操作中存在缺陷,它是 (填字母)。
A.实验操作过程中没有采取较为严格的保温措施
B.加入物质的质量可能不相等
C.加入物质的种类不一样
五、计算类题。
26、福尔马林是甲醛(其分子结构如图所示)含量为35%至40% 的水溶液,外观无色透明,有腐蚀性,具防腐、消毒和漂白的功能,实验室用以浸制标本。某福尔马林溶液中碳元素含量14.4%,则该福尔马林溶液溶质质量分数是_____。
2022—2023学年化学沪教版(全国)九年级下册第6章 溶解现象 章末夯练题含答案
沪教版(全国)第6章 溶解现象
一、选择题。
1、下列各种生活实例中,不属于溶液应用的是( )。
A.医院里使用消毒酒精对皮肤、体温计等消毒
B.用熟石灰粉等物质配制粉刷内墙的涂料
C.长跑运动员赛跑途中服用葡萄糖口服液来补充能量
D.实验室里将物质配成溶液进行化学反应
【答案】B
2、实验室配制50g溶质质量分数为15%的氯化钠溶液。下列说法中错误的是( )
A.实验的步骤为计算、称量、量取、溶解、转移
B.溶解过程中玻璃棒的作用是搅拌,加快氯化钠的溶解速率
C.把配制好的氯化钠溶液倒入刚用蒸馏水润洗过的试剂瓶中,并贴上标签
D.量取水时,用规格为50mL的量筒量取42.5mL蒸馏水
【答案】C
3、(双选)NH4Cl和Na2SO4的溶解度表及溶解度曲线如下。下列说法正确的是 ( )
温度/℃ 10 20 30 40 50 60
溶解度S/g NH4Cl 33.3 37.2 41.4 45.8 50.4 60.2
Na2SO4 9.6 20.2 40.8 48.4 47.5 47.0
A.甲为NH4Cl
B.t3℃应介于40℃~50℃
C.乙物质的饱和溶液从t2升温到t3,溶液的溶质质量分数不变
D.甲、乙饱和溶液从t3降温到t1,析出晶体(均不带结晶水)的质量一定相等
【答案】BC
4、用15%的葡萄糖溶液配制150g 5%葡萄糖溶液,下列做法不正确的是( )
A.取用15%的葡萄糖溶液50g
B.使用量筒、烧杯和漏斗等仪器
C.加水100g
D.量水时选用规格100mL的量筒
【答案】B
5、在“粗盐中难溶性杂质的去除”实验中,玻璃棒的用途不正确的是( )
A.称取粗盐后,把粗盐研磨细
B.溶解时搅拌,加速粗盐溶解
C.称量精盐前,把精盐固体转移到纸上
D.蒸发时搅拌,防止局部温度过高,造成液体飞溅
【答案】A
6、某化学实验小组用如图所示的实验装置进行相关实验,向集气瓶中先装入Y试剂,然后从胶头滴管中滴加X(X的体积忽略不计),下列判断不正确的是( )。
A.若X为水,Y为硝酸铵,则乙瓶中右端导管内液面下降
B.若X为稀盐酸,Y为镁,则乙瓶中右端导管内液面上升
C.若乙瓶中右端导管内液面上升,X为水,则Y可能为氯化钠
D.若乙瓶中右端导管内液面上升,Y为生石灰,则X可能为水
【答案】C
7、实验室欲配制0.9%的生理水100g,下列操作步骤合理的是( )
A.用托盘天平称量9g NaCl B.用烧杯量取99.1mL水
C.在量筒中配制溶液 D.配好后转移到试剂瓶中,贴上标签
【答案】D
8、(双选)分析如图溶解度曲线,判断下列说法错误的是( )
A.t2℃时,硝酸钾的溶解度为110g
B.硝酸钾中含有少量氯化钠时,可以用冷却热饱和溶液的方法提纯硝酸钾
C.将t2℃时硝酸钾的饱和溶液降温到t1℃,一定会析出(110-a)g晶体
D.t1℃时,等质量的两种物质的饱和溶液中,含硝酸钾的质量一定比含氯化钠的质量大
【答案】CD
9、化学是一门以实验为基础的科学。下列仪器用途不正确的是( )
A.A. B.B C.C D.D
【答案】A
10、某中学化学兴趣小组的同学对海水“晒盐”得到的粗盐进行提纯,流程如图,有关说法正确的是( )
A.操作①是溶解
B.经过上述流程得到的精盐是纯净物
C.蒸发后,取下蒸发皿直接放在实验台上
D.操作①②③均用到玻璃棒,且玻璃棒的作用相同
【答案】A
11、鱼类腥味产生的原因是鱼身上有甲胺,甲胺易溶于乙醇,因此,煮鱼时加些酒,能使甲胺溶于乙醇并随加热挥发逸出,这样烹饪的鱼就不再有腥味。下列过程与上述原理相似的是( )。
A.用洗涤剂洗碗 B.用酒精将试管壁上的碘洗掉
C.用烧碱除油污 D.用盐酸除去铁锈
【答案】B
12、常温下,在15 g氯化钠中加入60 g水,完全溶解后,溶液中氯化钠的质量分数为( )
A.15% B.20% C.25% D.33.3%
【答案】B
13、(双选)如图所示为甲、乙、丙三种固体物质的溶解度曲线,下列说法错误的是( )
A.甲中混有少量乙,若要提纯甲,可采取冷却热饱和溶液法
B.t2℃时,丙的饱和溶液中溶质和溶剂的质量比为1:4
C.将t3℃的甲、乙饱和溶液降温到t1℃,析出固体甲的质量一定大于乙
D.在t3℃时,等质量的甲、乙、丙的饱和溶液降温至t1℃时,所得溶液中溶质的质量分数由大到小的顺序为乙﹥甲﹥丙
【答案】CD
14、将家庭中常用的四种调味品分别放入水中,不能形成溶液的是( )
A.醋 B.蔗糖 C.花生油 D.食盐
【答案】C
15、除质量分数以外,人们有时也用体积分数来表示溶液的浓度.例如,52%的饮用白酒就是指每100体积的饮用白酒中含有52体积的乙醇.下列溶液的浓度属于用体积分数来表示的是( )
A.0.9%的生理盐水 B.5%的葡萄糖注射液
C.10%的氢氧化钠溶液 D.75%的医用酒精
【答案】D
二、填空题。
16、下列物质属于溶液的是 ,属于悬浊液的是 ,属于乳浊液的是 。
A蒸馏水 B石灰浆 C牛奶 D矿泉水
【答案】; D; B; C
17、t1 ℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100 g水的两个烧杯中,充分搅拌后现象如图1所示,硝酸钾和氯化钾的溶解度曲线如图2所示。
(1)烧杯②种的上层清液是否达到饱和状态?____(填“是”“否”或“无法判断”);
(2)烧杯①中溶解的溶质是____(写名称或化学式);
(3)将t1 ℃时50 g硝酸钾的饱和溶液稀释成10%的溶液,需加水____g;
(4)关于图1中烧杯内的物质,下列说法正确的是____。
A.烧杯①内溶液中溶质的质量分数>烧杯②内上层清液中溶质的质量分数
B.蒸发一定量的水,两烧杯中都一定有固体析出
C.将两个烧杯中的溶液混合,充分搅拌后,烧杯中一定还有剩余固体
D.将温度升高到t2 ℃,两烧杯内溶液中溶质的质量分数相等(不考虑水的蒸发)
【答案】(1) 是 (2)氯化钾 (3)50 (4)A
18、t1 ℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100 g水的两个烧杯中,充分搅拌后现象如图1所示,硝酸钾和氯化钾的溶解度曲线如图2所示。
(1)烧杯②种的上层清液是否达到饱和状态? (填“是”“否”或“无法判断”);
(2)烧杯①中溶解的溶质是 (写名称或化学式);
(3)将t1 ℃时50 g硝酸钾的饱和溶液稀释成10%的溶液,需加水 g;
(4)关于图1中烧杯内的物质,下列说法正确的是 。
A.烧杯①内溶液中溶质的质量分数>烧杯②内上层清液中溶质的质量分数
B.蒸发一定量的水,两烧杯中都一定有固体析出
C.将两个烧杯中的溶液混合,充分搅拌后,烧杯中一定还有剩余固体
D.将温度升高到t2 ℃,两烧杯内溶液中溶质的质量分数相等(不考虑水的蒸发)
【答案】是; 氯化钾; 50; A
19、化学就在我们身边,生活中蕴藏着丰富的化学知识。
(1)净化水的操作有①过滤②蒸馏③静置沉淀等多种,其中净化程度最高的操作是 (填序号)。净水器中经常使用活性炭,主要利用活性炭的
性。
(2)农业上选种需配制一定溶质质量分数的氯化钠溶液,在其他操作无错误的前提下,用量筒取水时俯视读数,则配制的溶液中溶质质量分数会
(选填“偏大”、“偏小”或“不变”)。
(3)实验时要处处注意安全。用完酒精灯后,必须用灯帽盖灭,熄灭火焰的主要原理是 (填序号)。
A降温到着火点以下 B隔绝氧气 C清除可燃物
【答案】②; 吸附; 偏大; B
20、粗盐的初步提纯:
①使用蒸发皿蒸发溶液时,液体不超过其容积的_______ ;②蒸发过程中要用_______不断搅拌,防止局部过热,造成液滴飞溅;③蒸发皿中出现________时,停止加热,用余热蒸干。
【答案】 玻璃棒 较多量固体
21、下列物质属于溶液的是_________,属于悬浊液的是__________,属于乳浊液的是_________。
A蒸馏水 B石灰浆 C牛奶 D矿泉水
【答案】(1) D (2)B (3) C
22、在抗击“新型冠状病毒”的疫情当中给病人治疗过程中需要输液,除了治疗,更重要的是预防,我们需要如酒精等进行消毒,而这些药品大多都属于溶液,写出下列医用药品中溶质的化学式:
编号 溶液 溶质化学式
① 医用碘酒 ________
② 医疗消毒用高锰酸钾溶液(俗称紫药水) ________
③ 0.9%的氯化钠注射液(俗称生理盐水) ________
④ 75%的医用酒精 _________
⑤ 医疗上消毒用3%的过氧化氢溶液 __________
【答案】(1) I2 (2) KMnO4 NaCl
(3)C2H5OH (4) H2O2
23、控制变量法是科学探究中常用的方法之一。
(1)在探究固体物质的溶解度时,需要考虑的因素有:①溶质的种类; ②溶剂的种类;③溶质最多被溶解的质量; ④溶剂的质量; ⑤温度。
如测定“某物质在不同温度下的溶解度”,研究的是 (填序号)受温度的影响,这就需要控制其他因素保持不变。
(2)右表是利用控制变量法测得的氯化钠、硝酸钾在不同温度时的溶解度,请根据表格内容及实验现象回答下列问题。
温度(℃) 20 40 50
溶解度/g NaCl 36.0 36.6 37.0
KNO3 31.6 63.9 85.5
①从上表可知,两种物质的溶解度受温度变化影响较大的是 ;
②20℃时,将等质量的NaCl、KNO3分别放入盛有100 g水的两个烧杯中,充分溶解后如图1所示,升温到50℃时如图2所示。试判断:50℃时甲烧杯中的溶液一定是 (填“饱和溶液”、“不饱和溶液”或“不能确定”)。
【答案】③; 硝酸钾(或KNO3); 不饱和溶液
三、填空题。
24、粗盐的初步提纯实验中采用的方法利用了氯化钠的哪些性质?考虑到粗盐的来源,你判断这样提纯的盐是否为纯净物?怎样设计实验证明你的判断。
【答案】本实验中利用了氯化钠易溶于水,通过过滤能将氯化钠与不溶性泥沙分离,氯化钠溶解度受温度影响较小,可采用蒸发溶剂的方法析出氯化钠。
由于过滤只能除去粗盐中难溶性的固体杂质,并不能够除去其中可溶的氯化钙和氯化镁等杂质,因此,实验提纯的盐,属于混合物。
取样配成溶液,向溶液加入氢氧化钠溶液,若产生沉淀,则说明提纯的盐含有氯化镁,为混合物。
四、实验题。
25、某化学兴趣小组探究NH4Cl、CaCl2、NaCl三种物质溶于水过程中的热量变化。
【药品和器材】水、NH4Cl、CaCl2、NaCl;烧杯、药匙、玻璃棒、量筒、温度计等。
【实验探究】各取1药匙三种物质于烧杯中并分别溶于水,另取一个烧杯只加水,用温度计测量液体温度,并记录有关数据,如表所示。
实验 水的体积/mL 所加物质 测量液体温度/℃
实验1 50 NH4Cl 15
实验2 50 CaCl2 28
实验3 x NaCl 22
实验4 50 无 22
(1)表中x为 。
(2)比较实验2与实验4,可得出的结论是 。
(3)如果要生产一种“冰袋”用于冷敷,上述三种物质中最合适的是 (填化学式)。
【反思提升】
(4)经讨论认为本实验操作中存在缺陷,它是 (填字母)。
A.实验操作过程中没有采取较为严格的保温措施
B.加入物质的质量可能不相等
C.加入物质的种类不一样
【答案】(1)50 (2)CaCl2溶于水时放热 (3)NH4Cl (4)AB
五、计算类题。
26、福尔马林是甲醛(其分子结构如图所示)含量为35%至40% 的水溶液,外观无色透明,有腐蚀性,具防腐、消毒和漂白的功能,实验室用以浸制标本。某福尔马林溶液中碳元素含量14.4%,则该福尔马林溶液溶质质量分数是_____。
【答案】36%
沪教版(全国)第6章 溶解现象
一、选择题。
1、下列各种生活实例中,不属于溶液应用的是( )。
A.医院里使用消毒酒精对皮肤、体温计等消毒
B.用熟石灰粉等物质配制粉刷内墙的涂料
C.长跑运动员赛跑途中服用葡萄糖口服液来补充能量
D.实验室里将物质配成溶液进行化学反应
2、实验室配制50g溶质质量分数为15%的氯化钠溶液。下列说法中错误的是( )
A.实验的步骤为计算、称量、量取、溶解、转移
B.溶解过程中玻璃棒的作用是搅拌,加快氯化钠的溶解速率
C.把配制好的氯化钠溶液倒入刚用蒸馏水润洗过的试剂瓶中,并贴上标签
D.量取水时,用规格为50mL的量筒量取42.5mL蒸馏水
3、(双选)NH4Cl和Na2SO4的溶解度表及溶解度曲线如下。下列说法正确的是 ( )
温度/℃ 10 20 30 40 50 60
溶解度S/g NH4Cl 33.3 37.2 41.4 45.8 50.4 60.2
Na2SO4 9.6 20.2 40.8 48.4 47.5 47.0
A.甲为NH4Cl
B.t3℃应介于40℃~50℃
C.乙物质的饱和溶液从t2升温到t3,溶液的溶质质量分数不变
D.甲、乙饱和溶液从t3降温到t1,析出晶体(均不带结晶水)的质量一定相等
4、用15%的葡萄糖溶液配制150g 5%葡萄糖溶液,下列做法不正确的是( )
A.取用15%的葡萄糖溶液50g
B.使用量筒、烧杯和漏斗等仪器
C.加水100g
D.量水时选用规格100mL的量筒
5、在“粗盐中难溶性杂质的去除”实验中,玻璃棒的用途不正确的是( )
A.称取粗盐后,把粗盐研磨细
B.溶解时搅拌,加速粗盐溶解
C.称量精盐前,把精盐固体转移到纸上
D.蒸发时搅拌,防止局部温度过高,造成液体飞溅
6、某化学实验小组用如图所示的实验装置进行相关实验,向集气瓶中先装入Y试剂,然后从胶头滴管中滴加X(X的体积忽略不计),下列判断不正确的是( )。
A.若X为水,Y为硝酸铵,则乙瓶中右端导管内液面下降
B.若X为稀盐酸,Y为镁,则乙瓶中右端导管内液面上升
C.若乙瓶中右端导管内液面上升,X为水,则Y可能为氯化钠
D.若乙瓶中右端导管内液面上升,Y为生石灰,则X可能为水
7、实验室欲配制0.9%的生理水100g,下列操作步骤合理的是( )
A.用托盘天平称量9g NaCl B.用烧杯量取99.1mL水
C.在量筒中配制溶液 D.配好后转移到试剂瓶中,贴上标签
8、(双选)分析如图溶解度曲线,判断下列说法错误的是( )
A.t2℃时,硝酸钾的溶解度为110g
B.硝酸钾中含有少量氯化钠时,可以用冷却热饱和溶液的方法提纯硝酸钾
C.将t2℃时硝酸钾的饱和溶液降温到t1℃,一定会析出(110-a)g晶体
D.t1℃时,等质量的两种物质的饱和溶液中,含硝酸钾的质量一定比含氯化钠的质量大
9、化学是一门以实验为基础的科学。下列仪器用途不正确的是( )
A.A. B.B C.C D.D
10、某中学化学兴趣小组的同学对海水“晒盐”得到的粗盐进行提纯,流程如图,有关说法正确的是( )
A.操作①是溶解
B.经过上述流程得到的精盐是纯净物
C.蒸发后,取下蒸发皿直接放在实验台上
D.操作①②③均用到玻璃棒,且玻璃棒的作用相同
11、鱼类腥味产生的原因是鱼身上有甲胺,甲胺易溶于乙醇,因此,煮鱼时加些酒,能使甲胺溶于乙醇并随加热挥发逸出,这样烹饪的鱼就不再有腥味。下列过程与上述原理相似的是( )。
A.用洗涤剂洗碗 B.用酒精将试管壁上的碘洗掉
C.用烧碱除油污 D.用盐酸除去铁锈
12、常温下,在15 g氯化钠中加入60 g水,完全溶解后,溶液中氯化钠的质量分数为( )
A.15% B.20% C.25% D.33.3%
13、(双选)如图所示为甲、乙、丙三种固体物质的溶解度曲线,下列说法错误的是( )
A.甲中混有少量乙,若要提纯甲,可采取冷却热饱和溶液法
B.t2℃时,丙的饱和溶液中溶质和溶剂的质量比为1:4
C.将t3℃的甲、乙饱和溶液降温到t1℃,析出固体甲的质量一定大于乙
D.在t3℃时,等质量的甲、乙、丙的饱和溶液降温至t1℃时,所得溶液中溶质的质量分数由大到小的顺序为乙﹥甲﹥丙
14、将家庭中常用的四种调味品分别放入水中,不能形成溶液的是( )
A.醋 B.蔗糖 C.花生油 D.食盐
15、除质量分数以外,人们有时也用体积分数来表示溶液的浓度.例如,52%的饮用白酒就是指每100体积的饮用白酒中含有52体积的乙醇.下列溶液的浓度属于用体积分数来表示的是( )
A.0.9%的生理盐水 B.5%的葡萄糖注射液
C.10%的氢氧化钠溶液 D.75%的医用酒精
二、填空题。
16、下列物质属于溶液的是 ,属于悬浊液的是 ,属于乳浊液的是 。
A蒸馏水 B石灰浆 C牛奶 D矿泉水
17、t1 ℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100 g水的两个烧杯中,充分搅拌后现象如图1所示,硝酸钾和氯化钾的溶解度曲线如图2所示。
(1)烧杯②种的上层清液是否达到饱和状态?____(填“是”“否”或“无法判断”);
(2)烧杯①中溶解的溶质是____(写名称或化学式);
(3)将t1 ℃时50 g硝酸钾的饱和溶液稀释成10%的溶液,需加水____g;
(4)关于图1中烧杯内的物质,下列说法正确的是____。
A.烧杯①内溶液中溶质的质量分数>烧杯②内上层清液中溶质的质量分数
B.蒸发一定量的水,两烧杯中都一定有固体析出
C.将两个烧杯中的溶液混合,充分搅拌后,烧杯中一定还有剩余固体
D.将温度升高到t2 ℃,两烧杯内溶液中溶质的质量分数相等(不考虑水的蒸发)
18、t1 ℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100 g水的两个烧杯中,充分搅拌后现象如图1所示,硝酸钾和氯化钾的溶解度曲线如图2所示。
(1)烧杯②种的上层清液是否达到饱和状态? (填“是”“否”或“无法判断”);
(2)烧杯①中溶解的溶质是 (写名称或化学式);
(3)将t1 ℃时50 g硝酸钾的饱和溶液稀释成10%的溶液,需加水 g;
(4)关于图1中烧杯内的物质,下列说法正确的是 。
A.烧杯①内溶液中溶质的质量分数>烧杯②内上层清液中溶质的质量分数
B.蒸发一定量的水,两烧杯中都一定有固体析出
C.将两个烧杯中的溶液混合,充分搅拌后,烧杯中一定还有剩余固体
D.将温度升高到t2 ℃,两烧杯内溶液中溶质的质量分数相等(不考虑水的蒸发)
19、化学就在我们身边,生活中蕴藏着丰富的化学知识。
(1)净化水的操作有①过滤②蒸馏③静置沉淀等多种,其中净化程度最高的操作是 (填序号)。净水器中经常使用活性炭,主要利用活性炭的 性。
(2)农业上选种需配制一定溶质质量分数的氯化钠溶液,在其他操作无错误的前提下,用量筒取水时俯视读数,则配制的溶液中溶质质量分数会
(选填“偏大”、“偏小”或“不变”)。
(3)实验时要处处注意安全。用完酒精灯后,必须用灯帽盖灭,熄灭火焰的主要原理是 (填序号)。
A降温到着火点以下 B隔绝氧气 C清除可燃物
20、粗盐的初步提纯:
①使用蒸发皿蒸发溶液时,液体不超过其容积的_______ ;②蒸发过程中要用_______不断搅拌,防止局部过热,造成液滴飞溅;③蒸发皿中出现________时,停止加热,用余热蒸干。
21、下列物质属于溶液的是_________,属于悬浊液的是__________,属于乳浊液的是_________。
A蒸馏水 B石灰浆 C牛奶 D矿泉水
22、在抗击“新型冠状病毒”的疫情当中给病人治疗过程中需要输液,除了治疗,更重要的是预防,我们需要如酒精等进行消毒,而这些药品大多都属于溶液,写出下列医用药品中溶质的化学式:
编号 溶液 溶质化学式
① 医用碘酒 ________
② 医疗消毒用高锰酸钾溶液(俗称紫药水) ________
③ 0.9%的氯化钠注射液(俗称生理盐水) ________
④ 75%的医用酒精 _________
⑤ 医疗上消毒用3%的过氧化氢溶液 __________
23、控制变量法是科学探究中常用的方法之一。
(1)在探究固体物质的溶解度时,需要考虑的因素有:①溶质的种类; ②溶剂的种类;③溶质最多被溶解的质量; ④溶剂的质量; ⑤温度。
如测定“某物质在不同温度下的溶解度”,研究的是 (填序号)受温度的影响,这就需要控制其他因素保持不变。
(2)右表是利用控制变量法测得的氯化钠、硝酸钾在不同温度时的溶解度,请根据表格内容及实验现象回答下列问题。
温度(℃) 20 40 50
溶解度/g NaCl 36.0 36.6 37.0
KNO3 31.6 63.9 85.5
①从上表可知,两种物质的溶解度受温度变化影响较大的是 ;
②20℃时,将等质量的NaCl、KNO3分别放入盛有100 g水的两个烧杯中,充分溶解后如图1所示,升温到50℃时如图2所示。试判断:50℃时甲烧杯中的溶液一定是 (填“饱和溶液”、“不饱和溶液”或“不能确定”)。
三、填空题。
24、粗盐的初步提纯实验中采用的方法利用了氯化钠的哪些性质?考虑到粗盐的来源,你判断这样提纯的盐是否为纯净物?怎样设计实验证明你的判断。
四、实验题。
25、某化学兴趣小组探究NH4Cl、CaCl2、NaCl三种物质溶于水过程中的热量变化。
【药品和器材】水、NH4Cl、CaCl2、NaCl;烧杯、药匙、玻璃棒、量筒、温度计等。
【实验探究】各取1药匙三种物质于烧杯中并分别溶于水,另取一个烧杯只加水,用温度计测量液体温度,并记录有关数据,如表所示。
实验 水的体积/mL 所加物质 测量液体温度/℃
实验1 50 NH4Cl 15
实验2 50 CaCl2 28
实验3 x NaCl 22
实验4 50 无 22
(1)表中x为 。
(2)比较实验2与实验4,可得出的结论是 。
(3)如果要生产一种“冰袋”用于冷敷,上述三种物质中最合适的是 (填化学式)。
【反思提升】
(4)经讨论认为本实验操作中存在缺陷,它是 (填字母)。
A.实验操作过程中没有采取较为严格的保温措施
B.加入物质的质量可能不相等
C.加入物质的种类不一样
五、计算类题。
26、福尔马林是甲醛(其分子结构如图所示)含量为35%至40% 的水溶液,外观无色透明,有腐蚀性,具防腐、消毒和漂白的功能,实验室用以浸制标本。某福尔马林溶液中碳元素含量14.4%,则该福尔马林溶液溶质质量分数是_____。
2022—2023学年化学沪教版(全国)九年级下册第6章 溶解现象 章末夯练题含答案
沪教版(全国)第6章 溶解现象
一、选择题。
1、下列各种生活实例中,不属于溶液应用的是( )。
A.医院里使用消毒酒精对皮肤、体温计等消毒
B.用熟石灰粉等物质配制粉刷内墙的涂料
C.长跑运动员赛跑途中服用葡萄糖口服液来补充能量
D.实验室里将物质配成溶液进行化学反应
【答案】B
2、实验室配制50g溶质质量分数为15%的氯化钠溶液。下列说法中错误的是( )
A.实验的步骤为计算、称量、量取、溶解、转移
B.溶解过程中玻璃棒的作用是搅拌,加快氯化钠的溶解速率
C.把配制好的氯化钠溶液倒入刚用蒸馏水润洗过的试剂瓶中,并贴上标签
D.量取水时,用规格为50mL的量筒量取42.5mL蒸馏水
【答案】C
3、(双选)NH4Cl和Na2SO4的溶解度表及溶解度曲线如下。下列说法正确的是 ( )
温度/℃ 10 20 30 40 50 60
溶解度S/g NH4Cl 33.3 37.2 41.4 45.8 50.4 60.2
Na2SO4 9.6 20.2 40.8 48.4 47.5 47.0
A.甲为NH4Cl
B.t3℃应介于40℃~50℃
C.乙物质的饱和溶液从t2升温到t3,溶液的溶质质量分数不变
D.甲、乙饱和溶液从t3降温到t1,析出晶体(均不带结晶水)的质量一定相等
【答案】BC
4、用15%的葡萄糖溶液配制150g 5%葡萄糖溶液,下列做法不正确的是( )
A.取用15%的葡萄糖溶液50g
B.使用量筒、烧杯和漏斗等仪器
C.加水100g
D.量水时选用规格100mL的量筒
【答案】B
5、在“粗盐中难溶性杂质的去除”实验中,玻璃棒的用途不正确的是( )
A.称取粗盐后,把粗盐研磨细
B.溶解时搅拌,加速粗盐溶解
C.称量精盐前,把精盐固体转移到纸上
D.蒸发时搅拌,防止局部温度过高,造成液体飞溅
【答案】A
6、某化学实验小组用如图所示的实验装置进行相关实验,向集气瓶中先装入Y试剂,然后从胶头滴管中滴加X(X的体积忽略不计),下列判断不正确的是( )。
A.若X为水,Y为硝酸铵,则乙瓶中右端导管内液面下降
B.若X为稀盐酸,Y为镁,则乙瓶中右端导管内液面上升
C.若乙瓶中右端导管内液面上升,X为水,则Y可能为氯化钠
D.若乙瓶中右端导管内液面上升,Y为生石灰,则X可能为水
【答案】C
7、实验室欲配制0.9%的生理水100g,下列操作步骤合理的是( )
A.用托盘天平称量9g NaCl B.用烧杯量取99.1mL水
C.在量筒中配制溶液 D.配好后转移到试剂瓶中,贴上标签
【答案】D
8、(双选)分析如图溶解度曲线,判断下列说法错误的是( )
A.t2℃时,硝酸钾的溶解度为110g
B.硝酸钾中含有少量氯化钠时,可以用冷却热饱和溶液的方法提纯硝酸钾
C.将t2℃时硝酸钾的饱和溶液降温到t1℃,一定会析出(110-a)g晶体
D.t1℃时,等质量的两种物质的饱和溶液中,含硝酸钾的质量一定比含氯化钠的质量大
【答案】CD
9、化学是一门以实验为基础的科学。下列仪器用途不正确的是( )
A.A. B.B C.C D.D
【答案】A
10、某中学化学兴趣小组的同学对海水“晒盐”得到的粗盐进行提纯,流程如图,有关说法正确的是( )
A.操作①是溶解
B.经过上述流程得到的精盐是纯净物
C.蒸发后,取下蒸发皿直接放在实验台上
D.操作①②③均用到玻璃棒,且玻璃棒的作用相同
【答案】A
11、鱼类腥味产生的原因是鱼身上有甲胺,甲胺易溶于乙醇,因此,煮鱼时加些酒,能使甲胺溶于乙醇并随加热挥发逸出,这样烹饪的鱼就不再有腥味。下列过程与上述原理相似的是( )。
A.用洗涤剂洗碗 B.用酒精将试管壁上的碘洗掉
C.用烧碱除油污 D.用盐酸除去铁锈
【答案】B
12、常温下,在15 g氯化钠中加入60 g水,完全溶解后,溶液中氯化钠的质量分数为( )
A.15% B.20% C.25% D.33.3%
【答案】B
13、(双选)如图所示为甲、乙、丙三种固体物质的溶解度曲线,下列说法错误的是( )
A.甲中混有少量乙,若要提纯甲,可采取冷却热饱和溶液法
B.t2℃时,丙的饱和溶液中溶质和溶剂的质量比为1:4
C.将t3℃的甲、乙饱和溶液降温到t1℃,析出固体甲的质量一定大于乙
D.在t3℃时,等质量的甲、乙、丙的饱和溶液降温至t1℃时,所得溶液中溶质的质量分数由大到小的顺序为乙﹥甲﹥丙
【答案】CD
14、将家庭中常用的四种调味品分别放入水中,不能形成溶液的是( )
A.醋 B.蔗糖 C.花生油 D.食盐
【答案】C
15、除质量分数以外,人们有时也用体积分数来表示溶液的浓度.例如,52%的饮用白酒就是指每100体积的饮用白酒中含有52体积的乙醇.下列溶液的浓度属于用体积分数来表示的是( )
A.0.9%的生理盐水 B.5%的葡萄糖注射液
C.10%的氢氧化钠溶液 D.75%的医用酒精
【答案】D
二、填空题。
16、下列物质属于溶液的是 ,属于悬浊液的是 ,属于乳浊液的是 。
A蒸馏水 B石灰浆 C牛奶 D矿泉水
【答案】; D; B; C
17、t1 ℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100 g水的两个烧杯中,充分搅拌后现象如图1所示,硝酸钾和氯化钾的溶解度曲线如图2所示。
(1)烧杯②种的上层清液是否达到饱和状态?____(填“是”“否”或“无法判断”);
(2)烧杯①中溶解的溶质是____(写名称或化学式);
(3)将t1 ℃时50 g硝酸钾的饱和溶液稀释成10%的溶液,需加水____g;
(4)关于图1中烧杯内的物质,下列说法正确的是____。
A.烧杯①内溶液中溶质的质量分数>烧杯②内上层清液中溶质的质量分数
B.蒸发一定量的水,两烧杯中都一定有固体析出
C.将两个烧杯中的溶液混合,充分搅拌后,烧杯中一定还有剩余固体
D.将温度升高到t2 ℃,两烧杯内溶液中溶质的质量分数相等(不考虑水的蒸发)
【答案】(1) 是 (2)氯化钾 (3)50 (4)A
18、t1 ℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100 g水的两个烧杯中,充分搅拌后现象如图1所示,硝酸钾和氯化钾的溶解度曲线如图2所示。
(1)烧杯②种的上层清液是否达到饱和状态? (填“是”“否”或“无法判断”);
(2)烧杯①中溶解的溶质是 (写名称或化学式);
(3)将t1 ℃时50 g硝酸钾的饱和溶液稀释成10%的溶液,需加水 g;
(4)关于图1中烧杯内的物质,下列说法正确的是 。
A.烧杯①内溶液中溶质的质量分数>烧杯②内上层清液中溶质的质量分数
B.蒸发一定量的水,两烧杯中都一定有固体析出
C.将两个烧杯中的溶液混合,充分搅拌后,烧杯中一定还有剩余固体
D.将温度升高到t2 ℃,两烧杯内溶液中溶质的质量分数相等(不考虑水的蒸发)
【答案】是; 氯化钾; 50; A
19、化学就在我们身边,生活中蕴藏着丰富的化学知识。
(1)净化水的操作有①过滤②蒸馏③静置沉淀等多种,其中净化程度最高的操作是 (填序号)。净水器中经常使用活性炭,主要利用活性炭的
性。
(2)农业上选种需配制一定溶质质量分数的氯化钠溶液,在其他操作无错误的前提下,用量筒取水时俯视读数,则配制的溶液中溶质质量分数会
(选填“偏大”、“偏小”或“不变”)。
(3)实验时要处处注意安全。用完酒精灯后,必须用灯帽盖灭,熄灭火焰的主要原理是 (填序号)。
A降温到着火点以下 B隔绝氧气 C清除可燃物
【答案】②; 吸附; 偏大; B
20、粗盐的初步提纯:
①使用蒸发皿蒸发溶液时,液体不超过其容积的_______ ;②蒸发过程中要用_______不断搅拌,防止局部过热,造成液滴飞溅;③蒸发皿中出现________时,停止加热,用余热蒸干。
【答案】 玻璃棒 较多量固体
21、下列物质属于溶液的是_________,属于悬浊液的是__________,属于乳浊液的是_________。
A蒸馏水 B石灰浆 C牛奶 D矿泉水
【答案】(1) D (2)B (3) C
22、在抗击“新型冠状病毒”的疫情当中给病人治疗过程中需要输液,除了治疗,更重要的是预防,我们需要如酒精等进行消毒,而这些药品大多都属于溶液,写出下列医用药品中溶质的化学式:
编号 溶液 溶质化学式
① 医用碘酒 ________
② 医疗消毒用高锰酸钾溶液(俗称紫药水) ________
③ 0.9%的氯化钠注射液(俗称生理盐水) ________
④ 75%的医用酒精 _________
⑤ 医疗上消毒用3%的过氧化氢溶液 __________
【答案】(1) I2 (2) KMnO4 NaCl
(3)C2H5OH (4) H2O2
23、控制变量法是科学探究中常用的方法之一。
(1)在探究固体物质的溶解度时,需要考虑的因素有:①溶质的种类; ②溶剂的种类;③溶质最多被溶解的质量; ④溶剂的质量; ⑤温度。
如测定“某物质在不同温度下的溶解度”,研究的是 (填序号)受温度的影响,这就需要控制其他因素保持不变。
(2)右表是利用控制变量法测得的氯化钠、硝酸钾在不同温度时的溶解度,请根据表格内容及实验现象回答下列问题。
温度(℃) 20 40 50
溶解度/g NaCl 36.0 36.6 37.0
KNO3 31.6 63.9 85.5
①从上表可知,两种物质的溶解度受温度变化影响较大的是 ;
②20℃时,将等质量的NaCl、KNO3分别放入盛有100 g水的两个烧杯中,充分溶解后如图1所示,升温到50℃时如图2所示。试判断:50℃时甲烧杯中的溶液一定是 (填“饱和溶液”、“不饱和溶液”或“不能确定”)。
【答案】③; 硝酸钾(或KNO3); 不饱和溶液
三、填空题。
24、粗盐的初步提纯实验中采用的方法利用了氯化钠的哪些性质?考虑到粗盐的来源,你判断这样提纯的盐是否为纯净物?怎样设计实验证明你的判断。
【答案】本实验中利用了氯化钠易溶于水,通过过滤能将氯化钠与不溶性泥沙分离,氯化钠溶解度受温度影响较小,可采用蒸发溶剂的方法析出氯化钠。
由于过滤只能除去粗盐中难溶性的固体杂质,并不能够除去其中可溶的氯化钙和氯化镁等杂质,因此,实验提纯的盐,属于混合物。
取样配成溶液,向溶液加入氢氧化钠溶液,若产生沉淀,则说明提纯的盐含有氯化镁,为混合物。
四、实验题。
25、某化学兴趣小组探究NH4Cl、CaCl2、NaCl三种物质溶于水过程中的热量变化。
【药品和器材】水、NH4Cl、CaCl2、NaCl;烧杯、药匙、玻璃棒、量筒、温度计等。
【实验探究】各取1药匙三种物质于烧杯中并分别溶于水,另取一个烧杯只加水,用温度计测量液体温度,并记录有关数据,如表所示。
实验 水的体积/mL 所加物质 测量液体温度/℃
实验1 50 NH4Cl 15
实验2 50 CaCl2 28
实验3 x NaCl 22
实验4 50 无 22
(1)表中x为 。
(2)比较实验2与实验4,可得出的结论是 。
(3)如果要生产一种“冰袋”用于冷敷,上述三种物质中最合适的是 (填化学式)。
【反思提升】
(4)经讨论认为本实验操作中存在缺陷,它是 (填字母)。
A.实验操作过程中没有采取较为严格的保温措施
B.加入物质的质量可能不相等
C.加入物质的种类不一样
【答案】(1)50 (2)CaCl2溶于水时放热 (3)NH4Cl (4)AB
五、计算类题。
26、福尔马林是甲醛(其分子结构如图所示)含量为35%至40% 的水溶液,外观无色透明,有腐蚀性,具防腐、消毒和漂白的功能,实验室用以浸制标本。某福尔马林溶液中碳元素含量14.4%,则该福尔马林溶液溶质质量分数是_____。
【答案】36%
