第6章溶解现象专项训练(含解析)---2022-2023学年九年级化学沪教版(全国)下册
文档属性
| 名称 | 第6章溶解现象专项训练(含解析)---2022-2023学年九年级化学沪教版(全国)下册 |
|
|
| 格式 | zip | ||
| 文件大小 | 388.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-02 00:00:00 | ||
图片预览


文档简介
《第6章 溶解现象》专项训练
专项一 溶解度曲线及其应用
题型 1 溶解度曲线
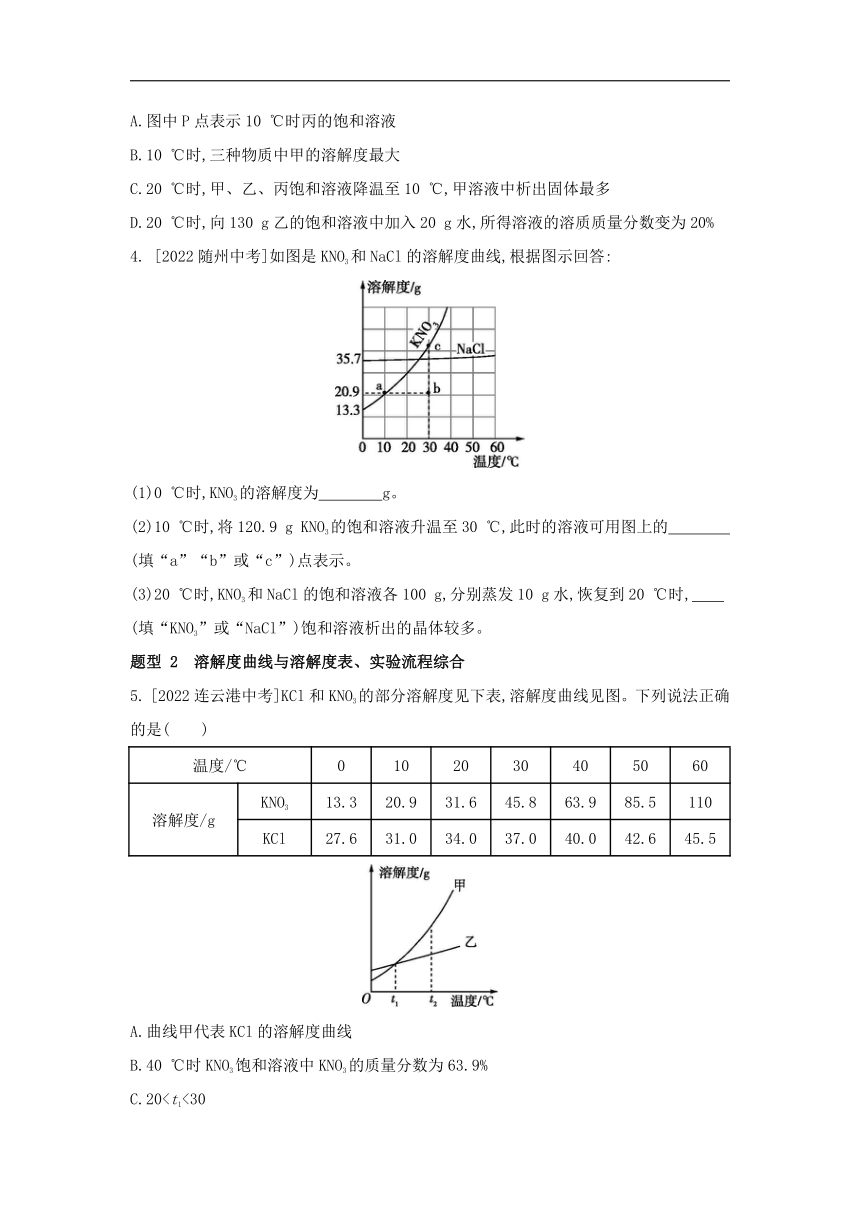
1. 不同温度下KCl 的溶解度如图所示。下列说法正确的是( )
A.10 ℃时,100 g KCl 饱和溶液中溶质质量为 31 g
B.20 ℃时,100 g KCl 饱和溶液的溶质质量分数为 34%
C.30 ℃时,将 40 g KCl 放入 100 g 水中得到 140 g 溶液
D.40 ℃时,100 g 水最多溶解 40 g KCl
2. [2022扬州中考]KNO3与KCl的溶解度曲线如图所示。下列说法正确的是( )
A.10 ℃时,KNO3的溶解度比KCl大
B.KCl的溶解度受温度影响的程度比KNO3大
C.60 ℃时,P点表示的KNO3溶液还能继续溶解KNO3固体
D.将60 ℃的KCl饱和溶液降温至10 ℃,溶液中溶质质量分数不变
3. 甲、乙、丙三种固体物质的溶解度曲线如图所示。下列说法正确的是( )
A.图中P点表示10 ℃时丙的饱和溶液
B.10 ℃时,三种物质中甲的溶解度最大
C.20 ℃时,甲、乙、丙饱和溶液降温至10 ℃,甲溶液中析出固体最多
D.20 ℃时,向130 g乙的饱和溶液中加入20 g水,所得溶液的溶质质量分数变为20%
4. [2022随州中考]如图是KNO3和NaCl的溶解度曲线,根据图示回答:
(1)0 ℃时,KNO3的溶解度为 g。
(2)10 ℃时,将120.9 g KNO3的饱和溶液升温至30 ℃,此时的溶液可用图上的 (填“a”“b”或“c”)点表示。
(3)20 ℃时,KNO3和NaCl的饱和溶液各100 g,分别蒸发10 g水,恢复到20 ℃时, (填“KNO3”或“NaCl”)饱和溶液析出的晶体较多。
题型 2 溶解度曲线与溶解度表、实验流程综合
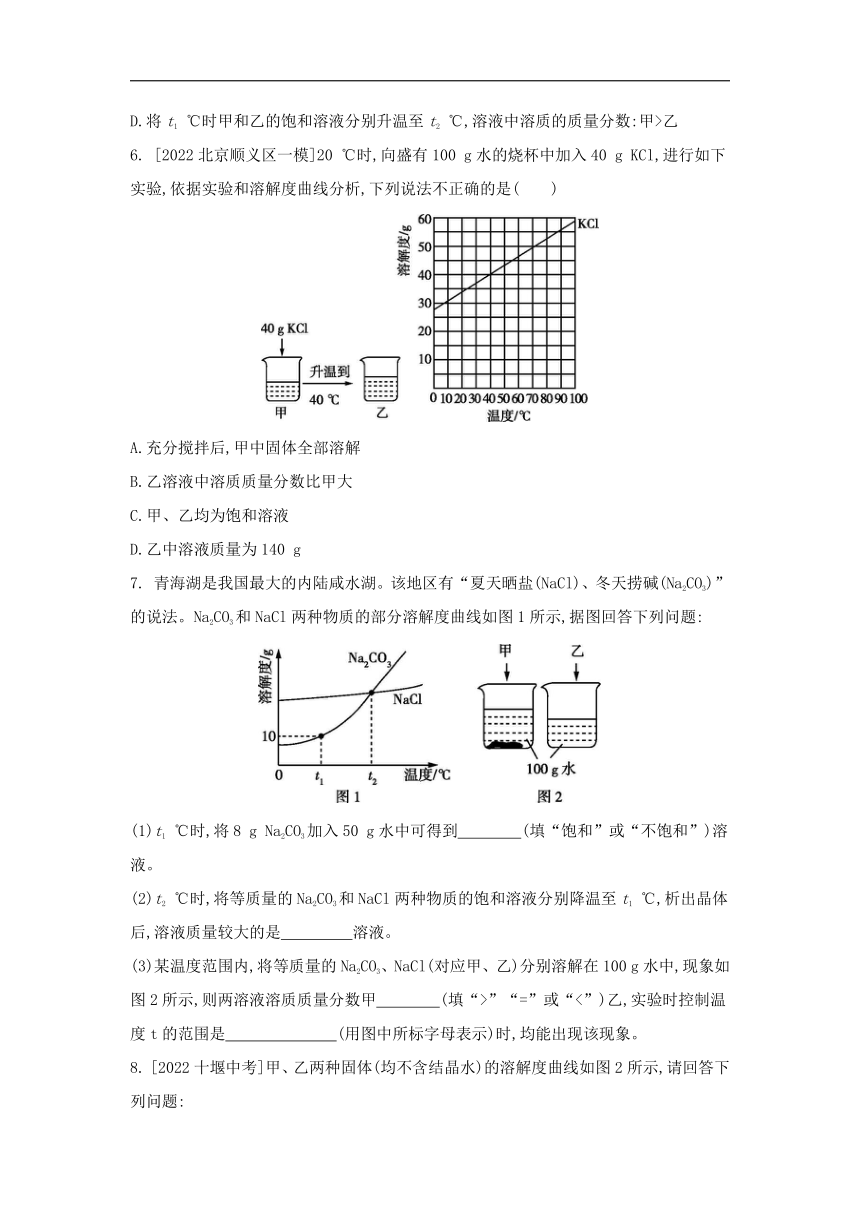
5. [2022连云港中考]KCl和KNO3的部分溶解度见下表,溶解度曲线见图。下列说法正确的是( )
温度/℃ 0 10 20 30 40 50 60
溶解度/g KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110
KCl 27.6 31.0 34.0 37.0 40.0 42.6 45.5
A.曲线甲代表KCl的溶解度曲线
B.40 ℃时KNO3饱和溶液中KNO3的质量分数为63.9%
C.20D.将t1 ℃时甲和乙的饱和溶液分别升温至t2 ℃,溶液中溶质的质量分数:甲>乙
6. [2022北京顺义区一模]20 ℃时,向盛有100 g水的烧杯中加入40 g KCl,进行如下实验,依据实验和溶解度曲线分析,下列说法不正确的是( )
A.充分搅拌后,甲中固体全部溶解
B.乙溶液中溶质质量分数比甲大
C.甲、乙均为饱和溶液
D.乙中溶液质量为140 g
7. 青海湖是我国最大的内陆咸水湖。该地区有“夏天晒盐(NaCl)、冬天捞碱(Na2CO3)”的说法。Na2CO3和NaCl两种物质的部分溶解度曲线如图1所示,据图回答下列问题:
(1)t1 ℃时,将8 g Na2CO3加入50 g水中可得到 (填“饱和”或“不饱和”)溶液。
(2)t2 ℃时,将等质量的Na2CO3和NaCl两种物质的饱和溶液分别降温至t1 ℃,析出晶体后,溶液质量较大的是 溶液。
(3)某温度范围内,将等质量的Na2CO3、NaCl(对应甲、乙)分别溶解在100 g水中,现象如图2所示,则两溶液溶质质量分数甲 (填“>”“=”或“<”)乙,实验时控制温度t的范围是 (用图中所标字母表示)时,均能出现该现象。
8. [2022十堰中考]甲、乙两种固体(均不含结晶水)的溶解度曲线如图2所示,请回答下列问题:
(1)t3 ℃时,乙的溶解度是 g。
(2)t3 ℃时,甲形成的饱和溶液中溶质与溶液的质量比为 。
(3)t1 ℃时,把等质量的甲、乙两种物质分别放入两只烧杯中,加入100 g水,充分搅拌,溶解情况如图1所示,则B烧杯内溶质是 (填“甲”或“乙”)。现对图1中两烧杯内物质同时做如下处理,有关说法正确的是 。
A.升温至t2 ℃,均形成不饱和溶液
B.升温至t2 ℃,所得溶液中溶质的质量分数相同
C.先升温至t3 ℃,再通过恒温蒸发溶剂的方法使两溶液均刚好达到饱和,蒸发水的质量:烧杯A>烧杯B
专项二 配制一定溶质质量分数的氯化钠溶液
题型1 用固体配制溶液的实验步骤和操作
1. [2022北京平谷区一模]农业上常用质量分数为16%的NaCl溶液选种。实验室配制100 g该浓度溶液的过程如图所示。下列说法不正确的是 ( )
A.实验操作顺序为④②①⑤③
B.②中需称量NaCl的质量为16 g
C.选用100 mL量筒量取所需水的体积
D.步骤③的操作可以增大NaCl的溶解度
2. [2022荆州中考改编]实验室配制50 g质量分数为6%的NaCl溶液,配制过程包括如下操作。请回答下列问题:
(1)图中使用到的玻璃仪器有 、量筒、 玻璃棒、广口瓶四种。
(2)溶解时用玻璃棒搅拌的目的是 。
(3)该实验中量取的水的体积应为 mL。(水的密度为1 g/cm3)
(4)图示中正确的操作顺序为 (填序号)。
A.④②⑤①③ B.①②③④⑤ C.①②④③⑤ D.④⑤②③①
(5)下列因素会造成所配溶液溶质质量分数偏小的是 (填序号)。
A.量取蒸馏水时仰视读数
B.量取蒸馏水时俯视读数
C.将称量好的NaCl固体转移至烧杯时,NaCl撒落
D.配好的溶液转移到试剂瓶时,部分溶液溅出
题型2 用浓溶液配制稀溶液的实验步骤和操作
3. [2021成都中考改编]将10 g质量分数为98%的浓硫酸(密度为1.84 g/cm3)配制成10%的稀硫酸。下列有关步骤的说法正确的是( )
A.计算需水98 g
B.量取浓硫酸时,仰视读数,所配溶液的溶质质量分数偏小
C.量取浓硫酸时,用规格为100 mL的量筒
D.实验步骤:计算、量取、稀释、装瓶存放
4. 某实验小组用6%的氯化钠溶液(密度约为1.04 g/cm3)配制50 g质量分数为3%的氯化钠溶液,步骤如下:①计算;②量取;③混匀;④装瓶贴标签。回答下列问题:
(1)计算需要6%的氯化钠溶液的体积是 mL(结果取整数)。
(2)实验中用到的仪器有25 mL的量筒、细口瓶、烧杯、 。
(3)下列实验操作会导致所配溶液中溶质的质量分数一定偏大的是 (填序号)。
A.量取6%的氯化钠溶液时仰视读数
B.向烧杯内加入水时有水洒出
C.混匀过程中没有使用玻璃棒搅拌
D.配制好的溶液装入未干燥的细口瓶
参考答案
专项一 溶解度曲线及其应用
1. D A( ):由溶解度曲线可知,10 ℃时, KCl的溶解度为31 g,表示10 ℃时,100 g水中最多溶解31 g KCl,131 g KCl饱和溶液中溶质质量为31 g。B( ):由溶解度曲线可知,20 ℃时,KCl的溶解度为34 g,KCl 饱和溶液的溶质质量分数为×100%=×100%≈25.4%<34%。C( ):由溶解度曲线可知,30 ℃时, KCl的溶解度为37 g,表示30 ℃时, 100 g水中最多溶解37 g KCl,所以30 ℃时,将 40 g KCl 放入 100 g 水中,最多溶解37 g,得到137 g溶液。D(√):由溶解度曲线可知,40 ℃时, KCl的溶解度为40 g,表示40 ℃时,100 g水中最多溶解40 g KCl。
2. C A( ):由题图可知,10 ℃时,KCl的溶解度大于KNO3。B( ):KNO3的溶解度受温度影响更大。C(√):60 ℃时,P点表示的是KNO3的不饱和溶液,还能再继续溶解KNO3固体。D( ):KCl的溶解度随温度降低而减小,将60 ℃时KCl饱和溶液降温至10 ℃,有晶体析出,溶液中溶质质量分数变小。
3. D A( ):10 ℃时,P点在丙的溶解度曲线的下方,表示丙的不饱和溶液。B( ):10 ℃时,三种物质中丙的溶解度最大。C( ):丙的溶解度随温度的降低而增大,降温不会析出晶体,甲、乙的溶解度随温度的降低而减小,且甲的溶解度受温度的影响比乙大,但题中没有指明饱和溶液的质量,无法比较析出晶体的多少。D(√):20 ℃时,130 g乙的饱和溶液中含有100 g水、30 g乙,加入20 g水后所得溶液的溶质质量分数为×100%=20%。
4. (1)13.3 (2)b (3)NaCl
【解析】 (2)10 ℃时,将120.9 g KNO3的饱和溶液升温至30 ℃,KNO3的溶解度增大,但溶液中溶质及溶剂的质量均不变,此时可用图中的b点表示。
(3)20 ℃时,NaCl的溶解度大于KNO3的溶解度,等质量溶剂中可溶解的NaCl质量大于KNO3的质量,蒸发掉10 g水再恢复到20 ℃,析出晶体的质量等于蒸发的10 g水中溶解的溶质质量,故析出的NaCl晶体比KNO3多。
5. C A( ):KNO3的溶解度受温度影响较大,KCl的溶解度受温度影响较小,则曲线乙表示KCl的溶解度曲线。B( ): 40 ℃时KNO3的溶解度是63.9 g,该温度下其饱和溶液的溶质质量分数为×100%≈39.0%<63.9%。C(√):20 ℃时,KCl和KNO3的溶解度相近,且溶解度较大的是KCl,30 ℃时两种物质中溶解度较大的是KNO3,则两物质溶解度相同的温度在20~30 ℃之间。D( ):t1 ℃时甲和乙的溶解度相等,该温度下两者饱和溶液的溶质质量分数相等。把t1 ℃时甲和乙的饱和溶液分别升温至t2 ℃时,两物质的溶解度均增大,两溶液都变为不饱和溶液,溶质、溶剂的质量都不变,所以溶质的质量分数也不变,仍然相等。
6. A A( ):20 ℃时,氯化钾溶解度小于40 g,100 g水中不能溶解40 g氯化钾,充分搅拌后,甲中固体有剩余。B(√):40 ℃时,氯化钾溶解度为40 g,100 g水中恰好完全溶解40 g氯化钾,乙溶液中溶质质量分数比甲大。C(√):甲、乙均为饱和溶液。D(√):乙中溶液质量为100 g+40 g=140 g。
7. (1)饱和
(2)NaCl(或氯化钠)
(3)< 0 ℃≤t【解析】 (1)t1 ℃时,Na2CO3的溶解度是10 g,50 g水中最多能溶解5 g Na2CO3,将8 g Na2CO3加入50 g水中可得到饱和溶液。
(2)Na2CO3的溶解度受温度的影响较大,NaCl的溶解度受温度的影响较小,故等质量的两种物质的饱和溶液分别降温,
Na2CO3溶液析出的晶体较多,NaCl溶液析出的晶体较少,故剩余溶液的质量NaCl>Na2CO3。
(3)由题意知,甲为Na2CO3,乙为NaCl,将等质量的Na2CO3、NaCl分别溶解在100 g水中,甲中有固体存在,乙中固体完全溶解,故溶质质量分数甲<乙。控制的温度范围应使甲(Na2CO3)的溶解度小于乙(NaCl)的溶解度,即0 ℃≤t8. (1)20 (2)1∶3 (3)甲 AB
【解析】 (2)t3 ℃时,甲的溶解度是50 g,即100 g水中溶解50 g的甲达到饱和,其中溶质与溶液的质量比为50 g:(50 g+ 100 g)=1∶3。
(3)t1 ℃时,甲的溶解度小于乙的溶解度,把等质量的甲、乙两种物质分别放入两只烧杯中,加入100 g水,充分搅拌,B烧杯中有未溶解的物质,则B烧杯内溶质是甲。t1 ℃时,A烧杯中溶质全部溶解,B烧杯中溶质有剩余,说明加入溶质的质量大于t1 ℃时甲的溶解度,小于等于t1 ℃时乙的溶解度。A、B(√):升温至t2 ℃,甲、乙的溶解度均增大,且甲剩余溶质可以全部溶解,二者均形成不饱和溶液,因所加溶质、溶剂的质量相等,则所得溶液的溶质质量分数相等。C( ):t3 ℃时甲的溶解度大于乙的溶解度,则溶解等质量的甲、乙溶质需要水的质量甲小于乙,故蒸发水的质量烧杯A小于烧杯B。
专项二 配制一定溶质质量分数的氯化钠溶液
1. D A(√):实验室配制100 g 16%的氯化钠溶液,首先计算配制溶液所需氯化钠和水的质量,再称量所需的氯化钠和量取水,最后进行溶解,实验操作顺序为④②①⑤③。B(√):溶质质量=溶液质量×溶质的质量分数,配制100 g 16% 的氯化钠溶液,需氯化钠的质量=100 g×16%=16 g。C(√):溶剂质量=溶液质量-溶质质量,所需溶剂的质量为100 g-16 g= 84 g(合84 mL),应用规格为100 mL的量筒量取水。D( ):步骤③的操作,不能改变该温度下100 g水中最多能溶解氯化钠的质量,不能增大NaCl的溶解度。
2. (1)烧杯 (2)加快溶解速率 (3)47 (4)A (5)AC
【解析】 (5)A(√):量取蒸馏水时仰视读数,读取数值小于实际数值,会导致量取水的体积偏大,溶液质量偏大,溶质质量分数偏小。B( ):量取蒸馏水时俯视读数,读取数值大于实际数值,会导致量取水的体积偏小,溶液质量偏小,溶质质量分数偏大。C(√):将称量好的NaCl固体转移至烧杯时,NaCl撒落,会导致溶质质量偏小,溶质质量分数偏小。D( ):溶液具有均一性,将配好的溶液转移到试剂瓶时,部分溶液溅出,不影响溶质质量分数的大小。
3. D A( ):需要水的质量为10 g×98%÷10%-10 g=88 g。B( ):用量筒量取浓硫酸时,仰视读数,读数比实际液体体积小,会造成实际量取的浓硫酸的体积偏大,使所配溶液溶质质量分数偏大。C( ):10 g 浓硫酸的体积为≈5.4 cm3,即5.4 mL,应用规格为10 mL的量筒量取。
4. (1)24 (2)胶头滴管、玻璃棒 (3)AB
【解析】 (1)溶液稀释过程中溶质的质量保持不变,设配制50 g 3%的氯化钠溶液需要6%的氯化钠溶液的质量为x,有6%×x=50 g×3%,解得x=25 g,需要6%的氯化钠溶液的体积为≈24 cm3=24 mL。
(2)实验中用到的仪器有25 mL的量筒、细口瓶、烧杯、胶头滴管、玻璃棒。
(3)A(√):量取6%的氯化钠溶液时仰视读数,会使实际量取的液体体积比读数大,导致溶质的质量分数偏大。B(√):向烧杯内加入水时有水洒出,会使水的体积偏小,导致溶质的质量分数偏大。C( ):混匀过程中没有使用玻璃棒搅拌,不会导致溶剂和溶质质量的变化,溶质的质量分数不变。D( ):配制好的溶液装入未干燥的细口瓶,相当于稀释了溶液,导致溶质的质量分数偏小。
专项一 溶解度曲线及其应用
题型 1 溶解度曲线
1. 不同温度下KCl 的溶解度如图所示。下列说法正确的是( )
A.10 ℃时,100 g KCl 饱和溶液中溶质质量为 31 g
B.20 ℃时,100 g KCl 饱和溶液的溶质质量分数为 34%
C.30 ℃时,将 40 g KCl 放入 100 g 水中得到 140 g 溶液
D.40 ℃时,100 g 水最多溶解 40 g KCl
2. [2022扬州中考]KNO3与KCl的溶解度曲线如图所示。下列说法正确的是( )
A.10 ℃时,KNO3的溶解度比KCl大
B.KCl的溶解度受温度影响的程度比KNO3大
C.60 ℃时,P点表示的KNO3溶液还能继续溶解KNO3固体
D.将60 ℃的KCl饱和溶液降温至10 ℃,溶液中溶质质量分数不变
3. 甲、乙、丙三种固体物质的溶解度曲线如图所示。下列说法正确的是( )
A.图中P点表示10 ℃时丙的饱和溶液
B.10 ℃时,三种物质中甲的溶解度最大
C.20 ℃时,甲、乙、丙饱和溶液降温至10 ℃,甲溶液中析出固体最多
D.20 ℃时,向130 g乙的饱和溶液中加入20 g水,所得溶液的溶质质量分数变为20%
4. [2022随州中考]如图是KNO3和NaCl的溶解度曲线,根据图示回答:
(1)0 ℃时,KNO3的溶解度为 g。
(2)10 ℃时,将120.9 g KNO3的饱和溶液升温至30 ℃,此时的溶液可用图上的 (填“a”“b”或“c”)点表示。
(3)20 ℃时,KNO3和NaCl的饱和溶液各100 g,分别蒸发10 g水,恢复到20 ℃时, (填“KNO3”或“NaCl”)饱和溶液析出的晶体较多。
题型 2 溶解度曲线与溶解度表、实验流程综合
5. [2022连云港中考]KCl和KNO3的部分溶解度见下表,溶解度曲线见图。下列说法正确的是( )
温度/℃ 0 10 20 30 40 50 60
溶解度/g KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110
KCl 27.6 31.0 34.0 37.0 40.0 42.6 45.5
A.曲线甲代表KCl的溶解度曲线
B.40 ℃时KNO3饱和溶液中KNO3的质量分数为63.9%
C.20
6. [2022北京顺义区一模]20 ℃时,向盛有100 g水的烧杯中加入40 g KCl,进行如下实验,依据实验和溶解度曲线分析,下列说法不正确的是( )
A.充分搅拌后,甲中固体全部溶解
B.乙溶液中溶质质量分数比甲大
C.甲、乙均为饱和溶液
D.乙中溶液质量为140 g
7. 青海湖是我国最大的内陆咸水湖。该地区有“夏天晒盐(NaCl)、冬天捞碱(Na2CO3)”的说法。Na2CO3和NaCl两种物质的部分溶解度曲线如图1所示,据图回答下列问题:
(1)t1 ℃时,将8 g Na2CO3加入50 g水中可得到 (填“饱和”或“不饱和”)溶液。
(2)t2 ℃时,将等质量的Na2CO3和NaCl两种物质的饱和溶液分别降温至t1 ℃,析出晶体后,溶液质量较大的是 溶液。
(3)某温度范围内,将等质量的Na2CO3、NaCl(对应甲、乙)分别溶解在100 g水中,现象如图2所示,则两溶液溶质质量分数甲 (填“>”“=”或“<”)乙,实验时控制温度t的范围是 (用图中所标字母表示)时,均能出现该现象。
8. [2022十堰中考]甲、乙两种固体(均不含结晶水)的溶解度曲线如图2所示,请回答下列问题:
(1)t3 ℃时,乙的溶解度是 g。
(2)t3 ℃时,甲形成的饱和溶液中溶质与溶液的质量比为 。
(3)t1 ℃时,把等质量的甲、乙两种物质分别放入两只烧杯中,加入100 g水,充分搅拌,溶解情况如图1所示,则B烧杯内溶质是 (填“甲”或“乙”)。现对图1中两烧杯内物质同时做如下处理,有关说法正确的是 。
A.升温至t2 ℃,均形成不饱和溶液
B.升温至t2 ℃,所得溶液中溶质的质量分数相同
C.先升温至t3 ℃,再通过恒温蒸发溶剂的方法使两溶液均刚好达到饱和,蒸发水的质量:烧杯A>烧杯B
专项二 配制一定溶质质量分数的氯化钠溶液
题型1 用固体配制溶液的实验步骤和操作
1. [2022北京平谷区一模]农业上常用质量分数为16%的NaCl溶液选种。实验室配制100 g该浓度溶液的过程如图所示。下列说法不正确的是 ( )
A.实验操作顺序为④②①⑤③
B.②中需称量NaCl的质量为16 g
C.选用100 mL量筒量取所需水的体积
D.步骤③的操作可以增大NaCl的溶解度
2. [2022荆州中考改编]实验室配制50 g质量分数为6%的NaCl溶液,配制过程包括如下操作。请回答下列问题:
(1)图中使用到的玻璃仪器有 、量筒、 玻璃棒、广口瓶四种。
(2)溶解时用玻璃棒搅拌的目的是 。
(3)该实验中量取的水的体积应为 mL。(水的密度为1 g/cm3)
(4)图示中正确的操作顺序为 (填序号)。
A.④②⑤①③ B.①②③④⑤ C.①②④③⑤ D.④⑤②③①
(5)下列因素会造成所配溶液溶质质量分数偏小的是 (填序号)。
A.量取蒸馏水时仰视读数
B.量取蒸馏水时俯视读数
C.将称量好的NaCl固体转移至烧杯时,NaCl撒落
D.配好的溶液转移到试剂瓶时,部分溶液溅出
题型2 用浓溶液配制稀溶液的实验步骤和操作
3. [2021成都中考改编]将10 g质量分数为98%的浓硫酸(密度为1.84 g/cm3)配制成10%的稀硫酸。下列有关步骤的说法正确的是( )
A.计算需水98 g
B.量取浓硫酸时,仰视读数,所配溶液的溶质质量分数偏小
C.量取浓硫酸时,用规格为100 mL的量筒
D.实验步骤:计算、量取、稀释、装瓶存放
4. 某实验小组用6%的氯化钠溶液(密度约为1.04 g/cm3)配制50 g质量分数为3%的氯化钠溶液,步骤如下:①计算;②量取;③混匀;④装瓶贴标签。回答下列问题:
(1)计算需要6%的氯化钠溶液的体积是 mL(结果取整数)。
(2)实验中用到的仪器有25 mL的量筒、细口瓶、烧杯、 。
(3)下列实验操作会导致所配溶液中溶质的质量分数一定偏大的是 (填序号)。
A.量取6%的氯化钠溶液时仰视读数
B.向烧杯内加入水时有水洒出
C.混匀过程中没有使用玻璃棒搅拌
D.配制好的溶液装入未干燥的细口瓶
参考答案
专项一 溶解度曲线及其应用
1. D A( ):由溶解度曲线可知,10 ℃时, KCl的溶解度为31 g,表示10 ℃时,100 g水中最多溶解31 g KCl,131 g KCl饱和溶液中溶质质量为31 g。B( ):由溶解度曲线可知,20 ℃时,KCl的溶解度为34 g,KCl 饱和溶液的溶质质量分数为×100%=×100%≈25.4%<34%。C( ):由溶解度曲线可知,30 ℃时, KCl的溶解度为37 g,表示30 ℃时, 100 g水中最多溶解37 g KCl,所以30 ℃时,将 40 g KCl 放入 100 g 水中,最多溶解37 g,得到137 g溶液。D(√):由溶解度曲线可知,40 ℃时, KCl的溶解度为40 g,表示40 ℃时,100 g水中最多溶解40 g KCl。
2. C A( ):由题图可知,10 ℃时,KCl的溶解度大于KNO3。B( ):KNO3的溶解度受温度影响更大。C(√):60 ℃时,P点表示的是KNO3的不饱和溶液,还能再继续溶解KNO3固体。D( ):KCl的溶解度随温度降低而减小,将60 ℃时KCl饱和溶液降温至10 ℃,有晶体析出,溶液中溶质质量分数变小。
3. D A( ):10 ℃时,P点在丙的溶解度曲线的下方,表示丙的不饱和溶液。B( ):10 ℃时,三种物质中丙的溶解度最大。C( ):丙的溶解度随温度的降低而增大,降温不会析出晶体,甲、乙的溶解度随温度的降低而减小,且甲的溶解度受温度的影响比乙大,但题中没有指明饱和溶液的质量,无法比较析出晶体的多少。D(√):20 ℃时,130 g乙的饱和溶液中含有100 g水、30 g乙,加入20 g水后所得溶液的溶质质量分数为×100%=20%。
4. (1)13.3 (2)b (3)NaCl
【解析】 (2)10 ℃时,将120.9 g KNO3的饱和溶液升温至30 ℃,KNO3的溶解度增大,但溶液中溶质及溶剂的质量均不变,此时可用图中的b点表示。
(3)20 ℃时,NaCl的溶解度大于KNO3的溶解度,等质量溶剂中可溶解的NaCl质量大于KNO3的质量,蒸发掉10 g水再恢复到20 ℃,析出晶体的质量等于蒸发的10 g水中溶解的溶质质量,故析出的NaCl晶体比KNO3多。
5. C A( ):KNO3的溶解度受温度影响较大,KCl的溶解度受温度影响较小,则曲线乙表示KCl的溶解度曲线。B( ): 40 ℃时KNO3的溶解度是63.9 g,该温度下其饱和溶液的溶质质量分数为×100%≈39.0%<63.9%。C(√):20 ℃时,KCl和KNO3的溶解度相近,且溶解度较大的是KCl,30 ℃时两种物质中溶解度较大的是KNO3,则两物质溶解度相同的温度在20~30 ℃之间。D( ):t1 ℃时甲和乙的溶解度相等,该温度下两者饱和溶液的溶质质量分数相等。把t1 ℃时甲和乙的饱和溶液分别升温至t2 ℃时,两物质的溶解度均增大,两溶液都变为不饱和溶液,溶质、溶剂的质量都不变,所以溶质的质量分数也不变,仍然相等。
6. A A( ):20 ℃时,氯化钾溶解度小于40 g,100 g水中不能溶解40 g氯化钾,充分搅拌后,甲中固体有剩余。B(√):40 ℃时,氯化钾溶解度为40 g,100 g水中恰好完全溶解40 g氯化钾,乙溶液中溶质质量分数比甲大。C(√):甲、乙均为饱和溶液。D(√):乙中溶液质量为100 g+40 g=140 g。
7. (1)饱和
(2)NaCl(或氯化钠)
(3)< 0 ℃≤t
(2)Na2CO3的溶解度受温度的影响较大,NaCl的溶解度受温度的影响较小,故等质量的两种物质的饱和溶液分别降温,
Na2CO3溶液析出的晶体较多,NaCl溶液析出的晶体较少,故剩余溶液的质量NaCl>Na2CO3。
(3)由题意知,甲为Na2CO3,乙为NaCl,将等质量的Na2CO3、NaCl分别溶解在100 g水中,甲中有固体存在,乙中固体完全溶解,故溶质质量分数甲<乙。控制的温度范围应使甲(Na2CO3)的溶解度小于乙(NaCl)的溶解度,即0 ℃≤t
【解析】 (2)t3 ℃时,甲的溶解度是50 g,即100 g水中溶解50 g的甲达到饱和,其中溶质与溶液的质量比为50 g:(50 g+ 100 g)=1∶3。
(3)t1 ℃时,甲的溶解度小于乙的溶解度,把等质量的甲、乙两种物质分别放入两只烧杯中,加入100 g水,充分搅拌,B烧杯中有未溶解的物质,则B烧杯内溶质是甲。t1 ℃时,A烧杯中溶质全部溶解,B烧杯中溶质有剩余,说明加入溶质的质量大于t1 ℃时甲的溶解度,小于等于t1 ℃时乙的溶解度。A、B(√):升温至t2 ℃,甲、乙的溶解度均增大,且甲剩余溶质可以全部溶解,二者均形成不饱和溶液,因所加溶质、溶剂的质量相等,则所得溶液的溶质质量分数相等。C( ):t3 ℃时甲的溶解度大于乙的溶解度,则溶解等质量的甲、乙溶质需要水的质量甲小于乙,故蒸发水的质量烧杯A小于烧杯B。
专项二 配制一定溶质质量分数的氯化钠溶液
1. D A(√):实验室配制100 g 16%的氯化钠溶液,首先计算配制溶液所需氯化钠和水的质量,再称量所需的氯化钠和量取水,最后进行溶解,实验操作顺序为④②①⑤③。B(√):溶质质量=溶液质量×溶质的质量分数,配制100 g 16% 的氯化钠溶液,需氯化钠的质量=100 g×16%=16 g。C(√):溶剂质量=溶液质量-溶质质量,所需溶剂的质量为100 g-16 g= 84 g(合84 mL),应用规格为100 mL的量筒量取水。D( ):步骤③的操作,不能改变该温度下100 g水中最多能溶解氯化钠的质量,不能增大NaCl的溶解度。
2. (1)烧杯 (2)加快溶解速率 (3)47 (4)A (5)AC
【解析】 (5)A(√):量取蒸馏水时仰视读数,读取数值小于实际数值,会导致量取水的体积偏大,溶液质量偏大,溶质质量分数偏小。B( ):量取蒸馏水时俯视读数,读取数值大于实际数值,会导致量取水的体积偏小,溶液质量偏小,溶质质量分数偏大。C(√):将称量好的NaCl固体转移至烧杯时,NaCl撒落,会导致溶质质量偏小,溶质质量分数偏小。D( ):溶液具有均一性,将配好的溶液转移到试剂瓶时,部分溶液溅出,不影响溶质质量分数的大小。
3. D A( ):需要水的质量为10 g×98%÷10%-10 g=88 g。B( ):用量筒量取浓硫酸时,仰视读数,读数比实际液体体积小,会造成实际量取的浓硫酸的体积偏大,使所配溶液溶质质量分数偏大。C( ):10 g 浓硫酸的体积为≈5.4 cm3,即5.4 mL,应用规格为10 mL的量筒量取。
4. (1)24 (2)胶头滴管、玻璃棒 (3)AB
【解析】 (1)溶液稀释过程中溶质的质量保持不变,设配制50 g 3%的氯化钠溶液需要6%的氯化钠溶液的质量为x,有6%×x=50 g×3%,解得x=25 g,需要6%的氯化钠溶液的体积为≈24 cm3=24 mL。
(2)实验中用到的仪器有25 mL的量筒、细口瓶、烧杯、胶头滴管、玻璃棒。
(3)A(√):量取6%的氯化钠溶液时仰视读数,会使实际量取的液体体积比读数大,导致溶质的质量分数偏大。B(√):向烧杯内加入水时有水洒出,会使水的体积偏小,导致溶质的质量分数偏大。C( ):混匀过程中没有使用玻璃棒搅拌,不会导致溶剂和溶质质量的变化,溶质的质量分数不变。D( ):配制好的溶液装入未干燥的细口瓶,相当于稀释了溶液,导致溶质的质量分数偏小。
