2022—2023学年化学沪教版(全国)九年级下册第7章 应用广泛的酸、碱、盐 单元夯练(含答案)
文档属性
| 名称 | 2022—2023学年化学沪教版(全国)九年级下册第7章 应用广泛的酸、碱、盐 单元夯练(含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 542.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-12 20:46:32 | ||
图片预览


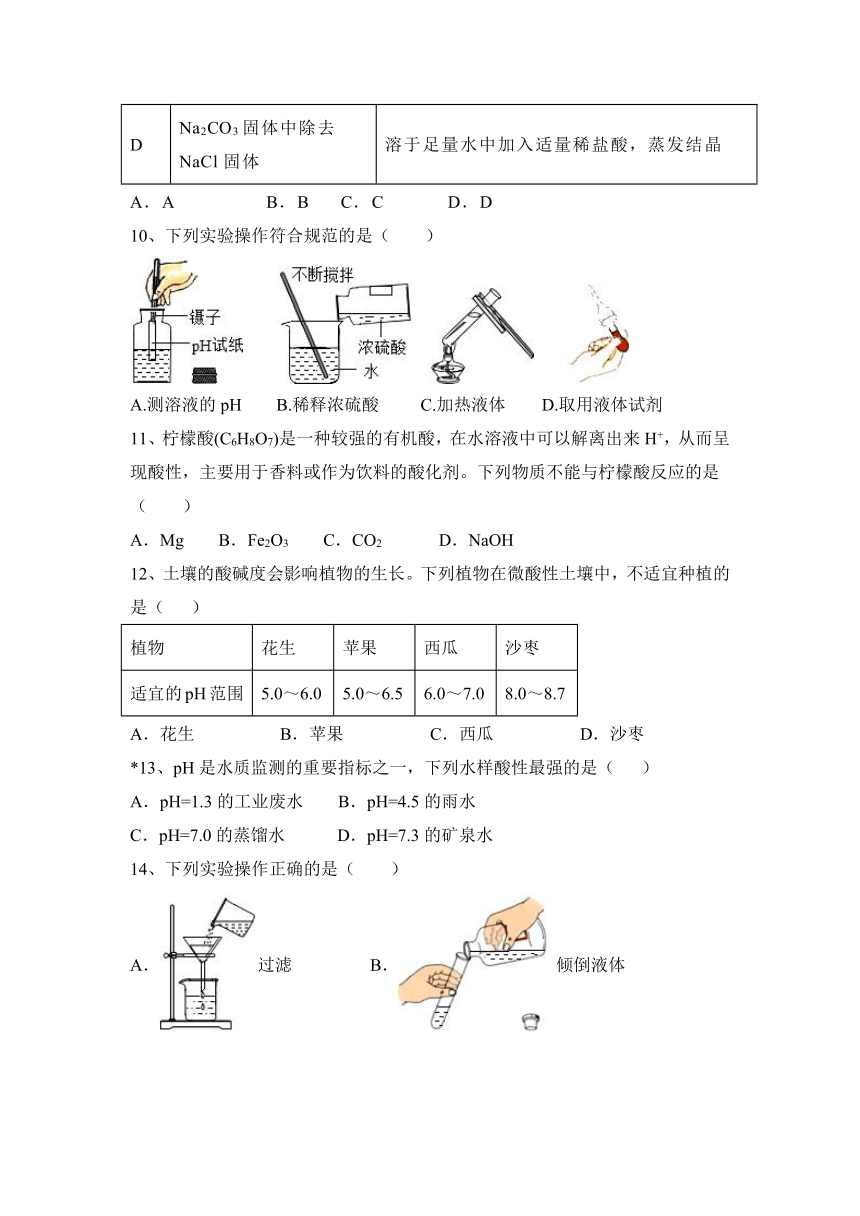


文档简介
2022—2023学年化学沪教版(全国)九年级下册第7章 应用广泛的酸、碱、盐 单元夯练附答案
沪教版(全国)第7章 应用广泛的酸、碱、盐
一、选择题。
1、下列物质中,能使酚酞溶液变红的是( )
A.氢氧化钠溶液 B.稀硫酸 C.稀盐酸 D.水
2、下列方法不可行的是( )
A.用烧碱治疗胃酸过多 B.用熟石灰改良酸性土壤
C.将浓硫酸沿器壁慢慢倒入水里稀释浓硫酸 D.用稀盐酸除铁锈
3、现有X、Y、Z三种金属,把X和Y分别放入稀硫酸中,仅X溶解并产生氢气;如果把Y和Z分别放入硝酸银溶液中,过一会儿,在Y表面有银析出,而Z没有变化。根据以上事实,对X、Y、Z三种金属活动性顺序判断正确的是( )
A.X >Y>(H)>Z B.X>(H)>Y>Z
C.Y>(H)>X>Z D.Y>X> (H)>Z
4、(双选)化学变化可以实现物质间的转化。a、b、c三种物质间的转化关系如下图所示,其中“→”表示某种物质经一步反应转化为另一种物质(部分反应物、生成物及反应条件已略去)。下列说法不正确的是( )
A.若a、b、c常温下均为气体,且含有同种非金属元素,b能与血红蛋白结合引起中毒,则a可能是甲烷
B.若a、b、c含有同种金属元素,b、c的水溶液为浅绿色,则a一定为Fe
C.若a、b、c均为金属单质,它们之间的转化在常温下进行,则三种金属的活动性顺序一定为a﹥b﹥c
D.若a、b、c均为碱,其中b易溶于水,c难溶于水,则a→b的反应一定为
5、下列对有关实验操作或现象的描述中,错误的是( )
A.用玻璃棒蘸取少量待测液滴在湿润的pH试纸上,与标准比色卡对照并读出pH
B.收集二氧化碳时,将燃着的木条伸到集气瓶口,如果木条立即熄灭,证明瓶内已集满二氧化碳
C.向鸡蛋清中滴加几滴浓硝酸,微热,出现黄色
D.将碘水滴加在馒头片上,出现蓝色
6、下列“液体“中可能为纯净物的是( )
A.胃液 B.波尔多液 C.滤液 D.“84”消毒液
7、下列四组溶液,只用紫色石蕊溶液就能鉴别的一组是( )
A.NaOH KOH HCl B.NaCl NaOH HCl
C.H2SO4 HCl NaOH D.NaCl Na2CO3 Na2SO4
8、将20g质量分数为98%的浓硫酸稀释为25%的稀硫酸。下列说法中不正确的是( )
A.实验步骤:计算、量取、混匀、装瓶贴标签
B.实验仪器:量筒、胶头滴管、烧杯、玻璃棒、细口瓶
C.稀释浓硫酸时将水沿烧杯内壁慢慢注入浓硫酸中,并不断搅拌
D.浓硫酸不慎沾到皮肤上,应立即用大量水冲洗,再涂上3%~5%的碳酸氢钠溶液
9、(双选)以下实验操作均正确的一组是( )
项目 进行的实验 所用试剂及主要实验操作
A CO中除去CO2 通过装有足量NaOH溶液的洗气瓶后,干燥
B 鉴别磷矿粉和硫酸铵两种化肥 观察颜色,灰白色固体物质为磷矿粉。白色晶体为硫酸铵
C NaCl固体中除去CaCl2固体 加入适量K2CO3溶液,充分后,过滤、蒸发、结晶
D Na2CO3固体中除去NaCl固体 溶于足量水中加入适量稀盐酸,蒸发结晶
A.A B.B C.C D.D
10、下列实验操作符合规范的是( )
A.测溶液的pH B.稀释浓硫酸 C.加热液体 D.取用液体试剂
11、柠檬酸(C6H8O7)是一种较强的有机酸,在水溶液中可以解离出来H+,从而呈现酸性,主要用于香料或作为饮料的酸化剂。下列物质不能与柠檬酸反应的是( )
A.Mg B.Fe2O3 C.CO2 D.NaOH
12、土壤的酸碱度会影响植物的生长。下列植物在微酸性土壤中,不适宜种植的是( )
植物 花生 苹果 西瓜 沙枣
适宜的pH范围 5.0~6.0 5.0~6.5 6.0~7.0 8.0~8.7
A.花生 B.苹果 C.西瓜 D.沙枣
*13、pH是水质监测的重要指标之一,下列水样酸性最强的是( )
A.pH=1.3的工业废水 B.pH=4.5的雨水
C.pH=7.0的蒸馏水 D.pH=7.3的矿泉水
14、下列实验操作正确的是( )
A.过滤 B.倾倒液体
C.蒸发食盐水 D.稀释浓硫酸
15、(双选)在托盘天平两盘上各放一只质量相同的烧杯,在两只烧杯里分别注入200g质量分数为7.3%的稀盐酸,天平平衡。向左盘烧杯中加入8g某碳酸钙和氧化钙组成的固体混合物,其钙元素质量分数为50%,充分反应。下列有关说法中,正确的是( )
A.左盘烧杯中可生成4.4g气体
B.充分反应后,左盘烧杯溶液中含有两种溶质
C.若向右盘烧杯中加入5.6g铁粉,天平重新平衡
D.若向右盘烧杯中加入5.6g质量分数为10%的硝酸银溶液,天平重新平衡
二、填空题。
16、判断题。
(1)碱能使紫色石蕊试剂变成红色,能使无色酚酞溶液变红色。( )
(2)某溶液不能使酚酞溶液变色,但该溶液不一定显酸性( )
(3)氢氧化铜能够使指示剂变色。( )
(4)能使酚酞变红色的一定是碱。( )
(5)常用的酸碱指示剂有紫色石蕊试剂与无色酚酞试剂。( )
17、纽扣电池是生活中常用的电源,下图是银锌纽扣电池的构造示意图,回答下列问题。
(1)纽扣电池的外壳可以加工得很薄,说明金属具有_____性。
(2)氧化银加热分解可以得到两种单质,其化学反应方程式为_______。
(3)该电池中涉及的铁、锌、银三种金属,它们的金属活动性由强到弱的顺序是_____,为了验证该结论,某同学向质量、外形相同的铁片、锌片、银片中分别加入足量15%的稀盐酸,以下现象中不能成为该结论证据的是________(填序号)。
A 银表面没有气泡生成
B 铁表面最终生成气体的总量比锌多
C 铁表面产生气泡的速率比锌慢
18、无土栽培是利用营养液栽培作物的一种方法。
(1)下列化学肥料中属于复合肥的是 (填序号);
①硝酸铵 ②磷酸二氢铵 ③硝酸钾 ④硫酸钾
(2)某同学要在实验室配制150g溶质质量分数为2%的硝酸钾溶液,需要硝酸钾的质量为 g。
19、如果实验室没有pH试纸,又要测定未知溶液的酸碱性,可选用 试液来进行实验,该试液从 色变成 色,能确定其呈碱性。
20、化学与我们的生产生活密切相关,请从下列物质中选择相应序号填空。
①稀盐酸②硝酸钾③碳酸钙④活性炭
(1)可用作补钙剂的是___________。
(2)可作复合肥料的是___________。
(3)可用作冰箱除味剂的是___________。
(4)可用于金属表面除锈的是___________。
21、某同学将一朵紫色牵牛花泡在石灰水里,牵牛花很快就变成了蓝色,又将牵牛花泡在稀盐酸中,牵牛花又变成了红色,请你根据以上实验现象回答:
(1)该同学将紫色牵牛花泡在肥皂水里,牵牛花很快就变成了蓝色,据此可推断肥皂水显_____(填“酸性”或“碱性”)。
(2)该牵牛花的汁液_____(填“能”或“不能”)用作指示剂。
22、青岛市公交车上常悬挂一块警示牌,“严禁携带易燃易爆、化学危险品上车!”下面列举了各种禁带物品:白磷、油纸、镁、汽油、酒精、硫酸、过氧化氢、烧碱、炸药、烟花炮竹……请从上述物质中选择合适的物质,将其化学式填写在下列空格中。
(1)一种银白色的金属_____。
(2)一种在空气中易自燃的单质_____。
(3)一种浓溶液具有吸水性的酸_____。
(4)一种可溶性碱_____。
23、化肥对提高农作物的产量具有重要作用,但不合理使用会带来很多环境问题。
(1)化肥对环境造成______等不良影响。
(2)对合理使用化肥提出两点合理化建议分别是______、______。
三、综合应用题。
24、在实验室里,可用如图装置进行CO还原Fe2O3的实验,并检验该反应的气体生成物。已知由一氧化碳发生装置得到的CO中混有CO2和H2O。
(1)写出装置C处尾气处理的方法______ (写一种即可);A装置中有关反应的化学方程式______ 。(写出一个即可)
(2)检验CO还原Fe2O3反应的气体生成物的现象是什么?
______ 。
(3)实验后取A中固体溶于水,滴加酚酞溶液,溶液变红色,请分析可能的原因:______ 。
(4)某钢铁厂用赤铁矿石炼铁。若该厂每天需消耗6000t含氧化铁80%的赤铁矿石,则理论上可日产含铁96%的生铁的质量是多少?(写出计算过程)
25、酸碱盐种类繁多,与人类日常生活和工农业生产关系十分密切。
(1)酸具有相似的性质,因为不同的酸在水溶液中都能解离出______。
(2)检验敞口放置的氢氧化钠溶液是否变质,可以选用的一种试剂是_____。
(3)利用数字化实验设备,测定盐酸与氢氧化钠溶液反应时溶液pH变化,实验结果如图,当滴入溶液为V2mL时,所得溶液中溶质化学式为_______,所得溶液能使紫色石蕊溶液变成_____色。
(4)氯化钠是生活中常见的盐,为除去某粗盐水中的MgCl、CaCl2杂质,得到NaCl溶液,某化学小组设计了如下实验方案。
①过滤操作中所用到的玻璃仪器有烧杯、漏斗和____________.
②以上方案中有关反应的化学方程式为__________ (写一个即可)
③写出溶液乙中含有的杂质,并将以上方案补充完整_______。
(5)某实验室用40g、20%的NaOH溶液洗涤一定量石油产品中残余的H2SO4,消耗NaOH溶液呈中性,请计算该一定量石油产品H2SO4的质量________。
四、计算题。
26、造纸厂会产生含氢氧化钠的废水,需经处理呈中性后排放。为测定此废水中氢氧化钠的质量分数,小明取40 g废水样品加入到锥形瓶中,逐滴加入10%的稀硫酸,至恰好完全反应时,消耗稀硫酸49 g。计算废水中氢氧化钠的质量分数。
2022—2023学年化学沪教版(全国)九年级下册第7章 应用广泛的酸、碱、盐 单元夯练附答案
沪教版(全国)第7章 应用广泛的酸、碱、盐
一、选择题。
1、下列物质中,能使酚酞溶液变红的是( )
A.氢氧化钠溶液 B.稀硫酸 C.稀盐酸 D.水
【答案】A
2、下列方法不可行的是( )
A.用烧碱治疗胃酸过多 B.用熟石灰改良酸性土壤
C.将浓硫酸沿器壁慢慢倒入水里稀释浓硫酸 D.用稀盐酸除铁锈
【答案】A
3、现有X、Y、Z三种金属,把X和Y分别放入稀硫酸中,仅X溶解并产生氢气;如果把Y和Z分别放入硝酸银溶液中,过一会儿,在Y表面有银析出,而Z没有变化。根据以上事实,对X、Y、Z三种金属活动性顺序判断正确的是( )
A.X >Y>(H)>Z B.X>(H)>Y>Z
C.Y>(H)>X>Z D.Y>X> (H)>Z
【答案】B
4、(双选)化学变化可以实现物质间的转化。a、b、c三种物质间的转化关系如下图所示,其中“→”表示某种物质经一步反应转化为另一种物质(部分反应物、生成物及反应条件已略去)。下列说法不正确的是( )
A.若a、b、c常温下均为气体,且含有同种非金属元素,b能与血红蛋白结合引起中毒,则a可能是甲烷
B.若a、b、c含有同种金属元素,b、c的水溶液为浅绿色,则a一定为Fe
C.若a、b、c均为金属单质,它们之间的转化在常温下进行,则三种金属的活动性顺序一定为a﹥b﹥c
D.若a、b、c均为碱,其中b易溶于水,c难溶于水,则a→b的反应一定为
【答案】BD
5、下列对有关实验操作或现象的描述中,错误的是( )
A.用玻璃棒蘸取少量待测液滴在湿润的pH试纸上,与标准比色卡对照并读出pH
B.收集二氧化碳时,将燃着的木条伸到集气瓶口,如果木条立即熄灭,证明瓶内已集满二氧化碳
C.向鸡蛋清中滴加几滴浓硝酸,微热,出现黄色
D.将碘水滴加在馒头片上,出现蓝色
【答案】A
6、下列“液体“中可能为纯净物的是( )
A.胃液 B.波尔多液 C.滤液 D.“84”消毒液
【答案】C
7、下列四组溶液,只用紫色石蕊溶液就能鉴别的一组是( )
A.NaOH KOH HCl B.NaCl NaOH HCl
C.H2SO4 HCl NaOH D.NaCl Na2CO3 Na2SO4
【答案】B
8、将20g质量分数为98%的浓硫酸稀释为25%的稀硫酸。下列说法中不正确的是( )
A.实验步骤:计算、量取、混匀、装瓶贴标签
B.实验仪器:量筒、胶头滴管、烧杯、玻璃棒、细口瓶
C.稀释浓硫酸时将水沿烧杯内壁慢慢注入浓硫酸中,并不断搅拌
D.浓硫酸不慎沾到皮肤上,应立即用大量水冲洗,再涂上3%~5%的碳酸氢钠溶液
【答案】C
9、(双选)以下实验操作均正确的一组是( )
项目 进行的实验 所用试剂及主要实验操作
A CO中除去CO2 通过装有足量NaOH溶液的洗气瓶后,干燥
B 鉴别磷矿粉和硫酸铵两种化肥 观察颜色,灰白色固体物质为磷矿粉。白色晶体为硫酸铵
C NaCl固体中除去CaCl2固体 加入适量K2CO3溶液,充分后,过滤、蒸发、结晶
D Na2CO3固体中除去NaCl固体 溶于足量水中加入适量稀盐酸,蒸发结晶
A.A B.B C.C D.D
【答案】AB
10、下列实验操作符合规范的是( )
A.测溶液的pH B.稀释浓硫酸 C.加热液体 D.取用液体试剂
【答案】B
11、柠檬酸(C6H8O7)是一种较强的有机酸,在水溶液中可以解离出来H+,从而呈现酸性,主要用于香料或作为饮料的酸化剂。下列物质不能与柠檬酸反应的是( )
A.Mg B.Fe2O3 C.CO2 D.NaOH
【答案】C
12、土壤的酸碱度会影响植物的生长。下列植物在微酸性土壤中,不适宜种植的是( )
植物 花生 苹果 西瓜 沙枣
适宜的pH范围 5.0~6.0 5.0~6.5 6.0~7.0 8.0~8.7
A.花生 B.苹果 C.西瓜 D.沙枣
【答案】D
*13、pH是水质监测的重要指标之一,下列水样酸性最强的是( )
A.pH=1.3的工业废水 B.pH=4.5的雨水
C.pH=7.0的蒸馏水 D.pH=7.3的矿泉水
【答案】A
14、下列实验操作正确的是( )
A.过滤 B.倾倒液体
C.蒸发食盐水 D.稀释浓硫酸
【答案】D
15、(双选)在托盘天平两盘上各放一只质量相同的烧杯,在两只烧杯里分别注入200g质量分数为7.3%的稀盐酸,天平平衡。向左盘烧杯中加入8g某碳酸钙和氧化钙组成的固体混合物,其钙元素质量分数为50%,充分反应。下列有关说法中,正确的是( )
A.左盘烧杯中可生成4.4g气体
B.充分反应后,左盘烧杯溶液中含有两种溶质
C.若向右盘烧杯中加入5.6g铁粉,天平重新平衡
D.若向右盘烧杯中加入5.6g质量分数为10%的硝酸银溶液,天平重新平衡
【答案】BD
二、填空题。
16、判断题。
(1)碱能使紫色石蕊试剂变成红色,能使无色酚酞溶液变红色。( )
(2)某溶液不能使酚酞溶液变色,但该溶液不一定显酸性( )
(3)氢氧化铜能够使指示剂变色。( )
(4)能使酚酞变红色的一定是碱。( )
(5)常用的酸碱指示剂有紫色石蕊试剂与无色酚酞试剂。( )
【答案】(1)错误 (2)正确 (3)错误 (4)错误 (5)正确
17、纽扣电池是生活中常用的电源,下图是银锌纽扣电池的构造示意图,回答下列问题。
(1)纽扣电池的外壳可以加工得很薄,说明金属具有_____性。
(2)氧化银加热分解可以得到两种单质,其化学反应方程式为_______。
(3)该电池中涉及的铁、锌、银三种金属,它们的金属活动性由强到弱的顺序是_____,为了验证该结论,某同学向质量、外形相同的铁片、锌片、银片中分别加入足量15%的稀盐酸,以下现象中不能成为该结论证据的是________(填序号)。
A 银表面没有气泡生成
B 铁表面最终生成气体的总量比锌多
C 铁表面产生气泡的速率比锌慢
【答案】(1) 延展性 (2) (3) 锌、铁、银 B
18、无土栽培是利用营养液栽培作物的一种方法。
(1)下列化学肥料中属于复合肥的是 (填序号);
①硝酸铵 ②磷酸二氢铵 ③硝酸钾 ④硫酸钾
(2)某同学要在实验室配制150g溶质质量分数为2%的硝酸钾溶液,需要硝酸钾的质量为 g。
【答案】 ②③;3
19、如果实验室没有pH试纸,又要测定未知溶液的酸碱性,可选用 试液来进行实验,该试液从 色变成 色,能确定其呈碱性。
【答案】无色酚酞 无 红
20、化学与我们的生产生活密切相关,请从下列物质中选择相应序号填空。
①稀盐酸②硝酸钾③碳酸钙④活性炭
(1)可用作补钙剂的是___________。
(2)可作复合肥料的是___________。
(3)可用作冰箱除味剂的是___________。
(4)可用于金属表面除锈的是___________。
【答案】③ ② ④ ①
21、某同学将一朵紫色牵牛花泡在石灰水里,牵牛花很快就变成了蓝色,又将牵牛花泡在稀盐酸中,牵牛花又变成了红色,请你根据以上实验现象回答:
(1)该同学将紫色牵牛花泡在肥皂水里,牵牛花很快就变成了蓝色,据此可推断肥皂水显_____(填“酸性”或“碱性”)。
(2)该牵牛花的汁液_____(填“能”或“不能”)用作指示剂。
【答案】碱性 能
22、青岛市公交车上常悬挂一块警示牌,“严禁携带易燃易爆、化学危险品上车!”下面列举了各种禁带物品:白磷、油纸、镁、汽油、酒精、硫酸、过氧化氢、烧碱、炸药、烟花炮竹……请从上述物质中选择合适的物质,将其化学式填写在下列空格中。
(1)一种银白色的金属_____。
(2)一种在空气中易自燃的单质_____。
(3)一种浓溶液具有吸水性的酸_____。
(4)一种可溶性碱_____。
【答案】(1) (2) (3)
23、化肥对提高农作物的产量具有重要作用,但不合理使用会带来很多环境问题。
(1)化肥对环境造成______等不良影响。
(2)对合理使用化肥提出两点合理化建议分别是______、______。
【答案】土壤污染、水体污染(合理即可) 测土配方施肥 增加有机肥料的使用改善土壤结构
三、综合应用题。
24、在实验室里,可用如图装置进行CO还原Fe2O3的实验,并检验该反应的气体生成物。已知由一氧化碳发生装置得到的CO中混有CO2和H2O。
(1)写出装置C处尾气处理的方法______ (写一种即可);A装置中有关反应的化学方程式______ 。(写出一个即可)
(2)检验CO还原Fe2O3反应的气体生成物的现象是什么?
______ 。
(3)实验后取A中固体溶于水,滴加酚酞溶液,溶液变红色,请分析可能的原因:______ 。
(4)某钢铁厂用赤铁矿石炼铁。若该厂每天需消耗6000t含氧化铁80%的赤铁矿石,则理论上可日产含铁96%的生铁的质量是多少?(写出计算过程)
【答案】(1) 加一个燃着的酒精灯或绑一个气球
或 或
(2)C处澄清石灰水变浑浊
(3)氢氧化钠、氢氧化钙、碳酸钠溶液均显碱性,均能使无色酚酞试液变色
(4)解:设理论上可日产含铁96%的生铁的质量是x
x=3500t
答:理论上可日产含铁96%的生铁的质量是3500t。
25、酸碱盐种类繁多,与人类日常生活和工农业生产关系十分密切。
(1)酸具有相似的性质,因为不同的酸在水溶液中都能解离出______。
(2)检验敞口放置的氢氧化钠溶液是否变质,可以选用的一种试剂是_____。
(3)利用数字化实验设备,测定盐酸与氢氧化钠溶液反应时溶液pH变化,实验结果如图,当滴入溶液为V2mL时,所得溶液中溶质化学式为_______,所得溶液能使紫色石蕊溶液变成_____色。
(4)氯化钠是生活中常见的盐,为除去某粗盐水中的MgCl、CaCl2杂质,得到NaCl溶液,某化学小组设计了如下实验方案。
①过滤操作中所用到的玻璃仪器有烧杯、漏斗和____________.
②以上方案中有关反应的化学方程式为__________ (写一个即可)
③写出溶液乙中含有的杂质,并将以上方案补充完整_______。
(5)某实验室用40g、20%的NaOH溶液洗涤一定量石油产品中残余的H2SO4,消耗NaOH溶液呈中性,请计算该一定量石油产品H2SO4的质量________。
【答案】(1)H+ 稀盐酸(或者稀硫酸、BaCl2溶液,CaCl2溶液等)
(3)HCl、NaCl 红
(4)①玻璃棒 ②Ba(OH)2 +MgSO4=BaSO4↓+Mg(OH)2↓
【或者Ba(OH)2 +Na2CO3=BaCO3↓+2NaOH
或者CaCl2 +Na2CO3= CaCO3↓+2NaCl】
③Na2CO3和NaOH在溶液乙中加入适量稀盐酸 (5)9.8g
四、计算题。
26、造纸厂会产生含氢氧化钠的废水,需经处理呈中性后排放。为测定此废水中氢氧化钠的质量分数,小明取40 g废水样品加入到锥形瓶中,逐滴加入10%的稀硫酸,至恰好完全反应时,消耗稀硫酸49 g。计算废水中氢氧化钠的质量分数。
【答案】10%
沪教版(全国)第7章 应用广泛的酸、碱、盐
一、选择题。
1、下列物质中,能使酚酞溶液变红的是( )
A.氢氧化钠溶液 B.稀硫酸 C.稀盐酸 D.水
2、下列方法不可行的是( )
A.用烧碱治疗胃酸过多 B.用熟石灰改良酸性土壤
C.将浓硫酸沿器壁慢慢倒入水里稀释浓硫酸 D.用稀盐酸除铁锈
3、现有X、Y、Z三种金属,把X和Y分别放入稀硫酸中,仅X溶解并产生氢气;如果把Y和Z分别放入硝酸银溶液中,过一会儿,在Y表面有银析出,而Z没有变化。根据以上事实,对X、Y、Z三种金属活动性顺序判断正确的是( )
A.X >Y>(H)>Z B.X>(H)>Y>Z
C.Y>(H)>X>Z D.Y>X> (H)>Z
4、(双选)化学变化可以实现物质间的转化。a、b、c三种物质间的转化关系如下图所示,其中“→”表示某种物质经一步反应转化为另一种物质(部分反应物、生成物及反应条件已略去)。下列说法不正确的是( )
A.若a、b、c常温下均为气体,且含有同种非金属元素,b能与血红蛋白结合引起中毒,则a可能是甲烷
B.若a、b、c含有同种金属元素,b、c的水溶液为浅绿色,则a一定为Fe
C.若a、b、c均为金属单质,它们之间的转化在常温下进行,则三种金属的活动性顺序一定为a﹥b﹥c
D.若a、b、c均为碱,其中b易溶于水,c难溶于水,则a→b的反应一定为
5、下列对有关实验操作或现象的描述中,错误的是( )
A.用玻璃棒蘸取少量待测液滴在湿润的pH试纸上,与标准比色卡对照并读出pH
B.收集二氧化碳时,将燃着的木条伸到集气瓶口,如果木条立即熄灭,证明瓶内已集满二氧化碳
C.向鸡蛋清中滴加几滴浓硝酸,微热,出现黄色
D.将碘水滴加在馒头片上,出现蓝色
6、下列“液体“中可能为纯净物的是( )
A.胃液 B.波尔多液 C.滤液 D.“84”消毒液
7、下列四组溶液,只用紫色石蕊溶液就能鉴别的一组是( )
A.NaOH KOH HCl B.NaCl NaOH HCl
C.H2SO4 HCl NaOH D.NaCl Na2CO3 Na2SO4
8、将20g质量分数为98%的浓硫酸稀释为25%的稀硫酸。下列说法中不正确的是( )
A.实验步骤:计算、量取、混匀、装瓶贴标签
B.实验仪器:量筒、胶头滴管、烧杯、玻璃棒、细口瓶
C.稀释浓硫酸时将水沿烧杯内壁慢慢注入浓硫酸中,并不断搅拌
D.浓硫酸不慎沾到皮肤上,应立即用大量水冲洗,再涂上3%~5%的碳酸氢钠溶液
9、(双选)以下实验操作均正确的一组是( )
项目 进行的实验 所用试剂及主要实验操作
A CO中除去CO2 通过装有足量NaOH溶液的洗气瓶后,干燥
B 鉴别磷矿粉和硫酸铵两种化肥 观察颜色,灰白色固体物质为磷矿粉。白色晶体为硫酸铵
C NaCl固体中除去CaCl2固体 加入适量K2CO3溶液,充分后,过滤、蒸发、结晶
D Na2CO3固体中除去NaCl固体 溶于足量水中加入适量稀盐酸,蒸发结晶
A.A B.B C.C D.D
10、下列实验操作符合规范的是( )
A.测溶液的pH B.稀释浓硫酸 C.加热液体 D.取用液体试剂
11、柠檬酸(C6H8O7)是一种较强的有机酸,在水溶液中可以解离出来H+,从而呈现酸性,主要用于香料或作为饮料的酸化剂。下列物质不能与柠檬酸反应的是( )
A.Mg B.Fe2O3 C.CO2 D.NaOH
12、土壤的酸碱度会影响植物的生长。下列植物在微酸性土壤中,不适宜种植的是( )
植物 花生 苹果 西瓜 沙枣
适宜的pH范围 5.0~6.0 5.0~6.5 6.0~7.0 8.0~8.7
A.花生 B.苹果 C.西瓜 D.沙枣
*13、pH是水质监测的重要指标之一,下列水样酸性最强的是( )
A.pH=1.3的工业废水 B.pH=4.5的雨水
C.pH=7.0的蒸馏水 D.pH=7.3的矿泉水
14、下列实验操作正确的是( )
A.过滤 B.倾倒液体
C.蒸发食盐水 D.稀释浓硫酸
15、(双选)在托盘天平两盘上各放一只质量相同的烧杯,在两只烧杯里分别注入200g质量分数为7.3%的稀盐酸,天平平衡。向左盘烧杯中加入8g某碳酸钙和氧化钙组成的固体混合物,其钙元素质量分数为50%,充分反应。下列有关说法中,正确的是( )
A.左盘烧杯中可生成4.4g气体
B.充分反应后,左盘烧杯溶液中含有两种溶质
C.若向右盘烧杯中加入5.6g铁粉,天平重新平衡
D.若向右盘烧杯中加入5.6g质量分数为10%的硝酸银溶液,天平重新平衡
二、填空题。
16、判断题。
(1)碱能使紫色石蕊试剂变成红色,能使无色酚酞溶液变红色。( )
(2)某溶液不能使酚酞溶液变色,但该溶液不一定显酸性( )
(3)氢氧化铜能够使指示剂变色。( )
(4)能使酚酞变红色的一定是碱。( )
(5)常用的酸碱指示剂有紫色石蕊试剂与无色酚酞试剂。( )
17、纽扣电池是生活中常用的电源,下图是银锌纽扣电池的构造示意图,回答下列问题。
(1)纽扣电池的外壳可以加工得很薄,说明金属具有_____性。
(2)氧化银加热分解可以得到两种单质,其化学反应方程式为_______。
(3)该电池中涉及的铁、锌、银三种金属,它们的金属活动性由强到弱的顺序是_____,为了验证该结论,某同学向质量、外形相同的铁片、锌片、银片中分别加入足量15%的稀盐酸,以下现象中不能成为该结论证据的是________(填序号)。
A 银表面没有气泡生成
B 铁表面最终生成气体的总量比锌多
C 铁表面产生气泡的速率比锌慢
18、无土栽培是利用营养液栽培作物的一种方法。
(1)下列化学肥料中属于复合肥的是 (填序号);
①硝酸铵 ②磷酸二氢铵 ③硝酸钾 ④硫酸钾
(2)某同学要在实验室配制150g溶质质量分数为2%的硝酸钾溶液,需要硝酸钾的质量为 g。
19、如果实验室没有pH试纸,又要测定未知溶液的酸碱性,可选用 试液来进行实验,该试液从 色变成 色,能确定其呈碱性。
20、化学与我们的生产生活密切相关,请从下列物质中选择相应序号填空。
①稀盐酸②硝酸钾③碳酸钙④活性炭
(1)可用作补钙剂的是___________。
(2)可作复合肥料的是___________。
(3)可用作冰箱除味剂的是___________。
(4)可用于金属表面除锈的是___________。
21、某同学将一朵紫色牵牛花泡在石灰水里,牵牛花很快就变成了蓝色,又将牵牛花泡在稀盐酸中,牵牛花又变成了红色,请你根据以上实验现象回答:
(1)该同学将紫色牵牛花泡在肥皂水里,牵牛花很快就变成了蓝色,据此可推断肥皂水显_____(填“酸性”或“碱性”)。
(2)该牵牛花的汁液_____(填“能”或“不能”)用作指示剂。
22、青岛市公交车上常悬挂一块警示牌,“严禁携带易燃易爆、化学危险品上车!”下面列举了各种禁带物品:白磷、油纸、镁、汽油、酒精、硫酸、过氧化氢、烧碱、炸药、烟花炮竹……请从上述物质中选择合适的物质,将其化学式填写在下列空格中。
(1)一种银白色的金属_____。
(2)一种在空气中易自燃的单质_____。
(3)一种浓溶液具有吸水性的酸_____。
(4)一种可溶性碱_____。
23、化肥对提高农作物的产量具有重要作用,但不合理使用会带来很多环境问题。
(1)化肥对环境造成______等不良影响。
(2)对合理使用化肥提出两点合理化建议分别是______、______。
三、综合应用题。
24、在实验室里,可用如图装置进行CO还原Fe2O3的实验,并检验该反应的气体生成物。已知由一氧化碳发生装置得到的CO中混有CO2和H2O。
(1)写出装置C处尾气处理的方法______ (写一种即可);A装置中有关反应的化学方程式______ 。(写出一个即可)
(2)检验CO还原Fe2O3反应的气体生成物的现象是什么?
______ 。
(3)实验后取A中固体溶于水,滴加酚酞溶液,溶液变红色,请分析可能的原因:______ 。
(4)某钢铁厂用赤铁矿石炼铁。若该厂每天需消耗6000t含氧化铁80%的赤铁矿石,则理论上可日产含铁96%的生铁的质量是多少?(写出计算过程)
25、酸碱盐种类繁多,与人类日常生活和工农业生产关系十分密切。
(1)酸具有相似的性质,因为不同的酸在水溶液中都能解离出______。
(2)检验敞口放置的氢氧化钠溶液是否变质,可以选用的一种试剂是_____。
(3)利用数字化实验设备,测定盐酸与氢氧化钠溶液反应时溶液pH变化,实验结果如图,当滴入溶液为V2mL时,所得溶液中溶质化学式为_______,所得溶液能使紫色石蕊溶液变成_____色。
(4)氯化钠是生活中常见的盐,为除去某粗盐水中的MgCl、CaCl2杂质,得到NaCl溶液,某化学小组设计了如下实验方案。
①过滤操作中所用到的玻璃仪器有烧杯、漏斗和____________.
②以上方案中有关反应的化学方程式为__________ (写一个即可)
③写出溶液乙中含有的杂质,并将以上方案补充完整_______。
(5)某实验室用40g、20%的NaOH溶液洗涤一定量石油产品中残余的H2SO4,消耗NaOH溶液呈中性,请计算该一定量石油产品H2SO4的质量________。
四、计算题。
26、造纸厂会产生含氢氧化钠的废水,需经处理呈中性后排放。为测定此废水中氢氧化钠的质量分数,小明取40 g废水样品加入到锥形瓶中,逐滴加入10%的稀硫酸,至恰好完全反应时,消耗稀硫酸49 g。计算废水中氢氧化钠的质量分数。
2022—2023学年化学沪教版(全国)九年级下册第7章 应用广泛的酸、碱、盐 单元夯练附答案
沪教版(全国)第7章 应用广泛的酸、碱、盐
一、选择题。
1、下列物质中,能使酚酞溶液变红的是( )
A.氢氧化钠溶液 B.稀硫酸 C.稀盐酸 D.水
【答案】A
2、下列方法不可行的是( )
A.用烧碱治疗胃酸过多 B.用熟石灰改良酸性土壤
C.将浓硫酸沿器壁慢慢倒入水里稀释浓硫酸 D.用稀盐酸除铁锈
【答案】A
3、现有X、Y、Z三种金属,把X和Y分别放入稀硫酸中,仅X溶解并产生氢气;如果把Y和Z分别放入硝酸银溶液中,过一会儿,在Y表面有银析出,而Z没有变化。根据以上事实,对X、Y、Z三种金属活动性顺序判断正确的是( )
A.X >Y>(H)>Z B.X>(H)>Y>Z
C.Y>(H)>X>Z D.Y>X> (H)>Z
【答案】B
4、(双选)化学变化可以实现物质间的转化。a、b、c三种物质间的转化关系如下图所示,其中“→”表示某种物质经一步反应转化为另一种物质(部分反应物、生成物及反应条件已略去)。下列说法不正确的是( )
A.若a、b、c常温下均为气体,且含有同种非金属元素,b能与血红蛋白结合引起中毒,则a可能是甲烷
B.若a、b、c含有同种金属元素,b、c的水溶液为浅绿色,则a一定为Fe
C.若a、b、c均为金属单质,它们之间的转化在常温下进行,则三种金属的活动性顺序一定为a﹥b﹥c
D.若a、b、c均为碱,其中b易溶于水,c难溶于水,则a→b的反应一定为
【答案】BD
5、下列对有关实验操作或现象的描述中,错误的是( )
A.用玻璃棒蘸取少量待测液滴在湿润的pH试纸上,与标准比色卡对照并读出pH
B.收集二氧化碳时,将燃着的木条伸到集气瓶口,如果木条立即熄灭,证明瓶内已集满二氧化碳
C.向鸡蛋清中滴加几滴浓硝酸,微热,出现黄色
D.将碘水滴加在馒头片上,出现蓝色
【答案】A
6、下列“液体“中可能为纯净物的是( )
A.胃液 B.波尔多液 C.滤液 D.“84”消毒液
【答案】C
7、下列四组溶液,只用紫色石蕊溶液就能鉴别的一组是( )
A.NaOH KOH HCl B.NaCl NaOH HCl
C.H2SO4 HCl NaOH D.NaCl Na2CO3 Na2SO4
【答案】B
8、将20g质量分数为98%的浓硫酸稀释为25%的稀硫酸。下列说法中不正确的是( )
A.实验步骤:计算、量取、混匀、装瓶贴标签
B.实验仪器:量筒、胶头滴管、烧杯、玻璃棒、细口瓶
C.稀释浓硫酸时将水沿烧杯内壁慢慢注入浓硫酸中,并不断搅拌
D.浓硫酸不慎沾到皮肤上,应立即用大量水冲洗,再涂上3%~5%的碳酸氢钠溶液
【答案】C
9、(双选)以下实验操作均正确的一组是( )
项目 进行的实验 所用试剂及主要实验操作
A CO中除去CO2 通过装有足量NaOH溶液的洗气瓶后,干燥
B 鉴别磷矿粉和硫酸铵两种化肥 观察颜色,灰白色固体物质为磷矿粉。白色晶体为硫酸铵
C NaCl固体中除去CaCl2固体 加入适量K2CO3溶液,充分后,过滤、蒸发、结晶
D Na2CO3固体中除去NaCl固体 溶于足量水中加入适量稀盐酸,蒸发结晶
A.A B.B C.C D.D
【答案】AB
10、下列实验操作符合规范的是( )
A.测溶液的pH B.稀释浓硫酸 C.加热液体 D.取用液体试剂
【答案】B
11、柠檬酸(C6H8O7)是一种较强的有机酸,在水溶液中可以解离出来H+,从而呈现酸性,主要用于香料或作为饮料的酸化剂。下列物质不能与柠檬酸反应的是( )
A.Mg B.Fe2O3 C.CO2 D.NaOH
【答案】C
12、土壤的酸碱度会影响植物的生长。下列植物在微酸性土壤中,不适宜种植的是( )
植物 花生 苹果 西瓜 沙枣
适宜的pH范围 5.0~6.0 5.0~6.5 6.0~7.0 8.0~8.7
A.花生 B.苹果 C.西瓜 D.沙枣
【答案】D
*13、pH是水质监测的重要指标之一,下列水样酸性最强的是( )
A.pH=1.3的工业废水 B.pH=4.5的雨水
C.pH=7.0的蒸馏水 D.pH=7.3的矿泉水
【答案】A
14、下列实验操作正确的是( )
A.过滤 B.倾倒液体
C.蒸发食盐水 D.稀释浓硫酸
【答案】D
15、(双选)在托盘天平两盘上各放一只质量相同的烧杯,在两只烧杯里分别注入200g质量分数为7.3%的稀盐酸,天平平衡。向左盘烧杯中加入8g某碳酸钙和氧化钙组成的固体混合物,其钙元素质量分数为50%,充分反应。下列有关说法中,正确的是( )
A.左盘烧杯中可生成4.4g气体
B.充分反应后,左盘烧杯溶液中含有两种溶质
C.若向右盘烧杯中加入5.6g铁粉,天平重新平衡
D.若向右盘烧杯中加入5.6g质量分数为10%的硝酸银溶液,天平重新平衡
【答案】BD
二、填空题。
16、判断题。
(1)碱能使紫色石蕊试剂变成红色,能使无色酚酞溶液变红色。( )
(2)某溶液不能使酚酞溶液变色,但该溶液不一定显酸性( )
(3)氢氧化铜能够使指示剂变色。( )
(4)能使酚酞变红色的一定是碱。( )
(5)常用的酸碱指示剂有紫色石蕊试剂与无色酚酞试剂。( )
【答案】(1)错误 (2)正确 (3)错误 (4)错误 (5)正确
17、纽扣电池是生活中常用的电源,下图是银锌纽扣电池的构造示意图,回答下列问题。
(1)纽扣电池的外壳可以加工得很薄,说明金属具有_____性。
(2)氧化银加热分解可以得到两种单质,其化学反应方程式为_______。
(3)该电池中涉及的铁、锌、银三种金属,它们的金属活动性由强到弱的顺序是_____,为了验证该结论,某同学向质量、外形相同的铁片、锌片、银片中分别加入足量15%的稀盐酸,以下现象中不能成为该结论证据的是________(填序号)。
A 银表面没有气泡生成
B 铁表面最终生成气体的总量比锌多
C 铁表面产生气泡的速率比锌慢
【答案】(1) 延展性 (2) (3) 锌、铁、银 B
18、无土栽培是利用营养液栽培作物的一种方法。
(1)下列化学肥料中属于复合肥的是 (填序号);
①硝酸铵 ②磷酸二氢铵 ③硝酸钾 ④硫酸钾
(2)某同学要在实验室配制150g溶质质量分数为2%的硝酸钾溶液,需要硝酸钾的质量为 g。
【答案】 ②③;3
19、如果实验室没有pH试纸,又要测定未知溶液的酸碱性,可选用 试液来进行实验,该试液从 色变成 色,能确定其呈碱性。
【答案】无色酚酞 无 红
20、化学与我们的生产生活密切相关,请从下列物质中选择相应序号填空。
①稀盐酸②硝酸钾③碳酸钙④活性炭
(1)可用作补钙剂的是___________。
(2)可作复合肥料的是___________。
(3)可用作冰箱除味剂的是___________。
(4)可用于金属表面除锈的是___________。
【答案】③ ② ④ ①
21、某同学将一朵紫色牵牛花泡在石灰水里,牵牛花很快就变成了蓝色,又将牵牛花泡在稀盐酸中,牵牛花又变成了红色,请你根据以上实验现象回答:
(1)该同学将紫色牵牛花泡在肥皂水里,牵牛花很快就变成了蓝色,据此可推断肥皂水显_____(填“酸性”或“碱性”)。
(2)该牵牛花的汁液_____(填“能”或“不能”)用作指示剂。
【答案】碱性 能
22、青岛市公交车上常悬挂一块警示牌,“严禁携带易燃易爆、化学危险品上车!”下面列举了各种禁带物品:白磷、油纸、镁、汽油、酒精、硫酸、过氧化氢、烧碱、炸药、烟花炮竹……请从上述物质中选择合适的物质,将其化学式填写在下列空格中。
(1)一种银白色的金属_____。
(2)一种在空气中易自燃的单质_____。
(3)一种浓溶液具有吸水性的酸_____。
(4)一种可溶性碱_____。
【答案】(1) (2) (3)
23、化肥对提高农作物的产量具有重要作用,但不合理使用会带来很多环境问题。
(1)化肥对环境造成______等不良影响。
(2)对合理使用化肥提出两点合理化建议分别是______、______。
【答案】土壤污染、水体污染(合理即可) 测土配方施肥 增加有机肥料的使用改善土壤结构
三、综合应用题。
24、在实验室里,可用如图装置进行CO还原Fe2O3的实验,并检验该反应的气体生成物。已知由一氧化碳发生装置得到的CO中混有CO2和H2O。
(1)写出装置C处尾气处理的方法______ (写一种即可);A装置中有关反应的化学方程式______ 。(写出一个即可)
(2)检验CO还原Fe2O3反应的气体生成物的现象是什么?
______ 。
(3)实验后取A中固体溶于水,滴加酚酞溶液,溶液变红色,请分析可能的原因:______ 。
(4)某钢铁厂用赤铁矿石炼铁。若该厂每天需消耗6000t含氧化铁80%的赤铁矿石,则理论上可日产含铁96%的生铁的质量是多少?(写出计算过程)
【答案】(1) 加一个燃着的酒精灯或绑一个气球
或 或
(2)C处澄清石灰水变浑浊
(3)氢氧化钠、氢氧化钙、碳酸钠溶液均显碱性,均能使无色酚酞试液变色
(4)解:设理论上可日产含铁96%的生铁的质量是x
x=3500t
答:理论上可日产含铁96%的生铁的质量是3500t。
25、酸碱盐种类繁多,与人类日常生活和工农业生产关系十分密切。
(1)酸具有相似的性质,因为不同的酸在水溶液中都能解离出______。
(2)检验敞口放置的氢氧化钠溶液是否变质,可以选用的一种试剂是_____。
(3)利用数字化实验设备,测定盐酸与氢氧化钠溶液反应时溶液pH变化,实验结果如图,当滴入溶液为V2mL时,所得溶液中溶质化学式为_______,所得溶液能使紫色石蕊溶液变成_____色。
(4)氯化钠是生活中常见的盐,为除去某粗盐水中的MgCl、CaCl2杂质,得到NaCl溶液,某化学小组设计了如下实验方案。
①过滤操作中所用到的玻璃仪器有烧杯、漏斗和____________.
②以上方案中有关反应的化学方程式为__________ (写一个即可)
③写出溶液乙中含有的杂质,并将以上方案补充完整_______。
(5)某实验室用40g、20%的NaOH溶液洗涤一定量石油产品中残余的H2SO4,消耗NaOH溶液呈中性,请计算该一定量石油产品H2SO4的质量________。
【答案】(1)H+ 稀盐酸(或者稀硫酸、BaCl2溶液,CaCl2溶液等)
(3)HCl、NaCl 红
(4)①玻璃棒 ②Ba(OH)2 +MgSO4=BaSO4↓+Mg(OH)2↓
【或者Ba(OH)2 +Na2CO3=BaCO3↓+2NaOH
或者CaCl2 +Na2CO3= CaCO3↓+2NaCl】
③Na2CO3和NaOH在溶液乙中加入适量稀盐酸 (5)9.8g
四、计算题。
26、造纸厂会产生含氢氧化钠的废水,需经处理呈中性后排放。为测定此废水中氢氧化钠的质量分数,小明取40 g废水样品加入到锥形瓶中,逐滴加入10%的稀硫酸,至恰好完全反应时,消耗稀硫酸49 g。计算废水中氢氧化钠的质量分数。
【答案】10%
