化学沪教版九下参考课件:6.2 溶液组成的表示(第2课时溶质质量分数)(共22张PPT)
文档属性
| 名称 | 化学沪教版九下参考课件:6.2 溶液组成的表示(第2课时溶质质量分数)(共22张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-13 00:00:00 | ||
图片预览








文档简介
(共22张PPT)
第二节 溶液组成的表示
(第2课时)
你认为溶液的
浓稀的变化由什么来决定
想一想
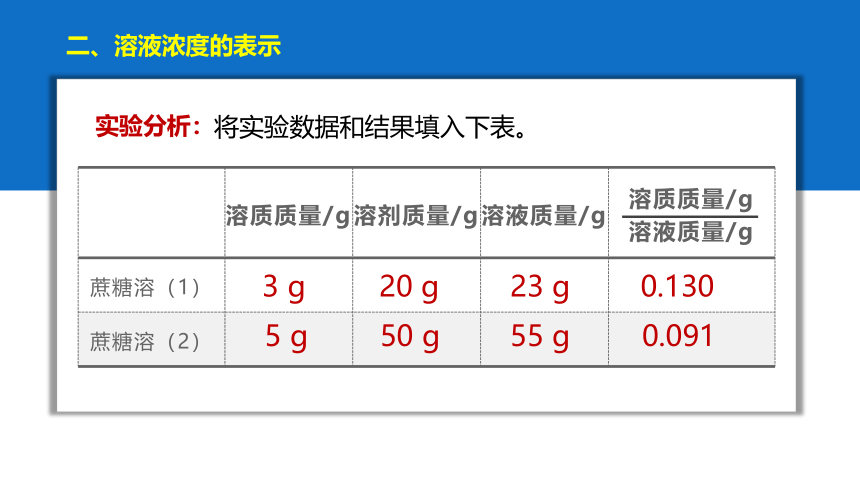
二、溶液浓度的表示
活动与探究:在常温下配置下列溶液
实验1: 3 g 蔗糖 + 20 mL水
实验2: 5 g 蔗糖 + 50 mL 水
二、溶液浓度的表示
将实验数据和结果填入下表。
实验分析:
溶质质量/g 溶剂质量/g 溶液质量/g 溶质质量/g
溶液质量/g
蔗糖溶(1)
蔗糖溶(2)
3 g
20 g
23 g
5 g
50 g
55 g
0.130
0.091
二、溶液浓度的表示
溶质的质量分数
定义:溶质质量与溶液质量的百分比(常用百分数表示)
=
m质
ρ溶液V溶液
×100%
溶液的溶质质量分数 =
溶质质量
溶液质量
× 100%
溶质质量
溶质质量+溶剂质量
× 100%
=
判断对错
对溶质质量分数为10%的氯化钠溶液理解是否正确
每100 g水中溶有10 g氯化钠 ( )
每100 g溶液中溶有10 g氯化钠 ( )
溶质和溶剂的质量比为1:9 ( )
溶质和溶液的质量比为1:10 ( )
从中取出一半后溶质质量分数为5%( )
√
√
√
二、溶液浓度的表示
例题1:实验室现需配制一定溶质质量分数的蔗糖溶液,现将8 g 的蔗糖固体,全部溶解在 92 mL的水中 ,最终得到的蔗糖溶液的溶质中量分数是多少?
解:溶液的溶质质量分数( ω )=
8 g
8 g+92 g
×100%=8%
答:所得氢氧化钠溶液的溶质质量分数是8%
二、溶液浓度的表示
例题2:20℃时,100 g水最多溶解NaCl36 g,现将20 gNaCl加入50 g水中,充分搅拌后,溶质质量为 ,溶液质量为 ,溶质质量分数为 。
18 g
68 g
26.5%
强调:1.溶质质量是指被溶解的物质质量,
不一定等于加入的物质质量。
2.溶质的质量分数越大,溶液越浓。
1. 10%的食盐溶液和15%的食盐溶液谁浓度大?
15%的浓
2. 将10%的食盐溶液倒出一半,溶质质量分数为多少?
10%
3. 100 g40%的蔗糖水与500 g40%的蔗糖水混合后,
所得溶液的溶质质量分数为多少?
40%
判断
20%的食盐溶液比10%的食盐溶液所含的溶质多( )
×
判断过程:
10 g 20%的食盐溶液中溶质质量为 ( )
1000 g 10%的食盐溶液中溶质质量为( )
2 g
100 g
二、溶液浓度的表示
溶质质量=
溶液质量
溶质质量
溶液质量
×100%
溶质质量分数=
2.根据公式变形的计算
溶液质量=
溶质质量
× 溶质质量分数
÷ 溶质质量分数
练习
ω(NaCl)
m(NaCl)=
m(溶液)
×
100 g × 16%
=100 g-16 g
解: m(NaCl)=
=16 g
m(水)
= 84 g
1. 欲配制100 g16%的氯化钠溶液为标准选种液,
加入的氯化钠的质量多少克?水多少克?
分析:
二、溶液浓度的表示
3.溶液稀释的计算
100 g 质量分数为98%的浓硫酸中溶质质量为多少?
若与100 g水混合后溶质质量为多少?求混合后溶质的质量分数?
(1)依据溶液稀释前后,溶质质量不变,
(2)加入水的质量 = 稀溶液质量 - 浓溶液质量
归纳总结
m浓ω浓 = m稀ω稀
配制消毒液换算公式
50 g 98%
? 20 %
50 g98%的浓硫酸加水稀释成20%的稀硫酸,求稀硫酸的质量为多少?需要加水多少克
解:设稀硫酸质量为m
50 g × 98% = m × 20%
加水 245 g-50 g=195 g
m= 245 g
答:稀硫酸的质量为245 g,
需要加水的质量为195 g。
例题
课本13页
练习
解:设稀硫酸质量为m。
用 98% 的浓硫酸10 mL( 密度 1.84 g·mL-1)
配制 10% 的硫酸溶液,需要水多少毫升?
10 mL × 1.84 g/mL × 98% = m × 20%
加水 90.16 g – 10 mL × 1.84 g/mL =71.76 g
m= 90.16 g
答:需要加水的质量为71.76 g。
课本第15页
第5题
ω 的几种变化
取100 g的5%的氯化钠溶液,若将其溶质质量分数变为16%的标准选种液,应如何操作?
浓度变大:加入氯化钠或蒸发水分
加入氯化钠固体多少克
或者是蒸发水分多少克?
练习
取100 g的5%的氯化钠溶液,若将其溶质质量分数变为16%的标准选种液,应如何操作?
=16%
m(NaCl) =13.1 g
加入氯化钠固体多少克
5 g
100 g- m(水)
×100%
=16%
m(水)=68.75 g
当溶质质量发生变化,溶液的质量也要发生变化
蒸发水分多少克?
5 g + m(NaCl)
100 g+m(NaCl)
×100%
ω 的几种变化
1.ω减小为原来的一半
10 g NaCl → 90 g H2O
10%
5%
10 g NaCl → 90 g H2O + H2O
加溶剂
=原溶液的质量
100 g
ω 的几种变化
2.ω增大为原来的2倍
10 g NaCl → 90 g H2O
10%
20%
10 g NaCl → 90 g H2O + NaCl
加溶质
>原溶液的质量
ω 的几种变化
2.ω增大为原来的2倍
10 g NaCl → 90 g H2O
10%
20%
10 g NaCl → 90 g H2O - H2O
蒸发溶剂
=原溶液质量的
练习:把100 g 10%的KNO3溶液的ω提高到20%可采用的方法是( )
A. 蒸发掉45 g H2O B. 蒸发掉50 gH2O
C. 加入10 gKNO3 D. 加入15 gKNO3晶体
第二节 溶液组成的表示
(第2课时)
你认为溶液的
浓稀的变化由什么来决定
想一想
二、溶液浓度的表示
活动与探究:在常温下配置下列溶液
实验1: 3 g 蔗糖 + 20 mL水
实验2: 5 g 蔗糖 + 50 mL 水
二、溶液浓度的表示
将实验数据和结果填入下表。
实验分析:
溶质质量/g 溶剂质量/g 溶液质量/g 溶质质量/g
溶液质量/g
蔗糖溶(1)
蔗糖溶(2)
3 g
20 g
23 g
5 g
50 g
55 g
0.130
0.091
二、溶液浓度的表示
溶质的质量分数
定义:溶质质量与溶液质量的百分比(常用百分数表示)
=
m质
ρ溶液V溶液
×100%
溶液的溶质质量分数 =
溶质质量
溶液质量
× 100%
溶质质量
溶质质量+溶剂质量
× 100%
=
判断对错
对溶质质量分数为10%的氯化钠溶液理解是否正确
每100 g水中溶有10 g氯化钠 ( )
每100 g溶液中溶有10 g氯化钠 ( )
溶质和溶剂的质量比为1:9 ( )
溶质和溶液的质量比为1:10 ( )
从中取出一半后溶质质量分数为5%( )
√
√
√
二、溶液浓度的表示
例题1:实验室现需配制一定溶质质量分数的蔗糖溶液,现将8 g 的蔗糖固体,全部溶解在 92 mL的水中 ,最终得到的蔗糖溶液的溶质中量分数是多少?
解:溶液的溶质质量分数( ω )=
8 g
8 g+92 g
×100%=8%
答:所得氢氧化钠溶液的溶质质量分数是8%
二、溶液浓度的表示
例题2:20℃时,100 g水最多溶解NaCl36 g,现将20 gNaCl加入50 g水中,充分搅拌后,溶质质量为 ,溶液质量为 ,溶质质量分数为 。
18 g
68 g
26.5%
强调:1.溶质质量是指被溶解的物质质量,
不一定等于加入的物质质量。
2.溶质的质量分数越大,溶液越浓。
1. 10%的食盐溶液和15%的食盐溶液谁浓度大?
15%的浓
2. 将10%的食盐溶液倒出一半,溶质质量分数为多少?
10%
3. 100 g40%的蔗糖水与500 g40%的蔗糖水混合后,
所得溶液的溶质质量分数为多少?
40%
判断
20%的食盐溶液比10%的食盐溶液所含的溶质多( )
×
判断过程:
10 g 20%的食盐溶液中溶质质量为 ( )
1000 g 10%的食盐溶液中溶质质量为( )
2 g
100 g
二、溶液浓度的表示
溶质质量=
溶液质量
溶质质量
溶液质量
×100%
溶质质量分数=
2.根据公式变形的计算
溶液质量=
溶质质量
× 溶质质量分数
÷ 溶质质量分数
练习
ω(NaCl)
m(NaCl)=
m(溶液)
×
100 g × 16%
=100 g-16 g
解: m(NaCl)=
=16 g
m(水)
= 84 g
1. 欲配制100 g16%的氯化钠溶液为标准选种液,
加入的氯化钠的质量多少克?水多少克?
分析:
二、溶液浓度的表示
3.溶液稀释的计算
100 g 质量分数为98%的浓硫酸中溶质质量为多少?
若与100 g水混合后溶质质量为多少?求混合后溶质的质量分数?
(1)依据溶液稀释前后,溶质质量不变,
(2)加入水的质量 = 稀溶液质量 - 浓溶液质量
归纳总结
m浓ω浓 = m稀ω稀
配制消毒液换算公式
50 g 98%
? 20 %
50 g98%的浓硫酸加水稀释成20%的稀硫酸,求稀硫酸的质量为多少?需要加水多少克
解:设稀硫酸质量为m
50 g × 98% = m × 20%
加水 245 g-50 g=195 g
m= 245 g
答:稀硫酸的质量为245 g,
需要加水的质量为195 g。
例题
课本13页
练习
解:设稀硫酸质量为m。
用 98% 的浓硫酸10 mL( 密度 1.84 g·mL-1)
配制 10% 的硫酸溶液,需要水多少毫升?
10 mL × 1.84 g/mL × 98% = m × 20%
加水 90.16 g – 10 mL × 1.84 g/mL =71.76 g
m= 90.16 g
答:需要加水的质量为71.76 g。
课本第15页
第5题
ω 的几种变化
取100 g的5%的氯化钠溶液,若将其溶质质量分数变为16%的标准选种液,应如何操作?
浓度变大:加入氯化钠或蒸发水分
加入氯化钠固体多少克
或者是蒸发水分多少克?
练习
取100 g的5%的氯化钠溶液,若将其溶质质量分数变为16%的标准选种液,应如何操作?
=16%
m(NaCl) =13.1 g
加入氯化钠固体多少克
5 g
100 g- m(水)
×100%
=16%
m(水)=68.75 g
当溶质质量发生变化,溶液的质量也要发生变化
蒸发水分多少克?
5 g + m(NaCl)
100 g+m(NaCl)
×100%
ω 的几种变化
1.ω减小为原来的一半
10 g NaCl → 90 g H2O
10%
5%
10 g NaCl → 90 g H2O + H2O
加溶剂
=原溶液的质量
100 g
ω 的几种变化
2.ω增大为原来的2倍
10 g NaCl → 90 g H2O
10%
20%
10 g NaCl → 90 g H2O + NaCl
加溶质
>原溶液的质量
ω 的几种变化
2.ω增大为原来的2倍
10 g NaCl → 90 g H2O
10%
20%
10 g NaCl → 90 g H2O - H2O
蒸发溶剂
=原溶液质量的
练习:把100 g 10%的KNO3溶液的ω提高到20%可采用的方法是( )
A. 蒸发掉45 g H2O B. 蒸发掉50 gH2O
C. 加入10 gKNO3 D. 加入15 gKNO3晶体
