化学九年级下册同步测试:7.2.2 常见的碱(有答案)
文档属性
| 名称 | 化学九年级下册同步测试:7.2.2 常见的碱(有答案) |  | |
| 格式 | doc | ||
| 文件大小 | 675.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-13 11:14:30 | ||
图片预览


文档简介
第七章 应用广泛的酸、碱、盐
7.2.2 常见的碱
一、单选题(共13题;共26分)
1.下列关于酸、碱的说法错误的是( )
A. 苛性钠、烧碱、火碱都是氢氧化钠 B. 氢氧化钙可以用来改良酸性土壤
C. 稀盐酸能够使酚酞溶液变红 D. 生活中许多常见的物质(如柠檬、柑橘)中含有酸
2.下列关于氢氧化钠的描述中不正确是( )
A. 可用于改良酸性土壤 B. 易溶于水,溶解时放出大量的热
C. 能去除油污,可作炉具清洁剂 D. 对皮肤有强烈的腐独作用
3.现有盐酸和氯化铜的混合溶液,向其中逐滴滴入氢氧化钠溶液,生成沉淀质量与滴入氢氧化钠溶液质量的变化关系如图所示。以下说法正确的是( )
滴加氢氧化钠溶液的质量至ag时,溶液中含有两种溶质
滴加氢氧化钠溶液的质量为m(b g<m<c g),此时溶液中发生的化学反应为CuCl2+2NaOH═ Cu(OH)2↓+2NaCl
滴加氢氧化钠溶液的质量至d g时,溶液pH>7
④ 在滴加氢氧化钠溶液的整个过程中,溶液中氯元素的质量先减小后不变
A. ②③ B. ①②③ C. ③④ D. ②③④
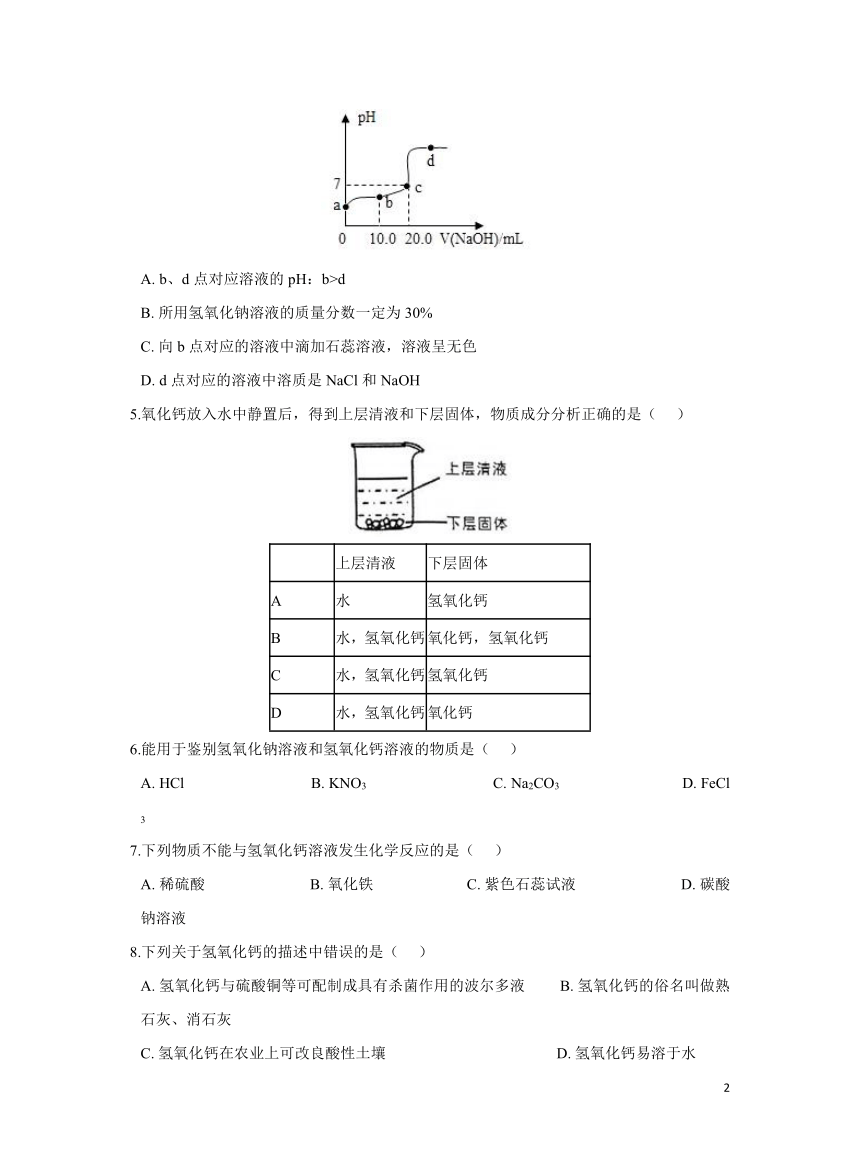
4.25℃时,向20.0 mL质量分数为30%的盐酸中滴加氢氧化钠溶液,溶液的pH与所加氢氧化钠溶液的体积如图所示。下列有关叙述正确的是( )
A. b、d点对应溶液的pH:b>d
B. 所用氢氧化钠溶液的质量分数一定为30%
C. 向b点对应的溶液中滴加石蕊溶液,溶液呈无色
D. d点对应的溶液中溶质是NaCl和NaOH
5.氧化钙放入水中静置后,得到上层清液和下层固体,物质成分分析正确的是( )
上层清液 下层固体
A 水 氢氧化钙
B 水,氢氧化钙 氧化钙,氢氧化钙
C 水,氢氧化钙 氢氧化钙
D 水,氢氧化钙 氧化钙
6.能用于鉴别氢氧化钠溶液和氢氧化钙溶液的物质是( )
A. HCl B. KNO3 C. Na2CO3 D. FeCl3
7.下列物质不能与氢氧化钙溶液发生化学反应的是( )
A. 稀硫酸 B. 氧化铁 C. 紫色石蕊试液 D. 碳酸钠溶液
8.下列关于氢氧化钙的描述中错误的是( )
A. 氢氧化钙与硫酸铜等可配制成具有杀菌作用的波尔多液 B. 氢氧化钙的俗名叫做熟石灰、消石灰
C. 氢氧化钙在农业上可改良酸性土壤 D. 氢氧化钙易溶于水
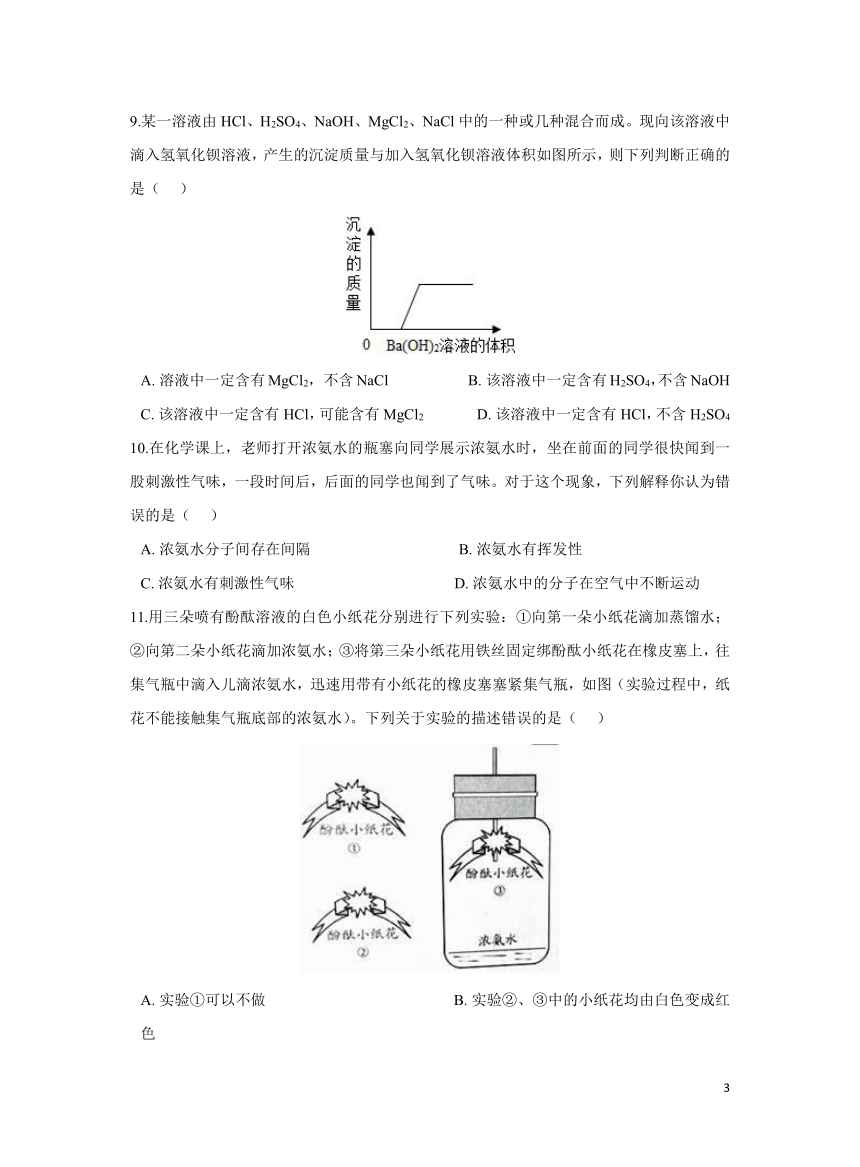
9.某一溶液由HCl、H2SO4、NaOH、MgCl2、NaCl中的一种或几种混合而成。现向该溶液中滴入氢氧化钡溶液,产生的沉淀质量与加入氢氧化钡溶液体积如图所示,则下列判断正确的是( )
A. 溶液中一定含有MgCl2, 不含NaCl B. 该溶液中一定含有H2SO4,不含NaOH
C. 该溶液中一定含有HCl,可能含有MgCl2 D. 该溶液中一定含有HCl,不含H2SO4
10.在化学课上,老师打开浓氨水的瓶塞向同学展示浓氨水时,坐在前面的同学很快闻到一股刺激性气味,一段时间后,后面的同学也闻到了气味。对于这个现象,下列解释你认为错误的是( )
A. 浓氨水分子间存在间隔 B. 浓氨水有挥发性
C. 浓氨水有刺激性气味 D. 浓氨水中的分子在空气中不断运动
11.用三朵喷有酚酞溶液的白色小纸花分别进行下列实验:①向第一朵小纸花滴加蒸馏水;②向第二朵小纸花滴加浓氨水;③将第三朵小纸花用铁丝固定绑酚酞小纸花在橡皮塞上,往集气瓶中滴入儿滴浓氨水,迅速用带有小纸花的橡皮塞塞紧集气瓶,如图(实验过程中,纸花不能接触集气瓶底部的浓氨水)。下列关于实验的描述错误的是( )
A. 实验①可以不做 B. 实验②、③中的小纸花均由白色变成红色
C. 本实验能说明浓氨水具有挥发性 D. 本实验能说明氨分子在不断运动
12.取一滤纸条,等间距滴入10滴紫色石蕊溶液,装入玻璃管中,然后从玻璃管的两端同时放入分别蘸有浓氨水和浓盐酸的棉球,并迅速封闭两端管口,很快可观察到管内有白烟产生,待白烟消失后还可观察到如下图所示的现象。
则下列说法中正确的是( )
A. 氨水和盐酸都属于易挥发性物质 B. 该过程中没有化学反应发生
C. 所有气体分子的运动速率都相同 D. 图示黑点表示石蕊溶液变成了红色
13.小华将一张滤纸在某示剂中浸泡后晾干,用蘸有氢氧化钠溶液的玻璃棒在上面写“化学”两字,立刻显红色。再将其悬挂于铁架台上,并在滤纸的下方(如图)放置一个盛有某溶液的烧杯,过一会儿,发现红色的字消失,则滤纸上的指示剂和烧杯中的溶液分别是( )
A B C D
滤纸上的指示剂 酚酞溶液 酚酞溶液 石蕊溶液 石蕊溶液
烧杯中的溶液 浓氨水 浓盐酸 浓氨水 浓盐酸
二、填空题(共2题;共9分)
14.小明为探究酸、碱、盐的化学性质,做了如下实验:
(1)实验后液体颜色变红的是________(填试管编号)。
(2)反应后试管C溶液中一定有的阳离子是________(写离子符号)。
(3)小明把试管D、E反应后的液体倒入一个洁净的烧杯中,观察到只有白色沉淀生成,过滤后得到白色沉淀和无色滤液,小明分别对试管D、E反应时的反应物用量有如下描述,正确的是______
A.试管D:氢氧化钙溶液一定过量 B.试管D:稀盐酸一定不足
C.试管E:碳酸钠溶液一定过量 D.试管E:稀盐酸一定不足
15.请根据酸、碱、盐的相关知识,回答下列问题:
(1)农业上常用于改良酸性土壤的一种碱是________。
(2)胃液中含有适量的盐酸。由于胃酸过多而引起的胃痛,可服用含有Mg(OH)2的药物来中和过多的胃酸,发生反应的化学方程式为 。
(3)用水鉴别NaOH、NaCl、CaCO3三种固体物质时,能够鉴别出NaOH固体所依据的现象是 。
(4)探究稀盐酸、Na2CO3溶液、Ca(OH)2溶液之间能否发生化学反应时,将所有废液 倒入同一洁净烧杯中。除指示剂外,最终烧杯中一定含有的一种溶质是________。
三、实验探究题(共3题;共21分)
16.某化学实验小组的同学们开展了如下有关碱的化学性质的探究活动。
(1)实验探究一:
实验一中产生的实验现象是 。
(2)实验结束后,同学们将实验二中的溶液过滤后与实验一和实验三试管内溶液一起倒入一个废液缸中,并对废液缸中的离子成分进行探究。
(提出问题)废液缸中的离子成分是什么?
(猜想与假设)大家根据混合后图像所示进行了如下猜想:
猜想1:Na+、C1- 猜想2:Na+、Cl-、SO42-
猜想3:Na+、Cl-、SO42-、H+ 猜想4:Na+、Cl-、Ba2+、OH-
(交流与评价)通过分析你认为猜想________是错误的(填序号),理由是 。
(3)经过同学们的实验研究,最终确定猜想2是正确的。
实验探究二:萧萧同学又针对此实验结论提出了一个新的问题:如何证明溶液中两种阴离子同时存在呢?
红红同学经过思考后设计了一个实验方案:取废液缸中上层清液少许于试管内,加入________后过滤,向滤液中再加入________,根据实验现象即可确定溶液中同时存在两种阴离子。
(归纳与总结)通过红红的实验,我们可以总结出“证明两种离子同时存在”的方法:首先证明________存在,并将其除去,然后再检验另一种离子存在即可达到实验目的。
17.某化学兴趣小组在学习碱的化学性质时,进行了如图所示的实验。
(1)图1实验中没有观察到明显现象。若先向氢氧化钠溶液中加入酚酞试液,再逐滴滴加稀硫酸,观察到_______ _的现象时,证明稀硫酸与氢氧化钠溶液确实发生了化学反应。
(2)图2反应的化学方程式是 ,该反应的基本类型是________反应。
(3)图3实验目的是探究二氧化碳与氢氧化钠溶液能发生化学反应。将注射器中的溶液推入充满二氧化碳的瓶中,反应的化学方程式是 ,出现的现象是 。
小方认为此实验设计不够完善,他对实验方案进一步改进,能充分证明二氧化碳确实能与氢氧化钠发生化学反应。
(方案1)增加对比实验:用同样的装置,将氢氧化钠溶液换成________。
(方案2)取反应后的液体少许于试管中,滴加足量的稀盐酸,出现的现象是 。(4)实验结束后,小华同学将图l、图2两个实验试管中的物质全部倒入同一个洁净的废液缸中,静置后,发现废液缸中有蓝色沉淀,上层清液呈蓝色,他判断该蓝色清液中一定含有的溶质是________。
18.某同学发现,上个月做实验用的氢氧化钠溶液忘记了盖瓶盖。对于该溶液是否变质,同学们进行了以下探究:
(1)(提出问题)氢氧化钠溶液是否变质?变质程度如何?
(做出猜想)猜想一:氢氧化钠溶液未变质
猜想二:氢氧化钠溶液完全变质
猜想三: 。
(2)(设计实验)请完成实验报告
实验步骤 实验现象 实验结论
①取少量溶液于试管中,加入________,充分反应。 ________ 猜想二成立
②将步骤①试管中的物质过滤,向滤液中加入________。 无明显现象
(3)(反思拓展)
①氢氧化钠溶液变质的原因 (用化学方程式表示),氢氧化钠溶液应________保存。
②分别取两份完全变质的氢氧化钠溶液样品于试管中,向其中一份加入盐酸有气泡产生,另一份加入氢氧化钙溶液有白色沉淀产生,然后将两支试管中所有物质一起倒入废液缸中,得到无色澄清溶液,所得溶液中溶质一定有________。
参考答案
一、单选题
1.C 2.A 3. A 4.D 5.C 6.C 7.B 8.D 9.D 10.A 11.A 12.A 13.B
二、填空题(共2题;共9分)
14.【答案】 (1)A (2)Fe3+ (3)C D
15.【答案】 (1)氢氧化钙[或熟石灰、消石灰、Ca(OH)2] (2)
(3)溶解时放出大量的热(或溶液温度升高) (4)氯化钠(或NaCl)
三、实验探究题(共3题;共21分)
16.【答案】 (1)溶液由无色变为红色
(2)3;根据图像,实验一中的氢氧化钠先与实验三中剩余的稀盐酸反应并将其耗尽,再与实验二中剩余的硫酸铜反应,所以溶液中一定没有HC1,所以一定没有H+
(3)足量硝酸钡溶液;硝酸银溶液;对后面待检验的离子有干扰的离子
17.【答案】 (1)溶液由红色变为无色 (2)CuSO4+2NaOH=Cu(OH)2↓+Na2SO4;复分解
(3)CO2+2NaOH=Na2CO3+H2O;气球体积变大;水;溶液红有气泡产生,胀大的气球被压瘪为原状
(4)硫酸铜、硫酸钠
18.【答案】 (1)氢氧化钠溶液部分变质
(2)加入足量(或过量)的氯化钙溶液(或可溶性钙盐、钡盐溶液)(合理即可);产生白色沉淀(或产生白色浑浊);酚酞溶液(或可溶性铜盐、铁盐、镁盐溶液、石蕊溶液)(合理即可)
(3);密封;氯化钠、氯化钙(或NaCl、CaC12)
1
7.2.2 常见的碱
一、单选题(共13题;共26分)
1.下列关于酸、碱的说法错误的是( )
A. 苛性钠、烧碱、火碱都是氢氧化钠 B. 氢氧化钙可以用来改良酸性土壤
C. 稀盐酸能够使酚酞溶液变红 D. 生活中许多常见的物质(如柠檬、柑橘)中含有酸
2.下列关于氢氧化钠的描述中不正确是( )
A. 可用于改良酸性土壤 B. 易溶于水,溶解时放出大量的热
C. 能去除油污,可作炉具清洁剂 D. 对皮肤有强烈的腐独作用
3.现有盐酸和氯化铜的混合溶液,向其中逐滴滴入氢氧化钠溶液,生成沉淀质量与滴入氢氧化钠溶液质量的变化关系如图所示。以下说法正确的是( )
滴加氢氧化钠溶液的质量至ag时,溶液中含有两种溶质
滴加氢氧化钠溶液的质量为m(b g<m<c g),此时溶液中发生的化学反应为CuCl2+2NaOH═ Cu(OH)2↓+2NaCl
滴加氢氧化钠溶液的质量至d g时,溶液pH>7
④ 在滴加氢氧化钠溶液的整个过程中,溶液中氯元素的质量先减小后不变
A. ②③ B. ①②③ C. ③④ D. ②③④
4.25℃时,向20.0 mL质量分数为30%的盐酸中滴加氢氧化钠溶液,溶液的pH与所加氢氧化钠溶液的体积如图所示。下列有关叙述正确的是( )
A. b、d点对应溶液的pH:b>d
B. 所用氢氧化钠溶液的质量分数一定为30%
C. 向b点对应的溶液中滴加石蕊溶液,溶液呈无色
D. d点对应的溶液中溶质是NaCl和NaOH
5.氧化钙放入水中静置后,得到上层清液和下层固体,物质成分分析正确的是( )
上层清液 下层固体
A 水 氢氧化钙
B 水,氢氧化钙 氧化钙,氢氧化钙
C 水,氢氧化钙 氢氧化钙
D 水,氢氧化钙 氧化钙
6.能用于鉴别氢氧化钠溶液和氢氧化钙溶液的物质是( )
A. HCl B. KNO3 C. Na2CO3 D. FeCl3
7.下列物质不能与氢氧化钙溶液发生化学反应的是( )
A. 稀硫酸 B. 氧化铁 C. 紫色石蕊试液 D. 碳酸钠溶液
8.下列关于氢氧化钙的描述中错误的是( )
A. 氢氧化钙与硫酸铜等可配制成具有杀菌作用的波尔多液 B. 氢氧化钙的俗名叫做熟石灰、消石灰
C. 氢氧化钙在农业上可改良酸性土壤 D. 氢氧化钙易溶于水
9.某一溶液由HCl、H2SO4、NaOH、MgCl2、NaCl中的一种或几种混合而成。现向该溶液中滴入氢氧化钡溶液,产生的沉淀质量与加入氢氧化钡溶液体积如图所示,则下列判断正确的是( )
A. 溶液中一定含有MgCl2, 不含NaCl B. 该溶液中一定含有H2SO4,不含NaOH
C. 该溶液中一定含有HCl,可能含有MgCl2 D. 该溶液中一定含有HCl,不含H2SO4
10.在化学课上,老师打开浓氨水的瓶塞向同学展示浓氨水时,坐在前面的同学很快闻到一股刺激性气味,一段时间后,后面的同学也闻到了气味。对于这个现象,下列解释你认为错误的是( )
A. 浓氨水分子间存在间隔 B. 浓氨水有挥发性
C. 浓氨水有刺激性气味 D. 浓氨水中的分子在空气中不断运动
11.用三朵喷有酚酞溶液的白色小纸花分别进行下列实验:①向第一朵小纸花滴加蒸馏水;②向第二朵小纸花滴加浓氨水;③将第三朵小纸花用铁丝固定绑酚酞小纸花在橡皮塞上,往集气瓶中滴入儿滴浓氨水,迅速用带有小纸花的橡皮塞塞紧集气瓶,如图(实验过程中,纸花不能接触集气瓶底部的浓氨水)。下列关于实验的描述错误的是( )
A. 实验①可以不做 B. 实验②、③中的小纸花均由白色变成红色
C. 本实验能说明浓氨水具有挥发性 D. 本实验能说明氨分子在不断运动
12.取一滤纸条,等间距滴入10滴紫色石蕊溶液,装入玻璃管中,然后从玻璃管的两端同时放入分别蘸有浓氨水和浓盐酸的棉球,并迅速封闭两端管口,很快可观察到管内有白烟产生,待白烟消失后还可观察到如下图所示的现象。
则下列说法中正确的是( )
A. 氨水和盐酸都属于易挥发性物质 B. 该过程中没有化学反应发生
C. 所有气体分子的运动速率都相同 D. 图示黑点表示石蕊溶液变成了红色
13.小华将一张滤纸在某示剂中浸泡后晾干,用蘸有氢氧化钠溶液的玻璃棒在上面写“化学”两字,立刻显红色。再将其悬挂于铁架台上,并在滤纸的下方(如图)放置一个盛有某溶液的烧杯,过一会儿,发现红色的字消失,则滤纸上的指示剂和烧杯中的溶液分别是( )
A B C D
滤纸上的指示剂 酚酞溶液 酚酞溶液 石蕊溶液 石蕊溶液
烧杯中的溶液 浓氨水 浓盐酸 浓氨水 浓盐酸
二、填空题(共2题;共9分)
14.小明为探究酸、碱、盐的化学性质,做了如下实验:
(1)实验后液体颜色变红的是________(填试管编号)。
(2)反应后试管C溶液中一定有的阳离子是________(写离子符号)。
(3)小明把试管D、E反应后的液体倒入一个洁净的烧杯中,观察到只有白色沉淀生成,过滤后得到白色沉淀和无色滤液,小明分别对试管D、E反应时的反应物用量有如下描述,正确的是______
A.试管D:氢氧化钙溶液一定过量 B.试管D:稀盐酸一定不足
C.试管E:碳酸钠溶液一定过量 D.试管E:稀盐酸一定不足
15.请根据酸、碱、盐的相关知识,回答下列问题:
(1)农业上常用于改良酸性土壤的一种碱是________。
(2)胃液中含有适量的盐酸。由于胃酸过多而引起的胃痛,可服用含有Mg(OH)2的药物来中和过多的胃酸,发生反应的化学方程式为 。
(3)用水鉴别NaOH、NaCl、CaCO3三种固体物质时,能够鉴别出NaOH固体所依据的现象是 。
(4)探究稀盐酸、Na2CO3溶液、Ca(OH)2溶液之间能否发生化学反应时,将所有废液 倒入同一洁净烧杯中。除指示剂外,最终烧杯中一定含有的一种溶质是________。
三、实验探究题(共3题;共21分)
16.某化学实验小组的同学们开展了如下有关碱的化学性质的探究活动。
(1)实验探究一:
实验一中产生的实验现象是 。
(2)实验结束后,同学们将实验二中的溶液过滤后与实验一和实验三试管内溶液一起倒入一个废液缸中,并对废液缸中的离子成分进行探究。
(提出问题)废液缸中的离子成分是什么?
(猜想与假设)大家根据混合后图像所示进行了如下猜想:
猜想1:Na+、C1- 猜想2:Na+、Cl-、SO42-
猜想3:Na+、Cl-、SO42-、H+ 猜想4:Na+、Cl-、Ba2+、OH-
(交流与评价)通过分析你认为猜想________是错误的(填序号),理由是 。
(3)经过同学们的实验研究,最终确定猜想2是正确的。
实验探究二:萧萧同学又针对此实验结论提出了一个新的问题:如何证明溶液中两种阴离子同时存在呢?
红红同学经过思考后设计了一个实验方案:取废液缸中上层清液少许于试管内,加入________后过滤,向滤液中再加入________,根据实验现象即可确定溶液中同时存在两种阴离子。
(归纳与总结)通过红红的实验,我们可以总结出“证明两种离子同时存在”的方法:首先证明________存在,并将其除去,然后再检验另一种离子存在即可达到实验目的。
17.某化学兴趣小组在学习碱的化学性质时,进行了如图所示的实验。
(1)图1实验中没有观察到明显现象。若先向氢氧化钠溶液中加入酚酞试液,再逐滴滴加稀硫酸,观察到_______ _的现象时,证明稀硫酸与氢氧化钠溶液确实发生了化学反应。
(2)图2反应的化学方程式是 ,该反应的基本类型是________反应。
(3)图3实验目的是探究二氧化碳与氢氧化钠溶液能发生化学反应。将注射器中的溶液推入充满二氧化碳的瓶中,反应的化学方程式是 ,出现的现象是 。
小方认为此实验设计不够完善,他对实验方案进一步改进,能充分证明二氧化碳确实能与氢氧化钠发生化学反应。
(方案1)增加对比实验:用同样的装置,将氢氧化钠溶液换成________。
(方案2)取反应后的液体少许于试管中,滴加足量的稀盐酸,出现的现象是 。(4)实验结束后,小华同学将图l、图2两个实验试管中的物质全部倒入同一个洁净的废液缸中,静置后,发现废液缸中有蓝色沉淀,上层清液呈蓝色,他判断该蓝色清液中一定含有的溶质是________。
18.某同学发现,上个月做实验用的氢氧化钠溶液忘记了盖瓶盖。对于该溶液是否变质,同学们进行了以下探究:
(1)(提出问题)氢氧化钠溶液是否变质?变质程度如何?
(做出猜想)猜想一:氢氧化钠溶液未变质
猜想二:氢氧化钠溶液完全变质
猜想三: 。
(2)(设计实验)请完成实验报告
实验步骤 实验现象 实验结论
①取少量溶液于试管中,加入________,充分反应。 ________ 猜想二成立
②将步骤①试管中的物质过滤,向滤液中加入________。 无明显现象
(3)(反思拓展)
①氢氧化钠溶液变质的原因 (用化学方程式表示),氢氧化钠溶液应________保存。
②分别取两份完全变质的氢氧化钠溶液样品于试管中,向其中一份加入盐酸有气泡产生,另一份加入氢氧化钙溶液有白色沉淀产生,然后将两支试管中所有物质一起倒入废液缸中,得到无色澄清溶液,所得溶液中溶质一定有________。
参考答案
一、单选题
1.C 2.A 3. A 4.D 5.C 6.C 7.B 8.D 9.D 10.A 11.A 12.A 13.B
二、填空题(共2题;共9分)
14.【答案】 (1)A (2)Fe3+ (3)C D
15.【答案】 (1)氢氧化钙[或熟石灰、消石灰、Ca(OH)2] (2)
(3)溶解时放出大量的热(或溶液温度升高) (4)氯化钠(或NaCl)
三、实验探究题(共3题;共21分)
16.【答案】 (1)溶液由无色变为红色
(2)3;根据图像,实验一中的氢氧化钠先与实验三中剩余的稀盐酸反应并将其耗尽,再与实验二中剩余的硫酸铜反应,所以溶液中一定没有HC1,所以一定没有H+
(3)足量硝酸钡溶液;硝酸银溶液;对后面待检验的离子有干扰的离子
17.【答案】 (1)溶液由红色变为无色 (2)CuSO4+2NaOH=Cu(OH)2↓+Na2SO4;复分解
(3)CO2+2NaOH=Na2CO3+H2O;气球体积变大;水;溶液红有气泡产生,胀大的气球被压瘪为原状
(4)硫酸铜、硫酸钠
18.【答案】 (1)氢氧化钠溶液部分变质
(2)加入足量(或过量)的氯化钙溶液(或可溶性钙盐、钡盐溶液)(合理即可);产生白色沉淀(或产生白色浑浊);酚酞溶液(或可溶性铜盐、铁盐、镁盐溶液、石蕊溶液)(合理即可)
(3);密封;氯化钠、氯化钙(或NaCl、CaC12)
1
