化学沪教版九下:7.3 几种重要的盐(第1课时 盐的概念及化学性质)课件(共25张PPT)
文档属性
| 名称 | 化学沪教版九下:7.3 几种重要的盐(第1课时 盐的概念及化学性质)课件(共25张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-14 00:00:00 | ||
图片预览







文档简介
(共25张PPT)
7.3 几种重要的盐
SEVAL COMMOMN SALTS
第1课时 什么是盐
食盐是盐,盐就是食盐
错, 盐≠食盐
判断对错
Judge right or wrong
如亚硝酸钠是盐,有毒,
是“工业用盐”,不是食盐
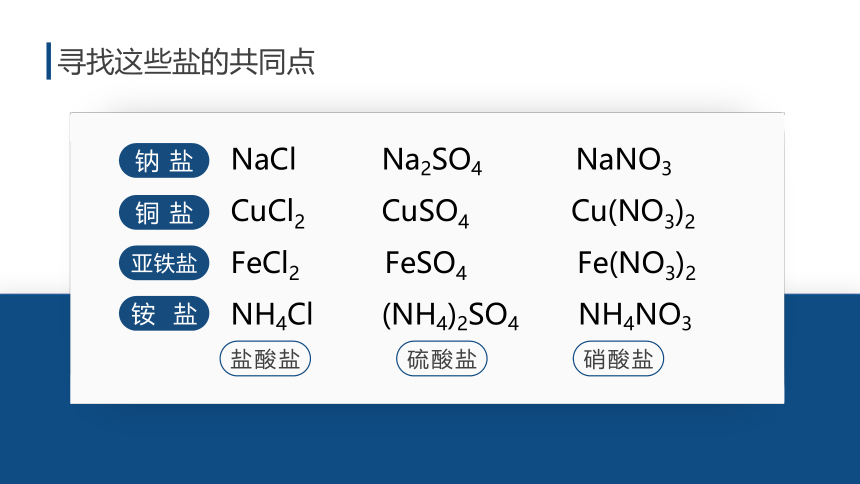
NaCl Na2SO4 NaNO3
CuCl2 CuSO4 Cu(NO3)2
FeCl2 FeSO4 Fe(NO3)2
NH4Cl (NH4)2SO4 NH4NO3
盐
由 (或 )+ 酸根离子组成的化合物
金属离子
NH4+
课堂巩固
关于酸、碱、盐中元素组成的说法正确的是( )
A. 酸、碱一定含氢,盐一定不含氢
B. 酸、碱、盐可能都不含金属元素
C. 碱、盐可能含氧、酸一定含氧
D. 盐一定含金属元素,酸、碱不一定含金属元素
B
NaCl Na2SO4 NaNO3
CuCl2 CuSO4 Cu(NO3)2
FeCl2 FeSO4 Fe(NO3)2
NH4Cl (NH4)2SO4 NH4NO3
寻找这些盐的共同点
钠盐
铜盐
亚铁盐
铵盐
盐酸盐
硫酸盐
硝酸盐
盐的分类
钠盐
铜盐
钾盐
铵盐
盐酸盐
硫酸盐
硝酸盐
Classification of salt
碳酸盐
阳离子
阴离子
有氧酸盐
无氧酸盐
Na2SO4
K2CO3
CuSO4
CuCl2
NaCl
KCl
某酸某
某化某
酸碱盐
Acid base salt
酸
某酸
HX
H+ + 酸根离子
碱
ROH
金属离子或NH4+和OH-
氢氧化某(氨水除外)
盐
课堂巩固
写出化学式,并指出所属的物质类别
①水 ②氢氧化钙 ③硫酸 ④干冰
⑤碳酸钠 ⑥氨水 ⑦碱式碳酸铜 ⑧硝酸
③⑧
②⑥
⑤⑦
①④
氨气
氧化物
酸
碱
盐
其他化合物
化合物
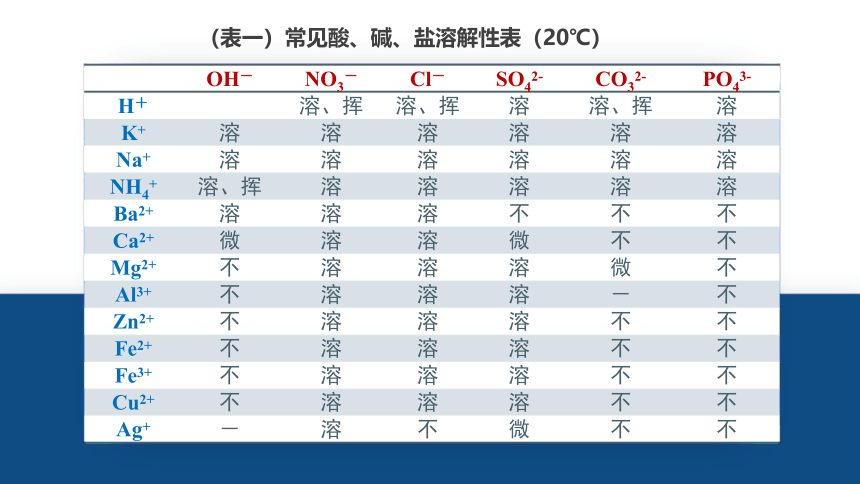
(表一)常见酸、碱、盐溶解性表(20℃)
OH- NO3- Cl- SO42- CO32- PO43-
H+ 溶、挥 溶、挥 溶 溶、挥 溶
K+ 溶 溶 溶 溶 溶 溶
Na+ 溶 溶 溶 溶 溶 溶
NH4+ 溶、挥 溶 溶 溶 溶 溶
Ba2+ 溶 溶 溶 不 不 不
Ca2+ 微 溶 溶 微 不 不
Mg2+ 不 溶 溶 溶 微 不
Al3+ 不 溶 溶 溶 - 不
Zn2+ 不 溶 溶 溶 不 不
Fe2+ 不 溶 溶 溶 不 不
Fe3+ 不 溶 溶 溶 不 不
Cu2+ 不 溶 溶 溶 不 不
Ag+ - 溶 不 微 不 不
盐的溶解性
Solubility of salt
钾 钠 铵 硝 全可溶 盐酸盐 不溶 氯化银
硫酸盐 不溶 硫酸钡 碳酸盐 只溶 钾钠铵
微溶:CaSO4
思考:实验室制CO2为什么一般不用稀硫酸?
会生成微溶的CaSO4,覆盖在石灰石表面阻碍反应
熟记八不溶
Familiar with eight insoluble
四 碱
四 盐
Mg(OH)2
Al(OH)3
Fe(OH)3
Cu(OH)2
白色
白色
红褐色
蓝色
AgCl
BaSO4
BaCO3
CaCO3
不与酸反应(即不溶于酸)
其他沉淀均能与酸反应(溶于酸)
常见有色盐溶液
Common colored salt solution
Cu2+
Fe3+
蓝色
黄色
浅绿色
Fe2+
高锰酸钾溶液
MnO4-
紫红色
铜 盐
铁 盐
亚铁盐
高锰酸盐
盐的化学性质
Chemical properties of salt
回忆“湿法冶金”的原理
盐能和金属反应
现象:
①铁丝表面出现红色的金属
②溶液由蓝色变成浅绿色
CuSO4 + Fe = FeSO4 + Cu
盐的化学性质
思考:是否所有的盐都可以和金属有此置换反应?
实验1:硫酸铜固体+铁
现象:
结论:
实验2:Zn放入CuSO4溶液
现象:
方程式:
锌表面有红色物质生成,溶液由蓝色变无色
Zn+ CuSO4 = Cu+ ZnSO4
金属要和盐溶液反应
无现象
盐的化学性质
思考:是否所有的盐都可以和金属有此置换反应?
实验3:铜(铁)丝放入AgNO3溶液中
现象:
方程式:
铜(铁)丝表面有黑色物质生成
(银——银白色,银粉——黑色)
Cu+2AgNO3=Cu(NO3)2+2Ag
Fe+2AgNO3=Fe(NO3)2+2Ag
铜(铁)丝表面有黑色物质生成
盐的化学性质
Chemical properties of salt
盐 +金属 → 新金属 + 新盐
思考:金属和新金属有什么关系?
1.活泼性:金属① > 金属② 前面的金属置换后面(与H无关)
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
4.铁单质参加置换反应得到亚铁盐
3.金属①不能用K、Ca、Na(太活泼会先与水反应)
2.盐必须是可溶的溶液
课堂巩固
下列物质加入水中能否发生反应
A. 锌和硝酸铅 B. 铜和硝酸汞
C. 铜和氯化亚铁 D. 铜和盐酸
能
能
不能
不能
盐的化学性质
Chemical properties of salt
盐 + 酸 → 新盐 + 新酸
Na2CO3 + 2HCl = 2NaCl+H2O+CO2↑
盐 + 碱 → 新碱+ 新酸
Na2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOH
盐1 + 盐2 → 新盐1+ 新盐2
Na2CO3 + CaCl2 = CaCO3↓+ 2NaCl
盐 +金属 → 新金属 + 新盐
CuSO4 + Fe = FeSO4 + Cu
BaSO4↓+2NaCl
AgCl↓+ NaNO3
BaCO3↓+ 2NaCl
盐1 + 盐2 → 新盐1+ 新盐2
NaCl + AgNO3 =
Na2SO4 + BaCl2=
Na2CO3 + BaCl2 =
氯化钙+碳酸钠
氯化钡+碳酸钠
氯化钡+硫酸钠
硝酸银+氯化钠
盐的化学性质
Chemical properties of salt
Na2CO3 + CaCl2 = CaCO3↓+ 2NaCl
与酸反应
不与酸反应
CaCO3
BaCO3
BaSO4
复分解发生的条件
Na2CO3+2HCl=2NaCl+H2O+CO2↑
NaOH+HCl=NaCl+H2O
1.有沉淀生成
2.有气体放出
3.有水生成
NaCl + AgNO3 = AgCl↓+ NaNO3
Na2SO4 + BaCl2 = BaSO4↓+2NaCl
Na2CO3 + CaCl2 = CaCO3↓+ 2NaCl
生成物中必须有沉淀或气体或水
三者必居其一
复分解发生的条件
AgNO3+FeCl3 BaCl2+CuSO4
AgCl+NaNO3 Ca(OH)2+Na2CO3
Na2SO4+HCl Ag2CO3+HCl
思考:下列物质加入水中能否发生反应?
能
能
不能
能
不能
能
可溶于水或者酸
有水或气体或沉淀生成
反应物
生成物
AgCl
BaSO4
不可作为反应物
复分解发生的条件
生成物中必须有沉淀或气体或水
NO3-
Ag+
Na+
Cl-
AgCl
AgNO3
NaCl
Cl-
H+
Na+
CO32-
CO2
HCl
Na2CO3
H2O
HCl
NaOH
Cl-
H+
Na+
OH-
复分解反应的本质
就是消耗某些离子的过程
即阴阳离子结合成气体或沉淀或水
中考突破——离子共存(必考)
凡是可结合成↑、↓或水的离子,都会反应,即不能共存
H+
NH4+
Ag+
Ba2+
Ca2+
Cu2+
Al3+
Fe3+
Mg2+
OH-
CO32-
HCO3-
Cl-
SO42-
H+
NH4+
Fe3+
Mg2+
Al3+
Cu2+
H+
Ba2+
Ca2+
H+
Ag+
Ba2+
巩固练习
1.下列各组的离子,能大量共存于同一溶液的是( )
A.H+、Na+、CO32- B.Cu2+、Cl-、SO42-
C.Fe3+、SO42-、OH- D.Ca2+、NO3-、CO32-
A. SO42-、Cl-、Na+、H+ B. K+、SO42-、Cu2+、NO3-
C. Cl-、K+、SO42-、Na+ D. Ca2+、Cl-、CO32-、Na+
2.下列离子能在pH=13的水溶液中大量共存的是 ( )
巩固练习
A.Ba2+ Cl- OH- Mg2+ B.Cu2+ SO42- K+ NO3-
C.Na+ CO3 2- NH4+ C1- D.Zn2+ SO42- Mg2+ NO3-
3.下列各组物质中能在pH=1的溶液中大量共存,且得到无色
透明溶液的是( )
4. 能大量共存且形成无色溶液的一组离子是( )
A.Cu2+、SO42﹣、H+ B.CI﹣、NH4+、OH﹣
C.Ba2+、SO42﹣、NO3﹣ D.Na+、K+、NO3﹣
7.3 几种重要的盐
SEVAL COMMOMN SALTS
第1课时 什么是盐
食盐是盐,盐就是食盐
错, 盐≠食盐
判断对错
Judge right or wrong
如亚硝酸钠是盐,有毒,
是“工业用盐”,不是食盐
NaCl Na2SO4 NaNO3
CuCl2 CuSO4 Cu(NO3)2
FeCl2 FeSO4 Fe(NO3)2
NH4Cl (NH4)2SO4 NH4NO3
盐
由 (或 )+ 酸根离子组成的化合物
金属离子
NH4+
课堂巩固
关于酸、碱、盐中元素组成的说法正确的是( )
A. 酸、碱一定含氢,盐一定不含氢
B. 酸、碱、盐可能都不含金属元素
C. 碱、盐可能含氧、酸一定含氧
D. 盐一定含金属元素,酸、碱不一定含金属元素
B
NaCl Na2SO4 NaNO3
CuCl2 CuSO4 Cu(NO3)2
FeCl2 FeSO4 Fe(NO3)2
NH4Cl (NH4)2SO4 NH4NO3
寻找这些盐的共同点
钠盐
铜盐
亚铁盐
铵盐
盐酸盐
硫酸盐
硝酸盐
盐的分类
钠盐
铜盐
钾盐
铵盐
盐酸盐
硫酸盐
硝酸盐
Classification of salt
碳酸盐
阳离子
阴离子
有氧酸盐
无氧酸盐
Na2SO4
K2CO3
CuSO4
CuCl2
NaCl
KCl
某酸某
某化某
酸碱盐
Acid base salt
酸
某酸
HX
H+ + 酸根离子
碱
ROH
金属离子或NH4+和OH-
氢氧化某(氨水除外)
盐
课堂巩固
写出化学式,并指出所属的物质类别
①水 ②氢氧化钙 ③硫酸 ④干冰
⑤碳酸钠 ⑥氨水 ⑦碱式碳酸铜 ⑧硝酸
③⑧
②⑥
⑤⑦
①④
氨气
氧化物
酸
碱
盐
其他化合物
化合物
(表一)常见酸、碱、盐溶解性表(20℃)
OH- NO3- Cl- SO42- CO32- PO43-
H+ 溶、挥 溶、挥 溶 溶、挥 溶
K+ 溶 溶 溶 溶 溶 溶
Na+ 溶 溶 溶 溶 溶 溶
NH4+ 溶、挥 溶 溶 溶 溶 溶
Ba2+ 溶 溶 溶 不 不 不
Ca2+ 微 溶 溶 微 不 不
Mg2+ 不 溶 溶 溶 微 不
Al3+ 不 溶 溶 溶 - 不
Zn2+ 不 溶 溶 溶 不 不
Fe2+ 不 溶 溶 溶 不 不
Fe3+ 不 溶 溶 溶 不 不
Cu2+ 不 溶 溶 溶 不 不
Ag+ - 溶 不 微 不 不
盐的溶解性
Solubility of salt
钾 钠 铵 硝 全可溶 盐酸盐 不溶 氯化银
硫酸盐 不溶 硫酸钡 碳酸盐 只溶 钾钠铵
微溶:CaSO4
思考:实验室制CO2为什么一般不用稀硫酸?
会生成微溶的CaSO4,覆盖在石灰石表面阻碍反应
熟记八不溶
Familiar with eight insoluble
四 碱
四 盐
Mg(OH)2
Al(OH)3
Fe(OH)3
Cu(OH)2
白色
白色
红褐色
蓝色
AgCl
BaSO4
BaCO3
CaCO3
不与酸反应(即不溶于酸)
其他沉淀均能与酸反应(溶于酸)
常见有色盐溶液
Common colored salt solution
Cu2+
Fe3+
蓝色
黄色
浅绿色
Fe2+
高锰酸钾溶液
MnO4-
紫红色
铜 盐
铁 盐
亚铁盐
高锰酸盐
盐的化学性质
Chemical properties of salt
回忆“湿法冶金”的原理
盐能和金属反应
现象:
①铁丝表面出现红色的金属
②溶液由蓝色变成浅绿色
CuSO4 + Fe = FeSO4 + Cu
盐的化学性质
思考:是否所有的盐都可以和金属有此置换反应?
实验1:硫酸铜固体+铁
现象:
结论:
实验2:Zn放入CuSO4溶液
现象:
方程式:
锌表面有红色物质生成,溶液由蓝色变无色
Zn+ CuSO4 = Cu+ ZnSO4
金属要和盐溶液反应
无现象
盐的化学性质
思考:是否所有的盐都可以和金属有此置换反应?
实验3:铜(铁)丝放入AgNO3溶液中
现象:
方程式:
铜(铁)丝表面有黑色物质生成
(银——银白色,银粉——黑色)
Cu+2AgNO3=Cu(NO3)2+2Ag
Fe+2AgNO3=Fe(NO3)2+2Ag
铜(铁)丝表面有黑色物质生成
盐的化学性质
Chemical properties of salt
盐 +金属 → 新金属 + 新盐
思考:金属和新金属有什么关系?
1.活泼性:金属① > 金属② 前面的金属置换后面(与H无关)
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
4.铁单质参加置换反应得到亚铁盐
3.金属①不能用K、Ca、Na(太活泼会先与水反应)
2.盐必须是可溶的溶液
课堂巩固
下列物质加入水中能否发生反应
A. 锌和硝酸铅 B. 铜和硝酸汞
C. 铜和氯化亚铁 D. 铜和盐酸
能
能
不能
不能
盐的化学性质
Chemical properties of salt
盐 + 酸 → 新盐 + 新酸
Na2CO3 + 2HCl = 2NaCl+H2O+CO2↑
盐 + 碱 → 新碱+ 新酸
Na2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOH
盐1 + 盐2 → 新盐1+ 新盐2
Na2CO3 + CaCl2 = CaCO3↓+ 2NaCl
盐 +金属 → 新金属 + 新盐
CuSO4 + Fe = FeSO4 + Cu
BaSO4↓+2NaCl
AgCl↓+ NaNO3
BaCO3↓+ 2NaCl
盐1 + 盐2 → 新盐1+ 新盐2
NaCl + AgNO3 =
Na2SO4 + BaCl2=
Na2CO3 + BaCl2 =
氯化钙+碳酸钠
氯化钡+碳酸钠
氯化钡+硫酸钠
硝酸银+氯化钠
盐的化学性质
Chemical properties of salt
Na2CO3 + CaCl2 = CaCO3↓+ 2NaCl
与酸反应
不与酸反应
CaCO3
BaCO3
BaSO4
复分解发生的条件
Na2CO3+2HCl=2NaCl+H2O+CO2↑
NaOH+HCl=NaCl+H2O
1.有沉淀生成
2.有气体放出
3.有水生成
NaCl + AgNO3 = AgCl↓+ NaNO3
Na2SO4 + BaCl2 = BaSO4↓+2NaCl
Na2CO3 + CaCl2 = CaCO3↓+ 2NaCl
生成物中必须有沉淀或气体或水
三者必居其一
复分解发生的条件
AgNO3+FeCl3 BaCl2+CuSO4
AgCl+NaNO3 Ca(OH)2+Na2CO3
Na2SO4+HCl Ag2CO3+HCl
思考:下列物质加入水中能否发生反应?
能
能
不能
能
不能
能
可溶于水或者酸
有水或气体或沉淀生成
反应物
生成物
AgCl
BaSO4
不可作为反应物
复分解发生的条件
生成物中必须有沉淀或气体或水
NO3-
Ag+
Na+
Cl-
AgCl
AgNO3
NaCl
Cl-
H+
Na+
CO32-
CO2
HCl
Na2CO3
H2O
HCl
NaOH
Cl-
H+
Na+
OH-
复分解反应的本质
就是消耗某些离子的过程
即阴阳离子结合成气体或沉淀或水
中考突破——离子共存(必考)
凡是可结合成↑、↓或水的离子,都会反应,即不能共存
H+
NH4+
Ag+
Ba2+
Ca2+
Cu2+
Al3+
Fe3+
Mg2+
OH-
CO32-
HCO3-
Cl-
SO42-
H+
NH4+
Fe3+
Mg2+
Al3+
Cu2+
H+
Ba2+
Ca2+
H+
Ag+
Ba2+
巩固练习
1.下列各组的离子,能大量共存于同一溶液的是( )
A.H+、Na+、CO32- B.Cu2+、Cl-、SO42-
C.Fe3+、SO42-、OH- D.Ca2+、NO3-、CO32-
A. SO42-、Cl-、Na+、H+ B. K+、SO42-、Cu2+、NO3-
C. Cl-、K+、SO42-、Na+ D. Ca2+、Cl-、CO32-、Na+
2.下列离子能在pH=13的水溶液中大量共存的是 ( )
巩固练习
A.Ba2+ Cl- OH- Mg2+ B.Cu2+ SO42- K+ NO3-
C.Na+ CO3 2- NH4+ C1- D.Zn2+ SO42- Mg2+ NO3-
3.下列各组物质中能在pH=1的溶液中大量共存,且得到无色
透明溶液的是( )
4. 能大量共存且形成无色溶液的一组离子是( )
A.Cu2+、SO42﹣、H+ B.CI﹣、NH4+、OH﹣
C.Ba2+、SO42﹣、NO3﹣ D.Na+、K+、NO3﹣
