化学沪教版九下 :7.2 常见的酸和碱(第4课时 酸碱中和反应) 课件(共25张PPT)
文档属性
| 名称 | 化学沪教版九下 :7.2 常见的酸和碱(第4课时 酸碱中和反应) 课件(共25张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-14 19:15:34 | ||
图片预览





文档简介
(共25张PPT)
Neutralization reaction
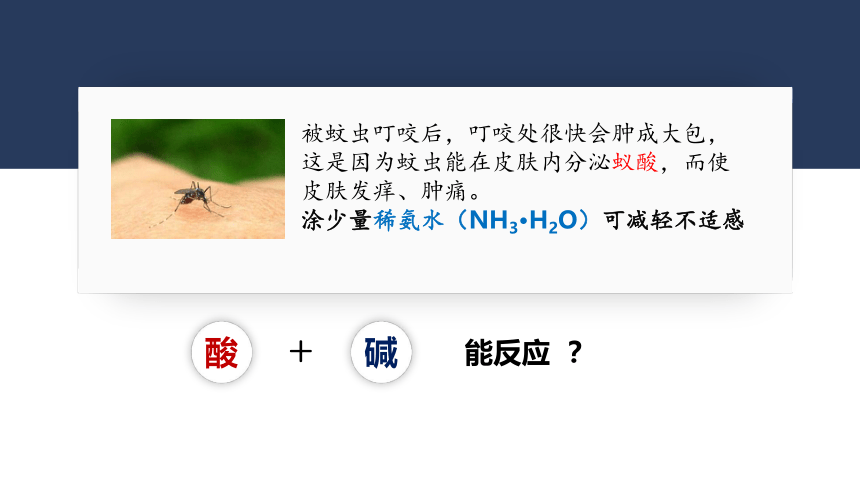
被蚊虫叮咬后,叮咬处很快会肿成大包,这是因为蚊虫能在皮肤内分泌蚁酸,而使皮肤发痒、肿痛。
涂少量稀氨水(NH3·H2O)可减轻不适感
碱
能反应 ?
酸
+
活动一:探究酸和碱能否发生反应
方案设计
供选用的试剂:
稀盐酸 氢氧化钠溶液
酚酞试液 紫色石蕊试液
镁条 硫酸铜溶液
氢氧化钠溶液能否与稀盐酸反应?
活动一:探究酸和碱能否发生反应
胶头滴管逐滴滴加
边滴边用玻璃棒搅拌
氢氧化钠溶液和稀盐酸能反应
思考:如何判断氢氧化钠和盐酸恰好完全反应?
结论
最后一滴稀盐酸滴入时
溶液恰好褪成无色
操作
现象
当溶液恰好由红色变成无色时
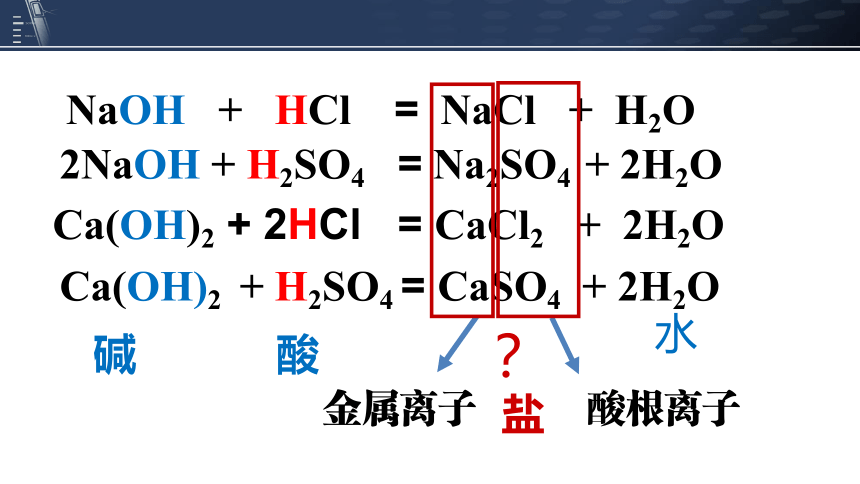
NaOH + HCl = NaCl + H2O
参照氢氧化钠与盐酸反应的化学方程式,
写出氢氧化钙与盐酸、硫酸反应的化学方程式。
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
Ca(OH)2 + H2SO4 = CaSO4 + 2H2O
活动二:认识酸和碱的反应
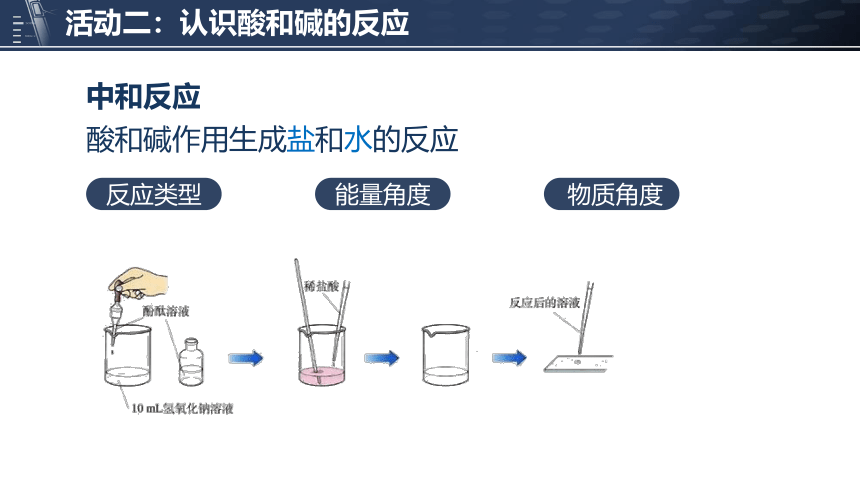
中和反应
能量角度
物质角度
反应类型
酸和碱作用生成盐和水的反应
活动三:探寻中和反应的本质
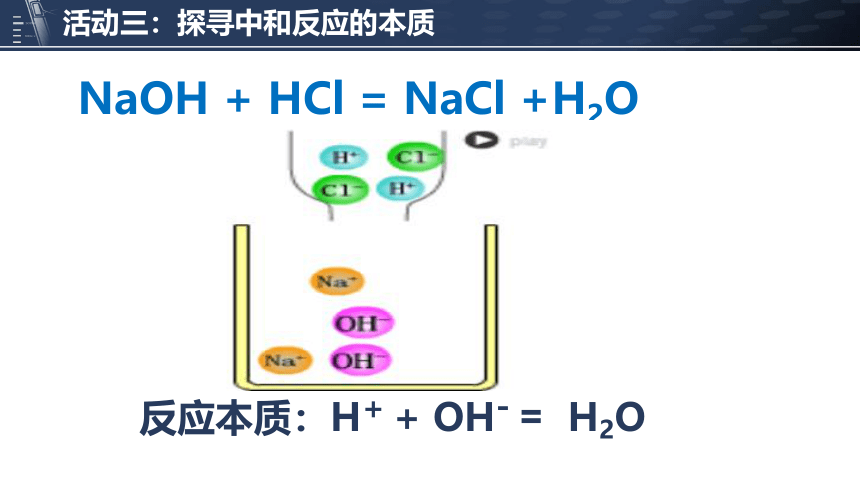
NaOH + HCl = NaCl +H2O
反应本质:H+ + OH- H2O
=
碱
酸
水
NaOH + HCl = NaCl + H2O
?
盐
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
2NaOH + H2SO4 = Na2SO4 + 2H2O
金属离子
酸根离子
Ca(OH)2 + H2SO4 = CaSO4 + 2H2O
交流与讨论
下面给出几种盐的化学式,
你能否说明它们可以用哪些酸和碱反应得到?
KCl KNO3 CaSO4
中和反应:酸和碱作用生成盐和水的反应
问题1:中和反应属于四大基本反应类型吗?
CuSO4 + 2 NaOH = Cu(OH)2 + Na2SO4
不属于,中和反应一定属于复分解反应,但复分解反应不一定是中和反应。
问题2:有盐和水生成的反应,一定是中和反应吗?
Fe2O3+6HCl=2FeCl3+3H2O
CO2+2NaOH=Na2CO3+H2O
结论:有盐和水生成的反应,不一定是中和反应。
1.下列反应,属于中和反应的是( )
A.Zn +2HCl = ZnCl2 + H2↑
B. CuO + 2HCl = CuCl2 + H2O
C. Cu(OH)2 + H2SO4 = CuSO4 + 2H2O
D. CO2 + 2NaOH = Na2CO3 + H2O
C
2.下列反应属于中和反应的是( )
A.6HCl + Fe2O3 = 2FeCl3 + 3H2O
B.CO2 + 2NaOH = Na2CO3 + H2O
C.CuSO4+2NaOH = Cu(OH)2↓+ Na2SO4
D.HNO3 + NaOH = NaNO3 + H2O
D
NaOH溶液
(滴有酚酞)
+HCl
酚酞颜色
酸碱性
溶质
刚好无色
中性
NaCl
红色
碱性
NaCl NaOH
无色
酸性
NaCl HCl
反应中溶液成分的分析
少量
适量
过量
NaOH NaCl pH>7
NaCl pH=7
HCl NaCl pH<7
向氢氧化钠溶液中滴加稀盐酸
实验中的几个细节——细节体现艺术,也只有细节的表现力最强
最后一滴酸滴入时,溶液恰好变为无色。
防止酸过量。
使溶液充分接触,反应迅速完全。
实验中酚酞的作用——
根据指示剂颜色变化,可判断反应的发生和中和反应的终点。
滴定终点的判断——
为什么用胶头滴管逐滴滴加——
用玻璃棒搅拌的目的——
活动四:了解中和反应的用途
蚊虫叮咬涂稀氨水或肥皂水
用氢氧化铝治疗胃酸过多
熟石灰改良酸性土壤
处理酸性或碱性的工业废水
Ca(OH)2 + 2HCl =CaCl2 + 2H2O
2NH3.H2O + H2SO4 =(NH4)2SO4 + 2H2O
Al(OH)3+ 3HCl =AlCl3+ 3H2O
生活
农业
工业
医疗
⑴ 为什么向酸性土壤中加入熟石灰,而不可以加入
氢氧化钠粉末?
因为氢氧化钠的腐蚀性太强。
是酸雨或化肥。
⑵ 导致土壤显酸性的主要原因是什么?
讨论:
有哪些反应是放热反应?
生石灰做干燥剂
燃烧
双氧水制氧气
活泼金属+酸
中和反应
例1:根据“在氢氧化钠溶液中滴加稀盐酸”的实验(如图),回答下列问题:
(1)仪器的名称是_____;
(2)使用玻璃棒搅拌的目的是_____;
(3)酚酞溶液的作用是_____;
(4)氢氧化钠与盐酸恰好完全反应的现象是_____。
例2:如图表示的是向盛有稀的甲溶液(其中滴有少量紫色石蕊试剂)中,加入乙溶液(相同浓度)后,溶液pH的变化曲线.已知甲、乙分别是盐酸溶液和氢氧化钠溶液中的一种.请分析曲线回答问题:
(1)甲是 溶液;
(2)当加入乙溶液的体积为 mL时,甲、乙溶液恰好完全反应;
(3)当溶液的pH=1.4时,溶液中存在的微观粒子有
(指示剂除外);
例3:将稀盐酸慢慢滴入盛有氢氧化钠溶液的烧杯中,用温度计测量烧杯中溶液的温度,温度随加入稀盐酸的质量变化曲线如图所示。
1. 在滴加的过程中,烧杯中溶液的pH逐渐
(填“增大”、“减小”或“不变”)
2. 由图可知,稀盐酸与氢氧化钠溶液发生的反应是
(填“放热”或“吸热”)反应
3. 图中B点时,溶液中的溶质是 (填化学式)
例4:小廷同学在实验室将 5% 的 NaOH 溶液逐滴加入到 14 g 稀盐酸中,边加边搅拌,随着 NaOH 溶液的不断加入,溶液 pH 的变化如图所示,请回答
(1)a 点溶液中含有的阳离子有 。
(2)当 pH=7 时,消耗 NaOH 的质量为 g。
(3)求恰好完全反应时溶液中溶质的质量分数 (精确到0.1%)。
时间,点点滴滴,滴定着我们的人生终点
Neutralization reaction
被蚊虫叮咬后,叮咬处很快会肿成大包,这是因为蚊虫能在皮肤内分泌蚁酸,而使皮肤发痒、肿痛。
涂少量稀氨水(NH3·H2O)可减轻不适感
碱
能反应 ?
酸
+
活动一:探究酸和碱能否发生反应
方案设计
供选用的试剂:
稀盐酸 氢氧化钠溶液
酚酞试液 紫色石蕊试液
镁条 硫酸铜溶液
氢氧化钠溶液能否与稀盐酸反应?
活动一:探究酸和碱能否发生反应
胶头滴管逐滴滴加
边滴边用玻璃棒搅拌
氢氧化钠溶液和稀盐酸能反应
思考:如何判断氢氧化钠和盐酸恰好完全反应?
结论
最后一滴稀盐酸滴入时
溶液恰好褪成无色
操作
现象
当溶液恰好由红色变成无色时
NaOH + HCl = NaCl + H2O
参照氢氧化钠与盐酸反应的化学方程式,
写出氢氧化钙与盐酸、硫酸反应的化学方程式。
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
Ca(OH)2 + H2SO4 = CaSO4 + 2H2O
活动二:认识酸和碱的反应
中和反应
能量角度
物质角度
反应类型
酸和碱作用生成盐和水的反应
活动三:探寻中和反应的本质
NaOH + HCl = NaCl +H2O
反应本质:H+ + OH- H2O
=
碱
酸
水
NaOH + HCl = NaCl + H2O
?
盐
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
2NaOH + H2SO4 = Na2SO4 + 2H2O
金属离子
酸根离子
Ca(OH)2 + H2SO4 = CaSO4 + 2H2O
交流与讨论
下面给出几种盐的化学式,
你能否说明它们可以用哪些酸和碱反应得到?
KCl KNO3 CaSO4
中和反应:酸和碱作用生成盐和水的反应
问题1:中和反应属于四大基本反应类型吗?
CuSO4 + 2 NaOH = Cu(OH)2 + Na2SO4
不属于,中和反应一定属于复分解反应,但复分解反应不一定是中和反应。
问题2:有盐和水生成的反应,一定是中和反应吗?
Fe2O3+6HCl=2FeCl3+3H2O
CO2+2NaOH=Na2CO3+H2O
结论:有盐和水生成的反应,不一定是中和反应。
1.下列反应,属于中和反应的是( )
A.Zn +2HCl = ZnCl2 + H2↑
B. CuO + 2HCl = CuCl2 + H2O
C. Cu(OH)2 + H2SO4 = CuSO4 + 2H2O
D. CO2 + 2NaOH = Na2CO3 + H2O
C
2.下列反应属于中和反应的是( )
A.6HCl + Fe2O3 = 2FeCl3 + 3H2O
B.CO2 + 2NaOH = Na2CO3 + H2O
C.CuSO4+2NaOH = Cu(OH)2↓+ Na2SO4
D.HNO3 + NaOH = NaNO3 + H2O
D
NaOH溶液
(滴有酚酞)
+HCl
酚酞颜色
酸碱性
溶质
刚好无色
中性
NaCl
红色
碱性
NaCl NaOH
无色
酸性
NaCl HCl
反应中溶液成分的分析
少量
适量
过量
NaOH NaCl pH>7
NaCl pH=7
HCl NaCl pH<7
向氢氧化钠溶液中滴加稀盐酸
实验中的几个细节——细节体现艺术,也只有细节的表现力最强
最后一滴酸滴入时,溶液恰好变为无色。
防止酸过量。
使溶液充分接触,反应迅速完全。
实验中酚酞的作用——
根据指示剂颜色变化,可判断反应的发生和中和反应的终点。
滴定终点的判断——
为什么用胶头滴管逐滴滴加——
用玻璃棒搅拌的目的——
活动四:了解中和反应的用途
蚊虫叮咬涂稀氨水或肥皂水
用氢氧化铝治疗胃酸过多
熟石灰改良酸性土壤
处理酸性或碱性的工业废水
Ca(OH)2 + 2HCl =CaCl2 + 2H2O
2NH3.H2O + H2SO4 =(NH4)2SO4 + 2H2O
Al(OH)3+ 3HCl =AlCl3+ 3H2O
生活
农业
工业
医疗
⑴ 为什么向酸性土壤中加入熟石灰,而不可以加入
氢氧化钠粉末?
因为氢氧化钠的腐蚀性太强。
是酸雨或化肥。
⑵ 导致土壤显酸性的主要原因是什么?
讨论:
有哪些反应是放热反应?
生石灰做干燥剂
燃烧
双氧水制氧气
活泼金属+酸
中和反应
例1:根据“在氢氧化钠溶液中滴加稀盐酸”的实验(如图),回答下列问题:
(1)仪器的名称是_____;
(2)使用玻璃棒搅拌的目的是_____;
(3)酚酞溶液的作用是_____;
(4)氢氧化钠与盐酸恰好完全反应的现象是_____。
例2:如图表示的是向盛有稀的甲溶液(其中滴有少量紫色石蕊试剂)中,加入乙溶液(相同浓度)后,溶液pH的变化曲线.已知甲、乙分别是盐酸溶液和氢氧化钠溶液中的一种.请分析曲线回答问题:
(1)甲是 溶液;
(2)当加入乙溶液的体积为 mL时,甲、乙溶液恰好完全反应;
(3)当溶液的pH=1.4时,溶液中存在的微观粒子有
(指示剂除外);
例3:将稀盐酸慢慢滴入盛有氢氧化钠溶液的烧杯中,用温度计测量烧杯中溶液的温度,温度随加入稀盐酸的质量变化曲线如图所示。
1. 在滴加的过程中,烧杯中溶液的pH逐渐
(填“增大”、“减小”或“不变”)
2. 由图可知,稀盐酸与氢氧化钠溶液发生的反应是
(填“放热”或“吸热”)反应
3. 图中B点时,溶液中的溶质是 (填化学式)
例4:小廷同学在实验室将 5% 的 NaOH 溶液逐滴加入到 14 g 稀盐酸中,边加边搅拌,随着 NaOH 溶液的不断加入,溶液 pH 的变化如图所示,请回答
(1)a 点溶液中含有的阳离子有 。
(2)当 pH=7 时,消耗 NaOH 的质量为 g。
(3)求恰好完全反应时溶液中溶质的质量分数 (精确到0.1%)。
时间,点点滴滴,滴定着我们的人生终点
