化学沪教版九下 :7.2 常见的酸和碱(第2课时 酸的化学性质) 课件(共19张PPT)
文档属性
| 名称 | 化学沪教版九下 :7.2 常见的酸和碱(第2课时 酸的化学性质) 课件(共19张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 4.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-14 19:23:10 | ||
图片预览





文档简介
(共19张PPT)
7.2 常见的酸和碱
COMMON ACIDS AND BASES
第2课时 酸的化学性质
常见的酸
Common acids
酸:电离产生的阳离子全部是H+的化合物
盐酸 HCl
硫酸 H2SO4
硝酸 HNO3
磷酸 H3PO4
碳酸 H2CO3
醋酸 CH3COOH
名称角度
都称为某酸
组成角度
酸溶液里都含有H+
它们都有一些相似的化学性质
即通性
Name angle
Composition angle
温故知新
使紫色石蕊试液 色
使无色酚酞试液 色
变红
不变
酸的通性
The generality of acids
1.稀盐酸遇紫色石蕊试液变成红色
×
是石蕊变色
2.某溶液中滴入酚酞为无色,则该溶液一定显酸性
课堂巩固
×
也可能为中性
判断以下说法是否正确
+
酸的通性
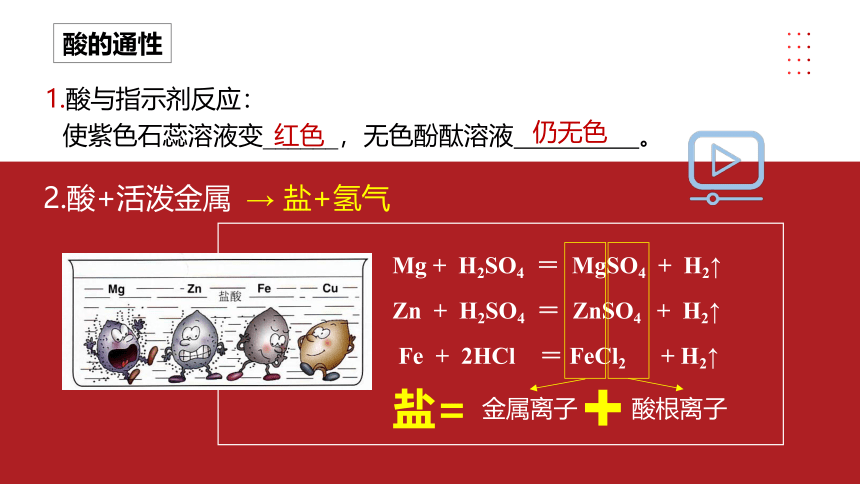
1.酸与指示剂反应:
使紫色石蕊溶液变______,无色酚酞溶液 。
红色
2.酸+活泼金属
Mg + H2SO4 = MgSO4 + H2↑
Zn + H2SO4 = ZnSO4 + H2↑
Fe + 2HCl = FeCl2 + H2↑
金属离子
酸根离子
盐=
→ 盐+氢气
仍无色
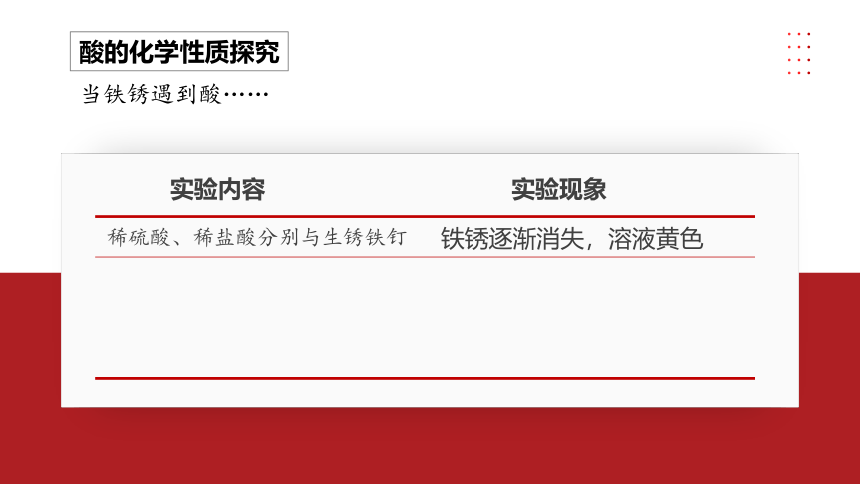
酸的化学性质探究
当铁锈遇到酸……
实验内容
实验现象
稀硫酸、稀盐酸分别与生锈铁钉
铁锈逐渐消失,溶液黄色
酸的化学性质
3.酸+金属氧化物→
Fe2O3 + 6HCl = 2FeCl3+3H2O
Fe2O3 + 3H2SO4 = Fe2(SO4)3+3H2O
现象:铁锈逐渐减少,溶液由无色变为黄色
思考:除锈一段时间后为什么铁钉表面有气泡产生?
Fe + 2HCl = FeCl2 + H2↑
盐+水
请写出稀盐酸、稀硫酸分别与氧化铜的化学方程式
CuO + H2SO4 = CuSO4 + H2O
CuO + 2HCl = CuCl2 + H2O
黑色粉末减少,溶液由无色变蓝
现象:
课堂巩固
酸的化学性质探究
用稀硫酸和稀盐酸做几个简单的实验,把观察到的现象填入下表,并与同学们讨论以下问题:
实验内容
实验现象
稀盐酸与石灰石作用
稀盐酸、稀硫酸分别
与滴有酚酞的氢氧化钠反应
溶液逐渐由红色变为无色
固体逐渐溶解,产生大量气泡
酸的化学性质
4.酸+碱→
思考:胃酸过多,可食用含氢氧化铝的药物,写出对应的化学方程式
NaOH + HCl =
NaCl + H2O
2NaOH + H2SO4 =
Na2SO4 + 2H2O
Al(OH)3+ 6HCl = AlCl3 + 3H2O
盐+水
酸的化学性质
5.酸+(部分)盐
CaCO3 + 2HCl = CaCl2+H2O+CO2↑
Na2CO3 + 2HCl = 2NaCl+H2O+CO2↑
思考:能否用 Na2CO3 代替CaCO3 用于实验室制CO2 ?
不能。反应太快
→ 新盐+新酸
小结
酸+金属氧化物→盐+水
03
酸+碱→盐+水
04
酸+(部分)盐→新酸+新盐
05
酸与指示剂反应
01
酸+活泼金属→ 盐+氢气
02
酸的通性
交流与讨论
为什么盐酸、硫酸、硝酸在性质上有许多共同之处?
因为盐酸、硫酸、硝酸溶液中都含有大量的H+
在其水溶液中都能产生的H+,所以酸有一些相似的性质—酸的通性。
又由于酸根离子不同,所以酸的化学性质也有差异。即组成决定性质。
H2SO4
H2SO4
H2SO4
SO42-
SO42-
SO42-
HCl → H+ + Cl-
H2SO4 → 2H+ + SO42-
含有下列离子的溶液中,溶质全部为酸的是( )
A. H+ 、Na+ 、 SO42- B. H+ 、Cl- 、 NO3-
C. OH- 、K+ 、 Ba2+ D. Ag+ 、K+ 、 NO3-
课堂巩固
B
思考:稀硫酸和稀盐酸的化学性质是否完全一样呢?
不完全一样,因为阴离子(酸根)不同
实验室制备二氧化碳用稀盐酸,而不能用稀硫酸
向稀盐酸、稀硫酸中分别滴加氯化钡溶液,现象不同
BaCl2 + H2SO4 =
BaCl2 + HCl
不反应
论据1
论据2
硫酸钡(白色沉淀)
BaSO4↓+ 2HCl
酸的化学性质
AgNO3+HCl=AgCl ↓ + HNO3
产生白色沉淀
产生白色沉淀
H2SO4+BaCl2=BaSO4↓+2HCl
5.酸+(部分)盐
→ 新盐+新酸
硫酸跟氯化钡的反应
盐酸跟硝酸银的反应
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性顺序
金属活动性由强逐渐减弱
钾 钙 钠 镁 铝 锌 铁锡铅(氢)铜汞银铂金
1.金属的位置越靠前,其活动性 .
2. 排在 的金属能与酸反应置换出 , 的金属不能
与酸发生置换反应.
3. 排在 的金属(不含K、Ca、Na)可以将其后面的金属从其盐
溶液中置换出来
越强
H前面
H2
H后面
前面
铝和稀硫酸 银和盐酸
铝和盐酸 铜和稀硫酸
课堂巩固
能
不能
能
不能
2.下列物质① FeCl3 ② ZnCl2 ③CuCl2④ AlCl3中,
能用金属和盐酸直接反应制得的物质( )
B
1.判断下列反应能否发生
A. ① ② B. ② ④ C. ③ ④ D. ① ③
请你设计实验来判断镁铁铜三种金属的活动性
取样,将等大小的三种金属分别和等量等浓度的稀硫酸反应,
相同条件下,金属单质的活动性越强,其与酸溶液发生反应越剧烈
快速产生气泡
较慢产生气泡
不产生气泡
镁
铁
铜
操作
现象
结论
7.2 常见的酸和碱
COMMON ACIDS AND BASES
第2课时 酸的化学性质
常见的酸
Common acids
酸:电离产生的阳离子全部是H+的化合物
盐酸 HCl
硫酸 H2SO4
硝酸 HNO3
磷酸 H3PO4
碳酸 H2CO3
醋酸 CH3COOH
名称角度
都称为某酸
组成角度
酸溶液里都含有H+
它们都有一些相似的化学性质
即通性
Name angle
Composition angle
温故知新
使紫色石蕊试液 色
使无色酚酞试液 色
变红
不变
酸的通性
The generality of acids
1.稀盐酸遇紫色石蕊试液变成红色
×
是石蕊变色
2.某溶液中滴入酚酞为无色,则该溶液一定显酸性
课堂巩固
×
也可能为中性
判断以下说法是否正确
+
酸的通性
1.酸与指示剂反应:
使紫色石蕊溶液变______,无色酚酞溶液 。
红色
2.酸+活泼金属
Mg + H2SO4 = MgSO4 + H2↑
Zn + H2SO4 = ZnSO4 + H2↑
Fe + 2HCl = FeCl2 + H2↑
金属离子
酸根离子
盐=
→ 盐+氢气
仍无色
酸的化学性质探究
当铁锈遇到酸……
实验内容
实验现象
稀硫酸、稀盐酸分别与生锈铁钉
铁锈逐渐消失,溶液黄色
酸的化学性质
3.酸+金属氧化物→
Fe2O3 + 6HCl = 2FeCl3+3H2O
Fe2O3 + 3H2SO4 = Fe2(SO4)3+3H2O
现象:铁锈逐渐减少,溶液由无色变为黄色
思考:除锈一段时间后为什么铁钉表面有气泡产生?
Fe + 2HCl = FeCl2 + H2↑
盐+水
请写出稀盐酸、稀硫酸分别与氧化铜的化学方程式
CuO + H2SO4 = CuSO4 + H2O
CuO + 2HCl = CuCl2 + H2O
黑色粉末减少,溶液由无色变蓝
现象:
课堂巩固
酸的化学性质探究
用稀硫酸和稀盐酸做几个简单的实验,把观察到的现象填入下表,并与同学们讨论以下问题:
实验内容
实验现象
稀盐酸与石灰石作用
稀盐酸、稀硫酸分别
与滴有酚酞的氢氧化钠反应
溶液逐渐由红色变为无色
固体逐渐溶解,产生大量气泡
酸的化学性质
4.酸+碱→
思考:胃酸过多,可食用含氢氧化铝的药物,写出对应的化学方程式
NaOH + HCl =
NaCl + H2O
2NaOH + H2SO4 =
Na2SO4 + 2H2O
Al(OH)3+ 6HCl = AlCl3 + 3H2O
盐+水
酸的化学性质
5.酸+(部分)盐
CaCO3 + 2HCl = CaCl2+H2O+CO2↑
Na2CO3 + 2HCl = 2NaCl+H2O+CO2↑
思考:能否用 Na2CO3 代替CaCO3 用于实验室制CO2 ?
不能。反应太快
→ 新盐+新酸
小结
酸+金属氧化物→盐+水
03
酸+碱→盐+水
04
酸+(部分)盐→新酸+新盐
05
酸与指示剂反应
01
酸+活泼金属→ 盐+氢气
02
酸的通性
交流与讨论
为什么盐酸、硫酸、硝酸在性质上有许多共同之处?
因为盐酸、硫酸、硝酸溶液中都含有大量的H+
在其水溶液中都能产生的H+,所以酸有一些相似的性质—酸的通性。
又由于酸根离子不同,所以酸的化学性质也有差异。即组成决定性质。
H2SO4
H2SO4
H2SO4
SO42-
SO42-
SO42-
HCl → H+ + Cl-
H2SO4 → 2H+ + SO42-
含有下列离子的溶液中,溶质全部为酸的是( )
A. H+ 、Na+ 、 SO42- B. H+ 、Cl- 、 NO3-
C. OH- 、K+ 、 Ba2+ D. Ag+ 、K+ 、 NO3-
课堂巩固
B
思考:稀硫酸和稀盐酸的化学性质是否完全一样呢?
不完全一样,因为阴离子(酸根)不同
实验室制备二氧化碳用稀盐酸,而不能用稀硫酸
向稀盐酸、稀硫酸中分别滴加氯化钡溶液,现象不同
BaCl2 + H2SO4 =
BaCl2 + HCl
不反应
论据1
论据2
硫酸钡(白色沉淀)
BaSO4↓+ 2HCl
酸的化学性质
AgNO3+HCl=AgCl ↓ + HNO3
产生白色沉淀
产生白色沉淀
H2SO4+BaCl2=BaSO4↓+2HCl
5.酸+(部分)盐
→ 新盐+新酸
硫酸跟氯化钡的反应
盐酸跟硝酸银的反应
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性顺序
金属活动性由强逐渐减弱
钾 钙 钠 镁 铝 锌 铁锡铅(氢)铜汞银铂金
1.金属的位置越靠前,其活动性 .
2. 排在 的金属能与酸反应置换出 , 的金属不能
与酸发生置换反应.
3. 排在 的金属(不含K、Ca、Na)可以将其后面的金属从其盐
溶液中置换出来
越强
H前面
H2
H后面
前面
铝和稀硫酸 银和盐酸
铝和盐酸 铜和稀硫酸
课堂巩固
能
不能
能
不能
2.下列物质① FeCl3 ② ZnCl2 ③CuCl2④ AlCl3中,
能用金属和盐酸直接反应制得的物质( )
B
1.判断下列反应能否发生
A. ① ② B. ② ④ C. ③ ④ D. ① ③
请你设计实验来判断镁铁铜三种金属的活动性
取样,将等大小的三种金属分别和等量等浓度的稀硫酸反应,
相同条件下,金属单质的活动性越强,其与酸溶液发生反应越剧烈
快速产生气泡
较慢产生气泡
不产生气泡
镁
铁
铜
操作
现象
结论
