浙教版科学八年级(下册)检测卷(六):第2章 微粒的模型与符号(第1~4节)【word,含答案】
文档属性
| 名称 | 浙教版科学八年级(下册)检测卷(六):第2章 微粒的模型与符号(第1~4节)【word,含答案】 |  | |
| 格式 | doc | ||
| 文件大小 | 480.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-02-15 21:31:42 | ||
图片预览

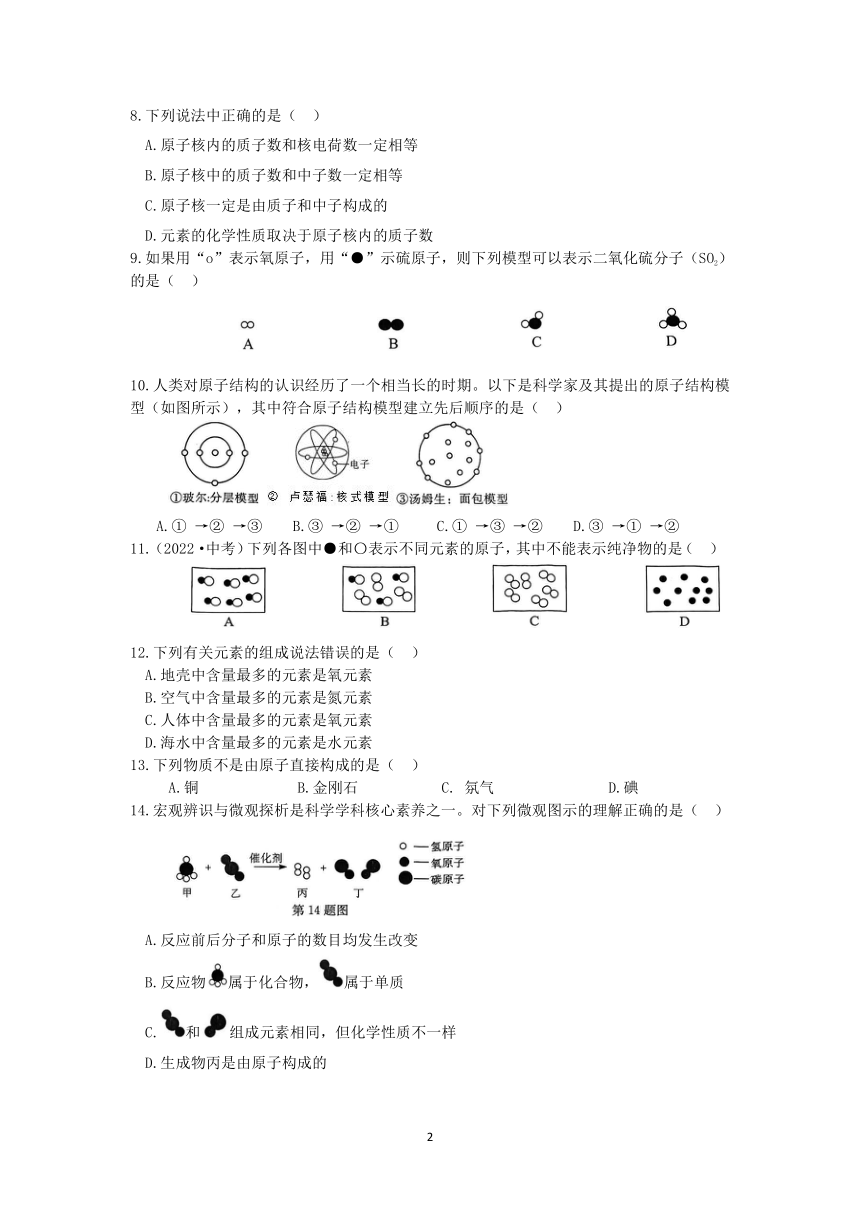

文档简介
浙教版科学八年级(下册)测试卷(六)
第2章 微粒的模型与符号(第1~4节)
班级_______ 姓名_______ 学号_______ 得分_______
一、选择题(每小题只有一个正确答案,每小题2分,共40分)
1.模型常常可以帮助人们认识和理解一些不能直接观察的或复杂的事物,下列不属于模型的是( )
A.原子结构 B.接种疫苗 C.新冠病毒 D.二氧化碳分子
2.下列关于分子、原子的说法错误的是( )
A.分子和原子总在不断地运动 B.同种原子可能构成不同分子
C.分子的质量一定大于原子的质量 D.化学变化中分子可分、原子不可分
3.(2022·中考)医生建议缺铁性贫血患者多吃肝脏、瘦肉、蛋、鱼、豆类等食物来补铁。这里的“铁”指的是( )
A.元素 B.原子 C.分子 D.单质
4.中国古代哲学家用“金木水火土”五行理论,来说明世界万物的组成以及世界万物间的相互关系。“金木水火土”五行理论最接近于科学概念中的( )
A.原子 B.分子 C.离子 D.元素
5.思维导图有助于建构知识网络,如图是小金建立的有关物质宏观组成和微观构成的思维导图,则下列说法正确的是( )
A.①处是元素
B.①处是电子
C.②处是元素
D.②处是原子核
6.氚是氢的一种同位素,氟原子含有1个质子和2个中子。下列示意图中能正确表示气原子结构的是( )
7.科学家计划用质子数为20的钙原子,轰击核电荷数为98的铜元素靶,使两元素的原子核合并在一起,合成核电荷数为118的新元素。对此理解正确的是( )
A.新元素的原子核外电子数为116 B.变化过程中元素种类没有发生改变
C.这个变化属于化学变化 D.新元素的质子数为118
8.下列说法中正确的是( )
A.原子核内的质子数和核电荷数一定相等
B.原子核中的质子数和中子数一定相等
C.原子核一定是由质子和中子构成的
D.元素的化学性质取决于原子核内的质子数
9.如果用“o”表示氧原子,用“●”示硫原子,则下列模型可以表示二氧化硫分子(SO2)的是( )
10.人类对原子结构的认识经历了一个相当长的时期。以下是科学家及其提出的原子结构模型(如图所示),其中符合原子结构模型建立先后顺序的是( )
A.① →② →③ B.③ →② →① C.① →③ →② D.③ →① →②
11.(2022·中考)下列各图中●和〇表示不同元素的原子,其中不能表示纯净物的是( )
12.下列有关元素的组成说法错误的是( )
A.地壳中含量最多的元素是氧元素
B.空气中含量最多的元素是氮元素
C.人体中含量最多的元素是氧元素
D.海水中含量最多的元素是水元素
13.下列物质不是由原子直接构成的是( )
A.铜 B.金刚石 C. 氛气 D.碘
14.宏观辨识与微观探析是科学学科核心素养之一。对下列微观图示的理解正确的是( )
A.反应前后分子和原子的数目均发生改变
B.反应物属于化合物,属于单质
C.和组成元素相同,但化学性质不一样
D.生成物丙是由原子构成的
15.生物体死亡后,体内含有的碳-14会逐渐减少(称为衰变)。因此科学家可通过测量生物体遗散中碳-14的含量,来计算它存活的年代,这种方法称之为放射性碳测年法。碳-14原子核中含6个质子与8个中子,在衰变时,一个中子变成质子,形成新的原子核。下列关于新原子核的说法正确的是( )
A.碳原子核,含7个质子,8个中子
B.氮原子核,含7个质子,7个中子
C.碳原子核,含6个质子,7个中子
D.氧原子核,含7个质子,8个中子
16.分类是化学学科常见的思想方法之一。如图呈现的物质分类关系中①与②是
并列关系,③包含在②中。若②是纯净物,则③不可能是( )
A.空气 B.硝酸钾 C.氢气 D.二氧化氮
17.正电子、负质子等都是反粒子。它们跟通常所说的电子、质子相比较,质量相等但电性相反。科学家设想在宇宙中可能存在完全由反粒子构成的物质-反物质。物质与反物质相遇会产生“酒灭”现象,释放出巨大的能量,在能源研究领域中前景非常可观。请你推测,反氢原子的结构可能是( )
A.由一个带正电荷的质子与一个带负电荷的电子构成
B.由一个带负电荷的质子与一个带正电荷的电子构成
C.由一个带正电荷的质子与一个带正电荷的电子构成
D.由一个带负电荷的质子与一个带负电荷的电子构成
18.1911年,英国科学家卢瑟福进行了著名的α粒子轰击金箔实验,如图所示。根据
实验不能获得的结论是( )
A.金原子核带正电
B.金原子核外电子带负电
C.金原子核体积很小
D.金原子核的质量比α粒子大得多
19.下表中a、b、c各项之间不符合如图关系的是( )
20.有两种微粒,已知它们的质子数相等,核外电子数也相等。下列关于这两种微粒的说法错误的是( )
A.可能是一种分子和一种原子
B.可能是两种不同的离子
C.可能是一种分子和一种离子
D.可能是两种不同的分子
二、填空题(每空1分,共32分)
21.(1)原子核是由_______和中子构成的。而质子和中子又是由更小的微粒______构成的。_____
(2)我们生活的世界由丰富多彩的物质组成,物质是由微小的粒子构成,例如人类时刻也离不开的水是由______构成的,用作调味剂和防腐剂的氯化钠(食盐)是由______构成的。
22.如图代表氢的三种原子的原子核。
(1)这三种原子的原子核内均含有____个质子,核外都有____个电子。
(2)这三种原子因为______数相同,所以它们都是氢原子;但中子数不相同,因此它们是氢的_______。
23.在这一章中我们已经学习和接触了以下几种微粒:
① 分子 ② 原子 ③ 电子 ④ 原子核 ⑤ 质子 ⑥ 中子 ⑦ 离子(阳离子和阴离子),请用恰当的序号填空。
(1)带正电的是______。
(2)带负电的是____。
(3)不显电性的是_______。
(4)能直接构成物质的是_______。
(5)质量最小的是____。
(6)在同一原子中数目相等是______。
(7)化学变化中最小的粒子是____。
(8)质量与氢原子大约相等的是_____
24.下列四瓶气体,所含微粒模型如图所示,请根据模型将它们分为两类。
(1)根据你的分类结果,若其中一类气体只有一种,则这种气体是______(填字母)。
(2)你分类的依据是____________。
(3)C瓶气体可能是______气体。
25.如图,甲、乙为科学教材上的插图,请根据要求完成填空。
(1)图甲中的钠原子______(填“得到”或“失去”)电子变为钠离子。
(2)图乙是地壳中各种元素的质量分数图,表示硅元素的质量分数的是____(填“A”“B”或“C”)。
26.探测月壤是“嫦娥一号”的主要任务之一。因为月壤中蕴藏着丰富的
He-3,其原子结构如图所示。 He-3 是一种安全、高效的清洁燃料,它的
应用前景十分广阔。
(1)图中微粒“●”是______(填“质子”“中子”或“电子”)。
(2)He-4是He-3的同位素原子,则He-4中的质子个数是____,中子个数是____。
(3)α粒子是带两个单位正电荷的氨原子核,则氨原子转化为α粒子时,____两个电子。
27.铝原子(A)和铝离子(A13+)属于同一种元素,因为它们的________相同。A1和A3+属
于 (填“相同”或“不同”)的粒子,因为它们核外的电子总数______(填“相同”
或“不同”)。
目前流行的有氧洗衣方法是在洗衣的过程中释放出有强氧化性的臭氧分子。已知1
个臭氧分子由3个氧原子构成,则1个臭氧分子有_____个电子,1个臭氧分子与1个氧气分子的核电荷数之比为______。
29.(带2个单位负电荷的硫离子)微粒中的质子数是16,中子数是_____,核外电子
数是____。
三、简答题(每空2分,共28分)
30.如图是某化学变化的微观示意图,A、B、C分别表示不同类别的原子,据图回答下列问
题。
(1)由@微粒构成的物质属于______(填“单质”或“化合物”)。
(2)从示意图可以看出,化学变化中最小的微粒是______。
(3)该化学反应中,两种反应物的分子个数比为______。
31.人类对原子结构的认识,经历了汤姆生、卢瑟福和玻尔等提出的模型的过程。
(1)卢瑟福核式结构模型是利用α粒子轰击金箔实验的基础上提出的。下列能正确反映他的实验结果的示意图是____(填序号)。
(2)从原子结构模型建立的过程中,我们发现__________(填字母,可多选)。
A.科学家模型的建立是一个不断完善、不断修正的过程
B.模型在科学研究中起着很重要的作用
C.玻尔的原子模型建立,使人们对原子结构的认识达到了完美的境界
D.人类借助模型的建立,对原子的认识逐渐接近本质
32.根据下列材料,回答问题。
材料1:法国科学家利用特种显微仪器,让一个分子做出了各种动作。这一成果使人类能精确控制单个分子运动,进而开发出分子机器人。
材料2:中科院上海硅酸盐研究所研制出了“药物分子运输车”。这种分子装载药物后,被引导到疾病靶点释放药物,对疾病进行高效治疗。
(1)根据上述材料,谈谈你对“分子运动”的新认识:__________________________。
(2)在阿西莫夫所写的科幻小说《梦幻航行》中,人被缩小到细胞般大小,在人体内经历了梦幻般的体验。试想,如果你被缩小到一个原子般大小,把你放到水里,你会看到的景象是______ ________,________________________。(写两点)
33.征服原子--揭开原子的神秘面纱
(1)1803年,近代化学之父,英国科学家道尔顿(DaltonJ)在前人研究的基础上,提出“道尔顿原子论”:一切物质都由原子构成,原子很小、呈圆球状、不可再分,而元素由微小的不可分的原子组成,不同元素的原子还可以简单数目比例形成不可再分的原子--“复杂原子”…但由于受当时实验条件限制,道尔顿无法用事实证明自己的观点。
1811年,意大利化学家阿伏加德罗提出:有些物质也是由分子构成,原子的基本工作形式是分子。
① 1897年,汤姆生通过实验发现了______,进一步发展了原子、分子论。汤姆生主要是纠正了“道尔顿原子论”中____ ________的观点。
② 1911年,卢瑟福又通过实验,推测原子是由_______________构成的,并提出了沿用至今的现代原子结构理论。
③ 道尔顿原子论中“复杂原子”构成的物质,按现在物质的组成分类,属于纯净物中的______。
(2)道尔顿的原子论,不是事实的归纳,而是思维的产物,体现了直觉和想象在科学创造中的作用。在科学研究中,像汤姆生和卢瑟福这样,根据实验现象进行解释的过程叫做______。原子是一种看不见、摸不着的微粒,为了帮助人们理解原子的结构,这三位科学家都运用了__________来表达他们的理论成果。
第2章 微粒的模型与符号(第1~4节)
参考答案
一、选择题(每小题只有一个正确答案,每小题2分,共40分)
1.B 2.C 3.A 4.D 5.A 6.A 7.D 8.A 9.C 10.B
11.B 12.D 13.D 14.C 15.B 16.A 17.B 18.B 19.C 20.C
二、填空题(每空1分,共32分)
21.(1)质子 夸克(2)分子 离子
22(1)1 1(2)质子 同位素
23.(1)④⑤ (2)③ (3)①②⑥ (4)①②⑦ (5)③(6)③⑤ (7)②(8)⑤⑥
24.(1)A(2)是否为混合物(3)稀有
25.(1)失去(2)B
26.(1)质子(2)2 2(3)失去
27.核电荷数 不同 不同
28. 24 3:2
29. 18 18
三、简答题(每空2分,共28分)
30.(1)化合物(2)原子(3)1:1
31.(1)乙(2)ABD
32.(1)人类可以控制分子进行定向移动(2)我在水分子之间穿行 不断运动的水分子时常撞到我
33.(1)①电子 原子不可再分 ② 原子核和核外电子
③ 化合物(2)推理 模型
第2章 微粒的模型与符号(第1~4节)
班级_______ 姓名_______ 学号_______ 得分_______
一、选择题(每小题只有一个正确答案,每小题2分,共40分)
1.模型常常可以帮助人们认识和理解一些不能直接观察的或复杂的事物,下列不属于模型的是( )
A.原子结构 B.接种疫苗 C.新冠病毒 D.二氧化碳分子
2.下列关于分子、原子的说法错误的是( )
A.分子和原子总在不断地运动 B.同种原子可能构成不同分子
C.分子的质量一定大于原子的质量 D.化学变化中分子可分、原子不可分
3.(2022·中考)医生建议缺铁性贫血患者多吃肝脏、瘦肉、蛋、鱼、豆类等食物来补铁。这里的“铁”指的是( )
A.元素 B.原子 C.分子 D.单质
4.中国古代哲学家用“金木水火土”五行理论,来说明世界万物的组成以及世界万物间的相互关系。“金木水火土”五行理论最接近于科学概念中的( )
A.原子 B.分子 C.离子 D.元素
5.思维导图有助于建构知识网络,如图是小金建立的有关物质宏观组成和微观构成的思维导图,则下列说法正确的是( )
A.①处是元素
B.①处是电子
C.②处是元素
D.②处是原子核
6.氚是氢的一种同位素,氟原子含有1个质子和2个中子。下列示意图中能正确表示气原子结构的是( )
7.科学家计划用质子数为20的钙原子,轰击核电荷数为98的铜元素靶,使两元素的原子核合并在一起,合成核电荷数为118的新元素。对此理解正确的是( )
A.新元素的原子核外电子数为116 B.变化过程中元素种类没有发生改变
C.这个变化属于化学变化 D.新元素的质子数为118
8.下列说法中正确的是( )
A.原子核内的质子数和核电荷数一定相等
B.原子核中的质子数和中子数一定相等
C.原子核一定是由质子和中子构成的
D.元素的化学性质取决于原子核内的质子数
9.如果用“o”表示氧原子,用“●”示硫原子,则下列模型可以表示二氧化硫分子(SO2)的是( )
10.人类对原子结构的认识经历了一个相当长的时期。以下是科学家及其提出的原子结构模型(如图所示),其中符合原子结构模型建立先后顺序的是( )
A.① →② →③ B.③ →② →① C.① →③ →② D.③ →① →②
11.(2022·中考)下列各图中●和〇表示不同元素的原子,其中不能表示纯净物的是( )
12.下列有关元素的组成说法错误的是( )
A.地壳中含量最多的元素是氧元素
B.空气中含量最多的元素是氮元素
C.人体中含量最多的元素是氧元素
D.海水中含量最多的元素是水元素
13.下列物质不是由原子直接构成的是( )
A.铜 B.金刚石 C. 氛气 D.碘
14.宏观辨识与微观探析是科学学科核心素养之一。对下列微观图示的理解正确的是( )
A.反应前后分子和原子的数目均发生改变
B.反应物属于化合物,属于单质
C.和组成元素相同,但化学性质不一样
D.生成物丙是由原子构成的
15.生物体死亡后,体内含有的碳-14会逐渐减少(称为衰变)。因此科学家可通过测量生物体遗散中碳-14的含量,来计算它存活的年代,这种方法称之为放射性碳测年法。碳-14原子核中含6个质子与8个中子,在衰变时,一个中子变成质子,形成新的原子核。下列关于新原子核的说法正确的是( )
A.碳原子核,含7个质子,8个中子
B.氮原子核,含7个质子,7个中子
C.碳原子核,含6个质子,7个中子
D.氧原子核,含7个质子,8个中子
16.分类是化学学科常见的思想方法之一。如图呈现的物质分类关系中①与②是
并列关系,③包含在②中。若②是纯净物,则③不可能是( )
A.空气 B.硝酸钾 C.氢气 D.二氧化氮
17.正电子、负质子等都是反粒子。它们跟通常所说的电子、质子相比较,质量相等但电性相反。科学家设想在宇宙中可能存在完全由反粒子构成的物质-反物质。物质与反物质相遇会产生“酒灭”现象,释放出巨大的能量,在能源研究领域中前景非常可观。请你推测,反氢原子的结构可能是( )
A.由一个带正电荷的质子与一个带负电荷的电子构成
B.由一个带负电荷的质子与一个带正电荷的电子构成
C.由一个带正电荷的质子与一个带正电荷的电子构成
D.由一个带负电荷的质子与一个带负电荷的电子构成
18.1911年,英国科学家卢瑟福进行了著名的α粒子轰击金箔实验,如图所示。根据
实验不能获得的结论是( )
A.金原子核带正电
B.金原子核外电子带负电
C.金原子核体积很小
D.金原子核的质量比α粒子大得多
19.下表中a、b、c各项之间不符合如图关系的是( )
20.有两种微粒,已知它们的质子数相等,核外电子数也相等。下列关于这两种微粒的说法错误的是( )
A.可能是一种分子和一种原子
B.可能是两种不同的离子
C.可能是一种分子和一种离子
D.可能是两种不同的分子
二、填空题(每空1分,共32分)
21.(1)原子核是由_______和中子构成的。而质子和中子又是由更小的微粒______构成的。_____
(2)我们生活的世界由丰富多彩的物质组成,物质是由微小的粒子构成,例如人类时刻也离不开的水是由______构成的,用作调味剂和防腐剂的氯化钠(食盐)是由______构成的。
22.如图代表氢的三种原子的原子核。
(1)这三种原子的原子核内均含有____个质子,核外都有____个电子。
(2)这三种原子因为______数相同,所以它们都是氢原子;但中子数不相同,因此它们是氢的_______。
23.在这一章中我们已经学习和接触了以下几种微粒:
① 分子 ② 原子 ③ 电子 ④ 原子核 ⑤ 质子 ⑥ 中子 ⑦ 离子(阳离子和阴离子),请用恰当的序号填空。
(1)带正电的是______。
(2)带负电的是____。
(3)不显电性的是_______。
(4)能直接构成物质的是_______。
(5)质量最小的是____。
(6)在同一原子中数目相等是______。
(7)化学变化中最小的粒子是____。
(8)质量与氢原子大约相等的是_____
24.下列四瓶气体,所含微粒模型如图所示,请根据模型将它们分为两类。
(1)根据你的分类结果,若其中一类气体只有一种,则这种气体是______(填字母)。
(2)你分类的依据是____________。
(3)C瓶气体可能是______气体。
25.如图,甲、乙为科学教材上的插图,请根据要求完成填空。
(1)图甲中的钠原子______(填“得到”或“失去”)电子变为钠离子。
(2)图乙是地壳中各种元素的质量分数图,表示硅元素的质量分数的是____(填“A”“B”或“C”)。
26.探测月壤是“嫦娥一号”的主要任务之一。因为月壤中蕴藏着丰富的
He-3,其原子结构如图所示。 He-3 是一种安全、高效的清洁燃料,它的
应用前景十分广阔。
(1)图中微粒“●”是______(填“质子”“中子”或“电子”)。
(2)He-4是He-3的同位素原子,则He-4中的质子个数是____,中子个数是____。
(3)α粒子是带两个单位正电荷的氨原子核,则氨原子转化为α粒子时,____两个电子。
27.铝原子(A)和铝离子(A13+)属于同一种元素,因为它们的________相同。A1和A3+属
于 (填“相同”或“不同”)的粒子,因为它们核外的电子总数______(填“相同”
或“不同”)。
目前流行的有氧洗衣方法是在洗衣的过程中释放出有强氧化性的臭氧分子。已知1
个臭氧分子由3个氧原子构成,则1个臭氧分子有_____个电子,1个臭氧分子与1个氧气分子的核电荷数之比为______。
29.(带2个单位负电荷的硫离子)微粒中的质子数是16,中子数是_____,核外电子
数是____。
三、简答题(每空2分,共28分)
30.如图是某化学变化的微观示意图,A、B、C分别表示不同类别的原子,据图回答下列问
题。
(1)由@微粒构成的物质属于______(填“单质”或“化合物”)。
(2)从示意图可以看出,化学变化中最小的微粒是______。
(3)该化学反应中,两种反应物的分子个数比为______。
31.人类对原子结构的认识,经历了汤姆生、卢瑟福和玻尔等提出的模型的过程。
(1)卢瑟福核式结构模型是利用α粒子轰击金箔实验的基础上提出的。下列能正确反映他的实验结果的示意图是____(填序号)。
(2)从原子结构模型建立的过程中,我们发现__________(填字母,可多选)。
A.科学家模型的建立是一个不断完善、不断修正的过程
B.模型在科学研究中起着很重要的作用
C.玻尔的原子模型建立,使人们对原子结构的认识达到了完美的境界
D.人类借助模型的建立,对原子的认识逐渐接近本质
32.根据下列材料,回答问题。
材料1:法国科学家利用特种显微仪器,让一个分子做出了各种动作。这一成果使人类能精确控制单个分子运动,进而开发出分子机器人。
材料2:中科院上海硅酸盐研究所研制出了“药物分子运输车”。这种分子装载药物后,被引导到疾病靶点释放药物,对疾病进行高效治疗。
(1)根据上述材料,谈谈你对“分子运动”的新认识:__________________________。
(2)在阿西莫夫所写的科幻小说《梦幻航行》中,人被缩小到细胞般大小,在人体内经历了梦幻般的体验。试想,如果你被缩小到一个原子般大小,把你放到水里,你会看到的景象是______ ________,________________________。(写两点)
33.征服原子--揭开原子的神秘面纱
(1)1803年,近代化学之父,英国科学家道尔顿(DaltonJ)在前人研究的基础上,提出“道尔顿原子论”:一切物质都由原子构成,原子很小、呈圆球状、不可再分,而元素由微小的不可分的原子组成,不同元素的原子还可以简单数目比例形成不可再分的原子--“复杂原子”…但由于受当时实验条件限制,道尔顿无法用事实证明自己的观点。
1811年,意大利化学家阿伏加德罗提出:有些物质也是由分子构成,原子的基本工作形式是分子。
① 1897年,汤姆生通过实验发现了______,进一步发展了原子、分子论。汤姆生主要是纠正了“道尔顿原子论”中____ ________的观点。
② 1911年,卢瑟福又通过实验,推测原子是由_______________构成的,并提出了沿用至今的现代原子结构理论。
③ 道尔顿原子论中“复杂原子”构成的物质,按现在物质的组成分类,属于纯净物中的______。
(2)道尔顿的原子论,不是事实的归纳,而是思维的产物,体现了直觉和想象在科学创造中的作用。在科学研究中,像汤姆生和卢瑟福这样,根据实验现象进行解释的过程叫做______。原子是一种看不见、摸不着的微粒,为了帮助人们理解原子的结构,这三位科学家都运用了__________来表达他们的理论成果。
第2章 微粒的模型与符号(第1~4节)
参考答案
一、选择题(每小题只有一个正确答案,每小题2分,共40分)
1.B 2.C 3.A 4.D 5.A 6.A 7.D 8.A 9.C 10.B
11.B 12.D 13.D 14.C 15.B 16.A 17.B 18.B 19.C 20.C
二、填空题(每空1分,共32分)
21.(1)质子 夸克(2)分子 离子
22(1)1 1(2)质子 同位素
23.(1)④⑤ (2)③ (3)①②⑥ (4)①②⑦ (5)③(6)③⑤ (7)②(8)⑤⑥
24.(1)A(2)是否为混合物(3)稀有
25.(1)失去(2)B
26.(1)质子(2)2 2(3)失去
27.核电荷数 不同 不同
28. 24 3:2
29. 18 18
三、简答题(每空2分,共28分)
30.(1)化合物(2)原子(3)1:1
31.(1)乙(2)ABD
32.(1)人类可以控制分子进行定向移动(2)我在水分子之间穿行 不断运动的水分子时常撞到我
33.(1)①电子 原子不可再分 ② 原子核和核外电子
③ 化合物(2)推理 模型
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
