化学沪教版九下课件:6.3 物质的溶解性(共31张PPT)
文档属性
| 名称 | 化学沪教版九下课件:6.3 物质的溶解性(共31张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-17 00:00:00 | ||
图片预览








文档简介
(共31张PPT)
第6章 溶解现象
第3节 物质的溶解性
课堂导入
我们知道,蔗糖或食盐很容易溶解在水中形成溶液。但是,它们能不能无限制地溶解在一定量的水中呢?
影响物质溶解性的因素
活动探究
[实验1]用量筒各量取 5mL水,分别加入A、B、C三试管中,再分别加入食盐、蔗糖、熟石灰各1g,振荡片刻,静置,观察物质的溶解情况。
食盐
蔗糖
熟石灰
水
水
水
你观察到的现象:
食盐、蔗糖在水中易于溶解,而熟石灰在水中不易溶解。
你得出的结论:
不同的物质在同一种溶剂中的溶解性不同。
影响物质溶解性的因素
结论②:
同一种物质在不同溶剂中的溶解性 ;
不同
即:
物质的溶解性与
有关。
溶剂性质 或
汽油
水
食用油
溶剂种类
几乎不能溶解,静置后分层
溶解
影响物质溶解性的因素
结论③:
同一种物质在同一 溶剂中的溶解性与 有关。
温度
冷水
硝酸钾
加热
固体没有
全部溶解
固体
全部溶解
影响物质溶解性的因素
编号 溶剂 溶质 现 象
1 水 碘
2 水 高锰酸钾
3 汽油 碘
4 汽油 高锰酸钾
①水是一种常用的溶剂,汽油、酒精也可以做溶剂;
②通过实验1、3或者2、4可知:______溶质在不同
溶剂里的溶解性______;
③通过实验1、2或者3、4可知:______溶质在同种
溶剂里的溶解性______;
结论
不同
同种
不同
不同
几乎不溶
溶解,溶液呈紫红色
溶解,溶液呈棕色
几乎不溶
影响物质溶解性的因素
影响物质溶解性的因素:
溶质性质(种类)
1.内因:
溶剂性质(种类)
2.外因:温度
⑴绝大部分固体物质的溶解性随着温度的升高而增强。
⑵极少数固体物质的溶解性随着温度的升高而减弱,如消石灰(氢氧化钙)。
影响物质溶解性的因素
交流与讨论
1.在日常生活中有许多事例说明物质的溶解性与溶质和溶剂的性质有关,同时也受温度的影响。请举例
人们常用酒精、汽油、氯仿、苯、香蕉水等作溶剂溶解难溶于水的物质。
2.你知道衣物是用什么物质来干洗的?
干洗剂。它能把不溶于水的污物溶解掉
影响物质溶解性的因素
加热烧杯,剩余的KNO3固体会有什么变化?
有固体剩余
加热
剩余固体全部溶解
再加5g硝酸钾
固体全部溶解
冷却至室温
有晶体析出
结论:在一定量水中,温度升高,最多能溶解的KNO3的量也增多。
结论:在一定量水中,温度降低,最多能溶解的KNO3的量也减少。
影响物质溶解性的因素
◆饱和溶液:
在一定的温度下,向一定量的溶剂里加入某种溶质,当溶质不能再溶解时,所得到的溶液叫做饱和溶液。
在一定的温度下,向一定量的溶剂里加入某种溶质,当溶质还能继续再溶解时,所得到的溶液叫做不饱和溶液。
◆不饱和溶液:
影响物质溶解性的因素
你有什么办法使:
①接近饱和的不饱和溶液变为饱和溶液?
②饱和溶液变为不饱和溶液?
增加溶质、
、降低温度
增加溶剂
、升高温度
蒸发溶剂
不饱和
溶 液
饱和
溶液
恰好饱和
注:以上为通常情况,不适合所有的物质。
最可靠的方法是:加溶质、蒸发溶剂
影响物质溶解性的因素
怎样判断溶液是否饱和?
1. 如果溶液中有未溶解的溶质, 观察能否继续溶解,若不能继续溶解,则是饱和溶液;反之,则是不饱和溶液。
2.如果溶液中无剩余物质,则加少量的溶质,溶质能继续溶解的是不饱和溶液,不能继续溶解的是饱和溶液。
影响物质溶解性的因素
浓、稀溶液与饱和、不饱和溶液的关系:
总结: 浓溶液不一定是饱和溶液,稀溶液不一定是不饱和溶液。
浓溶液
稀溶液
不饱和溶液
饱和溶液
用图示表示
物质溶解性的定量表示
如何区别食盐和蔗糖,在水中的溶解性大小?
一定温度
一定量的溶剂
达到饱和状态
溶解了的物质的质量
◆比较不同物质的溶解能力,应该控制的条件有哪些
在一定温度下,某固态物质在100克溶剂(通常是水)里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。
固体溶解度的概念
物质溶解性的定量表示
固体溶解度的四要素:
概括为:
剂、质、温、饱、
(记 着 温 饱)
条件 —— 一定温度
标准 —— 100克溶剂 (水)
状态 —— 饱和溶液
单位 —— 溶质的质量(克)
物质溶解性的定量表示
1. 20℃时,硝酸钾的溶解度是31.6克的意义?
(1) 20℃时,100克水中最多能溶解硝酸钾的质量为31.6克;
(2)20℃时,100克水中溶解了31.6克的硝酸钾就达到饱和状态。
温度 溶质的质量 溶剂的质量 饱和溶液的质量
20℃
31.6 g
100 g
131.6 g
2.20℃时硝酸钾的溶解度是31.6 g,这句话的含义是什么?将其关系代入下表:
m质:m剂:m液 = 31.6:100: 131.6
物质溶解性的定量表示
思考:我们在学习中常常遇到“易溶”“难溶”等概念,表示什么意思呢?
难溶
0.01g
1g
10g
可溶
易溶
溶解性
(20℃时溶解度)
数轴表示:
微溶
此时温度为室温
易溶物质 可溶物质 微溶物质 难(不)溶物质
0
>10g
1g~10g
﹤0.01g
0.01g~1g
物质溶解性的定量表示
溶解度的表示方法:
(1)表格法、列表法:
温度/℃ 0 10 20 30 40 50 60 70 80 90 100
溶解度/g NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3 37.8 38.4 39.0 39.8
KCl 27.6 31.0 34.0 37.0 40.0 42.6 45.5 48.3 51.1 54.0 56.7
NH4Cl 29.4 33.3 37.2 41.4 45.8 50.4 55.2 60.2 65.6 71.3 77.3
KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110 138 169 202 246
几种物质在不同温度时的溶解度
物质溶解性的定量表示
(2)溶解度曲线
几种物质的溶解度曲线
物质溶解性的定量表示
氢氧化钙的溶解度曲线
1. 大多数物质的溶解度随温度的升高而增大。
2. 少数物质的溶解度随温度的升高变化不大。
3. 极少数物质的溶解度随温度的升高而变小。
物质溶解性的定量表示
曲线上的点:
两条线的交点:
曲线上方的点:
曲线下方的点:
该温度某物质的溶解度
该温度下两种物质的溶解度相同
该温度下的过饱和溶液
该温度下的不饱和溶液
溶解度曲线中点的含义是:
曲线的含义:曲线越陡,该物质的溶解度受温度影响越大。
物质溶解性的定量表示
拓展视野
气体的溶解度与什么有关系呢?
【思考】1.打开汽水盖时,汽水会自动喷出来,这说明气体在水中的溶解度与什么有关?
2.喝了汽水后,常常会打嗝。这说明气体的溶解度还与什么有关?
3.用什么方法确定汽水中溶解的气体是二氧化碳?
温度:温度升高,气体在水中的溶解度减小。
压强:压强减小,气体在水中的溶解度减小。
收集气体,通入澄清石灰水中,看石灰水是否会变浑浊
物质溶解性的定量表示
气体溶解度一般随压强增大而增大,随压强减小而减小
气体溶解度一般随温度升高而减小,随温度降低而增大。
总结:气体溶解度的影响因素
气体溶解度:是一个比值
气体 氧气 氯气 二氧化硫 氯化氢 氨气
溶解度 1:0.03 1:2 1:40 1:500 1:700
1标准大气压下,20℃时部分气体的溶解度
结晶
结晶及其方法
热的溶液冷却后,已溶解在溶液中的硝酸钾从溶液中以晶体的形式析出,这一过程叫做结晶。
冷却后硝酸钾晶体从溶液中析出
硝酸钾晶体
1. 冷却热饱和溶液
结晶
蒸发结晶
2. 采用蒸发溶剂的方法使溶质结晶。
一般适用于溶解度受温度影响小的固体物质,如NaCl。
从上述实验可知,在一定条件下,可以使固体物质从它的水溶液中析出晶体的过程叫做结晶。
结晶
硫酸铜晶体
食盐晶体
重铬酸钾晶体
硝酸钾晶体
氯化铜晶体
明矾晶体
从溶液中析出的具有规则的几何外形的固体 叫做晶体
结晶
小结
降温结晶:冷却热饱和溶液;适用于溶解度受温度影响大的可溶物(如:KNO3)。
蒸发结晶:蒸发溶剂;适用于溶解度受温度影响小的可溶物(如:NaCl)。
(3)结晶方法分类
(1)晶体:具有规则几何外形的固体。
(2)晶体的性质:晶体有一定的熔点。
结晶
海水
贮水池
蒸发池
结晶池
食盐
母液
氯化钠
多种化工产品
人们利用以上原理从海水中提取食盐,并得到含有大量化工原料的母液(叫做苦卤),其大致过程如下:
典例讲解
1. 取少量下列家庭常见物质,放入水中,充分搅拌,不能完全溶解的是:( )
A. 食醋 B. 蔗糖
C. 金龙鱼食用调和油 D. 食盐
2. 小明和小芳两位同学分别在自己的杯子里倒了相同体积的白开水,小明用的 是热开水,小芳用的是冷开水,随后,他们很快在自己各自的杯子里溶解食糖,两位同学都将食糖溶解到不能再溶解为止。则结果是:( )
A. 小明的糖水更甜
B. 小芳的糖水更甜
C. 小明溶解的速度比小芳慢
D. 两杯水一样甜
C
A
典例讲解
3.甲、乙两种物质的溶解度曲线如右图所示,
下列说法中正确的是( )
A.30℃时,50 g水可以溶解25 g甲物质
B.升温能使甲物质的不饱和溶液变为饱和溶液
C.20℃时,甲、乙两种物质的溶解度相同
D.30℃时,乙物质的溶解度比甲物质的溶解度大
C
典例讲解
4. 如图所示是a、b、c三种物质的溶解度曲线图。
(1)t2℃时,a、b、c三种物质的溶解度由大到小的顺序是 。
(2)将t2℃时,一定质量c饱和溶液升温至t3℃(不考虑水分蒸发),此时该溶液属于 溶液(填“饱和”或“、不饱和”)。
a=b>c
饱和
第6章 溶解现象
第3节 物质的溶解性
课堂导入
我们知道,蔗糖或食盐很容易溶解在水中形成溶液。但是,它们能不能无限制地溶解在一定量的水中呢?
影响物质溶解性的因素
活动探究
[实验1]用量筒各量取 5mL水,分别加入A、B、C三试管中,再分别加入食盐、蔗糖、熟石灰各1g,振荡片刻,静置,观察物质的溶解情况。
食盐
蔗糖
熟石灰
水
水
水
你观察到的现象:
食盐、蔗糖在水中易于溶解,而熟石灰在水中不易溶解。
你得出的结论:
不同的物质在同一种溶剂中的溶解性不同。
影响物质溶解性的因素
结论②:
同一种物质在不同溶剂中的溶解性 ;
不同
即:
物质的溶解性与
有关。
溶剂性质 或
汽油
水
食用油
溶剂种类
几乎不能溶解,静置后分层
溶解
影响物质溶解性的因素
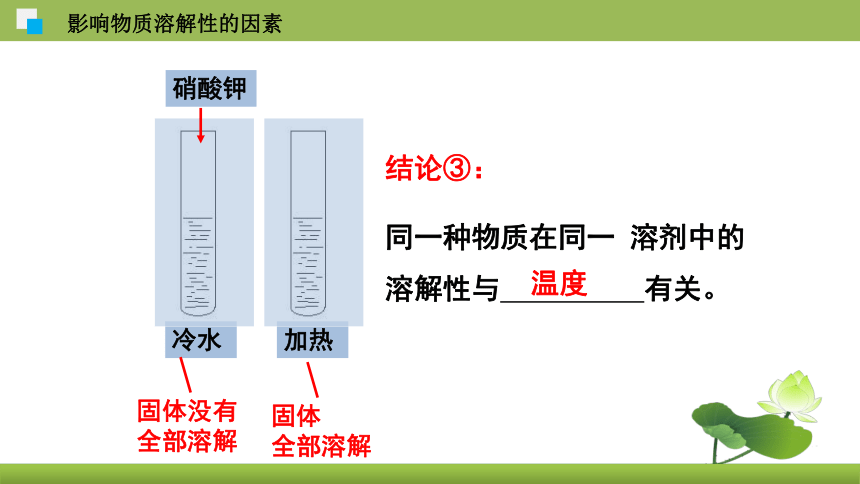
结论③:
同一种物质在同一 溶剂中的溶解性与 有关。
温度
冷水
硝酸钾
加热
固体没有
全部溶解
固体
全部溶解
影响物质溶解性的因素
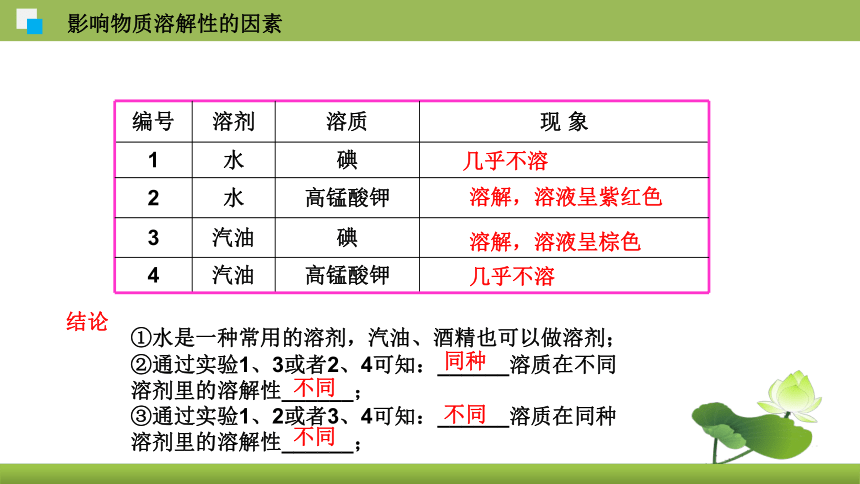
编号 溶剂 溶质 现 象
1 水 碘
2 水 高锰酸钾
3 汽油 碘
4 汽油 高锰酸钾
①水是一种常用的溶剂,汽油、酒精也可以做溶剂;
②通过实验1、3或者2、4可知:______溶质在不同
溶剂里的溶解性______;
③通过实验1、2或者3、4可知:______溶质在同种
溶剂里的溶解性______;
结论
不同
同种
不同
不同
几乎不溶
溶解,溶液呈紫红色
溶解,溶液呈棕色
几乎不溶
影响物质溶解性的因素
影响物质溶解性的因素:
溶质性质(种类)
1.内因:
溶剂性质(种类)
2.外因:温度
⑴绝大部分固体物质的溶解性随着温度的升高而增强。
⑵极少数固体物质的溶解性随着温度的升高而减弱,如消石灰(氢氧化钙)。
影响物质溶解性的因素
交流与讨论
1.在日常生活中有许多事例说明物质的溶解性与溶质和溶剂的性质有关,同时也受温度的影响。请举例
人们常用酒精、汽油、氯仿、苯、香蕉水等作溶剂溶解难溶于水的物质。
2.你知道衣物是用什么物质来干洗的?
干洗剂。它能把不溶于水的污物溶解掉
影响物质溶解性的因素
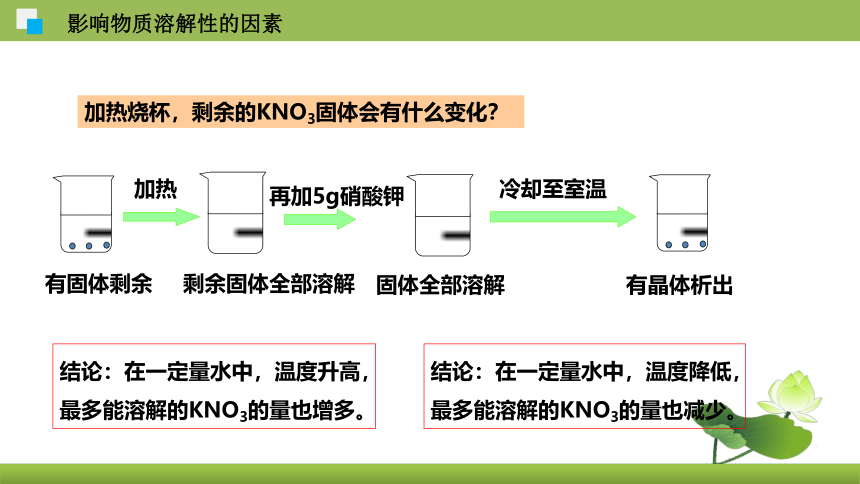
加热烧杯,剩余的KNO3固体会有什么变化?
有固体剩余
加热
剩余固体全部溶解
再加5g硝酸钾
固体全部溶解
冷却至室温
有晶体析出
结论:在一定量水中,温度升高,最多能溶解的KNO3的量也增多。
结论:在一定量水中,温度降低,最多能溶解的KNO3的量也减少。
影响物质溶解性的因素
◆饱和溶液:
在一定的温度下,向一定量的溶剂里加入某种溶质,当溶质不能再溶解时,所得到的溶液叫做饱和溶液。
在一定的温度下,向一定量的溶剂里加入某种溶质,当溶质还能继续再溶解时,所得到的溶液叫做不饱和溶液。
◆不饱和溶液:
影响物质溶解性的因素
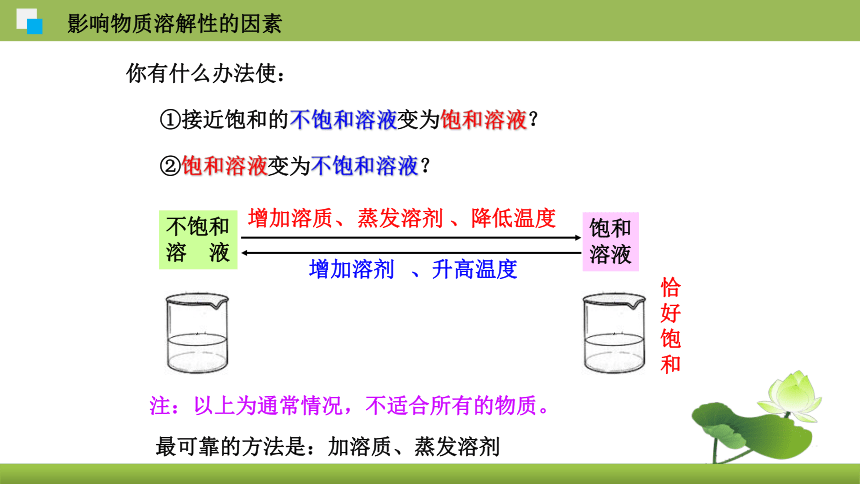
你有什么办法使:
①接近饱和的不饱和溶液变为饱和溶液?
②饱和溶液变为不饱和溶液?
增加溶质、
、降低温度
增加溶剂
、升高温度
蒸发溶剂
不饱和
溶 液
饱和
溶液
恰好饱和
注:以上为通常情况,不适合所有的物质。
最可靠的方法是:加溶质、蒸发溶剂
影响物质溶解性的因素
怎样判断溶液是否饱和?
1. 如果溶液中有未溶解的溶质, 观察能否继续溶解,若不能继续溶解,则是饱和溶液;反之,则是不饱和溶液。
2.如果溶液中无剩余物质,则加少量的溶质,溶质能继续溶解的是不饱和溶液,不能继续溶解的是饱和溶液。
影响物质溶解性的因素
浓、稀溶液与饱和、不饱和溶液的关系:
总结: 浓溶液不一定是饱和溶液,稀溶液不一定是不饱和溶液。
浓溶液
稀溶液
不饱和溶液
饱和溶液
用图示表示
物质溶解性的定量表示
如何区别食盐和蔗糖,在水中的溶解性大小?
一定温度
一定量的溶剂
达到饱和状态
溶解了的物质的质量
◆比较不同物质的溶解能力,应该控制的条件有哪些
在一定温度下,某固态物质在100克溶剂(通常是水)里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。
固体溶解度的概念
物质溶解性的定量表示
固体溶解度的四要素:
概括为:
剂、质、温、饱、
(记 着 温 饱)
条件 —— 一定温度
标准 —— 100克溶剂 (水)
状态 —— 饱和溶液
单位 —— 溶质的质量(克)
物质溶解性的定量表示
1. 20℃时,硝酸钾的溶解度是31.6克的意义?
(1) 20℃时,100克水中最多能溶解硝酸钾的质量为31.6克;
(2)20℃时,100克水中溶解了31.6克的硝酸钾就达到饱和状态。
温度 溶质的质量 溶剂的质量 饱和溶液的质量
20℃
31.6 g
100 g
131.6 g
2.20℃时硝酸钾的溶解度是31.6 g,这句话的含义是什么?将其关系代入下表:
m质:m剂:m液 = 31.6:100: 131.6
物质溶解性的定量表示
思考:我们在学习中常常遇到“易溶”“难溶”等概念,表示什么意思呢?
难溶
0.01g
1g
10g
可溶
易溶
溶解性
(20℃时溶解度)
数轴表示:
微溶
此时温度为室温
易溶物质 可溶物质 微溶物质 难(不)溶物质
0
>10g
1g~10g
﹤0.01g
0.01g~1g
物质溶解性的定量表示
溶解度的表示方法:
(1)表格法、列表法:
温度/℃ 0 10 20 30 40 50 60 70 80 90 100
溶解度/g NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3 37.8 38.4 39.0 39.8
KCl 27.6 31.0 34.0 37.0 40.0 42.6 45.5 48.3 51.1 54.0 56.7
NH4Cl 29.4 33.3 37.2 41.4 45.8 50.4 55.2 60.2 65.6 71.3 77.3
KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110 138 169 202 246
几种物质在不同温度时的溶解度
物质溶解性的定量表示
(2)溶解度曲线
几种物质的溶解度曲线
物质溶解性的定量表示
氢氧化钙的溶解度曲线
1. 大多数物质的溶解度随温度的升高而增大。
2. 少数物质的溶解度随温度的升高变化不大。
3. 极少数物质的溶解度随温度的升高而变小。
物质溶解性的定量表示
曲线上的点:
两条线的交点:
曲线上方的点:
曲线下方的点:
该温度某物质的溶解度
该温度下两种物质的溶解度相同
该温度下的过饱和溶液
该温度下的不饱和溶液
溶解度曲线中点的含义是:
曲线的含义:曲线越陡,该物质的溶解度受温度影响越大。
物质溶解性的定量表示
拓展视野
气体的溶解度与什么有关系呢?
【思考】1.打开汽水盖时,汽水会自动喷出来,这说明气体在水中的溶解度与什么有关?
2.喝了汽水后,常常会打嗝。这说明气体的溶解度还与什么有关?
3.用什么方法确定汽水中溶解的气体是二氧化碳?
温度:温度升高,气体在水中的溶解度减小。
压强:压强减小,气体在水中的溶解度减小。
收集气体,通入澄清石灰水中,看石灰水是否会变浑浊
物质溶解性的定量表示
气体溶解度一般随压强增大而增大,随压强减小而减小
气体溶解度一般随温度升高而减小,随温度降低而增大。
总结:气体溶解度的影响因素
气体溶解度:是一个比值
气体 氧气 氯气 二氧化硫 氯化氢 氨气
溶解度 1:0.03 1:2 1:40 1:500 1:700
1标准大气压下,20℃时部分气体的溶解度
结晶
结晶及其方法
热的溶液冷却后,已溶解在溶液中的硝酸钾从溶液中以晶体的形式析出,这一过程叫做结晶。
冷却后硝酸钾晶体从溶液中析出
硝酸钾晶体
1. 冷却热饱和溶液
结晶
蒸发结晶
2. 采用蒸发溶剂的方法使溶质结晶。
一般适用于溶解度受温度影响小的固体物质,如NaCl。
从上述实验可知,在一定条件下,可以使固体物质从它的水溶液中析出晶体的过程叫做结晶。
结晶
硫酸铜晶体
食盐晶体
重铬酸钾晶体
硝酸钾晶体
氯化铜晶体
明矾晶体
从溶液中析出的具有规则的几何外形的固体 叫做晶体
结晶
小结
降温结晶:冷却热饱和溶液;适用于溶解度受温度影响大的可溶物(如:KNO3)。
蒸发结晶:蒸发溶剂;适用于溶解度受温度影响小的可溶物(如:NaCl)。
(3)结晶方法分类
(1)晶体:具有规则几何外形的固体。
(2)晶体的性质:晶体有一定的熔点。
结晶
海水
贮水池
蒸发池
结晶池
食盐
母液
氯化钠
多种化工产品
人们利用以上原理从海水中提取食盐,并得到含有大量化工原料的母液(叫做苦卤),其大致过程如下:
典例讲解
1. 取少量下列家庭常见物质,放入水中,充分搅拌,不能完全溶解的是:( )
A. 食醋 B. 蔗糖
C. 金龙鱼食用调和油 D. 食盐
2. 小明和小芳两位同学分别在自己的杯子里倒了相同体积的白开水,小明用的 是热开水,小芳用的是冷开水,随后,他们很快在自己各自的杯子里溶解食糖,两位同学都将食糖溶解到不能再溶解为止。则结果是:( )
A. 小明的糖水更甜
B. 小芳的糖水更甜
C. 小明溶解的速度比小芳慢
D. 两杯水一样甜
C
A
典例讲解
3.甲、乙两种物质的溶解度曲线如右图所示,
下列说法中正确的是( )
A.30℃时,50 g水可以溶解25 g甲物质
B.升温能使甲物质的不饱和溶液变为饱和溶液
C.20℃时,甲、乙两种物质的溶解度相同
D.30℃时,乙物质的溶解度比甲物质的溶解度大
C
典例讲解
4. 如图所示是a、b、c三种物质的溶解度曲线图。
(1)t2℃时,a、b、c三种物质的溶解度由大到小的顺序是 。
(2)将t2℃时,一定质量c饱和溶液升温至t3℃(不考虑水分蒸发),此时该溶液属于 溶液(填“饱和”或“、不饱和”)。
a=b>c
饱和
