2022-2023学年沪教版 九年级化学下册同步精品课堂 6.3 物质的溶解性(第3课时)课件 (共18张PPT)
文档属性
| 名称 | 2022-2023学年沪教版 九年级化学下册同步精品课堂 6.3 物质的溶解性(第3课时)课件 (共18张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 7.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-18 16:35:27 | ||
图片预览





文档简介
(共18张PPT)
第3节 物质的溶解性
(第3课时)
第6章 溶解现象
【学习目标】
1. 了解使饱和溶液结晶的方法。
2. 了解结晶现象及其在生产、生活中的应用。
从溶液中析出晶体的过程。
具有规则的几何外形的固体
一、结晶
1. 概念
美丽的晶体
海
水
晒
盐
原理:借助日光和风力使水分蒸发,得到食盐
一、结晶
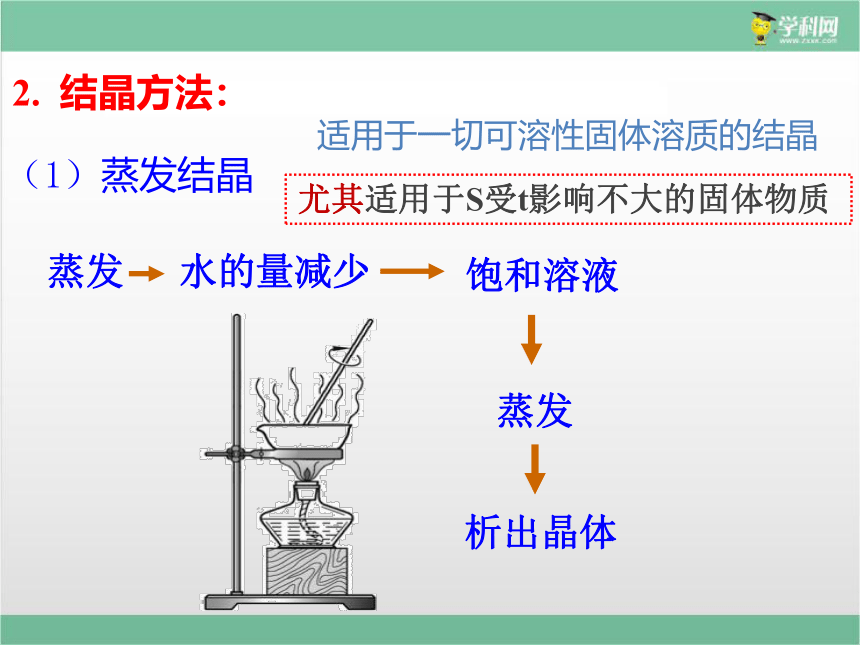
2. 结晶方法:
(1)蒸发结晶
水的量减少
蒸发
蒸发
析出晶体
饱和溶液
2. 结晶方法:
(1)蒸发结晶
适用于一切可溶性固体溶质的结晶
尤其适用于S受t影响不大的固体物质
操作要点
(1)蒸发皿中的液体量不能超过蒸发皿容积的2/3。
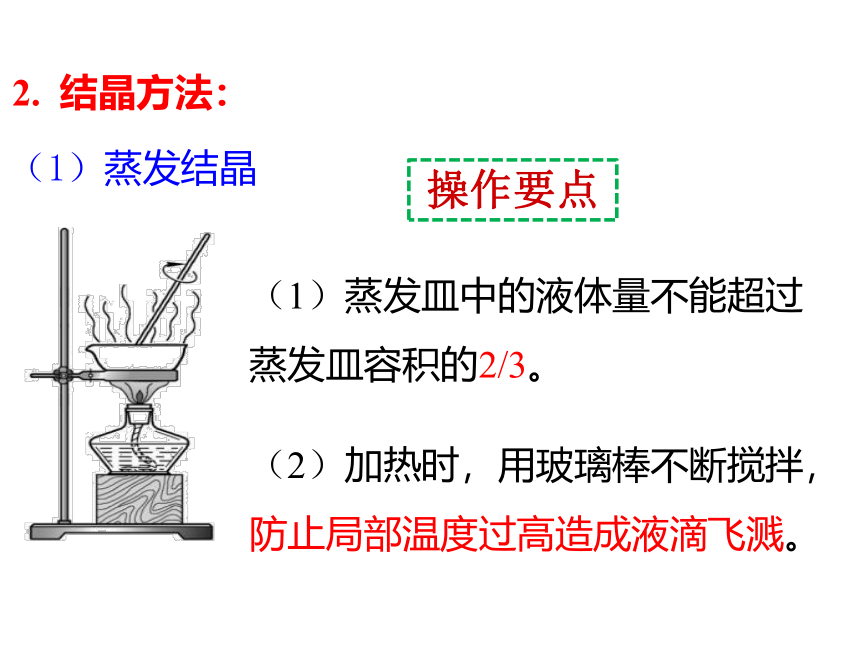
2. 结晶方法:
(1)蒸发结晶
(2)加热时,用玻璃棒不断搅拌,防止局部温度过高造成液滴飞溅。
(3)当蒸发皿中出现较多量固体时,停止加热,并用玻璃棒不断搅拌,利用余热将剩余水分蒸干。
2. 结晶方法:
(1)蒸发结晶
操作要点
(4)热的蒸发皿用坩埚钳夹持放在石棉网上,以免烫坏实验桌。
溶解度/
g
200
100
60
70
50
10
20
30
40
80
90
100
110
180
170
160
150
140
130
120
190
50
10
20
30
40
0
90
60
70
80
温度/℃
①
②
90℃时,109g的某物质溶在100g水中得到溶液①
③
④
溶液①
降温至
60℃
溶液②
溶液③
降温至
40℃
溶液④
降温至
20℃
2. 结晶方法:
(2)降温结晶
适用于S受t影响较大的固体溶质
溶解度/
g
200
100
60
70
50
10
20
30
40
80
90
100
110
180
170
160
150
140
130
120
190
50
10
20
30
40
0
90
60
70
80
温度/℃
①
②
③
④
用“变大”“变小”“不变”填表
变化 过程 溶质质量 溶剂质量 溶液质量 溶质质量分数 溶解度
①→②
②→③
③→④
不变
不变
不变
不变
变小
变小
不变
变小
变小
变小
变小
不变
变小
变小
变小
我国有许多盐碱地,湖水中溶有大量的氯化钠和纯碱,那里的农民夏天晒盐、冬天捞碱,试用你学过的知识说明其中的道理。
温度/℃ 0 10 20 40 60 80 100
氯化钠/克 35.7 35.8 36 36.6 37.3 38.4 39.8
温度/℃ 0 10 20 30 … … 90
纯碱/克 7.1 12.5 21.5 38.8 … … 43.9
氯化钠和纯碱在不同温度下的溶解度
【交流讨论】
小红军为游击队送食盐
缺盐
筹盐
送盐
煮盐
结晶
(1)从溶液中得到固体溶质
一、结晶
3. 结晶的应用:
①将S受t影响较大的固体溶质从其水溶液中析出
降温结晶(冷却热饱和溶液)法
②将S受t变化不大的固体溶质从其水溶液中析出
蒸发结晶(蒸发溶剂)法
硝酸钾(氯化钠) 硝酸钾
提纯
①配制热的饱和溶液
(溶解 加热浓缩/蒸发浓缩)
溶解度受温度影响大
溶解度受温
度影响小
②降温结晶
③过滤
(2)提纯可溶性固体混合物
3. 结晶的应用:
具体操作:
降温结晶法
氯化钠(硝酸钾) 氯化钠
提纯
①溶解
溶解度受温度影响小
溶解度受温度影响大
②蒸发结晶(大部分固体析出)
③趁热过滤
(2)提纯可溶性固体混合物
3. 结晶的应用:
蒸发结晶法
具体操作:
如何制作硫酸铜晶体?
药品:
步骤:
硫酸铜固体
1. 热水溶解,制成热饱和溶液
【交流讨论】
2. 降温结晶
1.(2022·江苏无锡)NaCl、KCl、MgCl2的溶解度曲线如图所示。下列叙述正确的是( )
A.80℃时,KCl的溶解度比NaCl小
B.t℃时,NaCl和KCl的溶解度相同
C.t℃时,KCl饱和溶液的质量分数为40%
D.NaCl中含有少量MgCl2,可以采用降温结晶的方法提纯NaCl
【中考链接】
B
2.(2022·四川巴中)如图为KNO3、NaCl两种物质的溶解度曲线,下列说法正确的是( )
A.a1℃时,向100g水中加入20gKNO3,
充分溶解后所得溶液是饱和溶液
B.KNO3和NaCl的溶解度相等
C.当KNO3中含有少量NaCl时,可以用蒸发结晶的方法提纯KNO3
D.将a2℃时等质量的NaCl与KNO3的饱和溶液降温到a1℃,所得溶液中溶质质量NaCl大于KNO3
【中考链接】
D
3.(2022·湖北恩施)甲、乙两种物质溶解度曲线如图所示。下列说法正确的是( )
A.a1℃时,甲、乙的溶解度相同
B.甲的溶解度受温度影响比乙小
C.当甲中混有少量乙时,可采用蒸发的方法提纯甲
D.a2℃时,在100g水中加入30g甲,形成饱和溶液
【中考链接】
A
第3节 物质的溶解性
(第3课时)
第6章 溶解现象
【学习目标】
1. 了解使饱和溶液结晶的方法。
2. 了解结晶现象及其在生产、生活中的应用。
从溶液中析出晶体的过程。
具有规则的几何外形的固体
一、结晶
1. 概念
美丽的晶体
海
水
晒
盐
原理:借助日光和风力使水分蒸发,得到食盐
一、结晶
2. 结晶方法:
(1)蒸发结晶
水的量减少
蒸发
蒸发
析出晶体
饱和溶液
2. 结晶方法:
(1)蒸发结晶
适用于一切可溶性固体溶质的结晶
尤其适用于S受t影响不大的固体物质
操作要点
(1)蒸发皿中的液体量不能超过蒸发皿容积的2/3。
2. 结晶方法:
(1)蒸发结晶
(2)加热时,用玻璃棒不断搅拌,防止局部温度过高造成液滴飞溅。
(3)当蒸发皿中出现较多量固体时,停止加热,并用玻璃棒不断搅拌,利用余热将剩余水分蒸干。
2. 结晶方法:
(1)蒸发结晶
操作要点
(4)热的蒸发皿用坩埚钳夹持放在石棉网上,以免烫坏实验桌。
溶解度/
g
200
100
60
70
50
10
20
30
40
80
90
100
110
180
170
160
150
140
130
120
190
50
10
20
30
40
0
90
60
70
80
温度/℃
①
②
90℃时,109g的某物质溶在100g水中得到溶液①
③
④
溶液①
降温至
60℃
溶液②
溶液③
降温至
40℃
溶液④
降温至
20℃
2. 结晶方法:
(2)降温结晶
适用于S受t影响较大的固体溶质
溶解度/
g
200
100
60
70
50
10
20
30
40
80
90
100
110
180
170
160
150
140
130
120
190
50
10
20
30
40
0
90
60
70
80
温度/℃
①
②
③
④
用“变大”“变小”“不变”填表
变化 过程 溶质质量 溶剂质量 溶液质量 溶质质量分数 溶解度
①→②
②→③
③→④
不变
不变
不变
不变
变小
变小
不变
变小
变小
变小
变小
不变
变小
变小
变小
我国有许多盐碱地,湖水中溶有大量的氯化钠和纯碱,那里的农民夏天晒盐、冬天捞碱,试用你学过的知识说明其中的道理。
温度/℃ 0 10 20 40 60 80 100
氯化钠/克 35.7 35.8 36 36.6 37.3 38.4 39.8
温度/℃ 0 10 20 30 … … 90
纯碱/克 7.1 12.5 21.5 38.8 … … 43.9
氯化钠和纯碱在不同温度下的溶解度
【交流讨论】
小红军为游击队送食盐
缺盐
筹盐
送盐
煮盐
结晶
(1)从溶液中得到固体溶质
一、结晶
3. 结晶的应用:
①将S受t影响较大的固体溶质从其水溶液中析出
降温结晶(冷却热饱和溶液)法
②将S受t变化不大的固体溶质从其水溶液中析出
蒸发结晶(蒸发溶剂)法
硝酸钾(氯化钠) 硝酸钾
提纯
①配制热的饱和溶液
(溶解 加热浓缩/蒸发浓缩)
溶解度受温度影响大
溶解度受温
度影响小
②降温结晶
③过滤
(2)提纯可溶性固体混合物
3. 结晶的应用:
具体操作:
降温结晶法
氯化钠(硝酸钾) 氯化钠
提纯
①溶解
溶解度受温度影响小
溶解度受温度影响大
②蒸发结晶(大部分固体析出)
③趁热过滤
(2)提纯可溶性固体混合物
3. 结晶的应用:
蒸发结晶法
具体操作:
如何制作硫酸铜晶体?
药品:
步骤:
硫酸铜固体
1. 热水溶解,制成热饱和溶液
【交流讨论】
2. 降温结晶
1.(2022·江苏无锡)NaCl、KCl、MgCl2的溶解度曲线如图所示。下列叙述正确的是( )
A.80℃时,KCl的溶解度比NaCl小
B.t℃时,NaCl和KCl的溶解度相同
C.t℃时,KCl饱和溶液的质量分数为40%
D.NaCl中含有少量MgCl2,可以采用降温结晶的方法提纯NaCl
【中考链接】
B
2.(2022·四川巴中)如图为KNO3、NaCl两种物质的溶解度曲线,下列说法正确的是( )
A.a1℃时,向100g水中加入20gKNO3,
充分溶解后所得溶液是饱和溶液
B.KNO3和NaCl的溶解度相等
C.当KNO3中含有少量NaCl时,可以用蒸发结晶的方法提纯KNO3
D.将a2℃时等质量的NaCl与KNO3的饱和溶液降温到a1℃,所得溶液中溶质质量NaCl大于KNO3
【中考链接】
D
3.(2022·湖北恩施)甲、乙两种物质溶解度曲线如图所示。下列说法正确的是( )
A.a1℃时,甲、乙的溶解度相同
B.甲的溶解度受温度影响比乙小
C.当甲中混有少量乙时,可采用蒸发的方法提纯甲
D.a2℃时,在100g水中加入30g甲,形成饱和溶液
【中考链接】
A
