第6章溶解现象检测题(含答案)---2022-2023学年九年级化学沪教版(全国)下册
文档属性
| 名称 | 第6章溶解现象检测题(含答案)---2022-2023学年九年级化学沪教版(全国)下册 |  | |
| 格式 | docx | ||
| 文件大小 | 107.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-21 12:41:06 | ||
图片预览


文档简介
第6章《溶解现象》检测题
一、单选题
1.下列关于实验现象的描述错误的是
A.高锰酸钾几乎不溶于汽油 B.电解水产生的两种气体的质量比是1:2
C.镁条在空气中燃烧放出耀眼的强光 D.水和植物油混合后用力振荡可形成乳浊液
2.把20%的硝酸钾溶液加水稀释成10%的硝酸钾溶液,则所加水的质量为( )
A. B. C. D.
3.某温度时,向水中加入蔗糖,搅拌后,还剩余蔗糖未溶解,则这时溶液的质量为( )
A. B. C. D.
4.有100g 10%的盐酸溶液,要使其溶质质量分数增大一倍,应采取的方法是( )
A.把溶液的量倒掉一半
B.溶质的质量增大一倍
C.将100g 10%的盐酸与200g 25%的盐酸混合
D.蒸发掉50g溶剂
5.在实验室中用氯化钠和水配制100g质量分数为16%的氯化钠溶液并装瓶备用。下列说法不正确的是
A.通过计算可知所需氯化钠的质量为16g
B.所需玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管、试剂瓶
C.实验的主要步骤是计算、称量、量取、溶解、装瓶
D.用量筒量取水时仰视读数,所配得溶液的溶质质量分数偏大
6.实验室配制 50g 质量分数为 6%的氯化钠溶液时,下列说法正确的是
A.配制该溶液需要称量 3g 氯化钠,量取 50mL 蒸馏水
B.称量氯化钠时,只需在盛放氯化钠的右盘垫一张纸
C.用玻璃棒搅拌是为了增大氯化钠的溶解度
D.量取蒸馏水时俯视读数,所配溶液溶质质量分数偏大
7.下列物质中,常温下易溶于水的是
A.氢气 B.粉笔灰 C.蔗糖 D.植物油
8.下列关于溶液的说法正确的是( )
A.从一杯质量分数为10%的食盐溶液中倒出一半,余下的溶液质量分数为5%
B.某饱和溶液降温后析出晶体,此时它就变成不饱和溶液
C.向某物质的饱和溶液中加少量该物质,恒温下放置一定时间后,溶液中的溶质质量分数变大
D.稀溶液可能是饱和溶液,浓溶液也可能是不饱和溶液
9.甲、乙两种固体的溶解度曲线如图所示,下列说法正确的是
A.甲的溶解度大于乙的溶解度
B.t1℃时,甲和乙的溶液中溶质的质量分数相等
C.t2℃时,60g甲的饱和溶液稀释到20%需加水40g
D.将t1℃时相等质量的甲、乙的饱和溶液升温到t2℃,溶液中溶质的质量甲大于乙
10.下图是a、b两种固体物质的溶解度曲线,下列说法中正确的是
A.a中含有少量b时,一般用蒸发溶剂的方法提纯a
B.t℃时,a、b饱和溶液中含有的溶质质量a大于b
C.当温度大于t℃时,a溶液一定比b溶液浓
D.a物质的溶解度受温度变化的影响较大
11.下列对于“一定”说法正确的是( )
A.化合物一定由分子构成 B.单质一定由原子构成
C.溶液和合金一定是混合物 D.固体和液体构成的一定是混合物
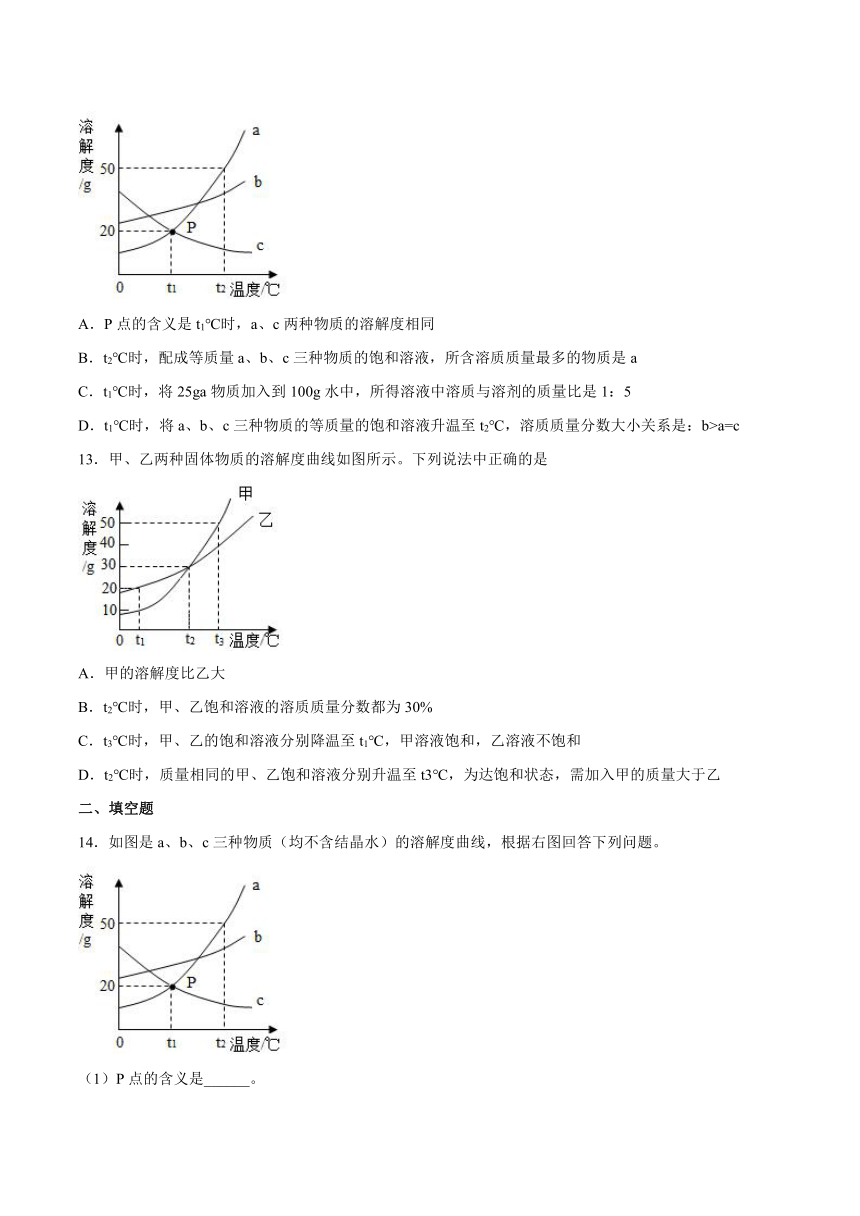
12.如下图是a、b、c三种物质(均不含结晶水)的溶解度曲线,下列说法错误的是
A.P点的含义是t1℃时,a、c两种物质的溶解度相同
B.t2℃时,配成等质量a、b、c三种物质的饱和溶液,所含溶质质量最多的物质是a
C.t1℃时,将25ga物质加入到100g水中,所得溶液中溶质与溶剂的质量比是1:5
D.t1℃时,将a、b、c三种物质的等质量的饱和溶液升温至t2℃,溶质质量分数大小关系是:b>a=c
13.甲、乙两种固体物质的溶解度曲线如图所示。下列说法中正确的是
A.甲的溶解度比乙大
B.t2℃时,甲、乙饱和溶液的溶质质量分数都为30%
C.t3℃时,甲、乙的饱和溶液分别降温至t1℃,甲溶液饱和,乙溶液不饱和
D.t2℃时,质量相同的甲、乙饱和溶液分别升温至t3℃,为达饱和状态,需加入甲的质量大于乙
二、填空题
14.如图是a、b、c三种物质(均不含结晶水)的溶解度曲线,根据右图回答下列问题。
(1)P点的含义是______。
(2)t2°C时,a、b、c三种物质的溶解度由大到小的顺序是______。
(3)t1℃时,将25ga物质加入到100g水中,充分搅拌溶解后恢复到原温度,所得溶液中溶质与溶剂的质量比是______(最简整数比)。
(4)t2℃时,将a、b、c三种物质的等质量的饱和溶液降温至t1℃,下列说法正确的是______。
A都是饱和溶液 B溶质质量分数大小关系是:b>a>c C析出晶体质量最多的是a
15.比较和分类是重要的学习方法。
(1)17中元帅实验小组同学想用氯化钠和水配制50g溶质质量分数为5%的氯化钠溶液,他们分析到在实验过程中会出现以下一些情况:请根据最终导致溶质质量分数偏大或偏小的情况进行分类:
①你的分类依据:_______;
②包含的选项______(填字母)a.称量固体质量,物品和砝码放颠倒了;b.固体氯化钠中含有杂质;c.量取水时,俯视量筒;d.实验前烧杯中有水;e.实验前量筒中有水;f.细口瓶中有水;g.称量固体前,未调节平衡,指针指向右,称量后,指针指向分度盘的中间
(2)我们学习过铁和稀硫酸的反应: ,高中以后还将学习铁和浓硫酸在加热条件下反应: ,请仿照上述反应写出铜和浓硫酸反应的化学方程式_________,反应前后硫元素的化合价为______。
三、推断题
16.下图中,甲是相对分子质量为16的有机物;乙是最常见的溶剂;丁是白色难溶固体,其中金属元素的质量分数为40%。甲的化学式为____;③的化学方程式为____;丙的一种用途是____。
17.如图是甲、乙、丙三种固体物质的溶解度曲线,请回答:
(1)P点意义是______。
(2)t2℃时,甲、乙、丙三种物质的溶解度由小到大的顺序是______。
(3)将t2℃时,甲、乙、丙三种物质的饱和溶液,都降温至t1℃时,所得溶液的溶质质量分数由大到小的顺序是______。
(4)将甲的不饱和溶液变为饱和溶液,下列说法正确的是______。
A.溶剂的质量一定变小 B.溶质的质量可能不变
C.溶质的质量分数一定变大 D.溶液的质量一定变大
四、实验题
18.化学是一门以实验为基础的自然科学
(一)实验帮助我们研究物质的组成
如图是测定空气中氧气体积分数的实验装置,请回答下列问题:
(1)红磷在空气中燃烧的现象是______,发生反应的化学方程式为:______。
(2)实验结论:氧气约占空气总体积的______。
(二)实验帮助我们研究物质的性质
(3)图1实验中,食用油溶解于______中,该实验表明影响物质溶解性的因素是______。
(4)图2试管B中发生反应的化学方程式为:______。
(5)为了探究Zn、Fe、Cu的金属活动性顺序,图2试管C中需要补全的一组试剂是______。
(三)实验帮助我们研究物质的制法
实验室模拟炼铁原理的装置如下图所示,请回答下列问题:
(6)写出A装置玻璃管中发生反应的化学方程式:______,该反应前后碳元素化合价发生的变化是______。
(7)B装置中的现象是______。
(8)实验中需要进行尾气处理的原因是______。
五、计算题
19.实验室用一定量的过氧化氢溶液和二氧化锰混合物制取氧气,实验过程中的相关数据如图所示,当完全反应后,从装置内提取出固体2g。请计算:
(1)完全反应后,装置内的水的质量是___________g;反应生成氧气的质量为___________g。
(2)所用过氧化氢溶液中过氧化氢的质量分数(请写出计算过程)
参考答案:
1.B 2.A 3.D 4.C 5.D 6.D 7.C 8.D 9.C 10.D 11.C 12.D 13.D
14. t1℃时,a、c两物质的溶解度相等(都为20g) a>b>c 1:5 BC
15.(1) 溶质质量分数偏小(或溶质质量分数偏大) abdf(或cg)
(2) +6价,+4价
16. CH4 气体肥料、灭火等
17.(1)甲乙两物质的溶解度相等
(2)丙乙甲
(3)乙甲丙
(4)B
18.(1) 产生大量的白烟,放出大量的热,生成白色固体
(2)
(3) 汽油 溶剂的种类
(4)
(5)锌、硫酸亚铁溶液(合理即可)
(6) 化合价升高
(7)澄清石灰水变浑浊
(8)一氧化碳有毒,污染空气
19.(1) 66.4 1.6
(2)设参加反应的过氧化氢的质量为x。
解得:x=3.4g
过氧化氢溶液中过氧化氢的质量分数=
答:过氧化氢溶液中过氧化氢的质量分数为5%。
一、单选题
1.下列关于实验现象的描述错误的是
A.高锰酸钾几乎不溶于汽油 B.电解水产生的两种气体的质量比是1:2
C.镁条在空气中燃烧放出耀眼的强光 D.水和植物油混合后用力振荡可形成乳浊液
2.把20%的硝酸钾溶液加水稀释成10%的硝酸钾溶液,则所加水的质量为( )
A. B. C. D.
3.某温度时,向水中加入蔗糖,搅拌后,还剩余蔗糖未溶解,则这时溶液的质量为( )
A. B. C. D.
4.有100g 10%的盐酸溶液,要使其溶质质量分数增大一倍,应采取的方法是( )
A.把溶液的量倒掉一半
B.溶质的质量增大一倍
C.将100g 10%的盐酸与200g 25%的盐酸混合
D.蒸发掉50g溶剂
5.在实验室中用氯化钠和水配制100g质量分数为16%的氯化钠溶液并装瓶备用。下列说法不正确的是
A.通过计算可知所需氯化钠的质量为16g
B.所需玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管、试剂瓶
C.实验的主要步骤是计算、称量、量取、溶解、装瓶
D.用量筒量取水时仰视读数,所配得溶液的溶质质量分数偏大
6.实验室配制 50g 质量分数为 6%的氯化钠溶液时,下列说法正确的是
A.配制该溶液需要称量 3g 氯化钠,量取 50mL 蒸馏水
B.称量氯化钠时,只需在盛放氯化钠的右盘垫一张纸
C.用玻璃棒搅拌是为了增大氯化钠的溶解度
D.量取蒸馏水时俯视读数,所配溶液溶质质量分数偏大
7.下列物质中,常温下易溶于水的是
A.氢气 B.粉笔灰 C.蔗糖 D.植物油
8.下列关于溶液的说法正确的是( )
A.从一杯质量分数为10%的食盐溶液中倒出一半,余下的溶液质量分数为5%
B.某饱和溶液降温后析出晶体,此时它就变成不饱和溶液
C.向某物质的饱和溶液中加少量该物质,恒温下放置一定时间后,溶液中的溶质质量分数变大
D.稀溶液可能是饱和溶液,浓溶液也可能是不饱和溶液
9.甲、乙两种固体的溶解度曲线如图所示,下列说法正确的是
A.甲的溶解度大于乙的溶解度
B.t1℃时,甲和乙的溶液中溶质的质量分数相等
C.t2℃时,60g甲的饱和溶液稀释到20%需加水40g
D.将t1℃时相等质量的甲、乙的饱和溶液升温到t2℃,溶液中溶质的质量甲大于乙
10.下图是a、b两种固体物质的溶解度曲线,下列说法中正确的是
A.a中含有少量b时,一般用蒸发溶剂的方法提纯a
B.t℃时,a、b饱和溶液中含有的溶质质量a大于b
C.当温度大于t℃时,a溶液一定比b溶液浓
D.a物质的溶解度受温度变化的影响较大
11.下列对于“一定”说法正确的是( )
A.化合物一定由分子构成 B.单质一定由原子构成
C.溶液和合金一定是混合物 D.固体和液体构成的一定是混合物
12.如下图是a、b、c三种物质(均不含结晶水)的溶解度曲线,下列说法错误的是
A.P点的含义是t1℃时,a、c两种物质的溶解度相同
B.t2℃时,配成等质量a、b、c三种物质的饱和溶液,所含溶质质量最多的物质是a
C.t1℃时,将25ga物质加入到100g水中,所得溶液中溶质与溶剂的质量比是1:5
D.t1℃时,将a、b、c三种物质的等质量的饱和溶液升温至t2℃,溶质质量分数大小关系是:b>a=c
13.甲、乙两种固体物质的溶解度曲线如图所示。下列说法中正确的是
A.甲的溶解度比乙大
B.t2℃时,甲、乙饱和溶液的溶质质量分数都为30%
C.t3℃时,甲、乙的饱和溶液分别降温至t1℃,甲溶液饱和,乙溶液不饱和
D.t2℃时,质量相同的甲、乙饱和溶液分别升温至t3℃,为达饱和状态,需加入甲的质量大于乙
二、填空题
14.如图是a、b、c三种物质(均不含结晶水)的溶解度曲线,根据右图回答下列问题。
(1)P点的含义是______。
(2)t2°C时,a、b、c三种物质的溶解度由大到小的顺序是______。
(3)t1℃时,将25ga物质加入到100g水中,充分搅拌溶解后恢复到原温度,所得溶液中溶质与溶剂的质量比是______(最简整数比)。
(4)t2℃时,将a、b、c三种物质的等质量的饱和溶液降温至t1℃,下列说法正确的是______。
A都是饱和溶液 B溶质质量分数大小关系是:b>a>c C析出晶体质量最多的是a
15.比较和分类是重要的学习方法。
(1)17中元帅实验小组同学想用氯化钠和水配制50g溶质质量分数为5%的氯化钠溶液,他们分析到在实验过程中会出现以下一些情况:请根据最终导致溶质质量分数偏大或偏小的情况进行分类:
①你的分类依据:_______;
②包含的选项______(填字母)a.称量固体质量,物品和砝码放颠倒了;b.固体氯化钠中含有杂质;c.量取水时,俯视量筒;d.实验前烧杯中有水;e.实验前量筒中有水;f.细口瓶中有水;g.称量固体前,未调节平衡,指针指向右,称量后,指针指向分度盘的中间
(2)我们学习过铁和稀硫酸的反应: ,高中以后还将学习铁和浓硫酸在加热条件下反应: ,请仿照上述反应写出铜和浓硫酸反应的化学方程式_________,反应前后硫元素的化合价为______。
三、推断题
16.下图中,甲是相对分子质量为16的有机物;乙是最常见的溶剂;丁是白色难溶固体,其中金属元素的质量分数为40%。甲的化学式为____;③的化学方程式为____;丙的一种用途是____。
17.如图是甲、乙、丙三种固体物质的溶解度曲线,请回答:
(1)P点意义是______。
(2)t2℃时,甲、乙、丙三种物质的溶解度由小到大的顺序是______。
(3)将t2℃时,甲、乙、丙三种物质的饱和溶液,都降温至t1℃时,所得溶液的溶质质量分数由大到小的顺序是______。
(4)将甲的不饱和溶液变为饱和溶液,下列说法正确的是______。
A.溶剂的质量一定变小 B.溶质的质量可能不变
C.溶质的质量分数一定变大 D.溶液的质量一定变大
四、实验题
18.化学是一门以实验为基础的自然科学
(一)实验帮助我们研究物质的组成
如图是测定空气中氧气体积分数的实验装置,请回答下列问题:
(1)红磷在空气中燃烧的现象是______,发生反应的化学方程式为:______。
(2)实验结论:氧气约占空气总体积的______。
(二)实验帮助我们研究物质的性质
(3)图1实验中,食用油溶解于______中,该实验表明影响物质溶解性的因素是______。
(4)图2试管B中发生反应的化学方程式为:______。
(5)为了探究Zn、Fe、Cu的金属活动性顺序,图2试管C中需要补全的一组试剂是______。
(三)实验帮助我们研究物质的制法
实验室模拟炼铁原理的装置如下图所示,请回答下列问题:
(6)写出A装置玻璃管中发生反应的化学方程式:______,该反应前后碳元素化合价发生的变化是______。
(7)B装置中的现象是______。
(8)实验中需要进行尾气处理的原因是______。
五、计算题
19.实验室用一定量的过氧化氢溶液和二氧化锰混合物制取氧气,实验过程中的相关数据如图所示,当完全反应后,从装置内提取出固体2g。请计算:
(1)完全反应后,装置内的水的质量是___________g;反应生成氧气的质量为___________g。
(2)所用过氧化氢溶液中过氧化氢的质量分数(请写出计算过程)
参考答案:
1.B 2.A 3.D 4.C 5.D 6.D 7.C 8.D 9.C 10.D 11.C 12.D 13.D
14. t1℃时,a、c两物质的溶解度相等(都为20g) a>b>c 1:5 BC
15.(1) 溶质质量分数偏小(或溶质质量分数偏大) abdf(或cg)
(2) +6价,+4价
16. CH4 气体肥料、灭火等
17.(1)甲乙两物质的溶解度相等
(2)丙乙甲
(3)乙甲丙
(4)B
18.(1) 产生大量的白烟,放出大量的热,生成白色固体
(2)
(3) 汽油 溶剂的种类
(4)
(5)锌、硫酸亚铁溶液(合理即可)
(6) 化合价升高
(7)澄清石灰水变浑浊
(8)一氧化碳有毒,污染空气
19.(1) 66.4 1.6
(2)设参加反应的过氧化氢的质量为x。
解得:x=3.4g
过氧化氢溶液中过氧化氢的质量分数=
答:过氧化氢溶液中过氧化氢的质量分数为5%。
