第7章应用广泛的酸、碱、盐检测题(含答案)---2022-2023学年九年级化学沪教版(全国)下册
文档属性
| 名称 | 第7章应用广泛的酸、碱、盐检测题(含答案)---2022-2023学年九年级化学沪教版(全国)下册 |  | |
| 格式 | docx | ||
| 文件大小 | 103.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-21 12:13:58 | ||
图片预览



文档简介
第7章《应用广泛的酸、碱、盐》检测题
一、单选题
1.有一包固体粉末X可能含有Zn、Fe粉、CuO 中的一种或几种。为探究其成分,将mg固体粉末加入到一定质量的稀盐酸中,充分反应后剩余ng固体。下列说法正确的是
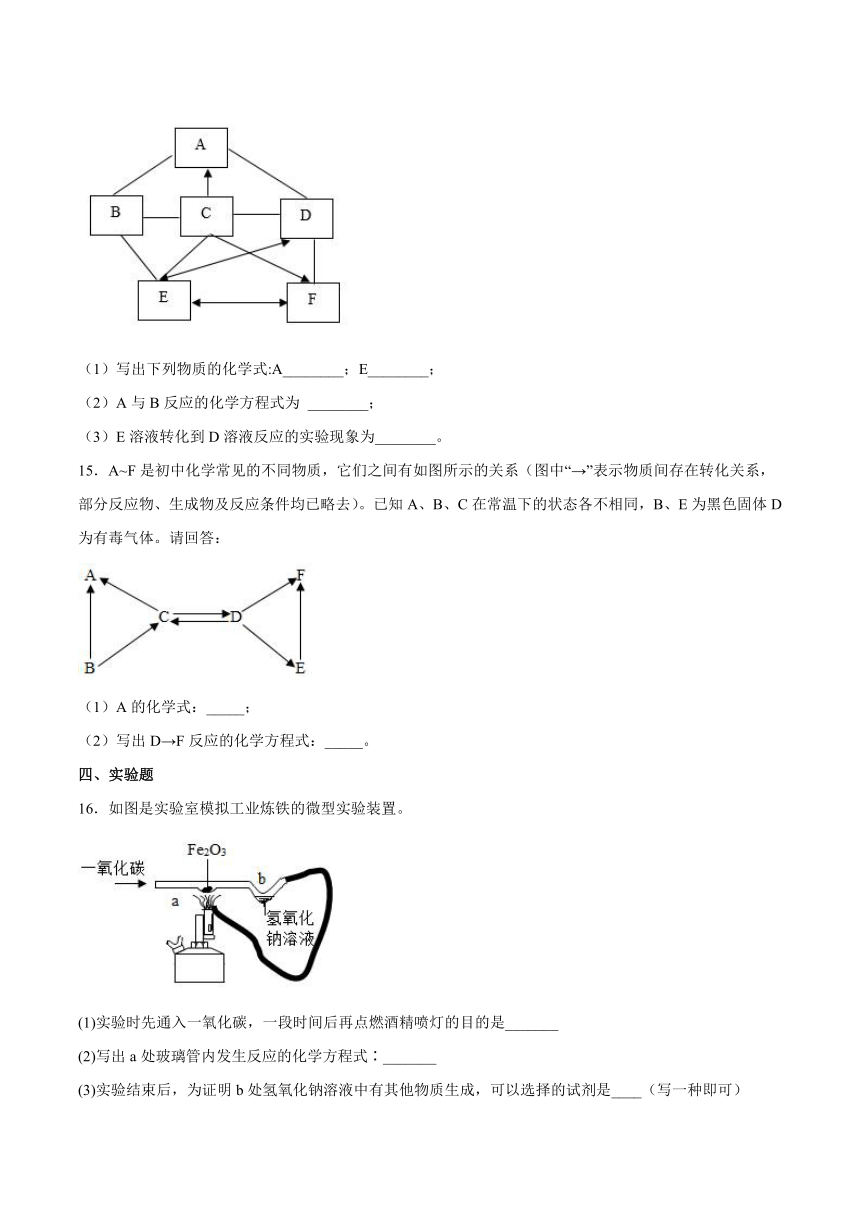
A.若固体粉末X含有铁,则m可能小于n
B.若充分反应后溶液中含有四种阳离子,则剩余固体一定为纯净物
C.若充分反应后溶液中含有三种阳离子,则固体粉末X一定由三种物质组成
D.剩余ng固体可能由铁和组成
2.打开盛放碳酸氢铵固体的试剂瓶瓶盖,会闻到刺激性气味,这是因为发生了化学反应:,该反应属于下列哪种类型
A.复分解反应 B.置换反应 C.化合反应 D.分解反应
3.西汉刘安曾记载“曾青得铁则化为铜”。这里的“铜”指的是
A.铜单质 B.铜元素 C.氧化铜 D.铜原子
4.逻辑推理是化学常用的思维方法,下列逻辑推理正确的是
A.点燃氢气之前需要验纯,则点燃可燃性气体之前都需要验纯
B.活泼金属能与稀酸反应放出气体,则能与稀酸反应放出气体的物质一定是活泼金属
C.单质由同一种元素组成,则由同一种元素组成的物质一定是单质
D.水和过氧化氢的组成元素相同,则两者的化学性质相同
5.在托盘天平的两盘上各放一个等质量的烧杯,在两个烧杯里分别加入50g溶质质量分数为14.6%的稀盐酸,将天平调节至平衡。然后向左盘烧杯中投入一定质量的碳酸钠固体,向右盘烧杯中投入一定质量的镁,均恰好完全反应,天平发生偏转。则下列各项操作中,能使天平重新达到平衡的是
A.将游码向右移动4.2g B.向右盘烧杯中再加入4g稀盐酸
C.在右盘上放4.8g镁 D.在左盘上放4g碳酸钠固体
6.下列图像能正确反映其对应关系的是
A.相同质量和相同质量分数的稀硫酸与足量的两种金属,分别反应
B.向一定量的稀盐酸中滴入水
C.向一定量的稀盐酸中加入石灰石
D.在密闭容器中用红磷测定空气中氧气含量
7.下列有关物质的性质与用途对应关系正确的是
A.石墨质软,可用于电池电极
B.不锈钢的硬度较大,可用于制作医疗器械
C.液态氧具有助燃性,用作火箭推进燃料
D.固体氢氧化钠有吸水性,可用作干燥剂
8.下列化学方程式书写完全正确的是
A.
B.
C.
D.
9.分析推理是化学学习中常用的思维方法,以下推理正确的是
A.氯化钠、硫酸铜等盐中都含有金属元素,所以盐中一定含有金属元素
B.化合物含有不同种元素,所以含有不同种元素的物质一定是化合物
C.燃烧都伴随有发光放热现象,所以有发光放热现象的一定是燃烧
D.盐酸、硫酸等酸溶液都能使石蕊溶液变红,所以使石蕊溶液变红的一定是酸性溶液
10.下列物质的用途与其物理性质有关的是
A.用生石灰作某些食品的干燥剂 B.稀盐酸常用于金属表面除锈
C.用碳素墨水写文字档案便于保存 D.用干冰进行人工降雨
11.下列俗语或成语所涉及的内容与化学变化或化学性质无关的是
A.铁杵成针 B.蜡炬成灰 C.烈火真金 D.海枯石烂
二、填空题
12.用“微粒的眼光看世界”是我们学习化学的重要思想方法。
(1)洋葱被誉为蔬菜皇后,切洋葱时可闻到刺激性气味,从微观角度解释_________。
(2)氢氧化钠必须密封保存的原因是:易吸收空气中______而潮解,易和空气中的______反应而变质。
A.二氧化碳 B.氮气 C.水蒸气 D.氧气
(3)硝酸可发生反应:。推断X的化学式为______。
13.在日常生活中,我们会接触到很多的化学物质,请写出下列物质的化学式:
(1)最常用的溶剂________;
(2)胃液中含有的酸________ ;
(3)用来改良酸性土壤的碱_______;
(4)碘酒中的溶剂是________ 。
三、推断题
14.A,B,C,D,E,F为初中化学常见的化合物,C、D、E、F为不同类别的物质,B是一种可溶性的盐,D可用于造纸和纺织,C中含有两种元素,A与D反应产生有刺激性气味的气体,“→”表示一种物质能转化为另一种物质,“一”表示物质之间能发生化学反应,回答下列问题:
(1)写出下列物质的化学式:A________;E________;
(2)A与B反应的化学方程式为 ________;
(3)E溶液转化到D溶液反应的实验现象为________。
15.A~F是初中化学常见的不同物质,它们之间有如图所示的关系(图中“→”表示物质间存在转化关系,部分反应物、生成物及反应条件均已略去)。已知A、B、C在常温下的状态各不相同,B、E为黑色固体D为有毒气体。请回答:
(1)A的化学式:_____;
(2)写出D→F反应的化学方程式:_____。
四、实验题
16.如图是实验室模拟工业炼铁的微型实验装置。
(1)实验时先通入一氧化碳,一段时间后再点燃酒精喷灯的目的是_______
(2)写出a处玻璃管内发生反应的化学方程式∶_______
(3)实验结束后,为证明b处氢氧化钠溶液中有其他物质生成,可以选择的试剂是____(写一种即可)
17.某化学兴趣小组为探究盐酸的化学性质,进行了如下实验(所加稀盐酸均过量)。
(1)试管A中观察到紫色石蕊试液变______色。
(2)试管B中观察到溶液由无色逐渐变成黄色,是因为反应生成了______(填化学式),一段时间后有气泡产生,写出产生气泡的化学方程式______。
(3)试管C中发生反应的化学方程式是______。
(4)试管D中加稀盐酸至过量,始终没有明显现象。请你设计实验方案证明试管D中的NaOH与HCl发生了反应,______(写出操作及其现象)。
五、计算题
18.利用下图甲所示的方法可粗略测定氢氧化钠溶液的浓度。反应的化学方程式为NaOH+HCl=NaCl+H2O。
(1)实验中,如何判断氢氧化钠溶液和稀盐酸恰好完全反应?_____________。
(2)若实验测得在持续滴加稀盐酸的过程中,该烧杯内物质溶液的pH变化如图乙所示。请计算该氢氧化钠溶液中溶质的质量分数。
19.黄铜(铜、锌合金)具有合金的特性,可以用来制造机器零件。某学习小组的同学为了测定黄铜中铜的含量,取黄铜样品25g放入烧杯中,再将160g稀硫酸分4次加入烧杯中,充分反应后,分别测得剩余固体的质量记录如下。
加入次数 第1次 第2次 第3次 第4次
加入稀硫酸的质量/g 40 40 40 40
充分反应后剩余固体的质量/g 18.5 12 10 m
请根据实验数据完成下列问题:
(1)m的值为_______。
(2)黄铜样品中铜的质量分数为_______。
(3)所用稀硫酸的溶质质量分数_______(写出计算过程,结果精确到0.1%)。
参考答案:
1.B 2.D 3.A 4.A 5.B 6.D 7.D 8.C 9.D 10.D 11.A
12.(1)分子在不断的运动
(2) C A
(3)O2
13. H2O HCl Ca(OH)2 C2H5OH
14. NH4Cl Na2CO3 NH4Cl+AgNO3=AgCl↓+NH4NO3 无色溶液中产生白色沉淀
15. H2O
16.(1)排尽装置内的空气,防止加热时发生爆炸
(2)
(3)稀盐酸或氯化钙溶液(合理即可)
17.(1)红
(2) FeCl3
(3)
(4)取少量试管D中溶液于试管中,加入硫酸铜溶液,无蓝色沉淀生成,说明氢氧化钠发生了反应(合理即可)
18.(1)向氢氧化钠溶液中滴加酚酞溶液,溶液变红。逐滴加入稀盐酸至溶液恰好褪成无色,此时两种物质恰好完全反应
(2)恰好完全反应时消耗HCl的质量=7.3 g×1%=0.073 g,设该氢氧化钠溶液中溶质的质量为x
x=0.08 g
该氢氧化钠溶液中溶质质量分数为。
答:该氢氧化钠溶液中溶质质量分数为0.8%。
19.(1)10
(2)40%
(3)解:由表格中数据可知,40g稀硫酸反应掉锌的质量为:。
设40g稀硫酸中溶质的质量为x
x=9.8g
所用稀硫酸的溶质质量分数是
答:所用稀硫酸的溶质质量分数为24.5%
一、单选题
1.有一包固体粉末X可能含有Zn、Fe粉、CuO 中的一种或几种。为探究其成分,将mg固体粉末加入到一定质量的稀盐酸中,充分反应后剩余ng固体。下列说法正确的是
A.若固体粉末X含有铁,则m可能小于n
B.若充分反应后溶液中含有四种阳离子,则剩余固体一定为纯净物
C.若充分反应后溶液中含有三种阳离子,则固体粉末X一定由三种物质组成
D.剩余ng固体可能由铁和组成
2.打开盛放碳酸氢铵固体的试剂瓶瓶盖,会闻到刺激性气味,这是因为发生了化学反应:,该反应属于下列哪种类型
A.复分解反应 B.置换反应 C.化合反应 D.分解反应
3.西汉刘安曾记载“曾青得铁则化为铜”。这里的“铜”指的是
A.铜单质 B.铜元素 C.氧化铜 D.铜原子
4.逻辑推理是化学常用的思维方法,下列逻辑推理正确的是
A.点燃氢气之前需要验纯,则点燃可燃性气体之前都需要验纯
B.活泼金属能与稀酸反应放出气体,则能与稀酸反应放出气体的物质一定是活泼金属
C.单质由同一种元素组成,则由同一种元素组成的物质一定是单质
D.水和过氧化氢的组成元素相同,则两者的化学性质相同
5.在托盘天平的两盘上各放一个等质量的烧杯,在两个烧杯里分别加入50g溶质质量分数为14.6%的稀盐酸,将天平调节至平衡。然后向左盘烧杯中投入一定质量的碳酸钠固体,向右盘烧杯中投入一定质量的镁,均恰好完全反应,天平发生偏转。则下列各项操作中,能使天平重新达到平衡的是
A.将游码向右移动4.2g B.向右盘烧杯中再加入4g稀盐酸
C.在右盘上放4.8g镁 D.在左盘上放4g碳酸钠固体
6.下列图像能正确反映其对应关系的是
A.相同质量和相同质量分数的稀硫酸与足量的两种金属,分别反应
B.向一定量的稀盐酸中滴入水
C.向一定量的稀盐酸中加入石灰石
D.在密闭容器中用红磷测定空气中氧气含量
7.下列有关物质的性质与用途对应关系正确的是
A.石墨质软,可用于电池电极
B.不锈钢的硬度较大,可用于制作医疗器械
C.液态氧具有助燃性,用作火箭推进燃料
D.固体氢氧化钠有吸水性,可用作干燥剂
8.下列化学方程式书写完全正确的是
A.
B.
C.
D.
9.分析推理是化学学习中常用的思维方法,以下推理正确的是
A.氯化钠、硫酸铜等盐中都含有金属元素,所以盐中一定含有金属元素
B.化合物含有不同种元素,所以含有不同种元素的物质一定是化合物
C.燃烧都伴随有发光放热现象,所以有发光放热现象的一定是燃烧
D.盐酸、硫酸等酸溶液都能使石蕊溶液变红,所以使石蕊溶液变红的一定是酸性溶液
10.下列物质的用途与其物理性质有关的是
A.用生石灰作某些食品的干燥剂 B.稀盐酸常用于金属表面除锈
C.用碳素墨水写文字档案便于保存 D.用干冰进行人工降雨
11.下列俗语或成语所涉及的内容与化学变化或化学性质无关的是
A.铁杵成针 B.蜡炬成灰 C.烈火真金 D.海枯石烂
二、填空题
12.用“微粒的眼光看世界”是我们学习化学的重要思想方法。
(1)洋葱被誉为蔬菜皇后,切洋葱时可闻到刺激性气味,从微观角度解释_________。
(2)氢氧化钠必须密封保存的原因是:易吸收空气中______而潮解,易和空气中的______反应而变质。
A.二氧化碳 B.氮气 C.水蒸气 D.氧气
(3)硝酸可发生反应:。推断X的化学式为______。
13.在日常生活中,我们会接触到很多的化学物质,请写出下列物质的化学式:
(1)最常用的溶剂________;
(2)胃液中含有的酸________ ;
(3)用来改良酸性土壤的碱_______;
(4)碘酒中的溶剂是________ 。
三、推断题
14.A,B,C,D,E,F为初中化学常见的化合物,C、D、E、F为不同类别的物质,B是一种可溶性的盐,D可用于造纸和纺织,C中含有两种元素,A与D反应产生有刺激性气味的气体,“→”表示一种物质能转化为另一种物质,“一”表示物质之间能发生化学反应,回答下列问题:
(1)写出下列物质的化学式:A________;E________;
(2)A与B反应的化学方程式为 ________;
(3)E溶液转化到D溶液反应的实验现象为________。
15.A~F是初中化学常见的不同物质,它们之间有如图所示的关系(图中“→”表示物质间存在转化关系,部分反应物、生成物及反应条件均已略去)。已知A、B、C在常温下的状态各不相同,B、E为黑色固体D为有毒气体。请回答:
(1)A的化学式:_____;
(2)写出D→F反应的化学方程式:_____。
四、实验题
16.如图是实验室模拟工业炼铁的微型实验装置。
(1)实验时先通入一氧化碳,一段时间后再点燃酒精喷灯的目的是_______
(2)写出a处玻璃管内发生反应的化学方程式∶_______
(3)实验结束后,为证明b处氢氧化钠溶液中有其他物质生成,可以选择的试剂是____(写一种即可)
17.某化学兴趣小组为探究盐酸的化学性质,进行了如下实验(所加稀盐酸均过量)。
(1)试管A中观察到紫色石蕊试液变______色。
(2)试管B中观察到溶液由无色逐渐变成黄色,是因为反应生成了______(填化学式),一段时间后有气泡产生,写出产生气泡的化学方程式______。
(3)试管C中发生反应的化学方程式是______。
(4)试管D中加稀盐酸至过量,始终没有明显现象。请你设计实验方案证明试管D中的NaOH与HCl发生了反应,______(写出操作及其现象)。
五、计算题
18.利用下图甲所示的方法可粗略测定氢氧化钠溶液的浓度。反应的化学方程式为NaOH+HCl=NaCl+H2O。
(1)实验中,如何判断氢氧化钠溶液和稀盐酸恰好完全反应?_____________。
(2)若实验测得在持续滴加稀盐酸的过程中,该烧杯内物质溶液的pH变化如图乙所示。请计算该氢氧化钠溶液中溶质的质量分数。
19.黄铜(铜、锌合金)具有合金的特性,可以用来制造机器零件。某学习小组的同学为了测定黄铜中铜的含量,取黄铜样品25g放入烧杯中,再将160g稀硫酸分4次加入烧杯中,充分反应后,分别测得剩余固体的质量记录如下。
加入次数 第1次 第2次 第3次 第4次
加入稀硫酸的质量/g 40 40 40 40
充分反应后剩余固体的质量/g 18.5 12 10 m
请根据实验数据完成下列问题:
(1)m的值为_______。
(2)黄铜样品中铜的质量分数为_______。
(3)所用稀硫酸的溶质质量分数_______(写出计算过程,结果精确到0.1%)。
参考答案:
1.B 2.D 3.A 4.A 5.B 6.D 7.D 8.C 9.D 10.D 11.A
12.(1)分子在不断的运动
(2) C A
(3)O2
13. H2O HCl Ca(OH)2 C2H5OH
14. NH4Cl Na2CO3 NH4Cl+AgNO3=AgCl↓+NH4NO3 无色溶液中产生白色沉淀
15. H2O
16.(1)排尽装置内的空气,防止加热时发生爆炸
(2)
(3)稀盐酸或氯化钙溶液(合理即可)
17.(1)红
(2) FeCl3
(3)
(4)取少量试管D中溶液于试管中,加入硫酸铜溶液,无蓝色沉淀生成,说明氢氧化钠发生了反应(合理即可)
18.(1)向氢氧化钠溶液中滴加酚酞溶液,溶液变红。逐滴加入稀盐酸至溶液恰好褪成无色,此时两种物质恰好完全反应
(2)恰好完全反应时消耗HCl的质量=7.3 g×1%=0.073 g,设该氢氧化钠溶液中溶质的质量为x
x=0.08 g
该氢氧化钠溶液中溶质质量分数为。
答:该氢氧化钠溶液中溶质质量分数为0.8%。
19.(1)10
(2)40%
(3)解:由表格中数据可知,40g稀硫酸反应掉锌的质量为:。
设40g稀硫酸中溶质的质量为x
x=9.8g
所用稀硫酸的溶质质量分数是
答:所用稀硫酸的溶质质量分数为24.5%
