基础实验6 粗盐的初步提纯 同步练习(含答案) 2022-2023学年 九年级下册化学沪教版(全国)
文档属性
| 名称 | 基础实验6 粗盐的初步提纯 同步练习(含答案) 2022-2023学年 九年级下册化学沪教版(全国) |  | |
| 格式 | zip | ||
| 文件大小 | 102.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-24 09:31:24 | ||
图片预览


文档简介
基础实验6 粗盐的初步提纯 同步练习
一、单选题
1.某化学兴趣小组同学设计了以下实验方案:①粗盐中泥沙的去除可采用溶解、过滤、蒸发的步骤;②只用酚酞试液鉴别出NaOH;HCl和NaCl三种无色溶液;③用Fe(NO3)2溶液、Cu和Ag比较Fe、Cu和Ag的金属活动性;④可用Ca(OH)2溶液来检验露置在空气中的NaOH溶液是否变质.其中正确说法的个数是( )
A.1个 B.2个 C.3个 D.4个
2.粗盐中通常含泥沙、CaCl2、MgCl2及硫酸盐等杂质,粗盐经过处理可以得到纯净的氯化钠,流程如下图所示,下列有关说法正确的是( )
A.“操作3”为降温结晶
B.加入过量盐酸的目的只是为了除去过量的碳酸钠
C.若8 g粗盐经过上述处理后得到纯净NaCl质量可能大于8 g
D.过滤后滤液中的主要离子有:Na+、Ca2 +、Cl-、 、OH-
3.下列所用试剂或方法不能达到目的是( )
A.区分硝酸铵和氢氧化钠固体﹣﹣水
B.比较黄铜片和铜片的硬度﹣﹣互相刻画
C.判断久置的氢氧化钠溶液是否变质﹣﹣观察颜色
D.除去粗盐中难溶性杂质﹣﹣加水充分溶解,过滤,蒸发结晶
4.除去难溶性杂质后的食盐中往往含有少量的Na2SO4、MgCl2、CaCl2等杂质,为了将这些杂质除去,可向食盐溶液中加入过量的NaOH、Na2CO3、BaCl2溶液,然后过滤除去沉淀,再加入盐酸调至溶液pH=7,最后蒸发得到精盐.下列操作及加入溶液顺序不正确的是( )
A.BaCl2、Na2CO3、NaOH、过滤、HCl
B.BaCl2、NaOH、Na2CO3、过滤、HCl
C.Na2CO3、BaCl2、NaOH、过滤、HCl
D.NaOH、BaCl2、Na2CO3、过滤、HCl
5.将含泥沙的粗盐提纯,并用制得的精盐配制80g10%的食盐溶液.下列说法错误的是( )
A.过滤操作时,搅拌漏斗中的液体,可以加快过滤的速度
B.配制时需用的主要仪器有:天平、药匙、量筒、胶头滴管、烧杯、玻璃棒
C.配制溶液的步骤是:计算、称量、溶解、转移装瓶、贴标签
D.蒸发滤液时,不断用玻璃棒搅拌,防止液体溅出
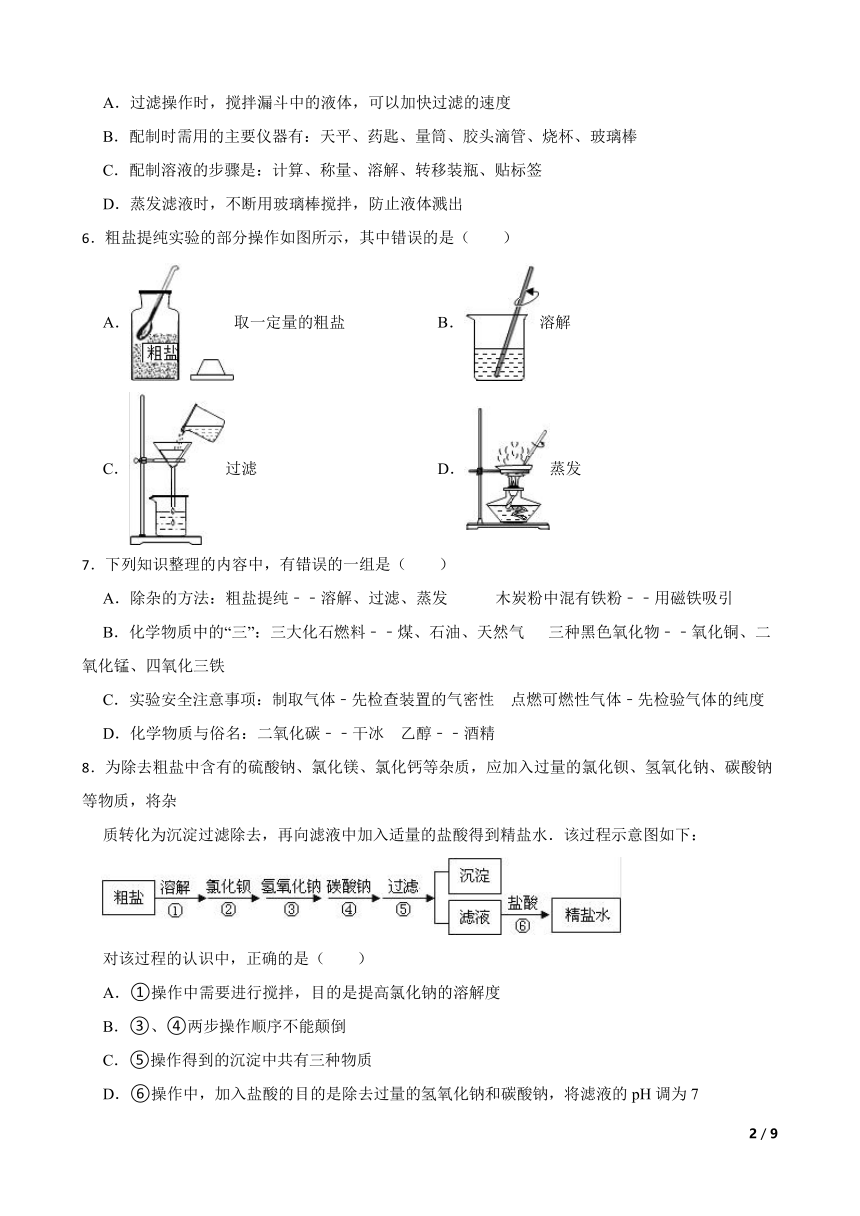
6.粗盐提纯实验的部分操作如图所示,其中错误的是( )
A.取一定量的粗盐 B.溶解
C.过滤 D.蒸发
7.下列知识整理的内容中,有错误的一组是( )
A.除杂的方法:粗盐提纯﹣﹣溶解、过滤、蒸发 木炭粉中混有铁粉﹣﹣用磁铁吸引
B.化学物质中的“三”:三大化石燃料﹣﹣煤、石油、天然气 三种黑色氧化物﹣﹣氧化铜、二氧化锰、四氧化三铁
C.实验安全注意事项:制取气体﹣先检查装置的气密性 点燃可燃性气体﹣先检验气体的纯度
D.化学物质与俗名:二氧化碳﹣﹣干冰 乙醇﹣﹣酒精
8.为除去粗盐中含有的硫酸钠、氯化镁、氯化钙等杂质,应加入过量的氯化钡、氢氧化钠、碳酸钠等物质,将杂
质转化为沉淀过滤除去,再向滤液中加入适量的盐酸得到精盐水.该过程示意图如下:
对该过程的认识中,正确的是( )
A.①操作中需要进行搅拌,目的是提高氯化钠的溶解度
B.③、④两步操作顺序不能颠倒
C.⑤操作得到的沉淀中共有三种物质
D.⑥操作中,加入盐酸的目的是除去过量的氢氧化钠和碳酸钠,将滤液的pH调为7
9.下列实验方案能够达到相应实验目的的是( )
实验目的 实验方案
A 鉴别NaOH溶液和NaCl溶液 分别向溶液中滴加酚酞
B 除去粗盐中的难溶性杂质 将粗盐溶解、蒸发
C 除去NaOH溶液中的Ca(OH)2 向溶液中加稀盐酸
D 除去CO2中的水蒸气 将气体通过NaOH固体
A.A B.B C.C D.D
10.下图是“粗盐中难溶性杂质的去除”实验过程中的部分操作,其中正确的是()
A. 取粗盐 B. 溶解
C. 过滤 D. 蒸发结晶
11.生活中处处有化学.根据所学化学知识判断下列做法不合理的是( )
A.无磷洗衣粉有利于防止水体富营养
B.用食盐调味和腌渍蔬菜
C.用洗洁精洗涤餐具上的油渍
D.用纯碱溶液除去水壶中的水垢
12.为了除去粗盐中的Ca2+、Mg2+、SO42﹣等离子,可将粗盐溶于水后进行如下操作:①加入适量盐酸,②加过量NaOH溶液,③加过量Na2CO3溶液,④加过量BaCl2溶液,⑤过滤.下列操作顺序合理的是( )
A.②③④⑤① B.②④③⑤① C.④②③①⑤ D.④③②①⑤
二、填空题
13.化学与生活、生产密切相关,请用所学知识回答问题:
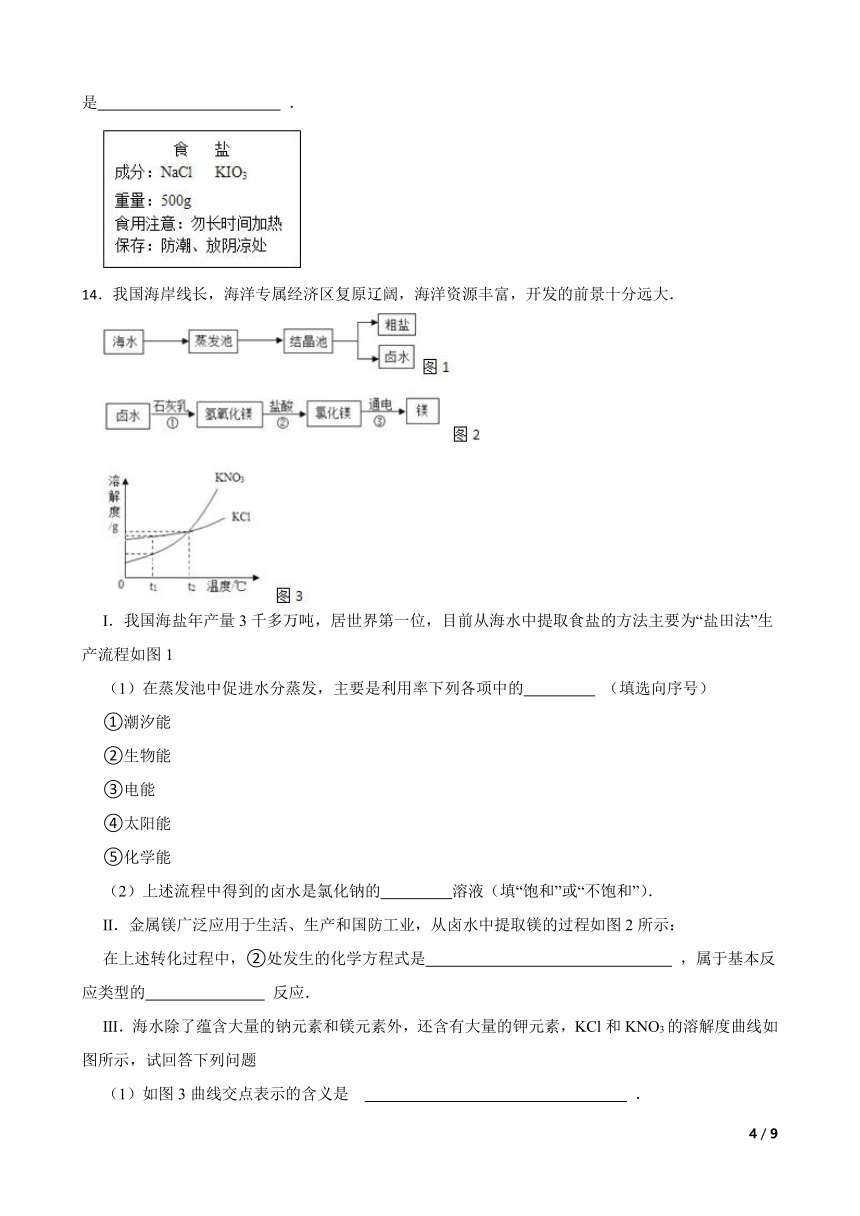
(1)如图是超市销售的一种食盐标签的部分文字说明,请按要求回答:
①从成分上看,食盐中除含有NaCl外还有KIO3,KIO3的作用是 ;
②家庭生活中,食盐除了可以调味,还可用于 .
(2)炒菜时油锅中的油不慎着火,可用锅盖盖灭或放入较多的蔬菜,其目的是 .
14.我国海岸线长,海洋专属经济区复原辽阔,海洋资源丰富,开发的前景十分远大.
Ⅰ.我国海盐年产量3千多万吨,居世界第一位,目前从海水中提取食盐的方法主要为“盐田法”生产流程如图1
(1)在蒸发池中促进水分蒸发,主要是利用率下列各项中的 (填选向序号)
①潮汐能
②生物能
③电能
④太阳能
⑤化学能
(2)上述流程中得到的卤水是氯化钠的 溶液(填“饱和”或“不饱和”).
Ⅱ.金属镁广泛应用于生活、生产和国防工业,从卤水中提取镁的过程如图2所示:
在上述转化过程中,②处发生的化学方程式是 ,属于基本反应类型的 反应.
Ⅲ.海水除了蕴含大量的钠元素和镁元素外,还含有大量的钾元素,KCl和KNO3的溶解度曲线如图所示,试回答下列问题
(1)如图3曲线交点表示的含义是 .
(2)t1℃时,KCl饱和溶液的溶质质量分数 KNO3饱和溶液的溶质质量分数(填“大于”“小于”“等于”之一).
(3)已知20℃时,KNO3的溶解度为31.6g,80℃时,KNO3的溶解度为169g,在20℃时,向盛有200g水的烧杯中加入80g硝酸钾,充分溶解,得到该温度时KNO3 (填“饱和”或“不饱和”)溶液,若使烧杯内物质缓慢升温至80℃(忽略水分蒸发)在该温度下,最后所得溶液中溶质与溶剂的质量之比为 (填最简整数比).
(4)若KNO3溶液中混有少量的NaCl杂质,可以采取 方法获得较纯净的KNO3.
15.下列实验方案能达到实验目的是 。
选项 实验目的 实验方案
A 检验固体Ca(OH)2是否变质 取样加少量水振荡观察固体是否完全溶解
B 制备Cu(OH)2固体 用CuO与适量NaOH溶液混合
C 除去粗盐中的泥沙 加水溶解后过滤,再蒸发结晶
D 鉴别棉织物和羊毛织物
16.在实验室配制溶液时,常涉及以下过程:①称量、量取;②过滤;③蒸发结晶、干燥;④计算;⑤溶解.请按要求回答下列问题:
(1)甲同学用氯化钠和蒸馏水配制50g5%的氯化钠溶液.现实验室中有10mL、50mL、100mL等不同规格的量筒,配制上述溶液时最好选用 mL的量筒.
(2)乙同学用10g含杂质10%的食盐(杂质不溶于水)和蒸馏水配制50g溶质质量分数一定的氯化钠溶液,正确的操作顺序是(操作步骤可重复使用) (用以上序号填空).若乙同学将所得精盐完全用于配制该溶液,则所得溶液的溶质质量分数为 .
三、综合题
17.食盐是一种重要的化工原料,由于粗盐中含有少量泥沙和 MgCl2、CaCl2、Na2SO4等杂质,不能满足化工生产的要求,因此必须将粗盐进行精制,流程如图(用于沉淀的试剂均过量),请回答下列问题:
(1)操作 3 所用的玻璃仪器有什么?
(2)写出操作 1 发生反应的化学方程式.
(3)该实验方案还需要完善,请写出具体的操作步骤.
18.粗盐中除了含有泥沙等难溶性物质外,还含有可溶性杂质MgSO4和CaCl2,为了除去其中的可溶性杂质,某化学兴趣小组设计了如图实验过程。
(1)写出加入BaCl2溶液时所发生反应的化学方程式 。
(2)最后所得的NaCl的质量大于原粗盐中NaCl的质量,写出一个可使NaCl质量增加的化学方程式 。
(3)上述流程中,当无色溶液Y的pH>7时,请设计实验确定白色固体的成分(NaCl除外) 。
19.去除粗盐中难溶性杂质的主要操作如下图所示。
(1)操作①中玻璃棒的作用是 。
(2)操作③的名称是 。
(3)正确的实验操作顺序是 (填序号)。
20.化学就在我们身边,请从下列物质中选择相应的序号填空:
①酒精②明矾③食盐④氮气⑤水银
(1)腌制鱼肉等常用的调味品是 ;
(2)用于食品包装袋内填充的保护气是 ;
(3)温度计中的液体物质是 ;
(4)实验室常用的燃料是 ;
(5)可用于净水的是 .
答案解析部分
1.【答案】C
2.【答案】C
3.【答案】C
4.【答案】C
5.【答案】A
6.【答案】C
7.【答案】D
8.【答案】D
9.【答案】A
10.【答案】D
11.【答案】D
12.【答案】B
13.【答案】补充人体所需的碘元素,防止甲状腺肿大;腌制蔬菜、鱼、肉等;隔绝氧气或降低温度
14.【答案】④;饱和;2HCl+Mg(OH)2═MgCl2+2H2O;复分解反应;在t2℃时,两物质的溶解度相等;大于;饱和;2:5;降温结晶
15.【答案】C;灼烧闻气味
16.【答案】50;⑤②③④①⑤;18%
17.【答案】(1)答:烧杯、漏斗、玻璃棒
(2)答:BaCl2+Na2SO4═BaSO4↓+2NaCl
(3)答:在蒸发滤液之前,向滤液中加入足量稀盐酸除去氢氧化钠和碳酸钠.
18.【答案】(1)
(2)(合理即可)
(3)向溶液 Y 中加入过量硝酸钡溶液(或 CaCl2溶液或 BaCl2溶液),若有沉淀产生,则含有碳酸钠;静置,取上层清液,滴加无色酚酞溶液,若变红,则含有NaOH
19.【答案】(1)引流
(2)蒸发
(3)②①③
20.【答案】(1)③
(2)④
(3)⑤
(4)①
(5)②
1 / 1
一、单选题
1.某化学兴趣小组同学设计了以下实验方案:①粗盐中泥沙的去除可采用溶解、过滤、蒸发的步骤;②只用酚酞试液鉴别出NaOH;HCl和NaCl三种无色溶液;③用Fe(NO3)2溶液、Cu和Ag比较Fe、Cu和Ag的金属活动性;④可用Ca(OH)2溶液来检验露置在空气中的NaOH溶液是否变质.其中正确说法的个数是( )
A.1个 B.2个 C.3个 D.4个
2.粗盐中通常含泥沙、CaCl2、MgCl2及硫酸盐等杂质,粗盐经过处理可以得到纯净的氯化钠,流程如下图所示,下列有关说法正确的是( )
A.“操作3”为降温结晶
B.加入过量盐酸的目的只是为了除去过量的碳酸钠
C.若8 g粗盐经过上述处理后得到纯净NaCl质量可能大于8 g
D.过滤后滤液中的主要离子有:Na+、Ca2 +、Cl-、 、OH-
3.下列所用试剂或方法不能达到目的是( )
A.区分硝酸铵和氢氧化钠固体﹣﹣水
B.比较黄铜片和铜片的硬度﹣﹣互相刻画
C.判断久置的氢氧化钠溶液是否变质﹣﹣观察颜色
D.除去粗盐中难溶性杂质﹣﹣加水充分溶解,过滤,蒸发结晶
4.除去难溶性杂质后的食盐中往往含有少量的Na2SO4、MgCl2、CaCl2等杂质,为了将这些杂质除去,可向食盐溶液中加入过量的NaOH、Na2CO3、BaCl2溶液,然后过滤除去沉淀,再加入盐酸调至溶液pH=7,最后蒸发得到精盐.下列操作及加入溶液顺序不正确的是( )
A.BaCl2、Na2CO3、NaOH、过滤、HCl
B.BaCl2、NaOH、Na2CO3、过滤、HCl
C.Na2CO3、BaCl2、NaOH、过滤、HCl
D.NaOH、BaCl2、Na2CO3、过滤、HCl
5.将含泥沙的粗盐提纯,并用制得的精盐配制80g10%的食盐溶液.下列说法错误的是( )
A.过滤操作时,搅拌漏斗中的液体,可以加快过滤的速度
B.配制时需用的主要仪器有:天平、药匙、量筒、胶头滴管、烧杯、玻璃棒
C.配制溶液的步骤是:计算、称量、溶解、转移装瓶、贴标签
D.蒸发滤液时,不断用玻璃棒搅拌,防止液体溅出
6.粗盐提纯实验的部分操作如图所示,其中错误的是( )
A.取一定量的粗盐 B.溶解
C.过滤 D.蒸发
7.下列知识整理的内容中,有错误的一组是( )
A.除杂的方法:粗盐提纯﹣﹣溶解、过滤、蒸发 木炭粉中混有铁粉﹣﹣用磁铁吸引
B.化学物质中的“三”:三大化石燃料﹣﹣煤、石油、天然气 三种黑色氧化物﹣﹣氧化铜、二氧化锰、四氧化三铁
C.实验安全注意事项:制取气体﹣先检查装置的气密性 点燃可燃性气体﹣先检验气体的纯度
D.化学物质与俗名:二氧化碳﹣﹣干冰 乙醇﹣﹣酒精
8.为除去粗盐中含有的硫酸钠、氯化镁、氯化钙等杂质,应加入过量的氯化钡、氢氧化钠、碳酸钠等物质,将杂
质转化为沉淀过滤除去,再向滤液中加入适量的盐酸得到精盐水.该过程示意图如下:
对该过程的认识中,正确的是( )
A.①操作中需要进行搅拌,目的是提高氯化钠的溶解度
B.③、④两步操作顺序不能颠倒
C.⑤操作得到的沉淀中共有三种物质
D.⑥操作中,加入盐酸的目的是除去过量的氢氧化钠和碳酸钠,将滤液的pH调为7
9.下列实验方案能够达到相应实验目的的是( )
实验目的 实验方案
A 鉴别NaOH溶液和NaCl溶液 分别向溶液中滴加酚酞
B 除去粗盐中的难溶性杂质 将粗盐溶解、蒸发
C 除去NaOH溶液中的Ca(OH)2 向溶液中加稀盐酸
D 除去CO2中的水蒸气 将气体通过NaOH固体
A.A B.B C.C D.D
10.下图是“粗盐中难溶性杂质的去除”实验过程中的部分操作,其中正确的是()
A. 取粗盐 B. 溶解
C. 过滤 D. 蒸发结晶
11.生活中处处有化学.根据所学化学知识判断下列做法不合理的是( )
A.无磷洗衣粉有利于防止水体富营养
B.用食盐调味和腌渍蔬菜
C.用洗洁精洗涤餐具上的油渍
D.用纯碱溶液除去水壶中的水垢
12.为了除去粗盐中的Ca2+、Mg2+、SO42﹣等离子,可将粗盐溶于水后进行如下操作:①加入适量盐酸,②加过量NaOH溶液,③加过量Na2CO3溶液,④加过量BaCl2溶液,⑤过滤.下列操作顺序合理的是( )
A.②③④⑤① B.②④③⑤① C.④②③①⑤ D.④③②①⑤
二、填空题
13.化学与生活、生产密切相关,请用所学知识回答问题:
(1)如图是超市销售的一种食盐标签的部分文字说明,请按要求回答:
①从成分上看,食盐中除含有NaCl外还有KIO3,KIO3的作用是 ;
②家庭生活中,食盐除了可以调味,还可用于 .
(2)炒菜时油锅中的油不慎着火,可用锅盖盖灭或放入较多的蔬菜,其目的是 .
14.我国海岸线长,海洋专属经济区复原辽阔,海洋资源丰富,开发的前景十分远大.
Ⅰ.我国海盐年产量3千多万吨,居世界第一位,目前从海水中提取食盐的方法主要为“盐田法”生产流程如图1
(1)在蒸发池中促进水分蒸发,主要是利用率下列各项中的 (填选向序号)
①潮汐能
②生物能
③电能
④太阳能
⑤化学能
(2)上述流程中得到的卤水是氯化钠的 溶液(填“饱和”或“不饱和”).
Ⅱ.金属镁广泛应用于生活、生产和国防工业,从卤水中提取镁的过程如图2所示:
在上述转化过程中,②处发生的化学方程式是 ,属于基本反应类型的 反应.
Ⅲ.海水除了蕴含大量的钠元素和镁元素外,还含有大量的钾元素,KCl和KNO3的溶解度曲线如图所示,试回答下列问题
(1)如图3曲线交点表示的含义是 .
(2)t1℃时,KCl饱和溶液的溶质质量分数 KNO3饱和溶液的溶质质量分数(填“大于”“小于”“等于”之一).
(3)已知20℃时,KNO3的溶解度为31.6g,80℃时,KNO3的溶解度为169g,在20℃时,向盛有200g水的烧杯中加入80g硝酸钾,充分溶解,得到该温度时KNO3 (填“饱和”或“不饱和”)溶液,若使烧杯内物质缓慢升温至80℃(忽略水分蒸发)在该温度下,最后所得溶液中溶质与溶剂的质量之比为 (填最简整数比).
(4)若KNO3溶液中混有少量的NaCl杂质,可以采取 方法获得较纯净的KNO3.
15.下列实验方案能达到实验目的是 。
选项 实验目的 实验方案
A 检验固体Ca(OH)2是否变质 取样加少量水振荡观察固体是否完全溶解
B 制备Cu(OH)2固体 用CuO与适量NaOH溶液混合
C 除去粗盐中的泥沙 加水溶解后过滤,再蒸发结晶
D 鉴别棉织物和羊毛织物
16.在实验室配制溶液时,常涉及以下过程:①称量、量取;②过滤;③蒸发结晶、干燥;④计算;⑤溶解.请按要求回答下列问题:
(1)甲同学用氯化钠和蒸馏水配制50g5%的氯化钠溶液.现实验室中有10mL、50mL、100mL等不同规格的量筒,配制上述溶液时最好选用 mL的量筒.
(2)乙同学用10g含杂质10%的食盐(杂质不溶于水)和蒸馏水配制50g溶质质量分数一定的氯化钠溶液,正确的操作顺序是(操作步骤可重复使用) (用以上序号填空).若乙同学将所得精盐完全用于配制该溶液,则所得溶液的溶质质量分数为 .
三、综合题
17.食盐是一种重要的化工原料,由于粗盐中含有少量泥沙和 MgCl2、CaCl2、Na2SO4等杂质,不能满足化工生产的要求,因此必须将粗盐进行精制,流程如图(用于沉淀的试剂均过量),请回答下列问题:
(1)操作 3 所用的玻璃仪器有什么?
(2)写出操作 1 发生反应的化学方程式.
(3)该实验方案还需要完善,请写出具体的操作步骤.
18.粗盐中除了含有泥沙等难溶性物质外,还含有可溶性杂质MgSO4和CaCl2,为了除去其中的可溶性杂质,某化学兴趣小组设计了如图实验过程。
(1)写出加入BaCl2溶液时所发生反应的化学方程式 。
(2)最后所得的NaCl的质量大于原粗盐中NaCl的质量,写出一个可使NaCl质量增加的化学方程式 。
(3)上述流程中,当无色溶液Y的pH>7时,请设计实验确定白色固体的成分(NaCl除外) 。
19.去除粗盐中难溶性杂质的主要操作如下图所示。
(1)操作①中玻璃棒的作用是 。
(2)操作③的名称是 。
(3)正确的实验操作顺序是 (填序号)。
20.化学就在我们身边,请从下列物质中选择相应的序号填空:
①酒精②明矾③食盐④氮气⑤水银
(1)腌制鱼肉等常用的调味品是 ;
(2)用于食品包装袋内填充的保护气是 ;
(3)温度计中的液体物质是 ;
(4)实验室常用的燃料是 ;
(5)可用于净水的是 .
答案解析部分
1.【答案】C
2.【答案】C
3.【答案】C
4.【答案】C
5.【答案】A
6.【答案】C
7.【答案】D
8.【答案】D
9.【答案】A
10.【答案】D
11.【答案】D
12.【答案】B
13.【答案】补充人体所需的碘元素,防止甲状腺肿大;腌制蔬菜、鱼、肉等;隔绝氧气或降低温度
14.【答案】④;饱和;2HCl+Mg(OH)2═MgCl2+2H2O;复分解反应;在t2℃时,两物质的溶解度相等;大于;饱和;2:5;降温结晶
15.【答案】C;灼烧闻气味
16.【答案】50;⑤②③④①⑤;18%
17.【答案】(1)答:烧杯、漏斗、玻璃棒
(2)答:BaCl2+Na2SO4═BaSO4↓+2NaCl
(3)答:在蒸发滤液之前,向滤液中加入足量稀盐酸除去氢氧化钠和碳酸钠.
18.【答案】(1)
(2)(合理即可)
(3)向溶液 Y 中加入过量硝酸钡溶液(或 CaCl2溶液或 BaCl2溶液),若有沉淀产生,则含有碳酸钠;静置,取上层清液,滴加无色酚酞溶液,若变红,则含有NaOH
19.【答案】(1)引流
(2)蒸发
(3)②①③
20.【答案】(1)③
(2)④
(3)⑤
(4)①
(5)②
1 / 1
